pH对毛蕊花糖苷稳定性影响及降解产物分析
2022-05-31武改丽霍志鹏张依倩刘元雪黄芝娟李瑞明
武改丽,霍志鹏,王 玉,张依倩,刘元雪,黄芝娟,李瑞明,何 毅*
pH对毛蕊花糖苷稳定性影响及降解产物分析
武改丽1, 2, 3,霍志鹏1, 2, 3,王 玉2, 3, 4,张依倩2, 3,刘元雪2, 3,黄芝娟2, 3,李瑞明2, 3,何 毅2, 3*
1. 天津中医药大学,天津 301617 2. 天士力医药集团股份有限公司研究院 现代中药开发中心,天津 300410 3. 天士力医药集团股份有限公司 创新中药关键技术国家重点实验室,天津 300410 4. 天津大学药物科学与技术学院,天津 300072
研究不同pH条件下毛蕊花糖苷的降解规律,鉴定降解产物并推测降解途径。采用HPLC-UV法研究毛蕊花糖苷在不同pH下的降解规律;采用高效液相色谱-离子阱飞行时间串联质谱(HPLC-IT-TOF-MS)鉴定其降解产物结构。使用Agilent ZORBAX Eclipse XDB C18色谱柱(150 mm×4.6 mm,5 μm);流动相为0.5%醋酸水溶液(A)-甲醇(B),体积流量1 mL/min,柱温30 ℃,检测波长254 nm,进样量10 μL;质谱分析使用电喷雾离子源(ESI),在正离子模式下扫描,扫描范围均为/100~800。通过比较毛蕊花糖苷在不同pH条件下色谱峰面积,分析其降解规律;并通过对照品比对、质谱数据等对降解产物进行鉴定。在不同pH缓冲溶液中,毛蕊花糖苷及异毛蕊花糖苷降解速率随pH值的增加而加快,降解产物有水解产物、氧化产物及同分异构体异毛蕊花糖苷等。分析了不同pH条件下毛蕊花糖苷的降解规律、降解产物和降解途径,研究结果可为含毛蕊花糖苷的中药的质量控制提供参考。
毛蕊花糖苷;异毛蕊花糖苷;pH;稳定性;降解规律;降解产物
车前子是中医常用的利尿通淋药,《中国药典》2020年版车前子项下含量测定要求检测毛蕊花糖苷,且含量不低于0.4%[1]。研究表明车前子中毛蕊花糖苷会受温度、加热时间、pH等影响而发生变化[2-6]。谷彩梅等[2]分析了车前子盐炙品与生品,发现炮制后的车前子中毛蕊花糖苷含量升高,同时盐炙品中异毛蕊花糖苷含量变化显著。田伟等[3]发现车前子中的毛蕊花糖苷和异毛蕊花糖苷含量随煎煮时间、温度、pH值的变化发生一定程度的变化,推测毛蕊花糖苷可能发生酯键断裂生成咖啡酸,并部分转化为异毛蕊花糖苷。本实验以毛蕊花糖苷为研究对象,深入研究pH对毛蕊花糖苷稳定性的影响,明确其变化规律及可能的转化机制。
毛蕊花糖苷是车前子中主要的苯乙醇苷类化合物,其化学结构见图1,为连接咖啡酰基的苯乙醇二糖苷。现代药理研究表明,毛蕊花糖苷具有神经保护作用,能修复阿尔茨海默病的受损神经元,改善学习和记忆功能[7-9];能通过抑制间质表皮转化因子(c-mesenchymal epithelial transition factor,c-Met)的表达进而抑制胶质母细胞瘤细胞的增殖、迁移和侵袭起到杀死肿瘤的作用[10];此外毛蕊花糖苷还具有抗炎[11]、抗氧化[12]、抗病原微生物[13]等作用。毛蕊花糖苷在植物中广泛存在,其毒性小、生物活性多样,因而具有良好的开发和应用前景。但毛蕊花糖苷结构中存在多个酚羟基,易被氧化,化学稳定性较差,限制了它的临床应用。为了进一步探索毛蕊花糖苷的降解特征和降解途径,本研究采用高效液相色谱-紫外(HPLC-UV)和高分辨质谱(HPLC-IT- TOF-MS)技术分析了毛蕊花糖苷在不同pH溶液中加热降解速率,并鉴定了降解产物,初步阐明了其降解规律。
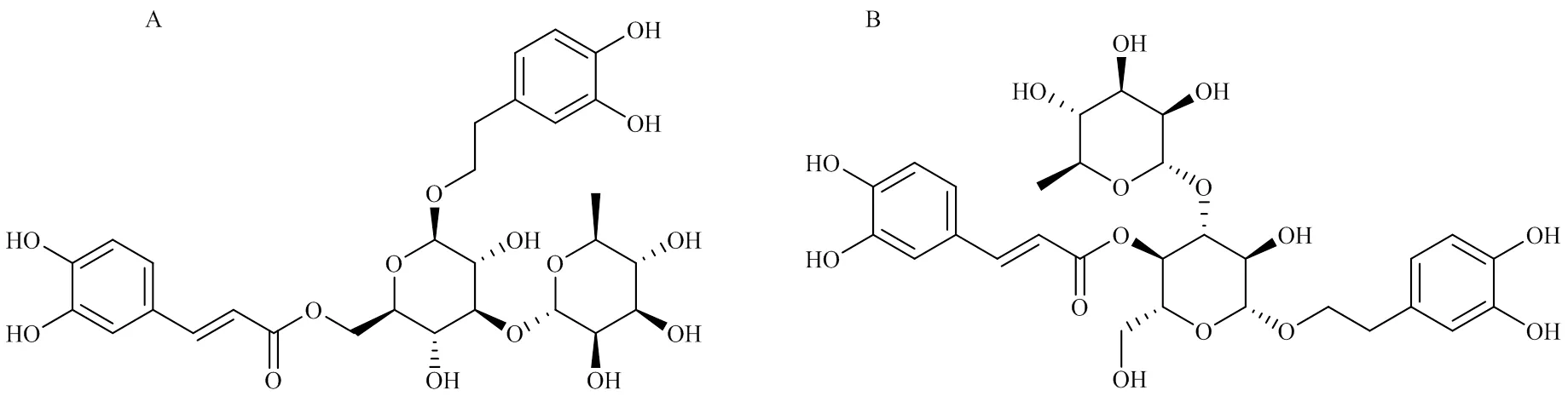
图1 毛蕊花糖苷(A) 与异毛蕊花糖苷(B) 结构
1 材料与仪器
1.1 仪器
Prominence型超快速高效液相色谱离子阱飞行时间质谱联用仪(包括LC-20AD型二元泵,SLI-20AC型自动进样器,CTO-20A型柱温箱,SPD-M20A型二极管阵列检测器,日本岛津公司),安捷伦1100型高效液相色谱仪(美国安捷伦公司),XS205DU型电子分析天平(瑞士梅特勒-托利多公司),ST16R型冷冻离心机(美国赛默飞世尔公司),Milli-Q型超纯水系统(美国密理博公司),KQ-500DV超声波清洗器(昆山市超声仪器有限公司),SevenEasy S20 pH计(瑞士梅特勒-托利多公司)。
1.2 药品与试剂
毛蕊花糖苷(成都普菲德生物技术有限公司,批号19082201,质量分数99.2%)、异毛蕊花糖苷(四川省维克奇生物科技有限公司,批号wkq20050603,质量分数92.3%)、磷酸二氢钾(天津市风船化学试剂科技有限公司,批号20190904,分析纯)、无水磷酸氢二钠(天津市威晨化学试剂科贸有限公司,批号20140411,分析纯)、冰乙酸(天津市致远化学试剂有限公司,批号20200301,色谱纯)、甲醇(默克公司)、实验用水为Milli-Q型超纯水系统制备超纯水。
2 方法与结果
2.1 色谱条件[1]
Agilent ZORBAX Eclipse XDB C18色谱柱(150 mm×4.6 mm,5 μm);流动相为0.5%醋酸水溶液(A)-甲醇(B),梯度洗脱(0~1 min,5%B;1~40 min,5%~60%B;40~50 min,5%B);检测波长为254 nm,进样量为10 μL,柱温为30 ℃,体积流量为1 mL/min。
2.2 质谱条件
采用电喷雾电离离子源(ESI),正离子模式扫描,正离子模式下喷雾电压设定为4.5 kV,一级、二级离子扫描范围均为/100~800,采用三氟乙酸钠作为校正液,雾化气为氮气,体积流量为1.5 mL/min,碰撞诱导解离能量50%;曲型脱溶剂管温度200 ℃,离子累积时间为30 ms,检测器电压1.75 kV。
2.3 溶液配制
2.3.1 毛蕊花糖苷对照品溶液 称取毛蕊花糖苷对照品适量,精密称定,置于棕色量瓶中,加20%甲醇水溶解,并定容至刻度,摇匀,制成0.2 mg/mL的对照品溶液。
2.3.2 异毛蕊化糖苷对照品溶液 称取异毛蕊花糖苷对照品适量,精密称定,置于棕色量瓶中,加20%甲醇水溶解,并定容至刻度,摇匀,制成0.2 mg/mL的对照品溶液。
2.3.3 磷酸缓冲液 分别称取磷酸二氢钾和磷酸氢二钠适量,以水为溶剂,配制pH 5、6、7的磷酸缓冲溶液。
2.4 毛蕊花糖苷降解实验
精密量取“2.3.1”项毛蕊花糖苷对照品溶液,分别与pH5、6、7磷酸缓冲液混匀(2∶1),振荡摇匀后于沸水浴中反应,按0、30、60、90、120、150、180、210、240、300 min时间点取样,每个时间点取反应液500 μL于1.5 mL离心管中,离心(12 000 r/min,10 min),取上清液于2 mL棕色液相小瓶中。
2.5 毛蕊花糖苷降解规律分析
对“2.3.1”项对照品溶液和“2.3.2”项样品,采用HPLC技术进行分析,色谱图见图2。以取样时间为横坐标,每个取样点的峰面积为纵坐标,绘制其在加热过程中变化规律,见图3。从图3可见,pH值越高,毛蕊花糖苷降解速度越快。其中pH5时毛蕊花糖苷降解缓慢,pH 7在90 min时毛蕊花糖苷几乎全部降解;异毛蕊花糖苷在pH 5时,其含量呈升高趋势,随pH升高后,其含量先升高后降低,说明毛蕊花糖苷和异毛蕊花糖苷在接近中性的水溶液中容易降解,毛蕊花糖苷和异毛蕊花糖苷适合在低pH条件下保存。在不同pH条件下,毛蕊花糖苷和异毛蕊花糖苷二者总含量均在降低,推测毛蕊花糖苷在降解过程中,生成异毛蕊花糖苷和其他降解产物,异毛蕊花糖苷在较高pH值还会继续降解成其他产物。
pH 5、6、7条件下毛蕊花糖苷的降解动力学拟合见图4。毛蕊花糖苷在pH 5时降解方程为=0.002+0.005 4,2=0.999 1;在pH 6时降解方程为=0.013+0.28,2=0.988 3;在pH 7时降解方程为=0.182 6+0.327,2=0.865 1;毛蕊花糖苷−ln(t/0)与的关系函数斜率即pH 5、6、7中毛蕊花糖苷的反应速率常数k呈增长趋势,且pH 5、6中毛蕊花糖苷−ln(t/0)与的线性相关系数(2)均接近1,可见相关性很好,降解反应属于一级反应;pH 7降解速率较快,数据较少,2为0.865 1。pH 5、6、7条件下毛蕊花糖苷的降解半衰期分别为346.5、51.9、3.73 min。随pH值增加,毛蕊花糖苷的降解反应速率增大,半衰期减小。通过分析毛蕊花糖苷在不同pH条件下降解反应常数及其半衰期,提示在低pH条件下毛蕊花糖苷稳定下较好,适合在低pH条件下保存。
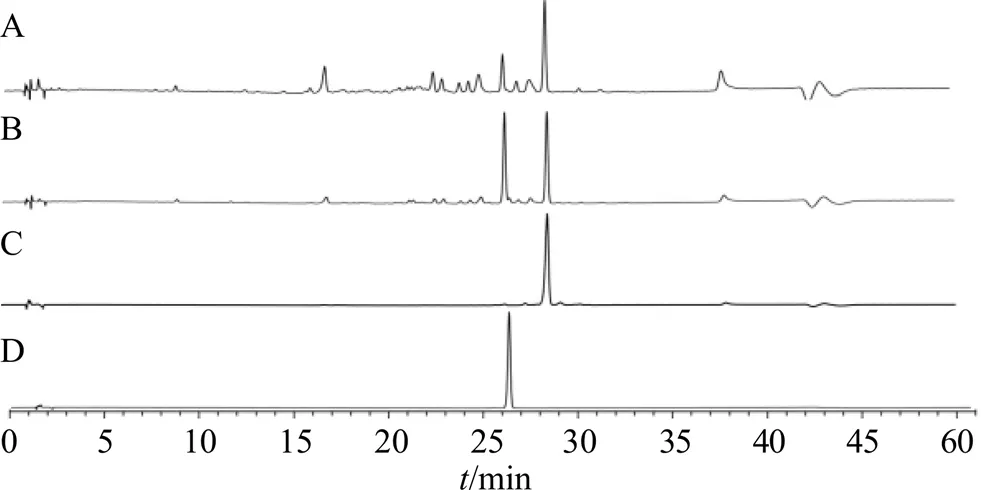
A-毛蕊花糖苷溶液(pH 6,加热180 min) B-毛蕊花糖苷溶液(pH 6,加热60 min) C-异毛蕊花糖苷 D-毛蕊花糖苷
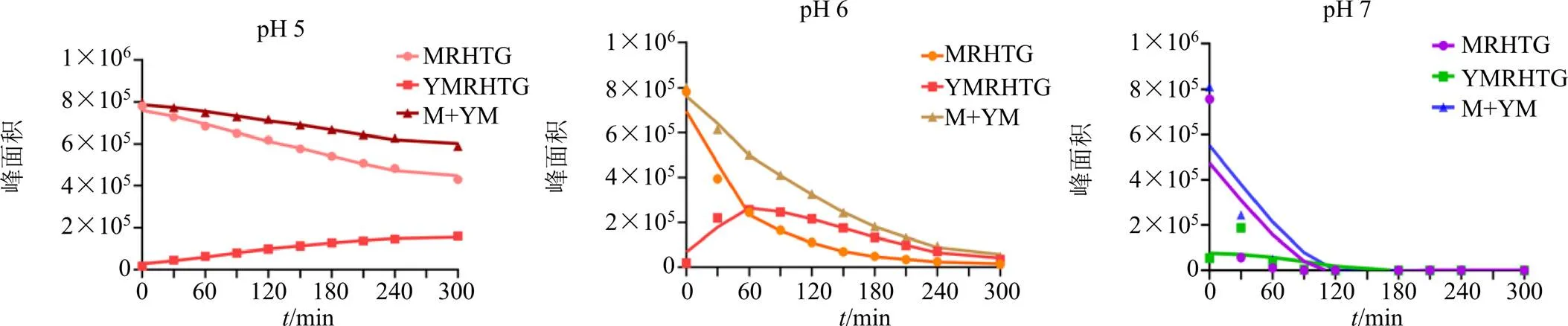
MRHTG-毛蕊花糖苷 YMRHTG-异毛蕊花糖苷 M+YM-毛蕊花糖苷和异毛蕊花糖苷总面积
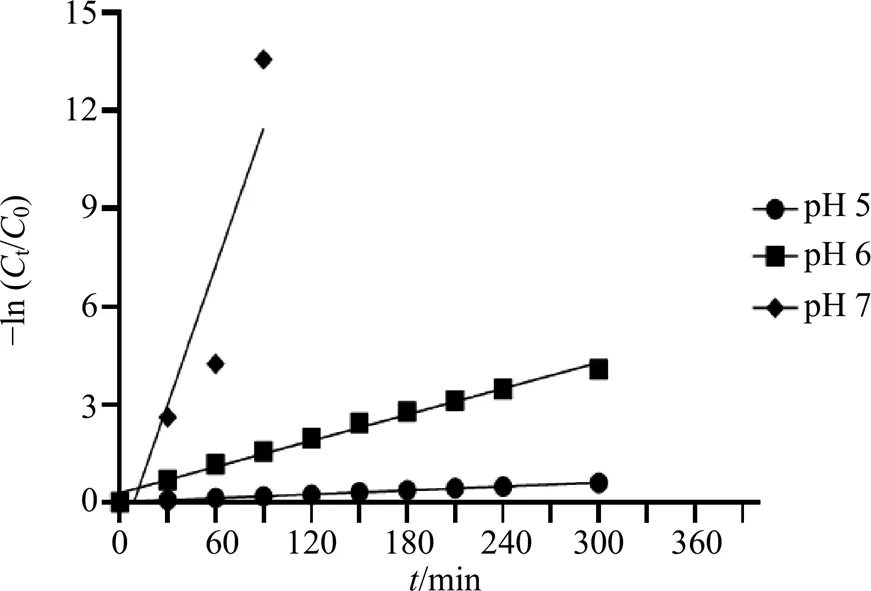
图4 不同pH条件下毛蕊花糖苷−ln (Ct/C0) 与t关系图
2.6 降解产物的HPLC-IT-TOF-MS鉴定
对“2.3.1”项对照品溶液和“2.3.2”项样品,采用HPLC-IT-TOF-MS技术进行分析。典型样品的总体离子流图见图5,根据色谱峰保留时间、质荷比及裂解规律信息推断化合物结构。毛蕊花糖苷降解产物的HPLC-IT-TOF-MS信息见表1。
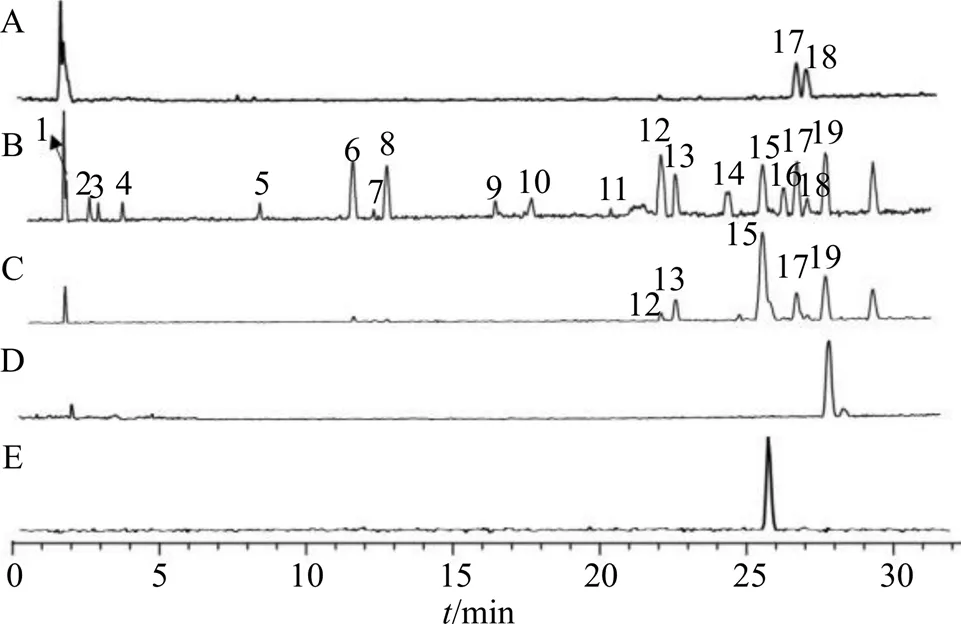
2.6.1 毛蕊花糖苷原形 峰15,保留时间为26.245 min,其准分子离子峰为/642.238 1 [M+NH4]+,推测的分子式为C29H36O15,误差为−2.6×10−6,峰15与毛蕊花糖苷和异毛蕊花糖苷相对分子质量相同;在MSE质谱图中,主要碎片有脱去1羟基酪醇(C8H10O3,154)的碎片/471.151 5 [M+H-NH4-C8H10O3]+以及脱去1鼠李糖基的(C6H10O4,146)碎片/325.091 8 [M+H-C8H10O3-C6H10O4]+,可能的裂解规律见图6。通过与毛蕊花糖苷对照品比对,鉴定峰15为毛蕊花糖苷。
2.6.2 异构化产物 峰19,保留时间为28.412 min,其准分子离子峰为/642.237 9 [M+NH4]+,推测的分子式为C29H36O15,误差为−3.0×10−6,峰19与毛蕊花糖苷和异毛蕊花糖苷相对分子质量相同;在MSE质谱图中,主要碎片离子/625.211 5 [M+H]+,/471.150 0 [M+H-C8H10O3]+,/325.093 3 [M+H-C8H10O3-C6H10O4]+,同峰15的裂解规律相同,通过与异毛蕊花糖苷对照品比对,鉴定峰19为异毛蕊花糖苷。
A-毛蕊花糖苷溶液(pH 7,加热90 min) B-毛蕊花糖苷溶液(pH 6,加热180 min) C-毛蕊花糖苷溶液(pH6,加热60 min) D-异毛蕊花糖苷 E-毛蕊花糖苷
2.6.3 水解产物 毛蕊花糖苷在加热过程中发生水解反应,可能水解掉咖啡酰基、鼠李糖基、羟基酪醇等结构,水解产物包括峰6、7、8。
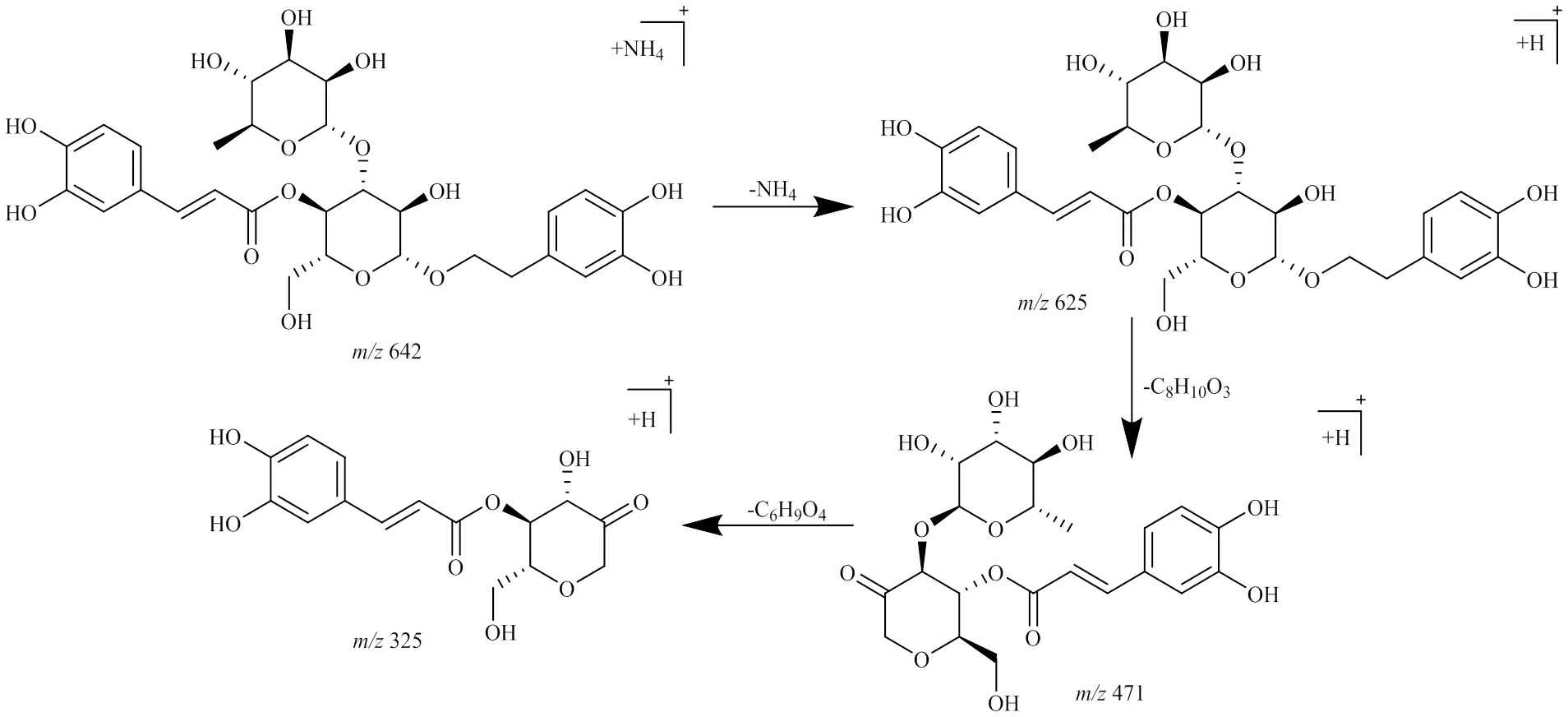
峰6,保留时间为11.645 min,准分子离子峰为/480.209 0 [M+NH4]+,推测的分子式为C20H30O12,误差为1.9×10−6,峰6相对于毛蕊花糖苷和异毛蕊花糖苷少了1咖啡酰基(C9H6O3,162)碎片;在MSE质谱图中,可见脱去一羟基酪醇(C8H10O3,154)产生的碎片/309.112 9 [M+H-C8H10O3-NH4]+,通过质谱数据推断峰6为毛蕊花糖苷或异毛蕊花糖苷水解掉一咖啡酰基(C9H6O3,162)的产物,其可能的裂解规律见图7。
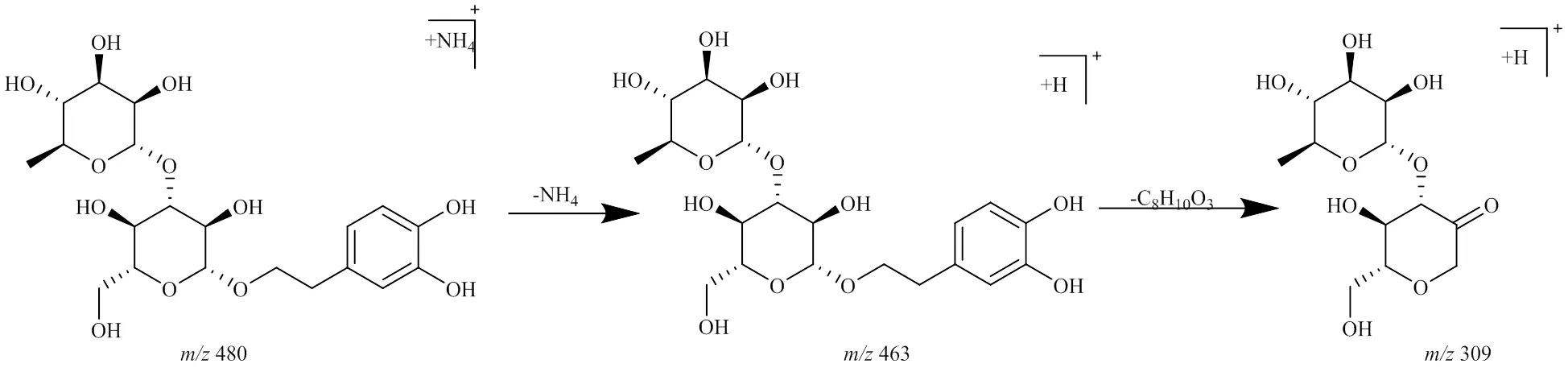
峰8,保留时间为12.812 min,准分子离子峰为/506.184 6 [M+NH4]+,推测的分子式为C21H28O13,误差为−2.3×10−6,峰8相对于毛蕊花糖苷和异毛蕊花糖苷少了1羟基酪醇(C8H10O3,154)碎片;在MSE质谱图中,可见脱去1咖啡酰基(C9H6O3,162)产生的碎片/325.090 7 [M+H-C9H6O3]+,通过质谱数据推断峰8为毛蕊花糖苷或异毛蕊花糖苷水解掉1羟基酪醇(C8H10O3,154)的产物,其可能的裂解规律见图8。毛蕊花糖苷在加热过程中生成的水解产物还包括峰7、10、18,其可能的结构见图9。
表1 毛蕊花糖苷降解产物的HPLC-IT-TOF-MS分析(pH6)
Table 1 HPLC-IT-TOF-MS analysis of degradation products of verbascoside (pH6)
序号tR/min分子式实测值(m/z)误差(×10−6)MS/MS(m/z)化合物 11.378C11H8O6237.040 2[M+H]+3.5 未知 22.212C7H8O6206.066 7[M+NH4]+1.1189.037 4 [M+H-NH4]+, 171.032 4 [M+H-NH4-H2O]+未知 32.512C14H24O12402.159 8[M+NH4]+−3.4309.111 0, 273.101 1, 147.248 0未知 43.378C7H6O5171.029 4[M+H]+3.5 没食子酸 58.245C10H16O5234.134 1[M+NH4]+−0.2 未知 611.645C20H30O12480.209 0[M+NH4]+1.9463.181 6 [M+H-NH4]+, 309.112 9 [M+H-NH4-C8H10O3]+水解掉1分子咖啡酰基产物 712.312C14H20O7318.154 4[M+NH4]+−2.8301.130 6 [M+H-NH4]+, 121.063 6 [M+H-NH4-C6H12O6]+水解掉1分子咖啡酰基和鼠李糖基产物 812.812C21H28O13506.186 2[M+NH4]+−2.3325.091 3 [M+H-C9H6O3]+水解掉1分子羟基酪醇产物 916.912C29H32O16654.200 0[M+NH4]+−5.2637.184 1 [M+H-NH4]+, 491.118 3 [M+H-NH4-C6H10O4]+, 329.062 2 [M+H-NH4-C6H10O4-C9H6O3]+邻苯酚羟基氧化产物 1018.012C15H18O9343.103 9[M+H]+4.5325.089 2 [M+H-H2O]+, 163.039 8 [M+H-H2O-C6H8O5]+水解掉1分子鼠李糖基和羟基酪醇的邻苯酚羟基氧化产物 1121.245C23H28O13513.160 5[M+H]+0.4325.092 4 [M+H-H2O]+, 307.081 4 [M+H-2H2O]+, 163.043 3 [M+H-C14H22O10]+未知 1222.612C29H34O15640.223 1[M+NH4]+−1.6623.197 9 [M+H-NH4]+, 477.137 4 [M+H-NH4-C6H10O4]+, 459.127 5 [M+H-NH4-C6H10O4-H2O]+, 315.085 3 [M+H-NH4-C6H10O4-C9H6O3]+邻苯酚羟基氧化产物 1323.212C17H12O6313.070 4[M+H]+−0.9295.055 9 [M+H-H2O]+未知 1425.012C29H34O15640.224 8[M+NH4]+1.0623.197 4 [M+H-NH4-2H]+, 477.140 4 [M+H-NH4-C6H10O4]+, 459.129 9 [M+H-NH4-C6H10O4-H2O]+, 315.086 1 [M+H-NH4-C6H10O4-C9H6O3]+邻苯酚羟基氧化产物 1526.245C29H36O15642.238 1[M+NH4]+−2.6625.222 8 [M+H-NH4]+, 471.151 5 [M+H-C8H10O3-NH4]+, 325.091 8 [M+H-C8H10O3-C6H10O4-NH4]+毛蕊花糖苷原型 1627.012C29H34O15640.223 3[M+NH4]+−1.3623.208 3 [M+H-NH4-2H]+, 477.137 0 [M+H-NH4-C6H10O4]+, 459.137 3 [M+H-NH4-C6H10O4-H2O]+, 315.087 5 [M+H-NH4-C6H10O4-C9H6O3]+邻苯酚羟基氧化产物 1727.580C16H28O7350.216 4[M+NH4]+−4.2 未知 1827.862C23H24O11477.140 7[M+H]+3.3297.076 1 [M+H-C6H12O6]+, 163.048 7 [M+H-C6H12O6-C6H8O5]+水解1分子鼠李糖基的邻苯酚羟基氧化产物 1928.412C29H36O15642.237 9[M+NH4]+−3.0625.211 5 [M+H-NH4]+, 471.150 0 [M+H-C8H10O3-NH4]+, 325.093 3 [M+H-C8H10O3-C6H10O4-NH4]+异毛蕊花糖苷
2.6.4 氧化产物 研究[14-15]表明,邻苯酚类化合物在过量氧存在时会发生自氧化,生成相应的半醌或醌类化合物。毛蕊花糖苷和异毛蕊花糖苷结构中均有2个邻苯酚存在,在过量氧存在时,发生自氧化。由于结构中邻苯酚位置不同,因此氧化产物不同,分别为峰9、10、12、14、16和18。
峰9,保留时间为16.912 min,准分子离子峰为/654.200 8 [M+NH4]+,推测的分子式为C29H32O16,误差为−5.2×10−6,峰9相对于毛蕊花糖苷和异毛蕊花糖苷少了4个H(4H)、加了1羟基(OH)碎片;在MSE质谱图中,可见脱去1鼠李糖基(C6H10O4,146)产生的碎片/491.118 3 [M+H-NH4-C6H10O4]+,再脱去1咖啡酰基(C9H6O3,162)产生的碎片/329.062 2 [M+H-NH4-C6H10O4-C9H6O3]+,通过质谱数据推断峰9为毛蕊花糖苷或异毛蕊花糖苷2个邻苯酚羟基均被氧化的产物,其可能的裂解规律见图10。
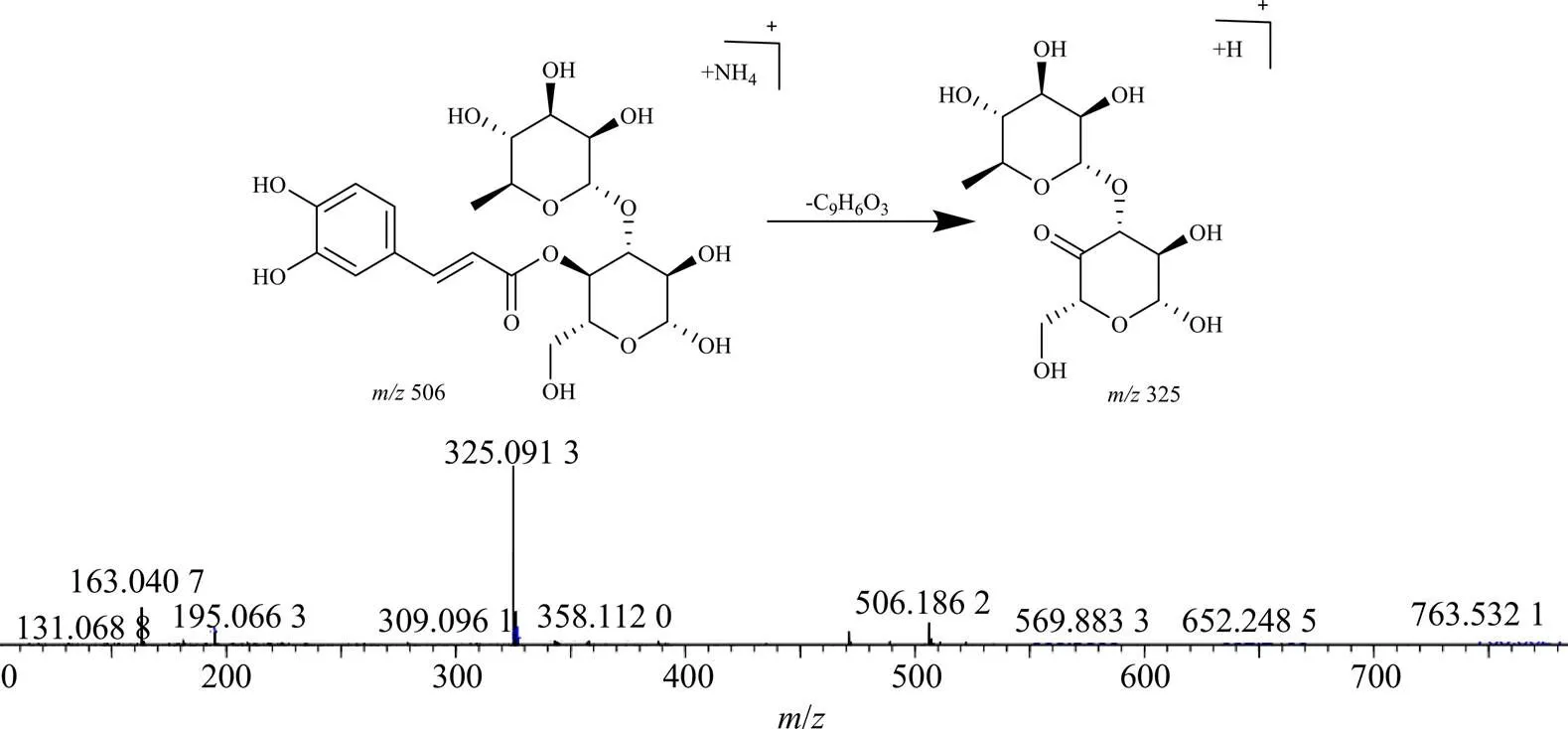
图8 峰8可能的裂解途径及MS/MS图
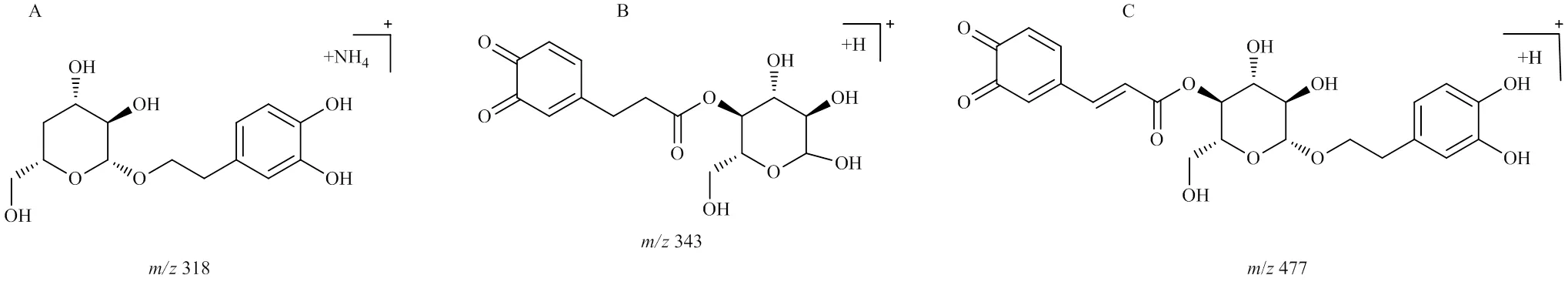
图9 峰7 (A)、10 (B)、18 (C) 可能的结构
峰12,保留时间为22.612 min,准分子离子峰为/640.223 1 [M+NH4]+,推测的分子式为C29H34O15,误差为−1.6×10−6,峰12相对于毛蕊花糖苷和异毛蕊花糖苷少了2个H(2H)碎片;在MSE质谱图中,可见脱去1鼠李糖基(C6H10O4,146)产生的碎片/477.137 4 [M+H-NH4-C6H10O4]+,再脱去1咖啡酰基(C9H6O3,162)产生的碎片离子为/315.085 3 [M+H-NH4-C6H10O4-H2O-C9H6O3]+,通过质谱数据推断峰初步推测峰12为毛蕊花糖苷或异毛蕊花糖苷邻苯酚羟基被氧化的产物;峰12、14和16有相同碎片和裂解规律,推测三者可能是同分异构体,其可能的裂解途径见图11。
2.6.5 其他类 毛蕊花糖苷在加热过程中发生水解、氧化反应,还可能发生聚合、还原等其他反应。峰4准分子离子峰为/171.029 4 [M+H]+,推测的分子式为C7H6O5,通过质谱数据推断及参考文献报道[16],鉴定峰4为没食子酸。图12为推测峰4、11、13可能的结构。
峰11,保留时间为21.245 min,准分子离子峰为/513.160 5 [M+H]+,误差为0.4×10−6,推测峰11可能是由毛蕊花糖苷结构中邻苯酚羟基发生氧化,再失去1苯二酚(C6H6O2,110)产生的化合物C23H28O13。峰13,保留时间为23.212 min,准分子离子峰为313.070 4 [M+H]+,误差为−0.9×10−6,推测峰13可能是由碎片咖啡酸(C9H8O4,180)和羟基酪醇(C8H10O3,154)结合生成的化合物C17H12O6。图13为峰11、13可能的生成途径。
3 讨论
多酚中特殊的多酚羟基结构,尤其是邻位酚羟基,在碱性条件下容易氧化,使多酚的应用受到了很大的限制[17-18]。毛蕊花糖苷结构中存在4个酚羟基,在不同pH条件下,毛蕊花糖苷存在不同程度的降解。在弱酸性条件下,毛蕊花糖苷溶液降解缓慢;在pH 7条件下其降解加快,且在90 min时几乎全部降解。Zhou等[19]研究表明在常温条件下,毛蕊花糖苷水溶液在pH 5条件下比在pH 9条件下稳定,降解速率慢,高pH降解速率加快。此研究结论与本研究结果一致,但本研究还鉴定了其降解产物,并对降解途径做了系统的推测,见图14。毛蕊化糖苷降解可能的途径包括异构、水解、氧化等。研究结果显示,毛蕊花糖苷可部分降解为异毛蕊花糖苷,毛蕊花糖苷与生成的异毛蕊花糖苷继续发生水解及氧化等降解反应,异毛蕊花糖苷含量在pH较高时呈先升高再降低趋势,水解与氧化降解的比例随pH升高增加。
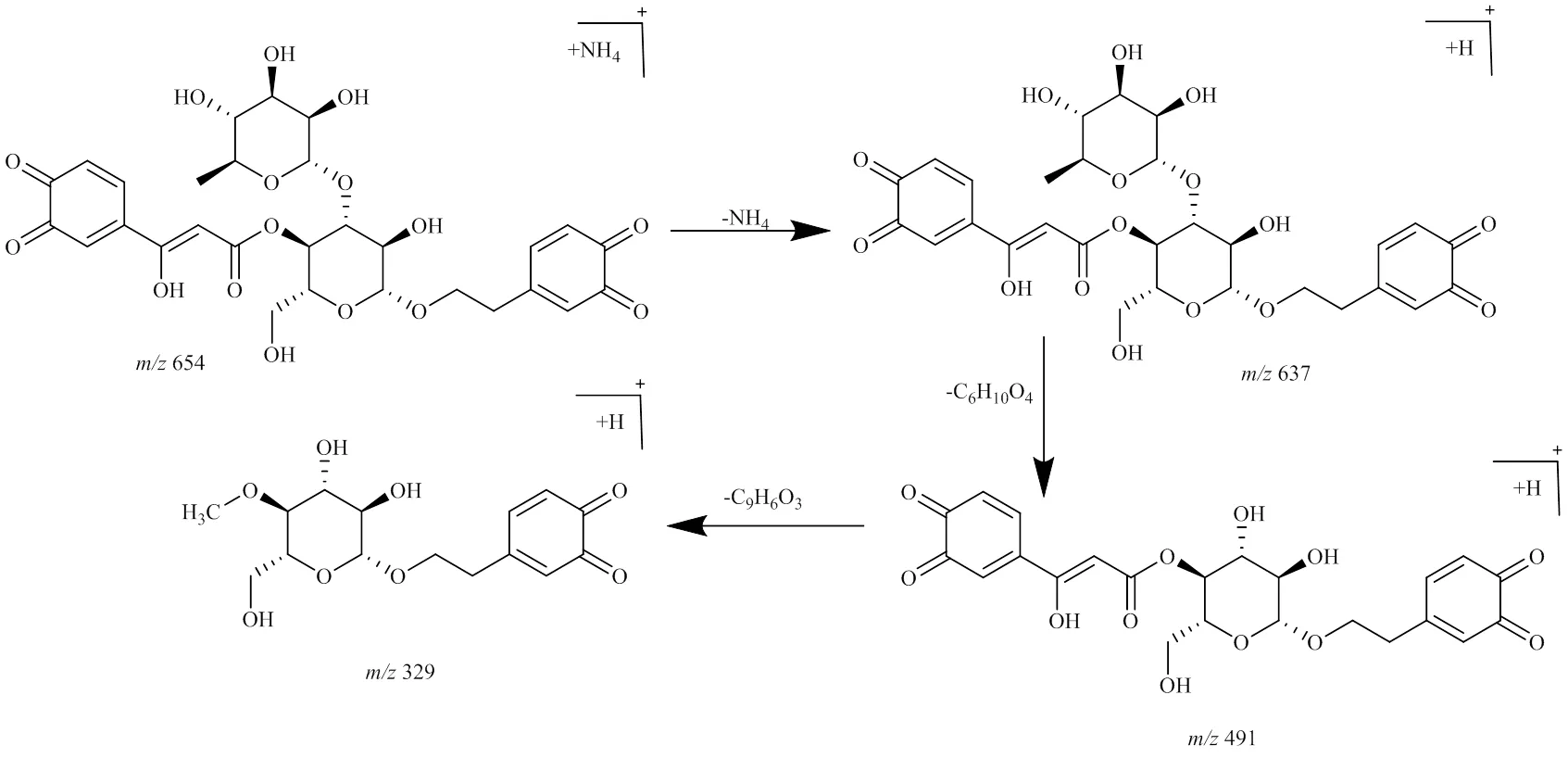
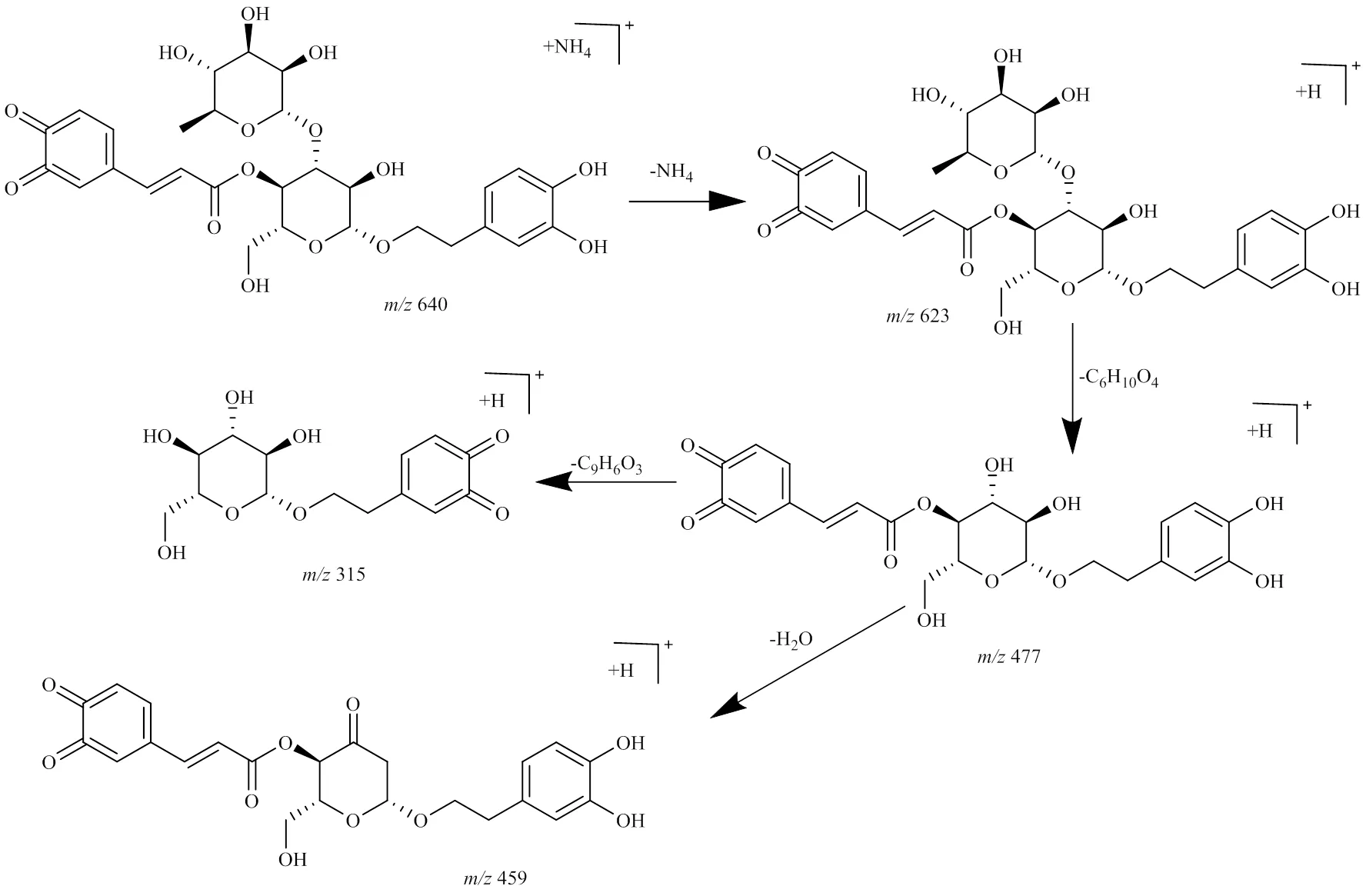
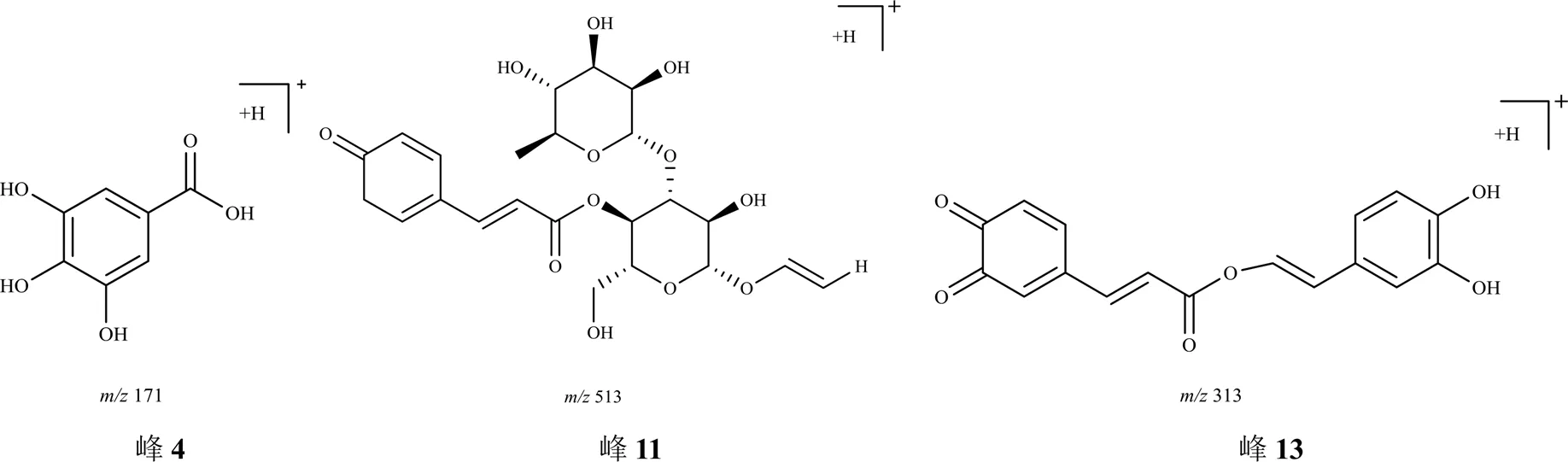
图12 峰4、11、13可能的结构
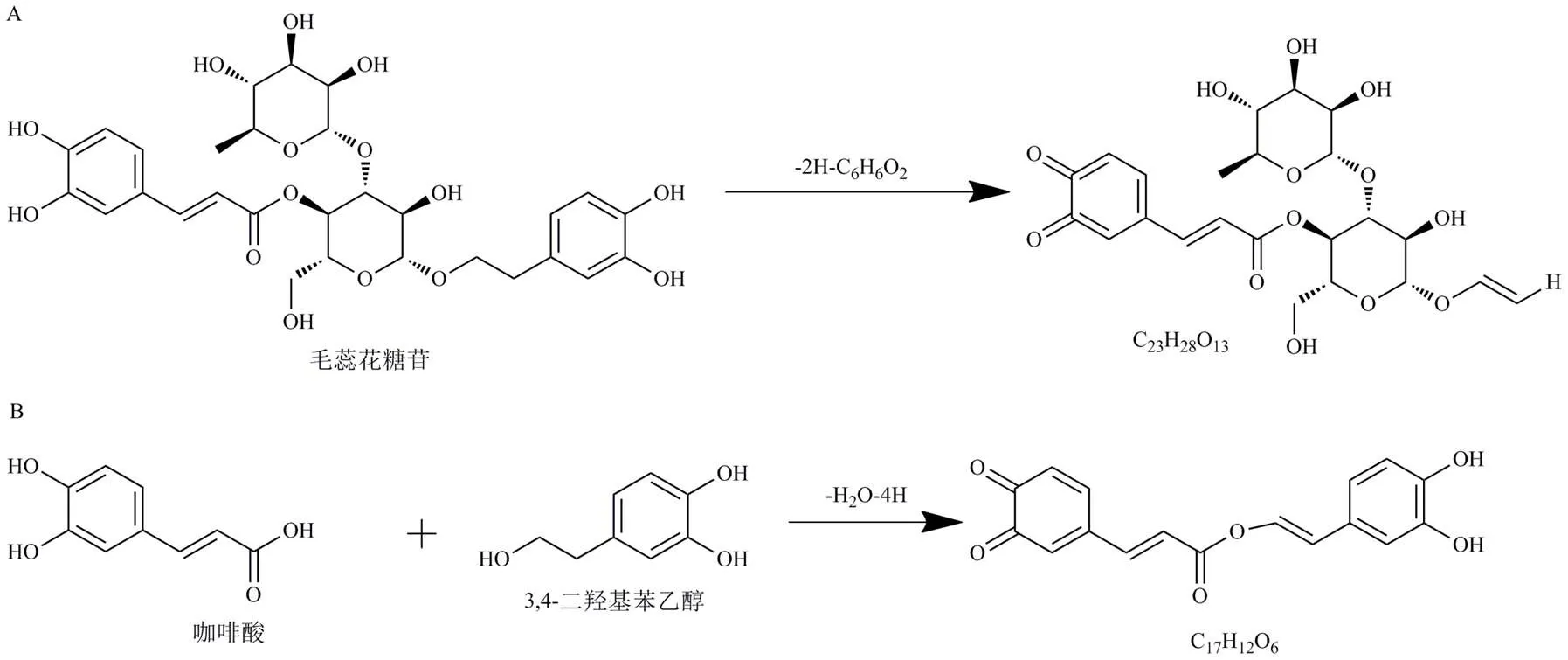
图13 峰11 (A)、13 (B) 可能的生成途径
田伟等[3]的研究显示,车前子煎煮过程中毛蕊花糖苷含量呈现先增加后降低的变化趋势,且随时间的增加,其含量继续降低,异毛蕊花糖苷含量在煎煮过程中呈增加的趋势。本研究前期对车前子水煎液的pH进行了测定,其pH值为6.2,介于本试验考察的pH 6与7条件之间,推测车前子水煎液中毛蕊花糖苷的变化规律可能与本研究结果相似。毛蕊花糖苷的降解产物可能在车前子水煎液存在并发挥药效,提示应关注车前子、地黄、肉苁蓉等含毛蕊花糖苷药材的煎液中毛蕊花糖苷的降解产物。
本研究结果显示毛蕊花糖苷在弱酸性条件向异毛蕊花糖苷转化,且转化率较高。现代药理研究表明,毛蕊花糖苷与异毛蕊花糖苷可以增强树突状细胞的增殖,具有免疫调节作用[20];毛蕊花糖苷具有神经保护作用[9],异毛蕊花糖苷可能通过上调神经型尼古丁受体亚单位蛋白来发挥神经保护作用[21],毛蕊花糖苷与异毛蕊花糖苷均具有抗氧化作用[22];毛蕊花糖苷与异毛蕊花糖苷具有相似的药理活性,因此建议开展毛蕊花糖苷与异毛蕊花糖苷相关药效等效性试验,明确二者药效关系。
本研究探讨了影响毛蕊花糖苷稳定性的因素并对其降解产物进行分析,为毛蕊花糖苷提取、纯化及车前子、地黄、肉苁蓉等富含毛蕊花糖苷的中药的质量控制提供了参考。
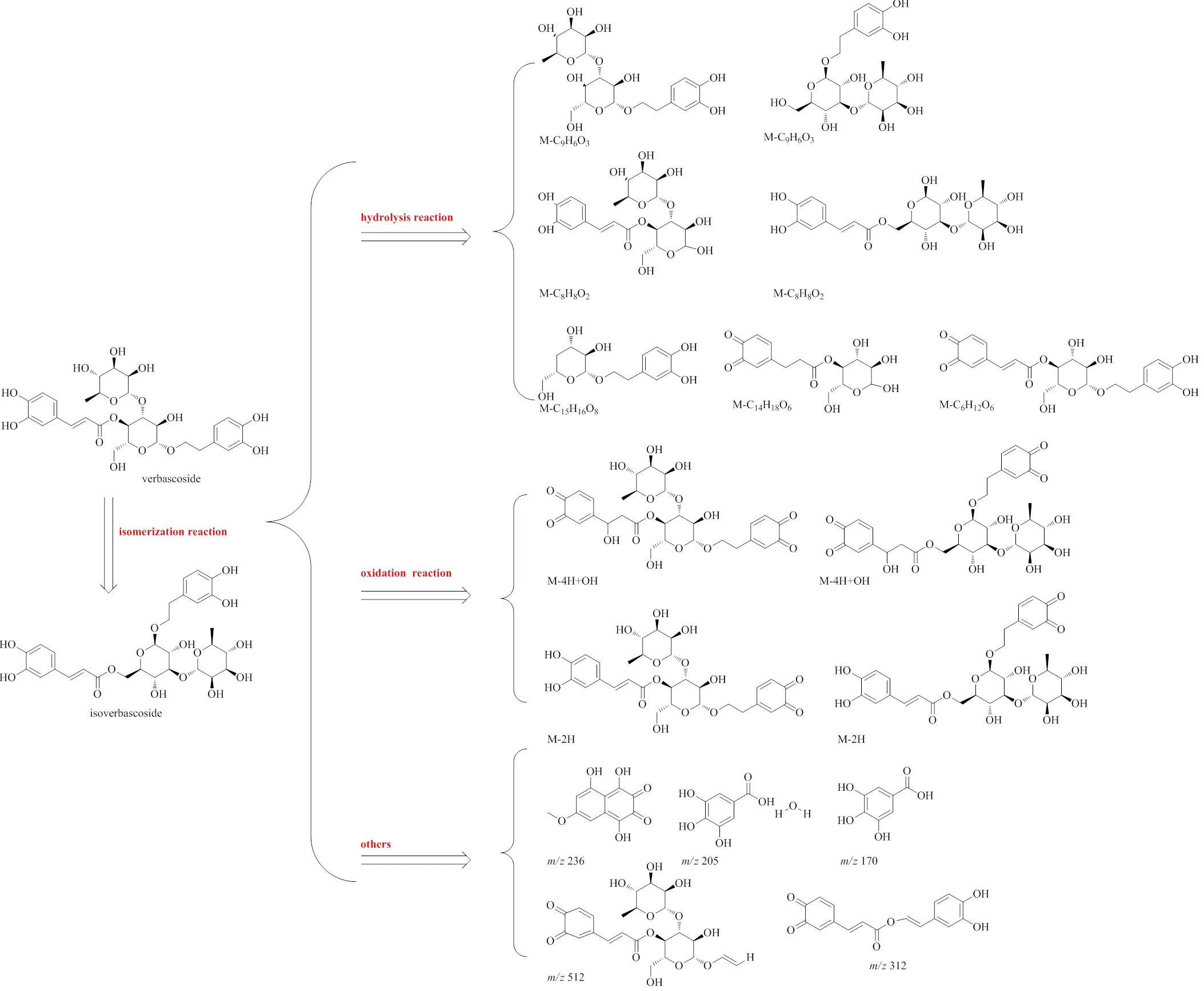
图14 毛蕊花糖苷的可能降解途径
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部. 2020: 69-70.
[2] 谷彩梅, 王增绘, 郑司浩, 等. 基于UPLC-Q-TOF/MS法分析车前子生品和盐炙品化学成分研究 [J]. 世界科学技术—中医药现代化, 2016, 18(1): 77-81.
[3] 田伟, 甄亚钦, 董秋菊, 等. 车前子煎煮过程中4种化学成分含量变化规律研究 [J]. 中国新药杂志, 2018, 27(16): 1927-1931.
[4] 曾金祥, 许兵兵, 王娟, 等. 车前子中毛蕊花糖苷及异毛蕊花糖苷降低急性高尿酸血症小鼠血尿酸水平及其机制 [J]. 中成药, 2016, 38(7): 1449-1454.
[5] 卢丹逸, 黄婉茹, 马志国. 盐炙对车前子中京尼平苷酸、毛蕊花糖苷和异毛蕊花糖苷含量的影响 [A]//2014年全国中药炮制学术年会暨中药饮片创新发展论坛及协同创新联盟会议论文集 [C]. 南京: 中华中医药学会中药炮制分会, 2014: 176.
[6] 许兵兵, 黄碧涛, 曾金祥, 等. 车前子及车前草中毛蕊花糖苷与异毛蕊花糖苷的含量比较 [J]. 中国实验方剂学杂志, 2016, 22(18): 64-67.
[7] 王建, 李晓琳, 李茂星, 等. 苯乙醇苷类化合物通过PI3K/Akt/mTOR-HIF-1α信号通路对高原低氧大鼠认知功能损伤的保护作用 [J]. 国际药学研究杂志, 2020, 47(12): 1137-1145.
[8] 胡航. 毛蕊花糖苷对阿尔茨海默病小鼠神经治疗作用研究 [J]. 辽宁中医药大学学报, 2016, 18(12): 21-24.
[9] 曲彦洁, 甄蓉蓉, 安红梅. 毛蕊花糖苷治疗神经退行性疾病作用及机制 [J]. 中华中医药学刊, 2021, 39(2): 69-72.
[10] Hei B, Wang J, Wu G Y,. Verbascoside suppresses the migration and invasion of human glioblastoma cells via targeting c-Met-mediated epithelial-mesenchymal transition [J]., 2019, 514(4): 1270-1277.
[11] Pesce M, Franceschelli S, Ferrone A,. Verbascoside down-regulates some pro-inflammatory signal transduction pathways by increasing the activity of tyrosine phosphatase SHP-1 in the U937 cell line [J]., 2015, 19(7): 1548-1556.
[12] 熊丽娜, 毛淑琴, 陆柏益, 等. 桂花提取物及毛蕊花糖苷抗-半乳糖致小鼠衰老作用研究 [A] //中国食品科学技术学会第十一届年会论文集 [C]. 杭州: 中国食品科学技术学会, 2014: 139-140.
[13] 赵小然. β-谷甾醇和毛蕊花糖苷对肺炎链球菌溶血素的抑制作用及机制 [D]. 长春: 吉林大学, 2017.
[14] 彭素萍, 巩珺, 苗瑞娟, 等. 连翘酯苷B与毛蕊花糖苷稳定性研究 [J]. 今日药学, 2012, 22(6): 326-328.
[15] 袁倬斌, 高若梅. 邻苯三酚自氧化反应的动力学研究 [J]. 高等学校化学学报, 1997, 18(9): 1438-1441.
[16] 周丹丹, 邹秦文, 林瑞超. 基于超高效液相色谱-四级杆-静电场轨道阱质谱的胃复春片化学成分研究[J]. 世界中医药, 2020, 15(13): 1841-1848.
[17] 张阿惜, 连英竹, 沈月峰, 等. 不同温度、pH、光照条件下毛蕊花苷的降解动力学 [J]. 食品工业科技, 2020, 41(21): 48-52.
[18] 陈晓云, 张峻, 吉伟之, 等. 高温操作及贮存过程中葡萄多酚的稳定性 [J]. 天津农业科学, 2003, 9(2): 18-21.
[19] Zhou F, Zhao Y J, Li M Q,. Degradation of phenylethanoid glycosides inLour. flowers and its effect on anti-hypoxia activity [J]., 2017, 7(1): 10068.
[20] 唐永富, 黄丹菲, 谢明勇, 等. 毛蕊花苷和异毛蕊花苷对树突状细胞增殖的影响 [J]. 中国药学杂志, 2008, 43(23): 1785-1787.
[21] 齐晓岚, 肖海涛, 肖雁, 等. 松果菊苷及异麦角甾苷对神经细胞尼古丁受体表达的影响 [J]. 时珍国医国药, 2011, 22(7): 1561-1563.
[22] 杨建华, 胡君萍, 热娜·卡斯木, 等. 肉苁蓉属植物中六种苯乙醇苷类化合物抗氧化活性的构效关系研究 [J]. 中药材, 2009, 32(7): 1067-1069.
Effect of pH on tability of verbascoside and analysis degradation products
WU Gai-li1, 2, 3, HUO Zhi-peng1, 2, 3, WANG Yu2, 3, 4, ZHANG Yi-qian2, 3, LIU Yuan-xue2, 3, HUANG Zhi-juan2, 3, LI Rui-ming2, 3, HE Yi2, 3
1. Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China 2. Development Center of Modern Chinese Medicine, Research Institute of Tasly Pharmaceutical Group Co. Ltd., Tianjin 300410, China 3. State Key Laboratory of Critical Technology in Innovative Chinese Medicine, Tasly Pharmaceutical Group Co. Ltd., Tianjin 300410, China 4. School of Pharmaceutical Science and Technology, Tianjin University, Tianjin 300072, China
The degradation rule of verbascoside under different pH conditions was studied, degradation products was identified, and degradation pathways was speculated.HPLC-UV was used to study the degradation rule of verbascoside at different pH values; High performance liquid chromatography tandem ion trap time-of-flight mass spectrometry (HPLC-IT-TOF-MS) was used to identify structures of degradation products. An Agilent ZORBAX Eclipse XDB C18column (4.6×150 mm, 5 μm) was used. The mobile phase consists of 0.5% acetic acid aqueous solution (A)-methanol (B). The flow rate was 1 mL/min. The column temperature was 30 ℃. The detection wavelength was 254 nm, and the injection volume was 10 μL. Mass spectrometry were acquired on a mass spectrometer with an electrospray ion source (ESI), and scanned in positive ion mode, with a scanning range of/100-800. The degradation behaviors were analyzed by comparing the chromatographic peak areas of verbascoside at different pH values. Structures of degradation products were identified by comparing with the reference-substances and the mass spectrometry.In different pH buffer solutions, the degradation rate of verbascoside and isoverbascoside accelerated as increase of the pH value. The degradation products included hydrolysis products, oxidation products and isomeric products, etc.In this study, the degradation rule, degradation products, and degradation pathways of verbascoside at different pH conditions were analyzed. It may provide a reference for the quality control of traditional Chinese medicines containing verbascoside.
verbascoside; isoverbascoside; pH; stability; degradation rule; degradation products
R284.1
A
0253-2670(2022)11- 3295 -11
10.7501/j.issn.0253-2670.2022.11.004
2021-11-24
国家“重大新药创制”科技重大专项(2017ZX09301005)
武改丽,在读硕士,从事中药药物开发研究。Tel: 15735641103 E-mail: gailiwu@163.com
何 毅,研究员,从事中药新药开发与研究工作。Tel: (022)86343860 E-mail: heyi@tasly.com
[责任编辑 王文倩]
