双硫仑对结肠癌细胞SW480生长和侵袭的作用及机制研究
2019-05-14张媛媛汪瑞辰
纪 猛,张媛媛,汪瑞辰
江苏省肿瘤医院,江苏省肿瘤防治研究所,南京医科大学附属肿瘤医院,南京 210009
随着生活水平的提高,人们的生活习惯和饮食方式发生了很大的改变,尤其是“红肉”饮食的大量摄入[1,2],使得我国结肠癌的发病率逐年增加,严重影响了人们的生存周期和生活质量。结肠癌具有增殖速率快、能量代谢旺盛、易发生转移和侵袭的特点[3,4],因而对于开发能够抑制结肠癌细胞增殖、生长和转移的药物显得极为紧迫。经典的结肠癌治疗药物的研发从化合物的筛选到成药需要数十年时间和数亿元的经费投入,严重限制了结肠癌的有效治疗,因而从临床常用的经典药物入手,“老药新用”的研发方式为药学专家所关注。双硫仑(disulfiram)[5]是一种常用的廉价戒酒药物,因其能够不可逆地抑制胞质内和线粒体内的乙醛脱氢酶,使嗜酒者转而对饮酒产生厌恶和恐惧心理,从而放弃酗酒而达到戒酒目的。同时毒理学研究表明,单独使用双硫仑对机体不产生毒性作用,更可贵的是,研究表明,双硫仑具有潜在的抗肿瘤潜力[6,7]且具体机制不清。因而,本研究通过体内体外细胞和移植瘤实验考察双硫仑的抗结肠癌作用,并通过低氧诱导因子-1α(hypoxia inducible factor-1,HIF-1α)和葡萄糖转运蛋白 1(Glucose transporter 1,GLUT1)信号通路[8,9]对其潜在的抗肿瘤作用机制进行研究,以期为后续的实验及临床研究提供参考。
1 材 料
1.1 药品与试剂
双硫仑 (批号S826357,Selleck公司);顺铂(Cisplatin,批号 S117264,Selleck 公司);MTS 试剂盒(Cell Proliferation Colorimetric Assay Kit,Biovision公司);胎牛血清和DMEM培养基(美国Gibco公司);Matrigel基底膜基质(批号6235007,美国BD公司);HIF-1α和GLUT1单克隆抗体(美国Abcam公司);小鼠SP检测试剂盒(索莱宝公司);其余试剂为化学纯,均购自国药化学有限公司;纯化水(自制)。
1.2 细胞株
人结肠癌SW480细胞株,购自中国科学院上海细胞生物学研究所。
1.3 动物
BALB/c裸小鼠18只,体重18~22 g,均为雄性,由扬州大学比较医学中心提供,动物合格证编号:201810315,动物许可证号:SCXK(苏)2017-0007。动物自由饮水饮食,光照/黑暗时间12 h/12 h,环境温度22℃~24℃,相对湿度50%~70%。
1.4 实验仪器
电子天平(型号BSA224S-CW,Sartorius科学仪器厂);二氧化碳培养箱(型号3110,美国Thermo公司);多功能酶标仪(型号GM3500,美国Promega公司);纯水仪(型号TANKPE060,美国Millipore公司)。
2 方 法
2.1 双硫仑对SW480细胞增殖的影响
采用MTS法对细胞增殖能力进行检测。采用0.25%胰酶对SW480细胞进行消化后,每孔接种5×103个细胞于96孔板中(100μL)。细胞贴壁后,吸去旧培养基,加入100 μL的新鲜含药培养基。实验共分7个组,每组6个平行孔。各组双硫仑浓度分别为0、2、4、8、16、32、64 μmol·L-1或顺铂浓度分别为 0、1.25、2.5、5、10、20、40 μmol·L-1。 药物分别处理 24 h或48 h后每孔加入20 μL MTS,置培养箱继续培养,2h后于酶标仪490nm波长处检测其吸光度值。
2.2 双硫仑对SW480细胞迁移的影响
采用细胞划痕实验检测细胞迁移能力。细胞消化后,每孔接种3×105个SW480细胞于6孔板中(2 mL)。细胞贴壁后,置于培养箱中培养,24 h后弃去上清液,无菌PBS清洗细胞两次后,用白色的10 μL枪头沿每孔的中线垂直划痕。然后无菌PBS继续清洗两次,加入100 μL的新鲜含药培养基。实验共分4组,分别为:对照组、顺铂组和双硫仑 4 μmol·L-1组、8μmol·L-1组,各组分别加入 PBS、顺铂 2.5μmol·L-1、双硫仑 4 μmol·L-1、8 μmol·L-1。每组设置 3 个平行孔。24 h后分别于100倍显微镜下拍照。细胞迁移率(%)=(1-24 h划痕宽度/0 h时间点划痕宽度)×100%。
2.3 双硫仑对SW480细胞侵袭的影响
采用Transwell实验检测细胞的侵袭能力。于Transwell小室上室的膜表面均匀铺被含Matrigel(去生长因子)的 DMEM培养基稀释液(1∶4,体积比),置培养箱中稍微受热使其凝固。将5×103个SW480细胞接种在Transwell小室的上室,同时于上室加入100 μL含药培养基。实验共分4组,分别为:对照组、顺铂组和双硫仑 4 μmol·L-1组、8 μmol·L-1组,各组分别加入 PBS、顺铂 2.5 μmol·L-1、双硫仑 4 μmol·L-1组、8 μmol·L-1。每组设置 3 个平行孔。Transwell下室加入 600 μL含 20%小牛血清的DMEM培养基,置培养箱中培养24 h。药物处理结束后,用棉签小心将上室中没有迁移的细胞拭去,将上室底部的膜取下,并按下述操作处理:用4%多聚甲醛固定10 min→PBS洗涤→0.1%结晶紫染色30 min→PBS漂洗3次→置载玻片上→200×镜下随机选5个视野进行拍照计数后、计算每个视野的平均值。
2.4 双硫仑对SW480荷瘤裸鼠肿瘤生长的影响
SW480细胞经大量培养后,胰酶消化后DMEM培养基重悬细胞并计数。采用DMEM培养基将细胞浓度调至2×107/mL,后加入等体积的Matrigel胶混合均匀,调整细胞终浓度为1×107/mL。于Balb/c裸鼠右下肢皮下接种细胞悬液,每只接种体积为0.2mL。观察肿瘤体积,待瘤块直径达0.5~1.0cm时,将裸鼠随机分为3组,每组6只,分别为模型组、双硫仑20mg·L-1组、40mg·L-1组。 采用灌胃给予相应的双硫仑或生理盐水,给药体积为0.4 mL/20 g体重,实验共21 d。用游标卡尺每3天测量各组裸鼠瘤体积,实验结束后,处死裸鼠,取出瘤组织,进行拍照并称重,肿瘤组织以4%的多聚甲醛固定以进行后续免疫组化实验。肿瘤体积计算方法:V=A×B2×0.5,其中A为肿瘤最长直径,B为肿瘤最短直径。
2.5 双硫仑对SW480荷瘤裸鼠肿瘤组织中HIF-1α和GLUT1蛋白表达的影响
采用免疫组化法检测肿瘤组织中的HIF-1α和GLUT1蛋白表达水平。将固定后的肿瘤组织进行常规石蜡包埋及切片,6μm厚度为宜,切片经脱蜡水化,先经过氧化物阻断、非免疫性动物血清保护后,加入HIF-1α和GLUT1一抗(1∶200进行稀释)孵育过夜,清洗封闭后,加入生物素标记的二抗孵育、链霉素抗生物素蛋白-过氧化物酶等步骤,进行DAB显色,苏木素复染、脱水、透明、中性树胶封片。晾干后显微镜400倍进行拍照。采用Image J软件统计HIF-1α和GLUT1蛋白的光密度值,计算平均光密度。平均光密度值=累计光密度/面积。
2.6 统计方法
实验结果采用Graph Pad Prism 5软件进行作图分析,数据采用SPSS 19.0软件进行单因素方差分析(One-way ANOVA),Student-Newman-Keuls post hoc检验进行组间比较。P<0.05为具有统计学意义。
3 结 果
3.1 双硫仑对SW480结肠癌细胞增殖具有抑制作用
采用不同浓度的双硫仑分别处理SW480结肠癌细胞24 h和48 h,MTS结果显示,双硫仑16、32、64 μmol·L-1浓度时可以抑制肿瘤细胞的增殖,并且呈现剂量依赖效应关系,与对照组相比差异具有统计学意义(P<0.05)。双硫仑处理结肠癌细胞24 h和48h 的 IC50分别为 42.12μmol·L-1和 33.77 μmol·L-1(见图1)。同时,顺铂处理结肠癌细胞24h和48h的IC50分别为 16.62μmol·L-1和 15.20μmol·L-1。实验表明,双硫仑能够明显抑制SW480结肠癌细胞的增殖。
3.2 双硫仑抑制SW480结肠癌细胞的迁移
选取了对细胞增殖无显著影响的双硫仑4μmol·L-1、8μmol·L-1浓度和顺铂 2.5μmol·L-1处理细胞 24h,研究双硫仑对SW480结肠癌细胞迁移能力的影响。结果显示,双硫仑处理细胞 24 h 后,4 μmol·L-1组和8 μmol·L-1组均能够抑制 SW480结肠癌细胞的体外迁移,与对照组相比差异具有统计学意义 (P<0.05)。结果表明,双硫仑能够抑制SW480结肠癌细胞的迁移(见图2)。

图1 双硫仑对结肠癌细胞SW480增殖的影响(x±s,n=6)

图2 双硫仑对SW480结肠癌肿瘤细胞迁移能力的影响(x±s,n=3)
3.3 双硫仑抑制SW480结肠癌细胞的侵袭
选取了对细胞增殖无显著影响的双硫仑4μmol·L-1和 8 μmol·L-1浓度,处理细胞 24 h,研究双硫仑对SW480结肠癌细胞侵袭能力的影响。结果显示,双硫仑 4μmol·L-1组和 8μmol·L-1组均抑制 SW480结肠癌细胞的侵袭,且与对照组相比差异具有统计学意义,表明双硫仑能够抑制SW480结肠癌细胞的侵袭(见图 3)。
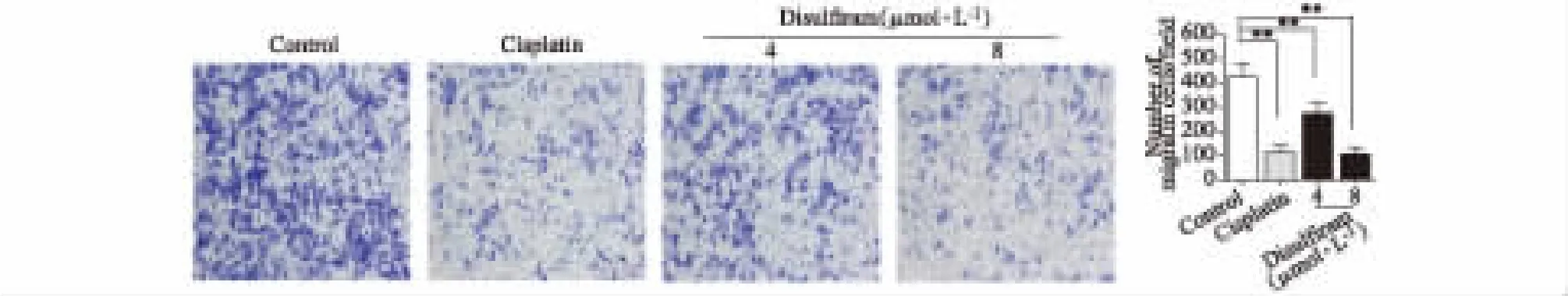
图3 双硫仑对SW480细胞侵袭的影响(x±s,n=3)
3.4 双硫仑对裸鼠移植瘤的抑制作用
裸鼠皮下移植瘤实验结果显示,双硫仑20 mg·kg-1组和40 mg·kg-1组均能减少SW480裸鼠皮下移植瘤的体积和瘤重,且与模型组相比具有显著性差异(P<0.01)。结果表明,双硫仑能够抑制SW480裸鼠皮下移植瘤的体内生长(见图4)。
3.5 双硫仑对GLUT1、HIF-1α因子表达的影响
结肠癌细胞体内生长极为迅速,因此伴随着HIF-1α高表达,同时HIF-1α能够促进结肠癌组织GLUT1表达增加,以促进肿瘤糖摄取和能量代谢[9],因此采用免疫组化检测肿瘤组织中的HIF-1α和GLUT1表达水平。结果显示,在裸鼠移植瘤组织中,双硫仑 20 mg·kg-1和 40 mg·kg-1均能够降低 HIF-1α和GLUT1的蛋白表达。实验结果表明,双硫仑可能通过下调HIF-1α和GLUT1蛋白的表达,起到抑制肿瘤生长的作用(见图5)。

图4 双硫仑对SW480细胞裸鼠皮下移植瘤的体内生长的影响,n=6)
4 讨 论
双硫仑是一种临床广泛使用的戒酒药物,鉴于其具有安全无毒且潜在的抗肿瘤作用,使得对于研究双硫仑的抗结肠癌作用及揭示其作用机制、开发新的抗结肠癌化疗药物具有重要的意义。殷文静等[10]研究发现,采用双硫仑单用或者联合顺铂共用,均具有促进宫颈癌HeLa细胞凋亡的作用,表明双硫仑具有潜在的抗癌价值。因此本研究对双硫仑抗结肠癌的作用及机制进行初步探索,并采用顺铂作为阳性药进行比较。
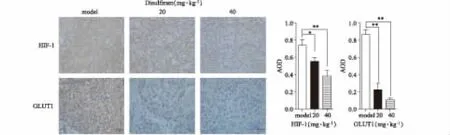
图5 双硫仑对SW480细胞裸鼠皮下移植瘤HIF-1α、GLUT1的影响(x±s,n=6)
本研究表明,单独使用双硫仑能够明显抑制体外SW480结肠癌细胞和体内移植瘤的增殖和生长,24 h 和 48 h 的 IC50分别为 42.12 μmol·L-1和 33.77 μmol·L-1,同时双硫仑能够抑制SW480细胞体外迁移和侵袭能力,其抑制作用与顺铂相近。鉴于结肠癌具有增殖迅速、能量代谢旺盛等特点,因而选取了缺氧诱导因子HIF-1[11]和葡萄糖转运体GLUT1[12]对双硫仑抑制SW480细胞恶性生物学行为的机制进行探讨。研究已表明,肿瘤细胞最主要的特征是失控性生长,急剧生长的肿瘤细胞对于氧和糖的需求极其旺盛,为了维持其自身生长和增殖,则会调控一系列分子生物学反应来维持对氧和糖的获取。HIF-1是一种肿瘤组织细胞适应缺氧环境的关键调控因子,能在缺氧状态下维持细胞氧的稳态。同时,肿瘤细胞也能够通过HIF-1促进下游的GLUT1蛋白表达,增加肿瘤细胞葡萄糖的摄入,维持其能量代谢水平,进而促进增殖、生长、迁移和侵袭。因而开展肿瘤细胞和组织中的HIF-1和GLUT1蛋白表达的研究,对于揭示双硫仑抗肿瘤的作用显得尤为重要。免疫组化结果表明,模型组结肠癌移植瘤组织中HIF-1和GLUT1蛋白水平相对较高,这与文献报道一致[12],而给予双硫仑治疗后移植瘤中的HIF-1和GLUT1蛋白水平明显降低,表明双硫仑可能通过抑制结肠癌细胞内HIF-1和GLUT1蛋白水平,调控细胞能量代谢,从而起到抗结肠癌的作用。
综上所述,双硫仑能够抑制结肠癌细胞的增殖、生长、迁移和侵袭,并发现其作用机制可能与抑制肿瘤细胞HIF-1和GLUT-1蛋白表达水平、调控能量代谢有关,这也提示下一步实验将采用基因敲除等方式来研究双硫仑抗结肠癌的作用机制。本研究表明,双硫仑是一个具有潜在研究价值的抗肿瘤药物,具有较好的研发前景。
