藜麦麸皮不同极性部位的抑菌及酪氨酸酶抑制活性研究
2019-04-15,,,,,*,,*
,, ,, ,*,,*
(1.潍坊医学院公共卫生与管理学院,“健康山东” 重大社会风险预测与治理协同创新中心,山东潍坊 261053;2.中国海关潍坊出入境检验检疫局,山东潍坊 261041)
藜麦(ChenopodiumquinoaWilld,Amaranthaceae)是一种在安第斯山区广泛种植的一年生双子叶“假谷物”,属于藜科,由于其丰富的营养价值而被国内外研究学者所广泛关注。藜麦中含有大量有益健康的植物化学物质,包括皂苷、类黄酮、植物激素、植物甾醇类化合物、酚醛树脂和生物活性肽[1-2]。皂苷是一类苷元为三萜或螺旋甾烷类化合物的糖苷,其中藜麦皂苷属于五环三萜类的齐墩果烷型皂苷,由苷元与一个或多个糖基组成[3]。藜麦皂苷按照苷元不同可以分为三类,分别为商陆酸皂苷(Phytolaccagenic acid,PA)、常春藤皂苷(Hederagenin,Hed)、齐墩果酸皂苷(Oleanolic acid,OA)。藜麦皂苷主要分布在藜麦麸皮(即藜麦的外种皮)中[4],皂苷味苦,食用前常通过水洗或者研磨去除[5],所以藜麦实际加工过程中会产生大量的藜麦麸皮。如果可以利用藜麦麸皮,就能提高藜麦的综合利用价值。
国际上对藜麦的研究方兴未艾,然而国内对藜麦的研究却起步较晚[6],目前研究主要集中在藜麦引种、栽培、品种选育、种植等领域,个别研究者对藜麦中的营养成分、矿物元素进行了测定[7-8];功能性成分方面,主要集中在藜麦总黄酮的提取、纯化及抗氧化活性研究[9-13];关于藜麦皂苷的研究多集中在藜麦总皂苷的提取优化[14]以及含量的测定上[15-16]。仅有几篇关于藜麦麸皮皂苷的研究,主要为藜麦麸皮的营养成分测定[17]、麸皮皂苷的提取优化[18]以及抗氧化性[19]上,但对于藜麦麸皮皂苷的抑菌活性研究较少,藜麦麸皮皂苷对于酪氨酸酶的抑制活性以及皂苷的裂解规律尚无人研究。
针对以上对于藜麦麸皮皂苷研究领域的不足,本实验选择藜麦麸皮作为研究对象,旨在研究藜麦麸皮不同萃取部位对金黄色葡萄球菌、表皮葡萄球菌、沙氏肠炎杆菌和铜绿假单胞菌四种致病菌的体外抑菌实验,探究其抑菌活性,为藜麦麸皮中的活性物质在抗菌感染方面的开发和利用提供参考依据;酪氨酸酶是黑色素形成的关键酶[20],以酪氨酸酶活性的抑制率为考核指标,观察抑制效果,为藜麦麸皮中的活性物质作为酪氨酸酶的天然抑制剂应用于生产中提供实验依据;利用质谱分析皂苷的裂解规律,可以为以后研究藜麦麸皮皂苷的构效关系奠定数据基础。
1 材料与方法
1.1 材料与仪器
藜麦麸皮 山西灰藜品种,购自山西省静乐县山西亿隆藜麦有限公司,粉碎机粉碎后过60目筛子筛选备用;无水乙醇、石油醚(60~90 ℃沸程)、乙酸乙酯、正丁醇、高氯酸、冰醋酸、香草醛 分析纯,国药集团化学试剂有限公司;甲醇、乙腈 色谱级,北京汇海科仪科技有限公司;商陆皂苷甲标准品 纯度>99%,上海源叶生物科技有限公司;青霉素 80万单位,山东鲁抗医药股份有限公司;头孢克肟 抗之霸,100 mg/片,天津华津制药有限公司;L-Dopa 纯度>99%,上海浩然生物公司;酪氨酸酶 ACT=570 U/mg,上海拜朗生物科技有限公司;硅藻土、普通肉汤培养基、琼脂、直径5 mm的纸片、96孔板;液相色谱与质谱用水为超纯水,其余用水为蒸馏水;金黄色葡萄球菌(bio-090809)、表皮葡萄球菌(bio-84876)、沙氏肠炎杆菌(bio-85090)、铜绿假单胞菌(bio-80513) 购自广东省微生物菌种保持中心。
PALL-cascade超纯水制备机 济南东岱科学器材有限公司;YXQ-LS-70A型立式压力蒸汽灭菌器 上海博讯实业有限公司;BPMJ-150F型霉菌培养箱 上海一恒科学仪器有限公司;SW-CJ-2F型双人双面净化工作台 苏州净化设备有限公司;RE-201D型旋转蒸发仪 郑州长城科工贸有限公司;HH-4型数显恒温水浴锅 常州国华电器有限公司;AR224CN电子天平 常州奥豪斯仪器有限公司;KQ-500DE型数控超声波清洗器 昆山市超声仪器有限公司;U-500可见分光光度计 上海元析科技有限公司;多功能粉碎机 广州市大祥电子机械设备有限公司;Shimadzu LC-20AT高效液相色谱仪 日本岛津;Agilent-1260安捷伦高分辨液相质谱联用仪 美国安捷伦科技有限公司;CT-3质构仪 倍迎电子科技(上海)有限公司;酶标仪 南京贝登医疗股份有限公司;Omega高速冷冻离心机 上海精宏实验设备有限公司。
1.2 实验方法
1.2.1 不同极性部位的提取 参考Medina-Meza I G等[21]制定提取步骤。称取藜麦麸皮粉末100 g,加入8倍量体积的75%乙醇提取,超声震荡40 min,静置2 h,纱布过滤,得上清液1;向剩余的滤渣内加入6倍量体积的75%乙醇继续提取,超声震荡30 min,静置2 h,抽滤得上清液2。两次上清液混合,旋转蒸发回收乙醇;分别用石油醚、乙酸乙酯和正丁醇依次萃取乙醇提取液2~3遍,得到相应的萃取层;将萃取层溶液依次旋转蒸发,回收石油醚(60 ℃)、乙酸乙酯(55 ℃)和正丁醇(60 ℃);萃取完后剩余的溶液为水层,将各萃取层放入已恒重的蒸发皿当中,待挥发至干后称重,计算各层得率,得率(%)=(m2-m1)/100×100,其中m1为恒重后蒸发皿的重量(g),m2为蒸发皿与萃取层的总重量(g),100为藜麦麸皮的重量(g)。
1.2.2 不同极性部位待测原液的配制 正丁醇层:取正丁醇层物质8.3 mg,溶解于2 mL的甲醇中,浓度为4.15 mg/mL;乙酸乙酯层:取乙酸乙酯层物质8.4 mg,溶解于2 mL的甲醇中,浓度为4.2 mg/mL;石油醚层:取石油醚层物质8.4 mg,溶解于2 mL的石油醚中,浓度为4.2 mg/mL;水层:取水层物质8.3 mg,溶解于2 mL的水中,浓度为4.15 mg/mL。
1.2.3 培养基的配制 取普通肉汤液体培养基,超纯水溶解,并不停搅拌,装入带棉花塞的三角烧瓶中,121 ℃高压灭菌15 min,待用。
1.2.4 菌液的配制 将四种细菌进行活化,分别取200 μL的菌液于25 mL的普通肉汤液体培养基中,37 ℃下进行培养,观察并校正菌液浓度,使其相当于0.5麦氏比浊标准,此时含菌量约为1.5×108CFU/mL,即为受试菌种的菌悬液,稀释后的菌悬液在15 min内接种。
1.2.5 纸片法测定藜麦麸皮不同萃取物的抑菌活性 依据参考文献[22],取24片直径为5 mm的经高压灭菌后的纸片,分为6组,用铅笔标记1~6,重复4次;用移液枪准确移取10 μL的正丁醇层溶液打到1号纸片上,待其挥干,再次打入10 μL,总共打五次,乙酸乙酯层、石油醚层、水层溶液操作与正丁醇层相同,依次打入2~4号纸片上;对照选用1 mg/mL的青霉素与1 mg/mL的头孢克肟,取10 μL分别打入5、6号纸片上,对照组仅打一次;吸取制备好的菌悬液20 μL打入600 mL的生理盐水中,涡旋振荡器中充分振荡摇匀,倒入固体培养基中,使其刚好铺满培养基的表面,将纸片有间隔的放入固体培养基中;做好的培养皿放入培养箱中37 ℃进行培养,6 h后观察是否有抑菌圈并测量抑菌圈的大小,记录实验数据。
1.2.6 最低抑菌浓度与最低杀菌浓度的测定 参考Xue P等[23],利用二倍稀释法将有抑菌活性的待测原液依次稀释,反复吹打,使其浓度分别为4.15、2.08、1.04、0.52、0.26、0.13 mg/mL,对照品的浓度依次稀释为1、0.5、0.25、0.125、0.0625、0.03125 mg/mL。取无菌96孔板,向A1-A6、B1-B6、C1-C6中依次加入稀释后的待测原液,A-C为三组平行,D1-D6、E1-E6分别加入青霉素与头孢克肟的稀释液作为阳性对照,F1-F3为不加药物的无菌液体培养基作为阴性对照,再向各个孔内加入菌液100 μL,此时药物浓度变为原来的一半。将制作好的96孔板放入37 ℃培养箱中进行孵育12 h后观察,阴性对照孔应有细菌生长,否则实验无效,以肉眼未见生长菌落的最低药物浓度为待测溶液对受试菌种的最低抑菌浓度(minimum inhibitory concentration,MIC),记录数据。再次孵育12 h后观察,以不生长菌落的最低药物浓度为待测溶液对受试菌种的最低杀菌浓度(minimum bactericidal concentration,MBC),记录数据。
1.2.7 酪氨酸酶的抑制率的测定 配制浓度依次为1、0.5、0.25、0.125、0.0625 mg/mL的萃取层溶液与VC对照液,根据表1的反应体系,在37 ℃水浴锅中反应15 min后,取200 μL反应液加入到96孔板中,用酶标仪在475 nm下检测各萃取层的吸光度。不同浓度的VC溶液作为阳性对照,三次实验取平均值,计算各萃取层对酪氨酸酶的抑制率[21],抑制率(%)=[1-(C-D)/(A-B)]×100。

表1 反应体系的组成Table 1 Composition of the reaction system
1.2.8 液质联用定性分析正丁醇层
1.2.8.1 液相色谱条件 色谱柱:Agilent ZORBAX SB-C18柱(100 mm×3 mm,1.8 μm);柱温:40 ℃;进样量:20 μL;流动相A:0.1%甲酸水溶液;流动相B:甲醇;梯度洗脱[24](流动相B浓度):0~5 min,0~5%,5 min~10 min,5%~90%,10 min~15 min,90%~98%,15 min~30 min,98%~5%,流速为0.3 mL/min。
1.2.8.2 质谱条件 离子源:电喷雾离子源(ESI);扫描模式:正离子(ESI+);解离方式:碰撞诱导解离;载气(N2);鞘气流速:35 arb;辅助气流速:10 arb;毛细管电压5000 V;毛细管温度:320 ℃;电喷雾电压3500 V;分辨率:50000;离子源温度:200 ℃。
1.2.9 高效液相色谱法与分光光度法定量分析正丁醇层
1.2.9.1 标准品与待测样品的配制 准确称取1.5 mg商陆皂苷甲标准品与正丁醇层物质,分别溶解于甲醇中,定容到10 mL的容量瓶中,得到浓度为0.15 mg/mL的标准品溶液与待测液。
1.2.9.2 高效液相条件 色谱柱:YMC ODS-Pack(4.6 mm×250 mm,5 μm);流动相:A(水),B(乙腈);洗脱条件[25](流动相B的浓度):5 min 10%;10 min 15%;15 min 20%;35 min 28%;50 min 40%;60 min 60%;70 min 70%;80 min 70%;90 min 10%;柱温:30 ℃;检测波长:202 nm;流速:1 mL/min。
1.2.9.3 标准曲线的建立与样本含量的测定 吸取1 mL标准溶液,过0.45 μm微孔滤膜备用,将标准溶液在液相色谱的洗脱条件下进行洗脱,进样量分别为5、10、15、20、25 μL记录数据,按照色谱图以皂苷含量为横坐标,以峰面积积分值为纵坐标建立标准曲线;将样品液过0.45 μm滤膜后按照上述方法进样20 μL,得到峰面积图,根据标准曲线确定皂苷含量。
1.2.9.4 分光光度法分析测定正丁醇层 移取0、0.2、0.4、0.6、0.8、1.0 mL标准溶液于10 mL的玻璃管当中,每组三个平行,水浴锅70 ℃下挥发至干,依次加入0.2 mL的香草醛-冰醋酸溶液和0.8 mL的高氯酸溶液,摇晃均匀后于60 ℃下恒温水浴15 min,流动冷水冷却5 min,加入5 mL的冰乙酸稀释,静置30 min后于可见分光光度计下560 nm处测量吸光度值,以含量为横坐标,吸光度值为纵坐标建立标准曲线;同时吸取0.5 mL的平行样品液三份按照上述方法测量吸光度值,以不加样品的平行样作空白,根据标准曲线确定含量[15]。
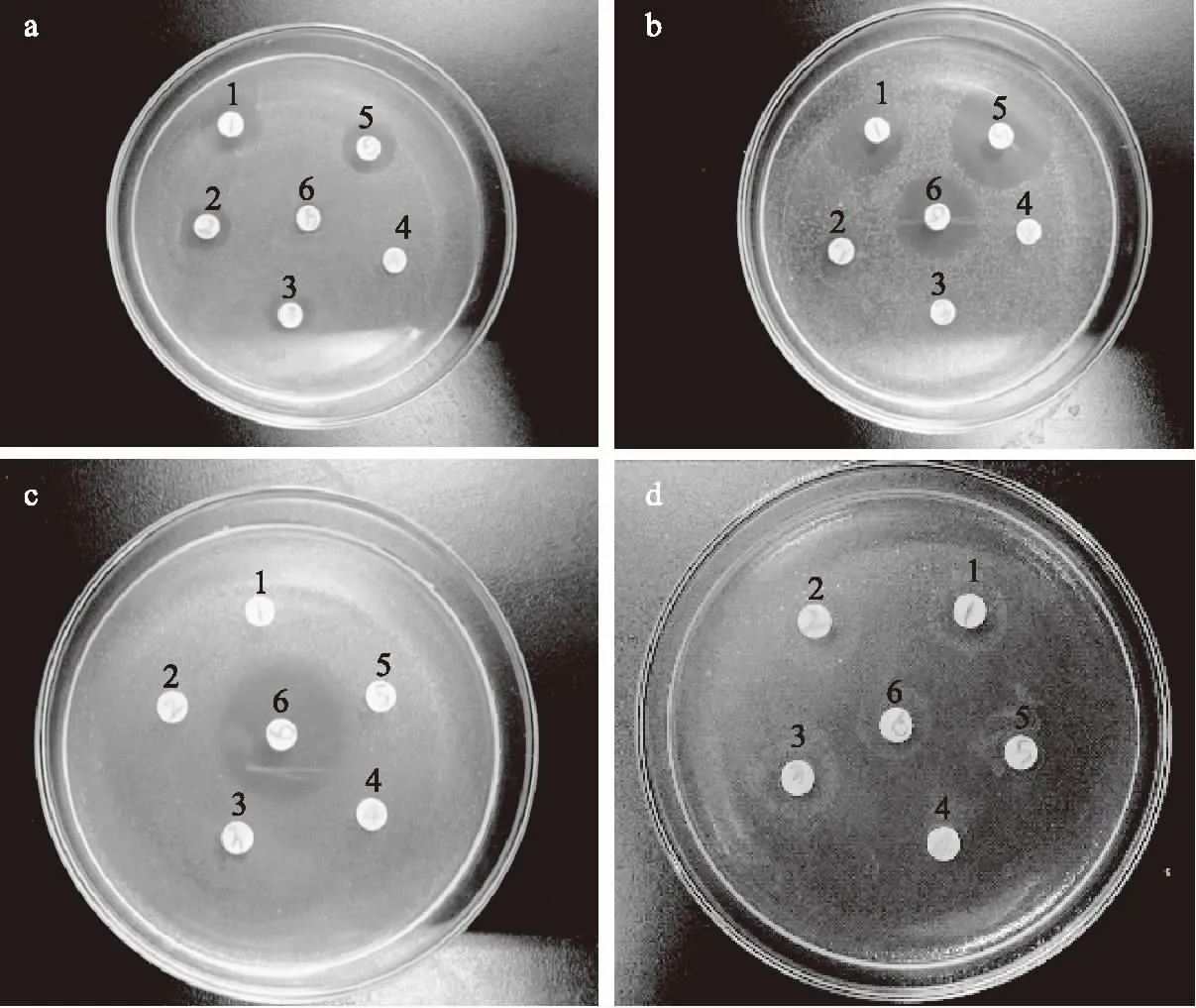
图1 各极性部位抑菌情况Fig.1 Bacteriostatic effects of polar regions注:a~d依次为Sau,Sep,Se,Pae;分别代表金黄色葡萄球菌、表面葡萄球菌、沙氏肠炎菌、铜绿假单胞菌;1~6号分别为正丁醇萃取物、乙酸乙酯萃取物、石油醚萃取物、水萃取物、青霉素与头孢克肟,下同。
1.3 数据统计分析
每组实验重复3~4次以减小实验误差,采用SPSS 17.0对数据进行处理分析。测定结果用平均值±标准差的形式表示。实验数据采用单因素方差分析的LSD两两比较,以p<0.05表示有差异性。
2 结果与分析
2.1 藜麦麸皮各极性部位得率
由表2可知,四种极性部位的得率依次为7.52%±0.8569%、0.61%±0.0741%、2.28%±0.4370%、11.08%±0.9884%,水层得率最高,其次为正丁醇层,说明藜麦麸皮中含有较多的水溶性物质例如水溶性的蛋白以及多糖等。

表2 藜麦麸皮各极性部位得率(%)Table 2 The obtain rate of the polarity of the quinoa bran(%)
2.2 藜麦麸皮各极性部位的抑菌效果
与青霉素和头孢克肟的抑菌圈大小作对比见表3,正丁醇层物质对金黄色葡萄球菌[(15.81±0.82) mm]和表皮葡萄球菌[(14.17±1.05) mm]有较大明显的抑菌圈,对沙氏肠炎杆菌和铜绿假单胞菌没有抑菌圈出现,说明此萃取层对革兰阳性菌较敏感而对革兰阴性菌无明显效果;乙酸乙酯层物质和石油醚层物质仅对金黄色葡萄球菌(10.08±0.26)、(9.92±1.21) mm有一定的抑制作用,对其余三种菌没有抑制作用,说明这两种萃取层可能只对部分革兰阳性菌有抑制效果;水层物质对四种细菌都没有抑菌作用,说明水层内没有抑菌物质的存在;青霉素只对革兰阳性菌有抑制效果,所以对沙氏肠炎和铜绿假单胞菌两种革兰阴性菌没有抑制效果;头孢克肟对部分革兰阳性菌(表皮金黄色葡萄球菌)与部分革兰阴性菌(沙氏肠炎杆菌)有抑制效果。
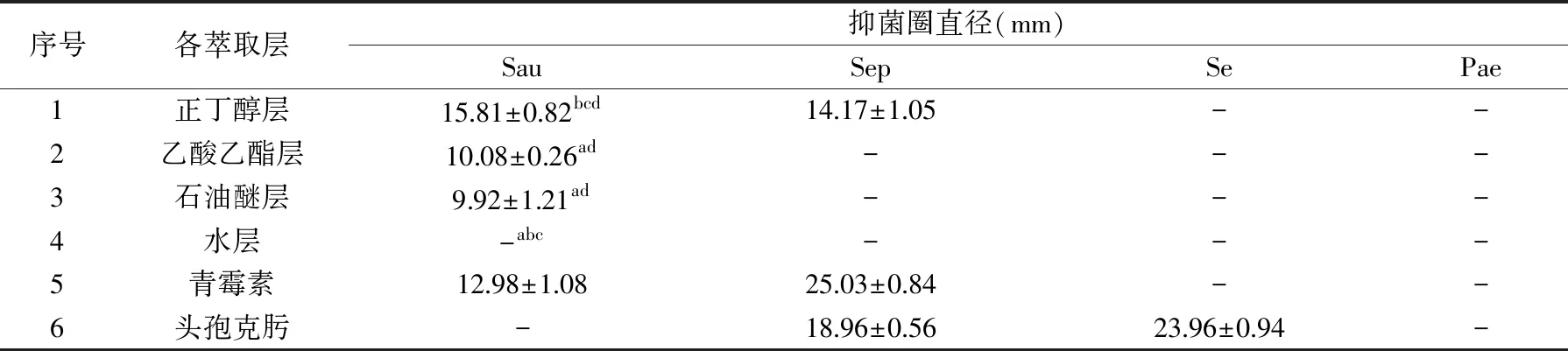
表3 抑菌圈直径的测定Table 3 Diameter of the antibacterial ring
由于青霉素是一种仅对革兰阳性菌表现出杀菌效果的广谱抗生素,所以加入另一种抗生素头孢克肟来增强对照,头孢克肟属于三代头孢类抗生素,对部分革兰阴性菌也存在杀菌效果,结合两种对照品,可以使实验结果更加可靠。其余研究显示,黎药角花胡颓子[26]、地绵草[27]、绵马贯众[28]、米口袋[29]、粗壮女贞[30]的正丁醇萃取层都具有一定的抑菌活性,其中地绵草与绵马贯众活性最高的萃取部位为氯仿萃取部位。其最高纸片药物含量分别为14、5 mg时,对金黄色葡萄球菌的抑菌圈直径分别为9.6与9.93 mm,均小于本实验活性最高的正丁醇层(药物含量为200 μg,抑菌直径为15.81 mm),正丁醇层具有良好的抑菌活性。
2.3 抑菌圈大小的测定与比较
对于方差齐性的检验,p<0.05,表明方差齐性。单因素方差分析显示数据之间比较有差异性,两两比较发现,石油醚层与乙酸乙酯层相比较,p>0.05,说明两者之间比较无统计学差异;正丁醇层与其他三种提取层比较,均p<0.05,说明之间的差异具有统计学意义,且正丁醇层的抑菌效果要优于其余萃取层。
2.4 MIC、MBC的测定结果
由表4知,活性最高的正丁醇层物质对金黄色葡萄球菌的MIC值为1.04 mg/mL,MBC值为2.08 mg/mL;对表皮葡萄球菌的MIC值为0.52 mg/mL,MBC值为1.04 mg/mL,且对表皮葡萄球菌的抑制效果要优于金黄色葡萄球菌。杜静婷[31]的研究也发现,正丁醇萃取物在浓度为1 mg/mL的时候,就可抑制金黄色葡萄球菌的活性,抑制率为11.44%,与测定的MIC值相同,说明在正丁醇层萃取物的浓度达到1 mg/mL时便可以抑制金黄色葡萄球菌的生长,推测原因可能是因为正丁醇层萃取物质可以使细菌的细胞壁破裂,使细胞内容物分散不均匀而引起的;而徐晓敏[32]的实验发现,正丁醇层萃取的物质对于金黄色葡萄球菌较为敏感,其MIC=0.625 mg/mL,与本实验MIC浓度相差近一倍,分析原因其一可能是由于实验用的菌种来源不同导致耐药强度不相同,其二为萃取层物质纯度不相同,其三是细菌的浓度不相同而导致。

表4 金黄色葡萄球菌、表皮葡萄球菌的MIC、MBC(mg/mL)Table 4 MIC,MBC of Staphylococcus aureus and Staphylococcus epidermidis(mg/mL)
2.5 藜麦麸皮各提取层对酪氨酸酶的抑制结果
藜麦麸皮各提取层对酪氨酸酶的抑制效果见表5。由表5可知,与阳性对照VC相比较,在浓度为1 mg/mL时,正丁醇层、乙酸乙酯层、石油醚层对于酪氨酸酶的抑制率分别为55.86%±0.67%、47.81%±1.25%、28.54%±1.53%,但当浓度减为0.5 mg/mL时,乙酸乙酯层与石油醚层的抑制率降低为25.24%±2.12%、8.65%±1.64%,利用LSD方差分析对抑制率进行两两比较,p值均小于0.05,说明不同极性部位对于酪氨酸酶的抑制率之间的差异具有统计学意义,正丁醇层物质对于酪氨酸酶的抑制作用最好且相对稳定。而水层对于酪氨酸酶没有抑制作用,原因可能为水层内大部分物质为粘性多糖,活性物质较少。与王建华等[33]的研究相比,在浓度同为1 mg/mL的时候,正丁醇层物质对于酪氨酸酶的抑制率要大于当归(35.8%)、桔梗(21.6%)、灵芝(9.6%),但比芦荟(74.2%)的抑制率要低;李俊强等[34]研究发现,在甘草总皂苷浓度为2 mg/mL时对于酪氨酸酶的抑制率为50.67%,与正丁醇层1 mg/mL的抑制率大致相同,说明正丁醇层物质的活性要优于甘草皂苷。

表5 各萃取层对于酪氨酸酶的抑制率(%)Table 5 Inhibitory rate of each extraction layer on tyrosinase

图2 各萃取层对酪氨酸酶抑制率Fig.2 Inhibitory rate of each extraction layer on tyrosinase
2.6 LC-MS/MS谱图
按照文献裂解规律[35],以最高峰保留时间RT(retention time)为7.88分钟峰为例,如图7:

图3 正丁醇层的总离子流谱图Fig.3 Ion flow chart of n-butanol layer

图4 正丁醇层7.88分钟离子碎片图Fig.4 Ion fragments of n-butanol layer in 7.88 min

图5 离子碎片的裂解规律Fig.5 Rule of ion fragmentation

图6 正丁醇层液相图Fig.6 N-butanol chromatography

图7 商陆皂苷甲标准曲线Fig.7 The standard curve of Esculentoside A
在初始质核比m/z=973下,经过一系列的裂解,首先脱掉两分子葡萄糖(Glucose)与一分子阿拉伯糖(Arabinose),m/z=973→811→649→517,随后脱掉两分子的H2O与C=O基团,m/z=517→499→481→453,最后脱掉一分子的H2O,m/z=453→435。脱掉糖链后为商陆酸皂苷的母核结构,此裂解方式也与商陆酸皂苷的裂解规律相吻合,所以可以确定7.88 min峰为商陆酸皂苷的离子峰,以此类推,正丁醇层的物质归类如下:

表6 正丁醇层物质归类Table 6 N-butyl alcohol layer material classification
由此可推断出正丁醇层的主要活性物质为皂苷。
2.7 定量分析皂苷含量
由于齐墩果酸皂苷与常春藤皂苷的标准品较难获得,所以本实验采用商陆皂苷甲标准品来建立含量测定方法[15]。
2.7.1 HPLC法测皂苷含量 根据液相与质谱的比对,47.5与53.7 min的峰为商陆酸皂苷PA,82.5 min的峰为齐墩果酸皂苷OA。商陆皂苷甲液相色谱法的标准曲线方程为Y=227829X-573,R2=0.9978,代入待测样品的峰面积得到皂苷含量为1.242 μg,计算后藜麦麸皮中皂苷纯度为61.6%。
2.7.2 分光光度法测皂苷含量 商陆皂苷甲分光光度法的标准曲线方程为Y=0.0053X-0.007,R2=0.9991,表明含量与吸光度值具有良好的线性关系。测得正丁醇层皂苷的吸光度平均值为0.159,带入公式得正丁醇层皂苷含量为31.32 μg,计算藜麦麸皮正丁醇层皂苷的纯度为62.6%。
3 结论
根据实验可知,在藜麦麸皮的四种萃取层中,正丁醇层的活性最高,通过二级质谱以及离子流谱图、碎片裂解规律分析得到正丁醇层所含的主要活性物质为藜麦皂苷,液相法与分光光度法定量测得藜麦皂苷的纯度分别为61.6%与62.6%。藜麦皂苷对金黄色葡萄球菌和表皮葡萄球菌的抑制作用较为明显,其抑菌圈直径分别为(15.81±0.82)与(14.17±1.05) mm;最低抑菌浓度MIC值分别为1.04与0.52 mg/mL,而对革兰氏阴性细菌没有表现出抑制活性,说明藜麦麸皮皂苷对革兰阳性菌较为敏感。金黄色葡萄球菌以及表皮葡萄球菌作为临床上常见的耐药性致病菌,随着抗生素的大量滥用,已表现出很强的耐药性。所以,将藜麦皂苷进行进一步的分离纯化后应用到临床治疗上也契合当今社会的医学发展理念,在提高了藜麦麸皮的利用价值的同时也为开发中药抗菌药,攻克细菌耐药性提供新的思路;对于酪氨酸酶的抑制,四种萃取层表现出不同的活性,正丁醇萃取层在浓度为1 mg/mL时对于酪氨酸酶的抑制率为55.86%±0.67%,效果是同浓度VC对照品抑制率的58.96%,说明藜麦麸皮皂苷对于酪氨酸酶的抑制效果好且稳定,可以作为一种天然的抑制剂应用到美白护肤品中,可以用来预防黑色素的沉积和黑色素瘤等,在化妆品领域有着非常广阔的应用前景。但是由于藜麦麸皮皂苷没有进行分离纯化,高纯度的藜麦皂苷是否具有更好的抑菌以及抑制酪氨酸酶的活性效果以及藜麦皂苷的抑菌机理有待进一步的实验验证。
