PRP、PRF联合脂肪来源干细胞治疗慢性皮肤溃疡研究
2019-03-17宋良萍
陈 阳,宋良萍,何 宇,陈 瑛,彭 铮
(1 福州市皮肤病防治院整形美容外科,福建 福州,350025;2 福州国际旅行卫生保健中心,福建 福州,350001)
糖尿病、创伤感染、动脉供血不足、静脉回流不畅以及压迫等因素引起的慢性皮肤溃疡,是临床上的常见病、多发病[1]。流行病学调查显示,目前以糖尿病继发足部皮肤溃疡为最常见,仅我国就早已有1000万以上的糖尿病足患者,其中又以老年人居多;因组织再生修复能力差,溃疡经久不愈,或愈后又迅速复发,形成难愈性溃疡,其创面修复一直是医学上的难题[2,3]。脂肪来源干细胞(adiposederived stem cell,ADSC)是一种具有多项分化潜能的多能干细胞,来源丰富,分离培养容易,自体应用无免疫排斥反应和继发传染病风险,已成为组织工程研究中常用的种子细胞[4-7]。近年的研究表明其对心、肺、皮肤、肌肉等组织创伤具有促进愈合和功能恢复的作用[8,9]。富血小板血浆(platelet rich plasma,PRP)是通过离心分离自体全血而得到的血小板浓缩物,经激活后能释放出大量高浓度的生长因子,刺激细胞增殖分化及新组织的形成,从而促进创伤的修复和愈合[10-13]。而富血小板纤维蛋白(platelet rich fibrin,PRF),是一种富含细胞因子和生长因子的自体来源的新型生物材料,被誉为新一代血小板浓缩物;其分子结构类似天然血凝块,为组织细胞提供迁移、增殖和分化的场所[14-16]。为此,我们开展PRP、PRF联合脂肪来源干细胞治疗皮肤溃疡的实验研究,以观察它们对皮肤溃疡修复的效果,以期为其临床应用提供科学依据。
1 材料和方法
1.1 材 料
1.1.1 实验仪器超净工作台(苏州智净净化设备有限公司)、CO2培养箱(美国Thermo公司)、倒置显微镜、荧光显微镜(日本Olympus公司)、轮转式切片机(RM2235型,LEICA公司)、病理组织漂烘仪(tec 2500型、常州市郝思琳仪器设备有限公司)、显微镜(BX43型,OLYMPUS公司)、移液器(北京大龙兴创实验仪器有限公司)、细胞培养皿/细胞培养板(美国Fisher Scientific公司)、低速自动平衡离心机(TDZ4-WS型,湖南湘仪)、台式高速冷冻离心机(湖南湘仪实验仪器公司,型号TGL-16)、台式低速离心机(上海卢湘仪离心机仪器公司,型号TDZ4-WS)、倒置生物荧光显微镜(IX73型,Olympus公司)等。
1.1.2 实验试剂DMEM培养基(Gibco公司)、SD大鼠脂肪间充质干细胞完全培养基、胰酶、I型胶原酶(美国Gibco公司)、胎牛血清(Gibco公司)、HaCaT细 胞(赫贝公司细胞库)、纤维蛋白胶(广州倍绣公司),Tegaderm(3M公司),抗体(AnaSpec公司),苏木精(sigma公司),伊红(sigma公司),青霉素钠、青霉素钠(美仑生物公司)、DAPI、D9542(sigma公司)、细胞角蛋白antibody(proteintech公司)、生理盐水(辰欣药业有限公司)
1.1.3 实验动物与饲养24只SD大鼠购自上海斯莱克有限公司,SCXK(沪)2017-0005,合格证号:20170005004523。饮用水为超纯水。实验动物房使用许可证号为SYXK(浙)2015-0008,饲养环境:温度范围20~25℃,相对湿度范围 40~70%。实验前在动物房适应性喂养一周,饲料由江苏协同生物工程有限责任公司提供,执行标准 GB14924.3-2010《实验动物配合饲料营养成分》。
1.2 方法
1.2.1 SD大鼠脂肪组织来源干细胞(ADSCs)的分离、培养取8周龄SD大鼠4只,10 g/L戊巴比妥钠腹腔注射麻醉,750 ml/L乙醇消毒腹股沟处,无菌条件下取腹股沟部的脂肪组织约5g,去除血管及其它组织,用含青、链霉素的PBS反复冲洗以除去血液。用剪刀将脂肪组织剪成1mm3小块,置于12.5 ml I型胶原酶中,37℃摇床100 r/min消化50 min,然后800r/min离心5 min,弃去上层的脂肪及上清,沉淀物用含100 ml/L胎牛血清的DMEM培养基制成单细胞悬液,进行细胞计数,以2×105/ml的密度接种于培养瓶中,置于37℃、50 ml/L CO2培养箱中常规培养,原代2 d后换液,细胞长满80%时用胰酶和EDTA消化传代培养。
1.2.2 SD大鼠脂肪组织来源干细胞(ADSCs) 体外成表皮诱导分化及免疫荧光鉴定第3代ADSCs细胞,用0.25% Typsin消化,1000rpm离心5min,计数板下计数,铺1个24孔板,选择4个孔每孔均加入5×104个细胞,分别放入培养箱中静置培养。细胞长满80%后,两个孔作为对照正常培养,另两个孔加入HaCaT细胞培养上清液联合表皮生长因子(EGF)10%作为培养基,2d换一次液,培养一个星期后。吸弃培养基,PBS洗3×3min,4%多聚甲醛室温固定20min,PBS洗3×3min,0.1%Triton X-100室温破膜20min,PBS洗3×3min,10% FBS室温封闭1h,PBS洗一遍,加入适当稀释比例的一抗(CK191:300),4℃孵育过夜,PBS洗3×3min,加入适当稀释比例的荧光二抗Donkey anti-Rabbit IgG (H+L)ReadyProbes™ Secondary Antibody(1:800),4℃避光孵育1h,PBS洗3×3min,加入10ng/ml的DAPI,4℃避光孵育10min;PBS洗3×3min,倒置荧光显微镜下观察拍照,完成免疫荧光检测。
1.2.3 SD大鼠脂肪组织来源干细胞(ADSCs) 体外成脂诱导分化及染色鉴定取第3代ADSCs细胞接种于预先放置玻片的6孔板内,用含100 ml/L FBS的DMEM培养基培养,达到80%融合后,用成脂诱导液(含1μmol/L地塞米松、10μmol/L牛胰岛素、200 μmol/L吲哚美辛、0.5 μmol/L的IBMX、10%FBS的DMEM/F12培养基)培养,观察细胞形态变化,20 d后用4%多聚甲醛固定,油红O染色。
1.2.4 SD大鼠脂肪组织来源干细胞(ADSCs) 体外成骨诱导分化及染色鉴定另取第3代ADSCs细胞,细胞培养板中加入成骨诱导液(含50μmol/L抗坏血酸、10 mmol/L的β-磷酸甘油钠、0.01μmol/L的维生素D及100ml/L FBS的DMEM/F12培养基)培养,3~4 d换液1次。培养10 d时,取部分细胞爬片行I型胶原免疫细胞化学染色。培养21 d时,取部分细胞爬片行von Kossa染色观察矿化结节的形成。
1.2.5 SD大鼠脂肪组织来源干细胞(ADSCs)体外成软骨诱导分化及染色鉴定再取第3代ADSCs细胞,细胞培养板中加入成软骨诱导液(含10%胎牛血清、10 μg/L TGF-β1、6.25mg/L胰岛素、6.25 mg/L转铁蛋白、50 μmol/L抗坏血酸-2-磷酸酯)培养,每2 d更换1次诱导培养基,21 d后行阿尔辛蓝染色,观察有无蓝色结节形成。
1.2.6 PRP制备抽取实验动物SD大鼠静脉血10ml,枸橼酸二钠抗凝,采用改良的Appel法分离提取PRP备用,同时进行全血及PRP血小板计数,以确保PRP中血小板数量是全血的4倍以上[17,18]。
1.2.7 PRF制备抽取实验动物SD大鼠静脉血10ml,置于无抗凝血酶的无菌试管中,立即将试管以3000r/min离心10min,静置后,血液样本分为3层,在位于底层的红细胞碎片和位于顶层的淡黄色澄清液体血小板血浆之间,取出中间层的淡黄色凝胶,即为富血小板纤维蛋白(PRF)。弃上清,去除凝胶状物底部的红细胞部分,获得初级的PRF凝胶,再将其静置于干燥消毒的容器内10min,使其自然收缩并释放其内的血清,或用无菌纱布吸附血清,同时经挤压塑形制备出具有一定形态、弹性及韧性的富血小板纤维蛋白膜[19,20]。
1.2.8 动物皮肤溃疡模型制备及治疗SD大鼠麻醉后于其背部脊柱两侧制作 6个1.5cm×1.5cm大小的全层皮肤缺损溃疡创面(图1),并随机分为A、B、C、D、E、F六组,给药治疗。A组创面注射PRF联合ADSCs治疗,B组创面注射PRF治疗,C组创面注射ADSCs治疗,D组创面注射ADSCs联合PRP治疗,E组创面注射PRP治疗,F组创面注射等量生理盐水(NS)治疗。治疗后7、14、21、28d溃疡创面取活检行组织病理学检查和观察溃疡愈合的速度和质量以及比较各自的表皮、真皮、成纤维细胞、血管及皮肤附属结构的再生情况。
2.实验结果
2.1 ADSCs的观察及多向诱导分化检测
显微镜下ADSCs呈长梭形生长,大小均匀一致,类似成纤维细胞(图2)。ADSCs细胞在HaCaT细胞培养上清液联合表皮生长因子(EGF)的体外诱导后,表皮细胞标志性蛋白细胞角蛋白含量明显增加,表明细胞诱导成功(图3)。ADSCs成脂诱导20d,看见细胞内充满圆形脂滴,呈单房或多房,油红O染色呈橘红色,说明为成熟脂滴(图4A)。成骨诱导21d,可见细胞聚集且表面形成不透光结节,茜素红染色呈红色,说明钙结节形成(图4B)。成软骨诱导21d,可见细胞聚集成团,阿新蓝染色呈蓝色结节,说明有软骨结节形成(图4C)。提示ADSCs在体外能够向脂肪、骨、软骨系细胞分化,有多向分化潜能,具有干细胞特性。

图1 SD大鼠背部皮肤溃疡模型
2.1 A、B、C、D、E、F六组动物实验结果
各组大鼠创面愈合效果良好,未出现感染等症状。7天时已无明显炎性细胞,伤口被结缔组织增生形成的肉芽组织填满,其内可见新生毛细血管,成纤维细胞等修复细胞;表皮层出现并增厚,逐渐向创口处迁移,再上皮化增生活跃(图5,图6)。14天时再上皮化阶段完成,肉芽组织被表皮覆盖,并逐渐纤维化,胶原纤维等含量显著增加,可见新生的毛囊、皮脂腺、汗腺、角质层等附属结构(图7,图8)。21天时,皮肤创面基本愈合,各组愈合速度无明显差异,同时毛囊、皮脂腺、汗腺、角质层等附属结构增多,肉芽组织逐渐向瘢痕组织转化,并进入组织重塑期(图9,图10)。28天与21天比较无明显变化,组织进入漫长重塑期(图11,图12)。愈合状况:D组(ADSC+PRP组)、A组(ADSC+PRF组)和C组(ADSC组)表皮较完整,血管新生明显增多,以D组最明显,A、C、E、B组依次,F组表皮迁移速度最慢,血管相对较少;新生毛囊明显增多,以D组最明显,A、C、E、B组依次,F组最少。
愈合速度与质量大致为ADSC+PRP>ADSC+PRF>ADSC>PRP>PRF>NS。

图2 ADSCs呈梭形(×40)
3 讨论
创面愈合是一个复杂而有序的生物学过程,呈现高度的整体性和网络性,在 机体的调控下,炎性细胞、修复细胞、细胞外基质及细胞因子等多因素相互协调,共同参与创面愈合[21]。一般认为创面修复缓慢甚至修复停止的原因主要有以下4种:①伤口感染或坏死组织存在;②伤口血供微循环障碍;③局部生长因子数量 减少,活性降低或多种生长因子网络调节失控;④修复细胞支架改变和过度凋亡,细胞膜上受体结构变化,导致生长因子与受体之间失偶联[22]。因此,移植补充新鲜的创面修复细胞和有活性的生长因子成为目前慢性溃疡创面修复领域研究的重点和热点。ADSC是存在于脂肪组织中的一类成体干细胞,具有来源丰富、取材方便、创伤小、体外分离培养容易、可塑性强、自体应用无免疫排斥反应和继发传染病风险等优势,已成为再生医学研究中很有前途的种子细胞[23]。本研究观察到ADSC对创面愈合具有一定的促进作用,推测这可能与干细胞具有补充和分化成为皮肤溃疡创面修复所需的多系细胞密切相关。另外,本研究还发现ADSC具有改善皮肤溃疡创面愈合质量的作用,使创面肉芽组织中成纤维细胞增多,功 能旺盛,血管密度提高,形成的新生表皮较完整、更厚。

图3 ADSCs成表皮细胞诱导分化及鉴定

图4 ADSCs成脂、成骨和成软骨诱导分化及鉴定
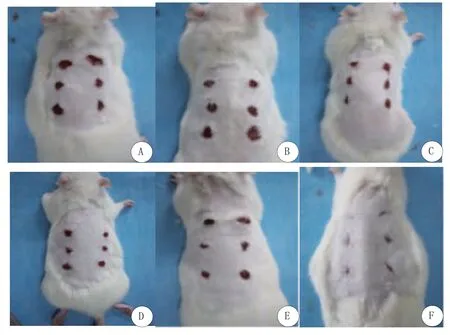
图5 六组SD大鼠背部皮肤溃疡治疗7天创面大体愈合情况

图6 六组SD大鼠背部皮肤溃疡治疗7天创面病理活检切片光镜下所见

图7 六组SD大鼠背部皮肤溃疡治疗14天创面大体愈合情况

图8 六组SD大鼠背部皮肤溃疡治疗14天创面病理活检切片光镜下所见

图9 六组SD大鼠背部皮肤溃疡治疗21天创面大体愈合情况
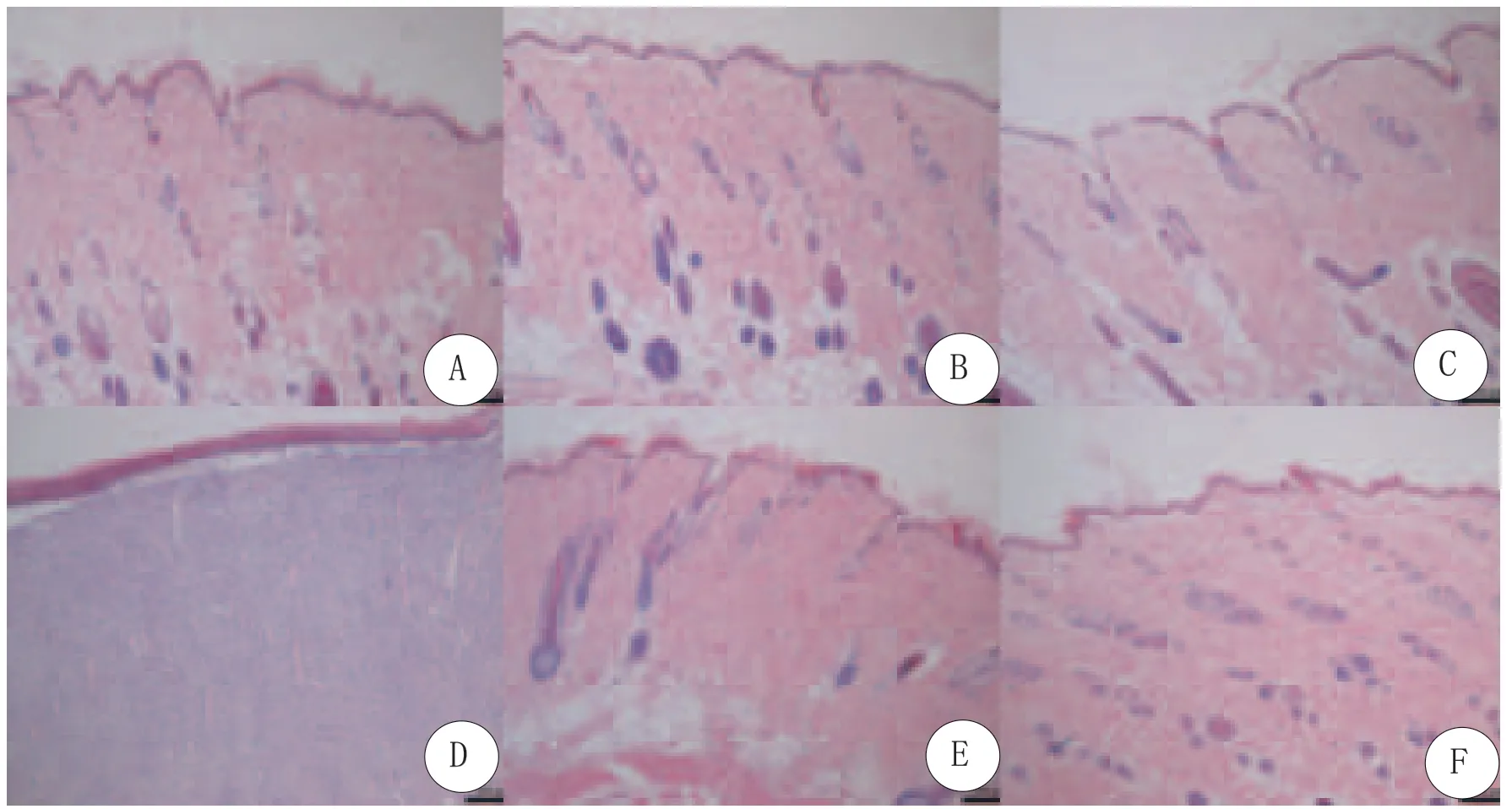
图10 六组SD大鼠背部皮肤溃疡治疗21天创面病理活检切片光镜下所见

图11 六组SD大鼠背部皮肤溃疡治疗28天创面大体愈合情况

图12 六组SD大鼠背部皮肤溃疡治疗28天创面病理活检切片光镜下所见
PRP是血小板浓缩物,经激活后能释放出大量高浓度的生长因子,如转化生长因子-β(TGF-β)、骨形成蛋白(BMPs)、血小板衍生生长因子(PDGF)、类胰岛素生长因子(IGF)、血管内皮生长因子(VEGF)、表皮生长因子(EGF)和成纤维细胞生长因子(FGF)等[24],这些生长因子具有诱导表皮细胞迁移、增殖、分化和促进第三、第四型的胶原蛋白有效增生的作用,从而促进创面的愈合。而且真皮干细胞增殖、分化,与血小板的浓度有直接正关联性,血浆浓度达到正常血小板浓度的4~5倍时,在优良的环境下,才会引起细胞的增殖与分化[25]。
目前研究证明,PRF富含的多种生长因子可协同作用,促进Ⅰ型胶原及纤连蛋白的合成,促进基质干细胞的趋化及增殖,刺激成纤维细胞及血管内皮的分化增殖在组织愈合过程中起重要调控作用[26];PRF的三维立体网状结构作为基质,为细胞的附着、迁移以及分化提供了有利的场所,使组织细胞及循环血中的干细胞能更快的长入其中,且这种结构弹性好,孔隙大,利于营养物质及氧气的弥散,加速愈合过程[27];大量的滞纳的血小板及生长因子与纤维蛋白发生化学键结合,这种特殊的结构与多种生长因子有较强的亲和力,从而使生长因子缓慢释放,延长PRF在创口的作用时间[28];也有研究表明,PRF的立体结构可以滞纳大部分白细胞,调节炎症反应,并使多种细胞因子缓慢持续释放,对于组织修复产生积极效果[29]。
本研究发现,单纯的ADSC或单纯的PRP、PRF对创面愈合也有一定的促进作用,但效果不如两者联合应用。其原因可能是,在创面愈合过程中,ADSC起到种子细胞的作用,在机体内环境的诱导作用下向组织细胞分化,而PRP起到营养的作用,同时,PRP中各种高浓度有活性的生长因子可促进ADSC的增殖分化,增加修复细胞数量,这些修复细胞通过旁分泌和自分泌形式分泌生长因子又可以作用于周围细胞及细胞自身;而PRF的三维立体网状结构则作为基质,为细胞的附着、迁移以及分化提供了有利的场所,从而构成了一个良性循环,各自联合起到协同修复的效果,促进创面的愈合和改善愈合质量。另外,本研究发现愈合速度与质量大致为ADSC+PRP>ADSC+PRF>ADSC>PRP>PRF>NS,推测ADSC在皮肤溃疡创面愈合中发挥的作用大于PRP和PRF,而RPR的作用又大于PRF,其具体分子机制仍有待进一步研究。
