利福平通过促进自噬保护帕金森病模型细胞损伤
2018-12-28王春燕冯凡巩企霞束瑜万晟霞赵晶徐平钱进军
王春燕, 冯凡,, 巩企霞, 束瑜, 万晟霞, 赵晶, 徐平, 钱进军
(1. 江苏大学医学院, 江苏 镇江 212013; 2. 江苏大学第四附属医院神经内科, 江苏 镇江 212001)
帕金森病最重要的病理性标志为黑质致密部多巴胺能神经元的选择性丢失,在残存的神经元内可见聚集的路易小体及α-突触核蛋白(α-syn)多聚体,导致纹状体内多巴胺水平的下降。对于多巴胺能神经元丢失的具体机制尚未十分清楚,但目前认为α-syn多聚体含量的增高或蛋白过表达可导致帕金森病,细胞内蛋白质的错误折叠和聚集(如α-syn)[1]成为帕金森病发病机制的核心假说。过表达或者聚集的α-syn蛋白可对细胞产生毒性作用,造成线粒体功能障碍[2]及氧化应激[3]等损伤,最终导致神经元凋亡。自噬途径在参与蛋白质寡聚体及多聚体降解的过程中发挥关键作用[4]。帕金森病患者自噬功能受损[5-6],导致溶酶体介导的α-syn多聚体的清除水平降低。利福平是一种半合成广谱抗生素,具有神经保护作用。在鱼藤酮诱导的帕金森病细胞模型中,利福平可减少多巴胺能神经元细胞内α-syn及其多聚体的含量[7]。利福平是否可以通过调节细胞自噬以增加α-syn多聚体的清除,从而降低神经元的凋亡率?基于此,本课题小组展开以下实验。
1 材料与方法
1.1 药物、细胞系和主要仪器
人骨髓神经母细胞瘤SH-SY5Y细胞由中国科学院上海生命科学研究院营养所惠赠;DMEM-F12培养基(Gibco公司);胎牛血清(杭州四季青公司);二甲基亚砜、鱼藤酮、利福平、雷帕霉素、氯喹和MTT(美国Sigma公司);AnnexinⅤ-FITC/PI细胞凋亡双染试剂盒(美国BD公司);兔抗人α-syn(美国Abcam公司);兔抗人Beclin-1、LC3-Ⅰ、LC3-Ⅱ、p62、β-肌动蛋白及HRP标记的羊抗兔抗体(美国Proteintech公司)。
FACS Calibur流式细胞仪(美国Becton Dickinson公司);Ti-S倒置相差显微镜(日本尼康公司)。
1.2 细胞培养
将SH-SY5细胞培养在含10%胎牛血清、1%青霉素和1%链霉素混合液的DMEM-F12培养基中,37 ℃、5%CO2条件下培养,24 h换液1次。当细胞密度达90%时,将其消化并以1∶3比例传代培养。取对数生长期细胞进行后续实验。
1.3 MTT实验检测各组细胞活力
1.3.1 选取鱼藤酮有效浓度 将细胞以1×105密度接种于96孔板,每孔100 μL,孵育24 h;弃上清液,每孔分别加入0、5、10、25 μmol/L鱼藤酮溶液100 μL,继续培养24 h;每孔加入10 μL MTT(5 mg/mL)孵育4 h;弃上层液体,每孔加入100 μL 二甲基亚砜,摇匀直至紫色化合物全部溶解;酶标仪490 nm处测定光密度(D)值,计算细胞存活率。细胞存活率(%)=(给药组D值/空白对照组D值)×100%。所有给药组每个浓度设置6个复孔。
1.3.2 选取利福平最佳浓度 按“1.3.1”中方法接种细胞,加入5 μmol/L鱼藤酮作用于细胞24 h;弃上清液,再分别加入0、50、150、300 μmol/L利福平继续处理细胞24 h;按照上述MTT法测定各组细胞光密度(D)值并计算细胞存活率。
1.3.3 选取雷帕霉素和氯喹最佳浓度 按上述“1.3.1”中方法接种细胞,分别将10、100、1 000 nmol/L雷帕霉素和1、10、100 μmol/L氯喹单独作用于SH-SY5细胞,孵育2 h;MTT法测定各组D值并计算细胞存活率。
1.4 实验分组及给药
将细胞分为4组。对照组:不加任何药物;鱼藤酮组:用5 μmol/L鱼藤酮处理细胞,24 h后弃上清液,改为完全培养基,培养24 h;利福平+鱼藤酮组:5 μmol/L鱼藤酮处理细胞24 h,弃上清液,再用150 μmol/L利福平处理细胞24 h;利福平组:用150 μmol/L利福平单独处理细胞24 h。提取各组细胞蛋白,蛋白质印迹法检测细胞内自噬标志性蛋白Beclin-1、p62、LC3-Ⅱ/Ⅰ水平。
1.5 流式细胞术检测细胞凋亡率
取“1.4”中分组细胞,用不含EDTA的胰酶消化收集细胞,各组样品加入100 μL 1×结合缓冲液重悬细胞;加入5 μL AnnexinⅤ-FITC和5 μL PI染色试剂,轻轻混匀后避光、室温反应10 min;加入400 μL 1×结合缓冲液重悬细胞;在1 h内用流式细胞仪检测各组细胞凋亡。每组重复3次。
1.6 雷帕霉素和氯喹最佳作用时间筛选
选取10 nmol/L雷帕霉素和10 μmol/L氯喹,分别作用于“1.2”中细胞0.5、1、2 h,提取细胞内总蛋白,蛋白质印迹法检测细胞内Beclin-1的表达水平。
将雷帕霉素(10 nmol/L,2 h)、氯喹(10 μmol/L,1 h)分别作用于“1.4”分组中的鱼藤酮组和利福平+鱼藤酮组细胞,蛋白质印迹法检测各组细胞内α-syn多聚体表达水平。
将0、0.2、1、5 μmol/L鱼藤酮分别作用于“1.2”中的细胞24 h,检测细胞内α-syn多聚体及Beclin-1表达水平。
将鱼藤酮(5 μmol/L,24 h)、氯喹(10 μmol/L,1 h)、雷帕霉素(10 nmol/L,2 h)分别作用于“1.2”中细胞,检测细胞内α-syn多聚体及Beclin-1表达。
1.7 蛋白质印迹法检测α-syn多聚体水平和自噬相关蛋白的表达
提取蛋白,BCA蛋白定量法测蛋白浓度,制备浓缩胶和分离胶,LC3-Ⅱ/Ⅰ蛋白适用12%分离胶,其余各蛋白均适用10%分离胶。将等量的各蛋白样本(约80 μg)分别上样,行SDS-PAGE;湿法电转膜(250 mA,40 min);将PVDF膜用5%脱脂奶粉室温封闭2 h;用1×TBST洗膜3次,5 min/次;加入α-syn、Beclin-1、p62、LC3、β-肌动蛋白抗体(稀释比均为1 ∶1 000) 4 ℃孵育过夜;TBST洗膜3次,10 min/次;加入二抗(稀释比均为1 ∶6 000)室温孵育1.5 h;洗膜后在暗室中加入ECL曝光液,经成像系统显影。采用Image J软件处理图像,目的蛋白相对表达量为目的条带与内参β-肌动蛋白的光密度比值。每组实验至少重复3次。
1.8 统计学分析
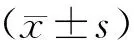
2 结果
2.1 各药物的最佳作用条件
2.1.1 鱼藤酮有效浓度与利福平最佳浓度的确定 与对照组相比,5、10、25 μmol/L鱼藤酮处理组SH-SY5Y细胞存活率明显降低(P均<0.01),综合考虑选取5 μmol/L鱼藤酮为起始有效浓度。与鱼藤酮组相比,50、150、300 μmol/L利福平组细胞存活率均有增高趋势,但150 μmol/L组差异有统计学意义(t=5.0,P<0.01),故选择150 μmol/L利福平作为最佳实验浓度。见图1。
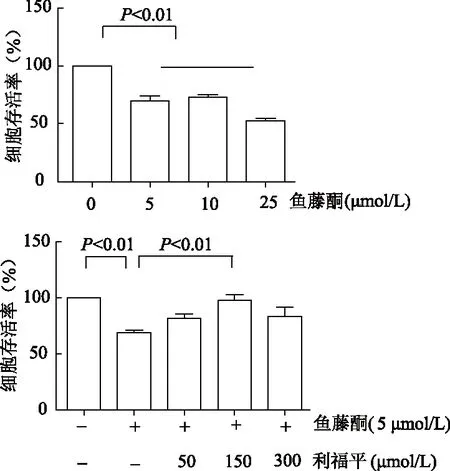
图1 经不同浓度鱼藤酮和利福平处理24 h后的细胞存活率
2.1.2 自噬调节剂雷帕霉素和氯喹最佳浓度与时间的确定 与对照组相比,10 nmol/L雷帕霉素和10 μmol/L氯喹细胞存活率不受影响(雷帕霉素:t=1.27,氯喹:t=2.72,P均>0.05)。见图2。
蛋白质印迹结果显示,与对照组相比,氯喹1 h组Beclin-1表达水平明显降低(t=18.84,P<0.01),雷帕霉素2 h组Beclin-1表达水平明显提高(t=25.78,P<0.01)。故后续实验中选用雷帕霉素10 nmol/L作用2 h,氯喹10 μmol/L作用1 h作为自噬促进剂雷帕霉素和自噬抑制剂氯喹预处理的最佳浓度和时间。见图3。

图2 MTT法检测各组细胞的存活率
2.2 自噬受抑制时SH-SY5Y细胞内α-syn多聚体含量增加
结果显示,与对照组相比,不同浓度鱼藤酮组SH-SY5Y细胞内Beclin-1表达明显减少(P均<0.01),且鱼藤酮对Beclin-1和α-syn多聚体含量的影响呈浓度依赖性,较高浓度鱼藤酮(5 μmol/L)使SH-SY5Y细胞内Beclin-1表达明显减少(t=27.04,P<0.01),α-syn多聚体表达明显增加(t=13.81,P<0.01)。 与对照组相比,氯喹组Beclin-1表达明显减少(t=4.08,P<0.05),α-syn蛋白多聚体含量显著升高(t=12.82,P<0.01)。见图4。

图3 蛋白质印迹检测Beclin-1蛋白的表达

a:P<0.01,b:P<0.05,与对照组比较
2.3 利福平降低帕金森病模型细胞的凋亡率
流式细胞检测结果显示,与对照组相比,鱼藤酮组凋亡率明显升高(t=10.0,P<0.05);与鱼藤酮组相比,利福平+鱼藤酮组凋亡率降低(t=7.81,P<0.05)。见图5。
2.4 利福平降低帕金森病细胞模型α-syn多聚体的含量
蛋白质印迹结果显示,与对照组相比,鱼藤酮组α-syn多聚体含量明显上升(t=4.66,P<0.01);与鱼藤酮组相比,利福平+鱼藤酮组α-syn多聚体含量显著降低(t=11.35,P<0.01)。见图6。
2.5 利福平通过促进自噬降低α-syn多聚体水平
蛋白印迹结果显示,与鱼藤酮组相比,利福平+鱼藤酮组Beclin-1表达显著升高,p62表达显著下降,LC3-Ⅱ/Ⅰ提高(Beclin-1:t=22.33,p62:t=9.17,LC3-Ⅱ/Ⅰ:t=12.4,P均<0.01)。与利福平+鱼藤酮组相比,氯喹预处理组α-syn多聚体表达水平明显增加(t=30.15,P<0.01)。见图7。

b:P<0.05

a:P<0.01
3 讨论
帕金森病的主要发病机制包括α-syn异常沉积、氧化应激、自噬损伤、免疫异常、炎症反应和细胞凋亡等[8],其中α-syn异常沉积、氧化应激等均可在不同层面导致细胞凋亡。神经退行性疾病在自噬的不同阶段受损,可以通过多种方式触发神经细胞死亡。当自噬体清除和底物降解步骤受损时,噬溶酶体会积累突变体和氧化蛋白、蛋白质寡聚体及蛋白质多聚体、受损的细胞器和其他未完全消化的产物,从而增加溶酶体膜的通透性,导致水解酶释放到细胞质中。溶酶体组织蛋白酶释放可通过线粒体释放的细胞色素c激活凋亡级联反应,最终导致细胞凋亡[9]。
大多数情况下,自噬促进细胞生存,意味着自噬倾向于抗细胞凋亡。通常在低剂量损伤时,自噬的细胞保护功能优于其潜在的细胞毒性作用[10]。研究显示,在帕金森病大鼠模型和PC12细胞中[11],鱼藤酮能够诱导自噬底物p62和α-syn聚集,损伤溶酶体膜的完整性,扰乱自噬流,促进细胞死亡。本研究发现,不同浓度鱼藤酮作用于SH-SY5Y细胞后,p62和α-syn多聚体水平升高,证实了鱼藤酮对细胞自噬的损害,说明在多巴胺能神经元神经退行性病变过程中自噬功能受抑制,干扰了α-syn蛋白多聚体的降解。
在脂多糖诱导的帕金森病炎症损伤模型中[12],利福平通过抑制TLR-4通路减少促炎因子的释放最终减少细胞凋亡。
利福平通过减少活性氧释放,避免线粒体损伤,发挥神经保护作用,亦可降低神经元凋亡率[13]。本实验采用鱼藤酮诱导帕金森病细胞模型,当利福平为150 μmol/L时,不仅能最大限度促进细胞生存,还能有效减少多巴胺能神经元凋亡,具体机制有待进一步研究。在阿尔兹海默症动物模型中[14],17月龄APPOSK小鼠每天口服利福平0.5 mg,1个月后β-淀粉样蛋白的积累明显减少;13月龄Tg2576小鼠每日口服利福平0.5 mg,1个月后,利福平以剂量依赖性方式减少α-淀粉样蛋白寡聚体积累和tau过度磷酸化,减少突触丧失以及抑制小胶质细胞激活化。本研究中利福平有效降低了鱼藤酮组α-syn多聚体水平,由此推测,利福平可能在阿尔兹海默症动物模型和帕金森病细胞模型中通过减少病理蛋白的积累,发挥抑制神经元凋亡的作用。

图7 蛋白质印迹检测各组细胞内α-syn多聚体及自噬相关蛋白表达水平
在帕金森病炎症细胞模型中,与未预处理的细胞相比,利福平预处理的BV2细胞中LC3-Ⅱ/Ⅰ表达明显增高,溶酶体与线粒体共定位增加,表明利福平可通过自噬途径发挥抗炎作用[15]。本研究结果显示,利福平可有效提高Beclin-1、LC3-Ⅱ/Ⅰ的表达,减少自噬底物p62和α-syn多聚体表达,且自噬抑制剂氯喹部分消除了利福平预处理的神经保护作用,提示利福平可能通过促进自噬加强α-syn蛋白多聚体的清除,从而发挥抗炎、抗氧化作用,最终减少神经元凋亡。
对于利福平神经保护作用的研究,本课题小组目前局限于细胞层面,未能很好地展现药物在生物体内复杂的代谢反应,下一步拟进行动物实验的设计和研究。自噬是一个动态的反应过程,在后续实验中,拟使用透射电镜、免疫荧光分析等技术全方位捕捉自噬流的变化,研究利福平在自噬泡形成的起始、延伸、融合等过程中的表现及其与氧化应激、细胞凋亡之间的关系。
综上所述,本研究初步证实在帕金森病细胞模型中,利福平能减少鱼藤酮诱导的多巴胺能神经元凋亡,且可能通过促进细胞自噬降低α-syn多聚体水平。
