新辅助放化疗对直肠癌患者临床分期、手术方式及预后的影响
2018-12-27
直肠癌是指处于乙状结肠直肠交界线与齿状线之间的肿瘤,是消化系统常见的恶性肿瘤之一,以低位直肠癌为主,在青年人中多见,且日渐增多[1]。随着科学技术的进步,人们对肿瘤的治疗效果也随之增加,由简单地追求延长寿命到最大程度地保留生活质量,对于直肠癌患者来说,保肛已变得十分重要[2]。目前,直肠癌治疗方式是以手术治疗为主,放化疗等为辅的综合治疗模式,放化疗时间的选择仍是部分学者争论的要点[3]。随之,新辅助放化疗出现在直肠癌治疗的“舞台”,并得到了欧洲众多医疗中心的认可,后也渐渐在我国得到应用。大部分学者认为新辅助放化疗可降低直肠癌患者的临床分期,提高切除率及保肛率,甚至可延长患者寿命;但也有部分学者不赞同此种观点,他们认为此种观点夸大了新辅助放化疗的优点,而忽略了其对患者本身的伤害[4-5]。本文选取2012年2月至2015年1月于我院进行直肠癌诊治的124例作为研究对象,探讨新辅助放化疗对直肠癌患者临床分期、手术方式及预后的影响,现将结果汇报如下。
1 资料与方法
1.1 入选标准
纳入标准:①经术前各种检查、临床表现及肿瘤切除术后病理诊断均提示直肠癌;②首次确诊为直肠癌且暂未接受任何治疗;③家属及患者本人均签订知情同意书;④依从性良好。排除标准:①手术绝对禁忌症;②术前及术中证实有远处转移者;③合并其它原发肿瘤的患者;④年龄大于75岁的患者;⑤精神病患者或有精神病史的患者。
1.2 临床资料
病例来源于2012年2月至2015年1月于我院进行直肠癌诊治的124例患者,根据治疗方式不同将其分为实验组和对照组,实验组给予新辅助放化疗和手术治疗,共53例,对照组则直接行手术治疗,共71例。实验组:男性31例,女性22例;年龄29~68岁,平均(41.35±10.83)岁;组织学类型:腺癌28例,腺鳞癌15例,未分化癌10例;肿瘤距齿状线的距离:≤5 cm 30例,>5 cm 23例;临床分期[6]:遵循WHO直肠癌临床分期标准,T3N0M021例,T4N0M013例,T2N1M010例,T3N1M09例。对照组:男性43例,女性28例;年龄25~70岁,平均(40.26±9.27)岁;组织学类型:腺癌35例,腺鳞癌20例,未分化癌16例;肿瘤距齿状线的距离:≤5 cm 43例,>5 cm 28例;临床分期:遵循WHO直肠癌临床分期标准,T3N0M029例,T4N0M018例,T2N1M012例,T3N1M012例。两组患者在性别、年龄、组织学类型、肿瘤部位及临床分期等一般临床资料上差异不明显(P>0.05),具有可比性。
1.3 治疗方法
实验组给予新辅助放化疗和手术治疗,对照组则直接行手术治疗。
新辅助放化疗具体方案为:术前行三维适形放射治疗,范围包括肿瘤部位及可能转移或已转移的淋巴结区域,放疗剂量2 Gy/次,每周5次,总共46 Gy。同时给予化疗,本研究中患者选择的化疗方案为MAYO方案,具体:第1~5天,每天给予患者亚叶酸钙(CF)200 mg/m2、5-氟嘧啶(5-Fu)425 mg/m2,每4周重复1次,为1个疗程,整个治疗过程共6个疗程。对于放化疗过程中出现的不良反应均积极对症处理。治疗结束后4周,重新评估患者的临床分期,并制定手术计划。
手术方案包括腹会阴联合直肠癌根治术(Miles术)、经腹直肠癌切除术(Dixon术)和经腹直肠癌切除+近端造口+远端封闭术(Hartmann术),手术方式根据患者具体情况而定。
术后进行随访,共随访24个月(患者死亡,随访结束),其中第1年内每3个月随访1次,以后每6个月随访1次。随访方式包括门诊复查、网络平台及电话问询等。
1.4 观察指标
收集实验组新辅助放化疗后患者的治疗效果、临床分期变化情况及不良反应情况;收集并分析两组患者的手术切除率、保肛率、术后并发症及预后(生活质量及生存情况)。
1.5 评判标准
实体瘤治疗疗效评价遵循国际抗癌联盟标准RECIST[7],该标准主要的依据是病灶的最大直径,分为四类:完全缓解(CR,靶肿瘤基本消失)、部分缓解(PR,靶肿瘤最大直径总和缩小≥30%)、疾病进展(PD,肿瘤最大直径总和增加≥20%和(或)有新病灶出现和(或)非靶病灶明确进展)、病灶稳定(SD,靶肿瘤无变化或虽增加但未达到PD)。新辅助放化疗的不良反应评价遵循美国国立癌症研究所通用毒性标准3.0版[8],包括骨髓抑制、恶心、呕吐、乏力、腹泻和肛周皮肤反应等。生活质量由生活质量核心问卷(QLQ-C30)评估所得,该表[9]是由欧洲癌症研究和治疗组织为肿瘤患者量身定制,该问卷一共有30个条目,分为4部分,第1部分由1个整体健康和生活质量量表构成;第2部分由5个功能量表构成;第3部分由3个症状量表构成;第4部分由6个单项测量项目构成。第1部分和第2部分分数越高,说明肿瘤患者生活质量和功能状态越好;而第3部分和第4部分得分越高,则说明患者症状越重,状态越差。
1.6 统计学方法
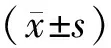
2 结果
2.1 新辅助放化疗后肿瘤的变化情况
实验组经新辅助放化疗后,CR 9例,PR 29例,PD 3例,SD 12例;新辅助放化疗前后患者临床分期变化情况。化疗前:Ⅱ期 34例,Ⅲ 19例;化疗后:Ⅰ期 24例,Ⅱ期 25例,Ⅲ 4例。见表1。

表1 新辅助放化疗前后患者临床分期变化情况/例
2.2 新辅助放化疗患者的不良反应情况
实验组经新辅助放化疗后,出现骨髓抑制 3例、恶心 2例、呕吐 2例、乏力 3例、腹泻 1例、肛周皮肤反应3例,不良反应发生率为26.42%,经对症处理后均顺利完成后续手术治疗。
2.3 两组患者的手术切除率及保肛率比较
实验组:Dixon术 48例、Miles术 3例、和Hartmann术 2例,切除率为100.00%,保肛率为90.57%;对照组:Dixon术 53例、Miles术 8例和Hartmann术 5例,切除率为92.96%,保肛率为74.65%。实验组切除率及保肛率均高于对照组,且差异具有统计学意义(P<0.05),见表2。

表2 两组患者手术切除率及保肛率比较(例,%)
2.4 两组患者术后并发症比较
实验组术后并发症总发生率为24.53%,对照组术后并发症总发生率为28.17%,两组差异无统计学意义(P>0.05),见表3。

表3 两组患者术后并发症比较/例
2.5 两组患者的预后比较
与对照组比较,实验组整体健康及生活质量量表评分和功能量表评分相对升高,而症状量表评分和单项测量项目评分相对降低,且差异均具有统计学意义(P<0.05),见表4。实验组2年生存率为62.26%,略高于对照组(40.85%),两组差异无统计学意义(P>0.05),见图1。
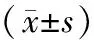
表4 两组生活质量比较

图1 两组2年生存率比较
3 讨论
随科学技术的不断发展,直肠癌的诊治及预后也有了变化。医者对肿瘤的位置、浸润深度、淋巴结、远处转移及TNM临床分期等情况的判断更加精确,从而能更加有效地选择1个适当的方案延长患者寿命,提高生活质量[10-11]。近年,直肠癌的新辅助放化疗应用广泛,且获得一致好评,与传统放化疗比较,新辅助放化疗将重点放在术前,他们认为术前肿瘤组织的血供丰富,在供氧丰富情况下的肿瘤细胞对放化疗更为敏感,增强放化疗的治疗效果-缩小肿瘤直径大小,降低临床分期,缩小手术范围,提高保肛术率;此外,患者术前身体状况相对良好,更能耐受放化疗对身体本身的损伤,且对于已发生的不良反应患者在对症治疗后更易恢复[12-13]。
本研究中,实验组在手术前优先给予新辅助放化疗,放化疗后53例患者的临床分期由(Ⅱ期 34例,Ⅲ 19例)变为(Ⅰ期 24例,Ⅱ期 25例,Ⅲ 4例),患者的临床分期在一定程度上有所降低。这与吴国举等[14]学者的结果是一致的,说明新辅助放化疗降低直肠癌的临床分期效果是有目共睹的。实验组切除率、保肛率及术后生活质量均优于对照组,且差别具有统计学意义(P<0.05),但两组在术后并发症(P>0.05),说明新辅助放化疗可在不增加患者其它损害的基础上,最大程度地保证手术切除率、保肛率及术后生活质量。这与刘英强等[15]学者的部分结果基本一致。实验组2年生存率略高于对照组,但两者差别无统计学意义(P>0.05),这可能是研究对象欠缺或随访年限不够所致,但这种趋势提示新辅助放化疗在改善直肠癌患者预后上是有积极意义的,可继续进行探讨。
综上,新辅助放化疗可降低直肠癌患者临床分期,从而提高其手术切除率及保肛率,改善生活质量,延长寿命。
