DNA发夹结构自组装信号放大策略应用的研究进展
2018-12-19陈时建徐天雄占忠旭赖卫华许恒毅
俞 蓓,陈时建,徐天雄,占忠旭,赖卫华,许恒毅*
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.南昌大学 科学技术学院,江西 南昌 330029)
基于核酸的检测技术因其高特异性和灵敏度被广泛用于生物小分子、无机金属离子、核酸和蛋白质分子的分析检测,然而实际样品中的被检物往往痕量,核酸探针与靶标物间通常以1∶1的比例结合,导致传统利用功能核酸链检测靶物的技术受到限制。近几年,为进一步提高检测灵敏度,研究者建立了一系列基于核酸信号放大的检测方法,将目标物的识别转化为DNA的扩增。
根据酶的参与与否,信号放大方式可分为基于酶介导的信号放大和无酶介导的信号放大两类(图1)。基于酶介导的信号放大主要通过酶的一些特殊功能对核酸进行复制、剪接及修饰以实现对生物活性分子的检测,该策略可分为热循环放大型和等温扩增放大型[1]。其中,以聚合酶链式反应(PCR)为代表的热循环放大型技术作为核酸检测的“金标准”,可将靶标的量放大108~109倍以利于常规方法的检测[2],但该方法需使用昂贵的仪器设备,且易出现交叉污染,从而造成假阴性或假阳性结果[3]。等温扩增放大型技术如链置换扩增(Strand displacement amplification,SDA)[4]、环介导等温扩增(Loop-mediated isothermal amplification,LAMP)[5]、滚环复制(Rolling circle amplification,RCA)[6]和核酸外切酶Ⅲ酶切循环放大(Exonuclease Ⅲ-aided amplification)[7]等虽可进行恒温扩增,无需特殊加热设备,但该类方法所用酶的价格昂贵,保存时间较短,且酶活性易受环境影响。
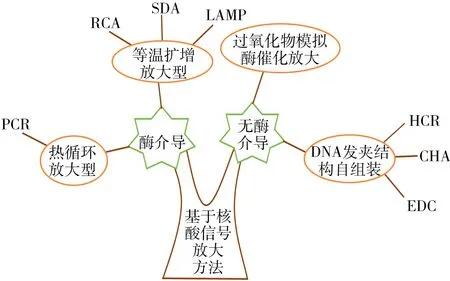
图1 基于核酸信号放大策略分类Fig.1 Classification of signal amplification based on nucleic acid
相对于酶介导的信号放大,无酶介导的信号放大因操作简便、选择性多、反应稳定而在现代分析领域中被广泛关注。其中,基于DNA发夹结构自组装的信号放大技术因具有无需酶催化、常温下可发生反应、无需专业技术人员及扩增设备、检测特异性强以及灵敏度与PCR相当[8]等优点,近年来在生化、食品和临床等领域得到迅速发展。本文针对DNA发夹结构自组装信号放大方法在致病菌、核酸肿瘤标记物、蛋白质、无机金属离子及生物小分子检测中的应用进展进行综述,并对其未来发展趋势进行了展望。
1 DNA发夹结构自组装信号放大方式的分类
DNA发夹结构自组装反应无需酶催化,DNA链可通过吉布斯自由能或位形熵的驱动自行组装,实现信号级联放大的杂交反应。常用的DNA发夹结构自组装反应主要有杂交链式反应、催化发夹型DNA自组装反应和熵驱动催化反应。
1.1 杂交链式反应
杂交链式反应(Hybridization chain reaction,HCR)是一种无需酶催化,常温下发夹型探针即可被目标DNA链“激活”,并不断杂交产生一条带有切口的长DNA双链的信号放大方法[9]。其原理如图2所示,反应体系中两个发夹型探针H1和H2均由粘性末端(a/c*)、茎部区(b和b*的配对区)及环状区(c/a*)3部分构成。在无目标链存在的情况下,这两个发夹型探针均以茎环结构稳定存在;当目标链a*b*存在时,目标链中的a*b*与H1中粘性末端a和茎部b互补,在自由能的驱动下,目标链可与H1杂交,并打开H1的茎环结构,从而暴露出cb*序列;同样地,cb*与H2中粘性末端c*和茎部b互补,然后在自由能的驱动下,将H2的茎环结构打开,从而暴露出与目标链相同的a*b*序列,其可作为目标链继续打开H1的茎环结构,反应依次循环进行,产生带有切口的H1、H2交替互补杂交的长DNA双链。因为反应物的自由能高于生成物的自由能,因此在自由能的驱动下可自发进行该反应,以增强检测信号。
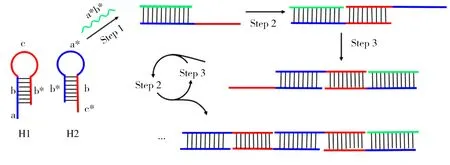
图2 HCR原理图Fig.2 The principle of HCR
1.2 催化发夹型DNA自组装反应
催化发夹型DNA自组装反应(Catalyzed hairpin assembly,CHA)是在HCR基础上发展的一种新型的自由能驱动的发夹型DNA组装方式。与HCR不同,CHA反应中的目标链可被置换并引发下一轮反应,在整个反应中起类似催化剂的作用。根据放大方式不同,CHA可分为线性放大型和指数放大型两种[10],线性放大型CHA中发夹型探针通常被目标链“激活”后依次进行自组装,并将目标链置换出来,生成稳定的线性双链DNA结构,置换出的目标链继续引发下一轮杂交反应,使检测信号得到循环放大[11](图3);而指数放大型CHA中发夹型探针被目标DNA催化自组装生成中间物,该中间物又可“激活”下一轮发夹探针同步进行自组装[12],从而使检测信号得到指数式放大。在CHA反应中,发夹型探针被目标链“激活”后组装,不仅可以增强目标链的检测信号,还可以根据不同的设计生成不同构型的双链DNA纳米结构组装体,如组装形成“Y”型DNA纳米组装体,以满足不同的实验需要[12]。
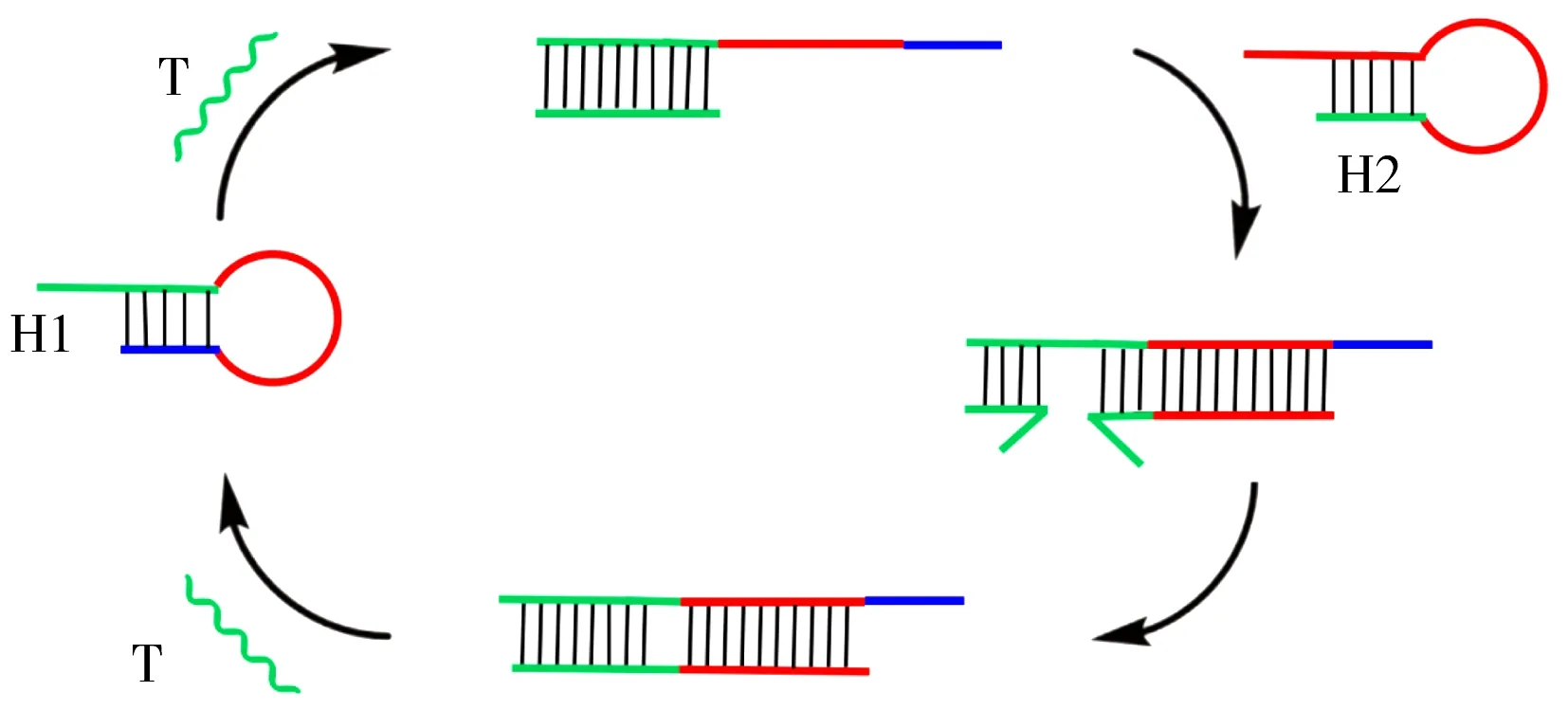
图3 CHA原理图Fig.3 The principle of linear CHA

图4 EDC原理图Fig.4 The principle of EDC
1.3 熵驱动催化反应
熵驱动催化反应(Entropy drive catalysis,EDC)是一种借助熵驱动实现信号放大的DNA自组装反应(反应原理见图4),引发链C先与底物链S杂交,生成中间体I1,经重排形成中间体I2,I2因结构域间的结合力较弱分解生成SB和I3,I3继续与底物F杂交生成中间体I4,I4经重排后分解成OB和I5,I5经重排后置换出引发链C并生成复合物W[13]。整个循环反应中因碱基配对未发生变化,故可以忽略自由能的变化,利用位形熵的增加自发进行链置换-杂交循环反应,以实现信号放大。
2 DNA发夹结构自组装信号放大技术的应用
DNA发夹结构自组装信号放大技术成为当前增强检测信号的研究热点,基于此技术建立的各种检测手段已被广泛用于致病菌、核酸肿瘤标记物、蛋白质、生物小分子以及无机金属离子的检测。表1详细总结了DNA发夹结构自组装信号放大技术在不同物质检测中的应用。
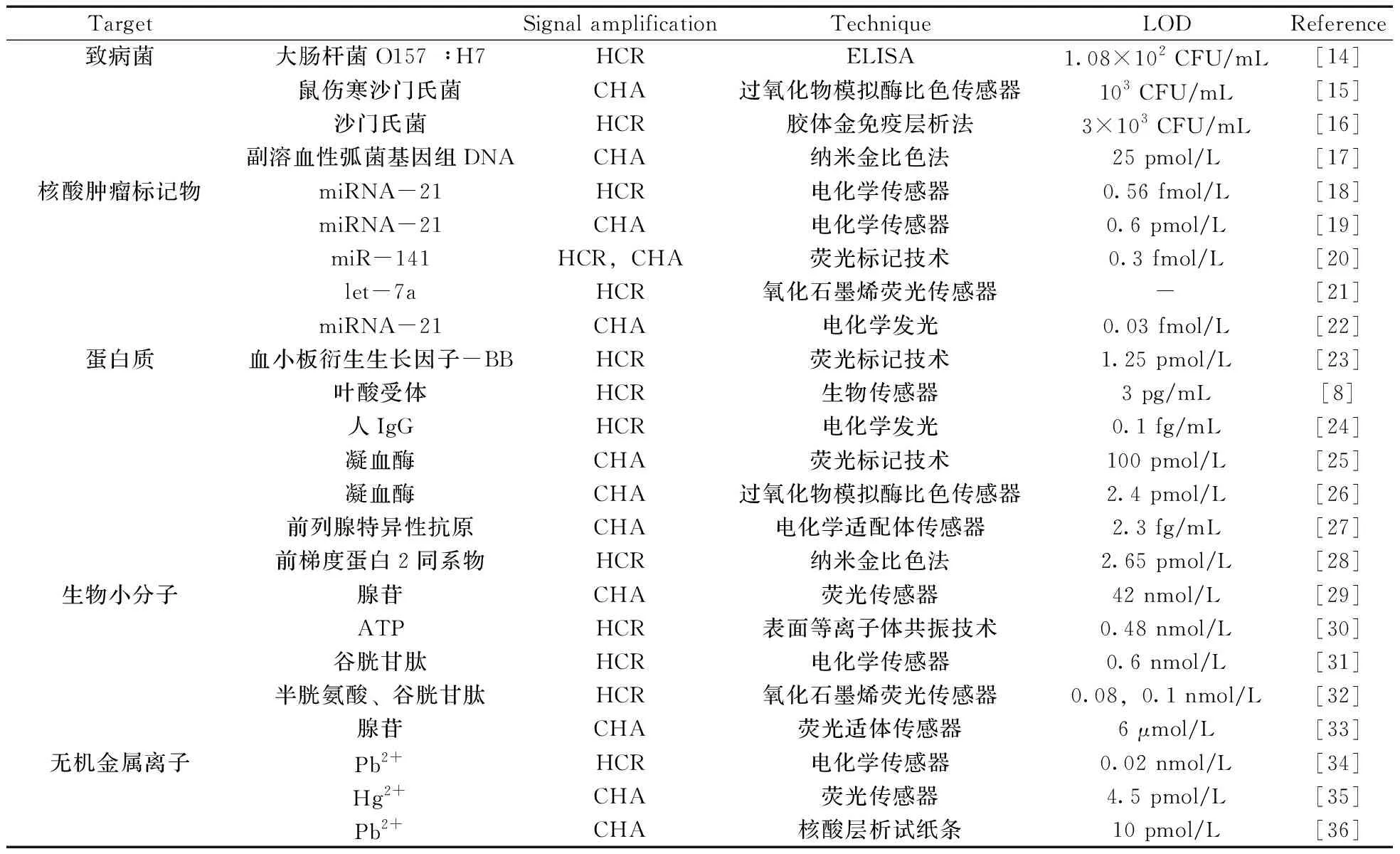
表1 DNA发夹结构自组装信号放大技术在不同被检物检测中的应用Table 1 The application of DNA self-assembly for the detection of different samples
2.1 致病菌检测
2.1.1致病菌全菌检测DNA自组装信号放大方法主要以两种形式实现对致病菌全菌的检测:①根据目标菌的核酸适配子设计发夹探针,实现自发组装,并通过循环反应实现信号放大。②信号输出方式中引入DNA自组装反应,以实现检测信号的放大。Guo等[14]建立了一种HCR参与的检测大肠杆菌O157∶H7的双抗夹心免疫法,抗体和寡核苷酸双标记的纳米金探针通过HCR产生一条长的带有大量生物素的双链DNA,通过生物素-链霉亲和素的作用力与链霉亲和素修饰的HRP酶连接,从而增强检测信号。该方法对纯培养的大肠杆菌O157∶H7的检测限可达1.08×102CFU/mL,较传统的ELISA法灵敏度提高了185倍。Chen等[15]结合CHA信号放大策略,构建了一种基于核酸适配体的检测鼠伤寒沙门氏菌的过氧化物模拟酶比色传感器,其将G-四联体序列部分隐藏在发夹结构中,在有鼠伤寒沙门氏菌存在的情况下,核酸适配体与其结合并释放CHA引发序列催化发夹自组装,暴露出的完整G-四联体序列可与氯化高铁血红素结合形成过氧化物模拟酶,在H2O2存在下,催化底物2,2′-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS2-)显色。该法在PBS中的检测限为103CFU/mL,检测仅需2 h。
2.1.2致病菌核酸检测利用DNA自组装信号放大技术对致病菌核酸进行检测时,首先需针对靶核苷酸序列设计两个至多个与之对应的特异性自组装发夹型探针,然后加入靶DNA引发DNA发夹自组装,最后通过不同的检测手段对反应终产物进行检测。Ying等[16]以沙门氏菌的16S rRNA基因为靶序列,结合胶体金免疫层析法和HCR信号放大的方法对其检测,该方法对沙门氏菌的检测限为3×103CFU/mL;对靶DNA的检测限可达1.76 pmol/L,比未经HCR放大的检测限低2个数量级。Ma等[17]利用纳米金聚集与分散而引起颜色变化的性质,结合指数放大型CHA(EHA),实现了对副溶血性弧菌基因组DNA中部分保守序列的裸眼检测,15 min内可实现裸眼检测且对靶DNA的检测限达25 pmol/L,较传统的纳米金比色法的灵敏度提高了约400倍。Chen等[15]构建了基于CHA信号放大的过氧化物模拟酶比色传感器,实现了对肺炎链球菌lytA的超灵敏检测,在纯培养液中肺炎链球菌的检测限为156 CFU/mL,对靶DNA的检测限达32 pmol/L,可实现裸眼检测。Yu等[37]以产呕吐毒素蜡样芽孢杆菌的呕吐毒素编码基因(cesB)部分片段为靶序列,结合HCR信号放大方法和流式细胞术对其检测,在纯培养液中产呕吐毒素蜡样芽孢杆菌的检测限为7.6×100CFU/mL,牛奶加标样中的检测限为9.2×102CFU/mL。
2.2 核酸肿瘤标记物检测
微小核糖核酸(miRNAs)是一类具有调控功能的内源性的非编码单链RNA分子。miRNAs的异常表达与一些癌症(肺癌、胃癌、乳腺癌等)的发生密切相关,已被当作新型的肿瘤标记物。Northern印迹杂交虽作为miRNAs检测的金标准[38],但费时费力且灵敏度低。DNA自组装信号放大技术简单易操作且特异性强,被引入易突变的miRNAs检测体系中。Wu等[39]将G-四联体序列一分为二,分别设计在两个自组装发夹型探针中,当let-7a存在时,可引发HCR反应,从而将G-四联体的两部分结合形成完整序列,并与氯化血红素结合形成具有辣根过氧化物酶活性的DNA模拟酶,催化H2O2和ABTS2-显色,该方法在let-7a浓度为10 fmol/L~10 nmol/L范围内具有良好的线性关系,对let-7a的检测限为7.4 fmol/L,且可以识别单碱基突变。Zhai等[18]将HCR辅助的信号放大与电化学传感器相结合,将捕获探针固定在纳米金修饰的电极上,捕获miRNA-21引发扩增的HCR反应产物,并将其作为电化学信号的载体,实现了对miRNA-21的超灵敏检测。该方法具有良好的特异性,线性范围为1 fmol/L~100 pmol/L,对miRNA的检测限可达0.56 fmol/L,检测时间为2.5 h。Miao等[40]建立了一种基于带正电纳米金和HCR信号放大的miRNA检测方法,只有miRNA-21存在时才可启动HCR形成很长的dsDNA,其可通过静电吸附与带正电的纳米金结合,从而使纳米金沉淀,并根据此变化实现对miRNA-21的检测。该方法特异性强,对miRNA-21的检测限为6.8 pmol/L,线性范围为20 pmol/L~10 nmol/L。
2.3 蛋白质检测
蛋白质作为生命体内重要的生物大分子,不仅能够调控细胞代谢,还能作为生物标志物监控疾病的发生。蛋白质的常用检测方法主要是基于抗原-抗体的特异性识别的标记免疫分析法,但其操作复杂、成本高且需专业操作人员[41]。随着指数富集的配体系统进化技术(SELEX)的发展,越来越多的靶标蛋白适配体被成功筛选出来。作为新型的分子识别元件,核酸适配体在蛋白质检测的应用中受到广泛关注。Wang课题组[42-43]依据核酸适配体与癌胚抗原(CEA)间的亲和力,分别构建了基于纳米金-辣根过氧化物酶复合物信号放大的胶体金适配子试纸条,以及基于适配体-纳米金探针与石墨烯-链霉亲和素纳米复合物的夹心型电化学适配体型传感器,实现了对CEA的灵敏检测。然而,核酸适配体与目标物通常以1∶1结合,导致检测限高,故DNA自组装信号放大技术被引入以增强检测信号,提高灵敏度。Yang等[44]基于核酸适配体的HCR和CHA双重信号放大策略,构建了检测CEA的荧光传感器,其检测限可达0.3 pg/mL。Lu等[45]将基于核酸适配体的CHA和Exo-Ⅲ酶切循环放大策略与荧光传感器相结合,通过荧光信号变化实现了对CEA的检测,该方法对CEA的检测限达58 fg/mL。Wang等[23]利用基于核酸适配体的HCR信号放大,结合氧化石墨烯建立了血小板衍生生长因子-BB(PDGF-BB)的灵敏检测方法,其将PDGF-BB的核酸适配体隐藏在发夹DNA中,当PDGF-BB存在时,核酸适配体与其结合并暴露出能引发HCR的序列,催化发夹结构的自组装,形成长的双链DNA,随后加入荧光染料SYBR Green I嵌入dsDNA间,产生荧光信号。该方法灵敏度高,检测限为1.25 pmol/L。Zhao等[8]构建了一种HCR参与的检测叶酸受体的双链DNA-铜纳米颗粒生物传感器,将捕获探针固定在纳米金修饰的电极上,捕获叶酸受体引发扩增的HCR反应产物,并将其作为dsDNA-CuNPs复合物产生的模板,进而合成CuNPs。电极表面的CuNPs被硝酸溶解后,产生的铜离子催化底物o-邻苯二胺(OPD)生成具有电活性的2,3-二氨基吩嗪(DAP),并通过电化学信号检测叶酸受体。该方法特异性强,检出限为3 pg/mL,线性范围为0.01~100 ng/mL。Bai等[46]发明了一种基于核酸适配体和CHA辅助放大的检测α-凝血酶的过氧化物模拟酶比色传感器,该方法对α-凝血酶的检测限为0.68 pmol/L,线性范围为1 pmol/L~2.5 nmol/L。
2.4 生物小分子检测
DNA发夹结构自组装信号放大策略主要通过结合核酸适配体技术实现对小分子的检测。Gao等[47]建立了一种基于核酸适配体和HCR辅助下信号放大的方法用于ATP检测,ATP可与核酸适配体结合,使非适配体部分序列暴露出来,从而引发HCR反应,形成的长链DNA分子可使纳米金聚集,从而产生颜色变化实现ATP的检测,该方法对ATP的检测限为1 nmol/L。Sun等[48]基于核酸适配体的HCR和核酸外切酶Ⅲ(Exo-Ⅲ)双重信号放大策略,构建了检测腺苷的过氧化物模拟酶比色传感器,检测限可达4.2×10-7mol/L。Huang等[29]将基于核酸适配体的CHA信号放大策略与荧光传感器相结合,在发夹型探针H1的5′端标记了芘分子,以CHA产物作为载体,通过荧光信号变化实现了对腺苷的检测。该方法对腺苷的检测限达42 nmol/L,并成功应用于人血清样本中腺苷的检测。Wang等[49]结合HCR信号放大策略,构建了一种基于核酸适配体的过氧化物模拟酶比色传感器来检测赭曲霉毒素A(OTA),其检测限可达0.01 nmol/L,线性范围为0.01~0.32 nmol/L。
2.5 无机金属离子检测
重金属离子Pb2+和Hg2+等广泛存在于自然界中,能通过生物富集作用以不同途径严重危害人体健康。基于DNA自组装信号放大的检测技术可以实现无机金属离子的痕量检测而被广泛应用。Zhuang等[50]将Pb2+特定的脱氧核酶固定在磁珠上,当Pb2+存在时,其可与脱氧核酶发生特异性作用,通过切割rRNA序列将功能酶底物剪切成两部分,其中连接在磁珠表面的残余核酸序列可通过HCR反应形成连有大量二茂铁的双链DNA,并通过电化学信号的改变实现对Pb2+的定量检测。该方法对Pb2+的检测限为37 pmol/L,线性范围为0.1~75 nmol/L。根据相同原理,Chen等[36]建立了一种基于脱氧核酶和CHA信号放大的Pb2+检测的胶体金免疫层析法,检测限为10 pmol/L,较未经信号放大的试纸条法,其检测限降低4个数量级。Huang等[51]构建了一种基于HCR辅助的信号放大策略检测Hg2+的荧光传感器,并引入氧化石墨烯作为猝灭剂降低背景信号,当加入Hg2+时,利用T-Hg2+-T配对连接在引发链和发夹型探针H1间,启动HCR反应并产生带有大量荧光基团FAM的双链DNA,实现了荧光信号放大,该方法对Hg2+的检测限达0.3 nmol/L,且具有良好的特异性。Wang等[52]建立了一种基于HCR信号放大的纳米金比色检测方法,当Hg2+存在时,其利用T-Hg2+-T配对打开发夹型探针H0,进而触发HCR反应,从而使纳米金聚集,并通过颜色变化实现对Hg2+的裸眼检测。该方法对Hg2+的检测限为30 nmol/L,较未经修饰的纳米金比色法,其检测限低1~2个数量级。
3 总结与展望
DNA发夹结构自组装作为近几年迅速发展的信号放大方法,因具有无酶参与、等温和识别序列能力强等优点,在致病菌、核酸肿瘤标记物、蛋白质和无机金属离子等分析检测方面展现了良好的应用前景。然而在基于DNA发夹结构自组装信号放大策略的生物分子检测中,仍存在一些问题亟待解决:①DNA发夹结构自组装信号放大效率与发夹探针的设计有关[16],目前针对发夹探针设计的具体操作鲜见报道,开发设计并评估发夹探针效果的软件尤为迫切;②单独使用DNA发夹结构自组装信号放大策略实现高灵敏检测的研究不多,未来可将几种DNA发夹结构自组装信号放大策略联用或与其他无酶信号放大方法结合,以实现检测信号的多重放大;③探寻其他检测手段或信号放大技术(如共聚焦显微镜、拉曼散射等)与DNA发夹结构自组装信号放大策略联用,以提高检测的灵敏度及特异性,为目标物检测提供一个无酶、免标记、高特异性和灵敏度的检测平台。随着技术的不断发展,DNA发夹结构自组装信号放大策略将朝着即时、灵敏、高特异性的方向发展,最大程度地实现其应用价值。
