氢氧化钾-乙醇标准溶液浓度的影响因素及规避
2018-11-15饶文瑛
饶文瑛
(中国石油长庆石化公司,陕西咸阳 712000)
炼油厂汽油、煤油、柴油的酸度测定中,最重要的分析步骤就是用氢氧化钾-乙醇标准溶液进行滴定。氢氧化钾-乙醇溶液,在不同的条件下其浓度易发生变化,从而导致分析结果的偏离。标准溶液在制备过程中,每一步都要精密、准确,从贮存容器的选择、洗涤、干燥,原试剂的纯度、预处理,天平的准确称量,环境温湿度及计量器具校准等因素,每个细小的误差,对标准溶液量值准确都会造成影响。因此,为减少标准溶液配制及标定时误差,结合实验对以下几点影响因素进行分析。
1 实验部分
1.1 主要仪器与试剂
分析天平:最大允许误差±0.01 mg;滴定管:容量为50 mL,分度值为0.1 mL,A级;邻苯二甲酸氢钾:工作基准,纯度为100%;氢氧化钾:分析纯;无水乙醇:分析纯;酚酞指示剂:10 g/L;实验用水:三级水。
1.2 实验步骤
根据GB/T 601-2016《化学试剂标准滴定溶液的制备》[1]的方法要求配制0.05 mol/L氢氧化钾-乙醇,用工作基准试剂邻苯二甲酸氢钾对其准确浓度进行标定。
配制:称取3.0 g氢氧化钾,置于聚乙烯容器中,加少量水(约5 mL)溶解。用95%乙醇稀释至1 000 mL,密闭放置24 h,用塑料管虹吸上层清液至另一聚乙烯容器中。
标定:氢氧化钾-乙醇溶液浓度用有证标准物质邻苯二甲酸氢钾(KHP)标定。配制目标浓度为0.05 mol/L的氢氧化钾-乙醇溶液,然后恒重、用减量法称取邻苯二甲酸氢钾约0.3 g,称准至0.000 1 g,用适量水溶解,加入指示剂,用氢氧化钾-乙醇溶液滴定,至溶液呈粉红色,同时做空白实验,临用前标定。
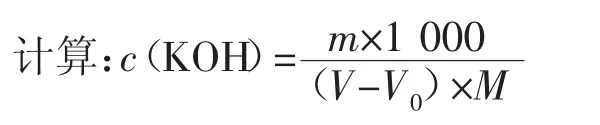
式中:c-氢氧化钾-乙醇的浓度,mol/L;m-邻苯二甲酸氢钾的质量的准确数值,g;V-氢氧化钾-乙醇溶液的体积的数值,mL;V0-空白实验氢氧化钾-乙醇溶液的体积的数值,mL;M-邻苯二甲酸氢钾的摩尔质量的数值,g/mol。
2 影响标准溶液浓度的因素
2.1 标定时间对溶液浓度的影响
一般标准溶液按操作规程配制后,直接用处理好的工作基准试剂进行其准确浓度的标定,但一些有特殊规定的溶液,要按操作规程处理或放置稳定后再标定。如硫代硫酸钠、氢氧化钠等需放置一周后标定,严禁现配现标。氢氧化钾-乙醇溶液要求配制后放置24 h取上清液进行标定。下面对现配标准溶液与放置24 h后两种标准溶液标定,对结果进行比对。
不同放置时间标定标准溶液的实验数据(见表1)。
通过比较,直接对新配制的标准溶液进行标定,重复性差,溶液不稳定。放置24 h后的标准溶液浓度稳定。虽然两者浓度变化在允许误差范围内,可以使用,但若遇到酸度测定有争议时,将影响最终分析结果的准确度,所以在标定此溶液之前要提前配制,应放置待充分溶解,浓度稳定后标定,结果更准确。
2.2 存放时间对标准溶液浓度的影响
标准溶液标定后室温(15℃~25℃)保存,一般标准贮存时间规定不超过2个月,当溶液出现浑浊、变色、沉淀时需重新标定[1]。氢氧化钾-乙醇溶液在实验过程中存放时间过长就会有沉淀析出,时间越长沉淀沉积越多,溶液浓度易改变,影响分析结果的准确性。
将放置24 h后标定出准确浓度的氢氧化钾-乙醇溶液(八次标定浓度平均值为:0.050 62 mol/L),存放在22℃~25℃的棕色瓶内,放置不同时间后的浓度变化情况(见表2)。
通过分析数据显示,7 d后标定出的浓度与真值无差异。
15 d后标定出的浓度与真值比较相对偏差为:0.08%。在允许误差范围内(允许误差<0.2%)。
30 d结果的均值与真值比较相对偏差为0.43%,超出了标准要求的允许误差范围,需要重新对浓度进行标定,而且时间过长溶液沉淀析出越多,对浓度的影响越大。
若不及时进行标定,对于油品酸度分析来说,造成分析结果偏差较大,从而影响分析结果的准确度,所以此溶液的有效期一般为15 d,工作中出现异常可以缩短标定时间。
2.3 滴定速度对标准溶液浓度的影响
GB/T 601-2016[1]标准中规定,标定标准溶液时,速度不能过快或过慢,一般为6 mL/min~8 mL/min,否则影响标准溶液的浓度的准确性。对0.05 mol/L的氢氧化钾-乙醇标准溶液在不同的滴定速度进行实验,得出结果(见表3)。
根据滴定一般要求,滴定开始时的滴定速度要快滴慢摇,接近终点时要慢滴快摇[2],通过表3结果发现:滴定速度小于6 mL/min时,结果偏小,与正常速度滴定的浓度相比其相对误差为0.10%;滴定速度大于8 mL/min时,结果偏大,相对误差为0.32%,不但超出了允许误差范围,而且结果重复性差。所以在标准溶液的标定过程中一定要控制好滴定速度。
2.4 杂质含量对溶液浓度的影响
2.4.1 除去杂质对标准溶液浓度的影响 氢氧化钾-乙醇溶液在配制时会出现浑浊、溶液上层有悬浮物。这与分析纯氢氧化钾试剂不纯,含有杂质碳酸盐(以K2CO3计)有关,分析纯氢氧化钾试剂含碳酸盐近1.5 w%,当氢氧化钾试剂加入醇后,不溶于醇的碳酸盐便悬浮在醇中,从而造成溶液浑浊。日常配制时虽然将溶液沉淀24 h,取上清液进行标定,但配制时需用95%的乙醇,会有部分碳酸盐溶于水中,难以分离。
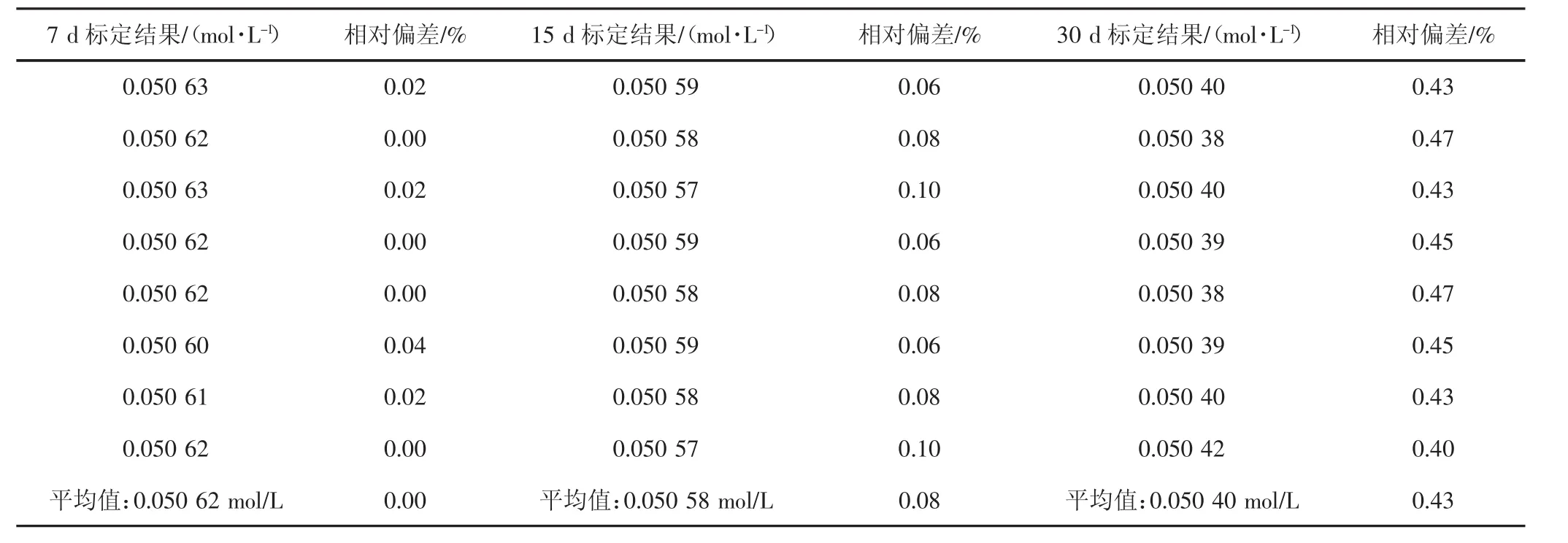
表2 不同时间标定氢氧化钾-乙醇溶液浓度变化

表3 氢氧化钾-乙醇溶液在不同滴定速度下的浓度值
在酸度测定过程中,经常会遇到样品还未测定完成,微量滴定管中就会有絮状物出现,溶液极易析出沉淀,给样品的分析过程带来不确定因素,影响分析结果的准确度。
为除去溶液中沉淀,减少样品分析过程的干扰因素,通过向标准溶液中加10%的氯化钡溶液进行实验。实验时先标定出一组准确浓度的氢氧化钾-乙醇标准溶液,将其等分成两份,一份中加入10%的氯化钡溶液(1 L标准溶液中需加3 mL~5 mL),中和溶液中的碳酸盐,另一份不加,在同等条件下静置一周,待溶液清澈后,弃去沉淀,再标定其浓度。反应式:BaCl2+CO32-=BaCO3↓+2Cl-。
结果(见表4)。标样一浓度为:0.050 45 mol/L,标样二浓度为:0.050 71 mol/L。
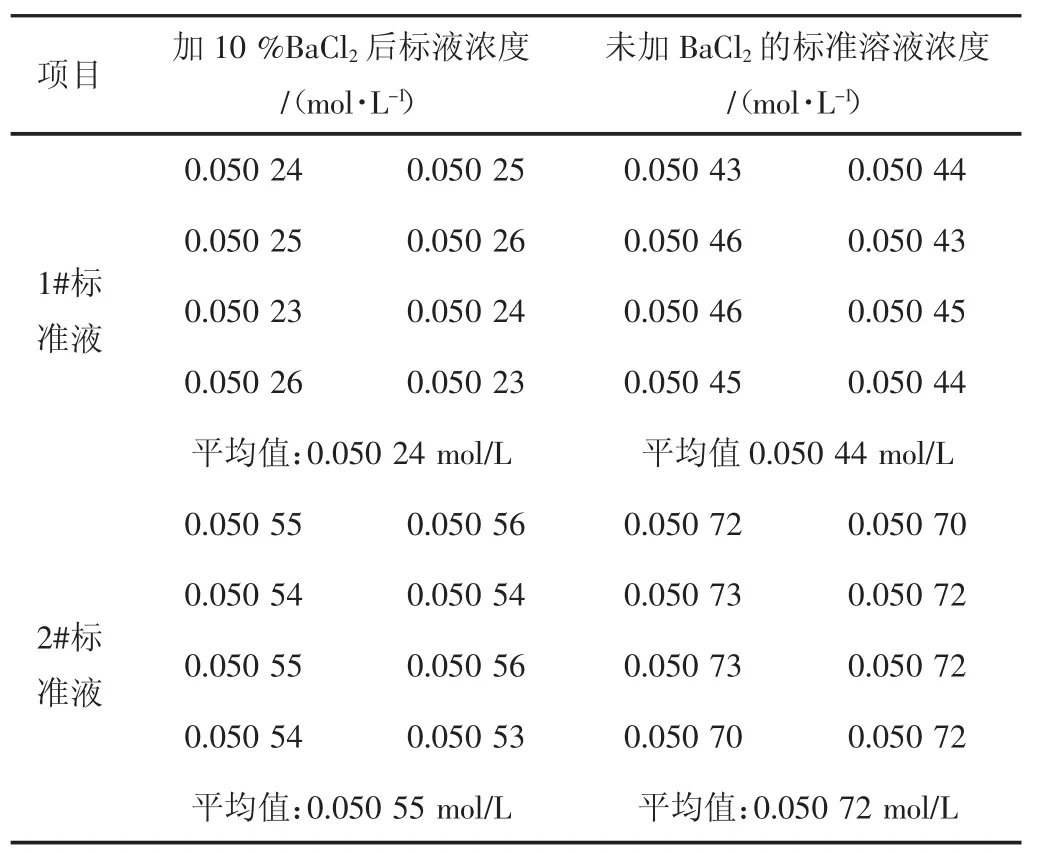
表4 加入氯化钡溶液氢氧化钾-乙醇溶液浓度的变化
通过对两种标准溶液同时进行标定,加入10%BaCl2后溶液的标准浓度偏小,但溶液浓度稳定,将加过BaCl2的溶液和未加BaCl2的溶液敞开放置24 h,发现加过BaCl2的溶液依然清亮,而未加BaCl2的溶液有明显的沉淀析出;在样品测定中,加入BaCl2的标准溶液在滴定管中长时间放置不易出现絮状物,有效保证了分析过程稳定。
2.4.2 标准溶液除去沉淀后对油品酸度的影响 用上述两种标准溶液对不同批次的车用柴油的酸度[3]进行测定,标准溶液加入10%的BaCl2溶液前后测定样品的结果(见表5)。

表5 标准溶液加入10%的BaCl2溶液前后测定样品的结果
通过实验,两种标准溶液对不同批次的油品进行酸度分析,结果符合方法重复性要求(<0.3 mgKOH/100mL);因此,在标准溶液中加入10%的氯化钡溶液,可以有效的脱出溶液中的杂质,减少沉淀析出,而且不影响油品酸度的测定,有效保证操作的稳定性。
3 建议及结论
通过多次对0.05 mol/L氢氧化钾-乙醇标准溶液进行实验和论证,分析出影响氢氧化钾-乙醇标准溶液浓度准确性的主要因素,采取了有效的规避措施,确保溶液标定过程的准确性。
(1)标准溶液配制后应按规定要求,需要放置待溶液浓度稳定后再标定,严禁现配现标并严格控制滴定速度在 6 mL/min~8 mL/min[1]。
(2)0.05 mol/L的氢氧化钾-乙醇溶液在标定15 d后需重新进行标定,确保溶液浓度准确,目前为保证油品酸度分析更加精准每周标定一次。
(3)溶液出现混浊或有沉淀现象时,应取上清液重新进行标定,若碳酸盐杂质含量高,浑浊严重,应加入10%的氯化钡溶液除去杂质,消除溶液的沉淀及浑浊现象,确保分析过程准确可靠。
