樟叶越桔不定根培养体系建立
2018-06-25卜程洪罗旭璐唐军荣
卜程洪 张 訸 罗旭璐 付 羚 唐军荣 李 娟 丁 勇 赵 平
(1. 西南林业大学西南山地森林资源保育与利用教育部重点实验室,云南 昆明 650224;2. 西南林业大学国家林业局西南地区生物多样性保育重点实验室,云南 昆明 650224;3. 西南林业大学云南省高校林木生物技术重点实验室,云南 昆明 650224)
樟叶越桔 (Vacciniumdunalianum) 为杜鹃花科 (Ericaceae) 越桔属 (Vaccinium)常绿灌木[1], 主要分布于云南西北部经滇中高原至滇南和滇东[2-3]。其果实营养丰富,全株具有舒筋活络、祛风除湿等功效,具有较高的药用和保健价值[4]。此外,樟叶越桔也是一种富含咖啡酰熊果苷类物质的特殊资源植物[5],其主要成分的黑色素生成抑制活性优于熊果苷,且毒性仅为熊果苷的1/2[6],可作为熊果苷天然替代资源加以开发利用。樟叶越桔目前仍处于野生状态,由于连年遭受破坏性采摘,导致其野生资源急剧减少,因此利用生物技术手段建立其培养体系具有重要意义。
采用 “不定根” 生物技术定向培养植物细胞或组织来获取活性次生代谢产物,具有生长周期短、可人为调控生长条件、重复性强等优点,是濒危药用植物资源开发利用研究的有效途径之一[7]。近年来,我国学者相继先后开展了一些药用植物如丹参 (Salviamiltiorrhiza)[8]、三七 (Panaxnotoginseng)[9]、苍术 (Atractylodeslancea)[10]、金铁锁 (Psammosilenetunicoides)[11]、太子参 (Pseudostellariaheterophylla)[12]和轮叶党参 (Codonopsislanceolata)[13]等的不定根研究,如柴素真[11]通过金铁锁茎段诱导出愈伤组织,再以其为外植体诱导不定根,发现不定根中的总皂苷含量约为金铁锁原药材的2倍。迄今为止,采用叶片直接诱导不定根的相关研究较少,本研究以樟叶越桔组培苗叶片为材料,建立其直接诱导不定根的培养体系,以期为樟叶越桔不定根中咖啡酰熊果苷类物质进一步的生产调控及其开发利用提供参考。
1 材料与方法
1.1 植物材料
供试樟叶越桔材料于2013年5月采自云南省楚雄彝族自治州武定县。选取当年新生无病虫害、生长健壮的幼嫩茎段进行表面清洗,然后采用75%乙醇和0.1% HgCl2进一步消毒,无菌水清洗4~5次,置于WPM + 3.0 mg/L 6-BA + 0.2 mg/L NAA启动培养基中培养,在WPM + 2.0 mg/L ZT培养基中进行继代培养[14],以健康的组培苗叶片作为实验材料。
1.2 实验方法
1.2.1叶片的处理和培养
选取生长健壮的樟叶越桔无菌组培苗,在无菌条件下将健康叶片 (10 mm × 15 mm) 取下,将叶片的正面划伤,叶片的背面紧贴培养基进行培养。以下各实验中每培养瓶各接种3枚叶片,每个处理均重复10瓶,置于25 ℃、暗培养或光照培养 (光照强度1 000~4 000 lx,光照时间12 h/d) 条件下继续培养。
1.2.2不定根生长培养时间选择
1.2.3植物生长调节剂配比选择
分别配制不同质量浓度 (0.1、0.3、0.5、1.0、2.0 mg/L) 生长激素 (IBA和NAA) 的WPM + 30 g/L白砂糖培养基,接种叶片后各处理组暗培养15 d,第30天统计生根率和根鲜质量。
1.2.4不定根生长的碳源选择
分别配制不同质量浓度 (10、20、30、40、50 g/L) 不同碳源 (蔗糖、白砂糖和葡萄糖) 的WPM +0.3 mg/L IBA培养基,接种叶片后各处理组暗培养15 d,第30天统计生根率和根鲜质量。
1.2.5不定根生长的培养基选择
分别配制含0.3 mg/L IBA和30 g/L白砂糖的1/4MS、1/2MS、MS、1/2WPM、WPM培养基,接种叶片后各处理组暗培养15 d,第30天统计生根率和根鲜质量。
1.2.6正交实验
一般来说,体育小镇的空间布局由点、轴、网和域等4个基本要素构成,这4个要素不是简单意义的空间形态,而是有着特定内涵和功能的区域[5],每一要素的内涵及布局要求如表1所示。
采用L9(33) 设计,选取暗培养时间、激素和碳源组合进行3因素3水平的正交实验。每瓶接种3枚叶片,每个处理重复10瓶,第30天统计生根率和根鲜质量,以筛选樟叶越桔叶片诱导不定根最优条件。
2 结果与分析
2.1 暗培养时间对不定根的影响
暗培养时间对樟叶越桔不定根生长的影响结果见表1。
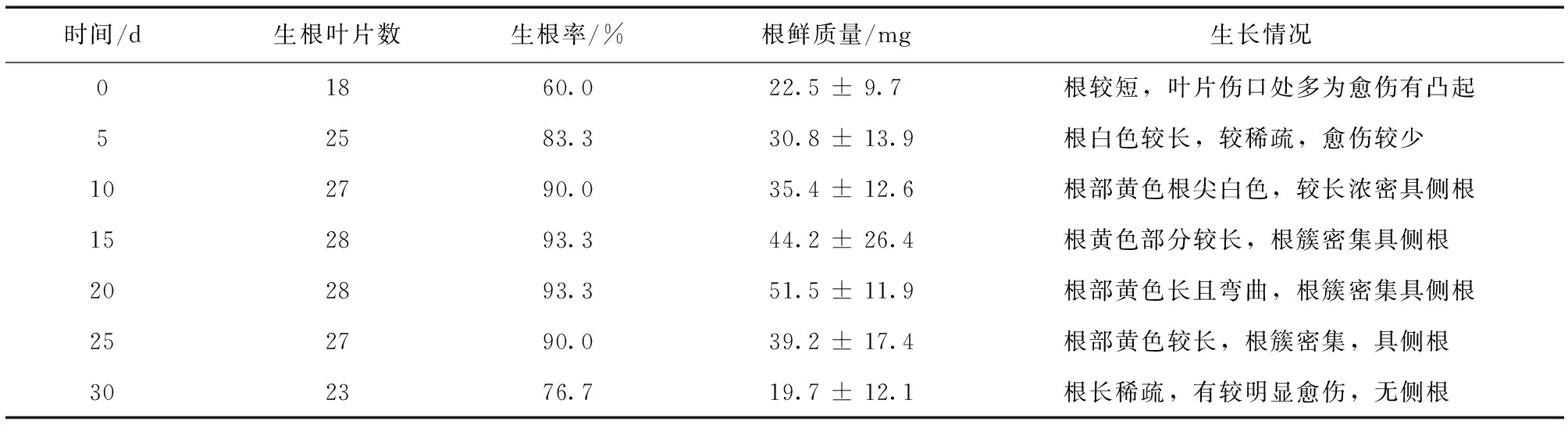
表1 暗培养时间对樟叶越桔不定根的影响Table 1 Effects of dark culture time on adventitious roots of V.dunalianum
注:接种叶片数均为30片。
由表1可知,随着暗培养0~20 d时间的增加,不定根的鲜质量和生根率也随之增加,在暗培养20 d处理组中,其不定根的鲜质量最大,表现为出根时间一致,在叶片伤口处出根密集,根长且有侧根发生。当暗培养时间超过20 d后,不定根的鲜质量和生根率呈现下降趋势,可能是由于暗培养时间过长导致根生长势减弱所致。
2.2 不同植物生长调节剂对不定根的影响
不同植物生长调节剂对叶片诱导生根的影响见表2。

表2 不同植物生长调节剂对叶片诱导生根的影响Table 2 Effects of different hormone concentration on adventitious roots of V.dunalianum
注:接种叶片数均为30片。
由表2可知,用IBA和NAA处理樟叶越桔叶片都具有诱导生根的作用。随着IBA和NAA浓度的增加,根的鲜质量是先增加后减小。当IBA为0.5 mg/L时,根的鲜质量最大,且根较长,根簇密集,密布叶片,0.3 mg/L和1.0 mg/L IBA诱导的根鲜质量次之。当NAA分别为0.1 mg/L和0.3 mg/L时,其根的发生和根鲜质量无明显差异。当2.0 mg/L NAA时,叶片卷曲,褐化,没有根的发生。由于低浓度植物生长调节剂能够促进根的发生,而高浓度则导致叶片褐化和抑制根的生长,因此IBA为0.3、0.5、1.0 mg/L时,樟叶越桔不定根的诱导效果较好。
2.3 不同碳源对樟叶越桔不定根的影响
不同碳源对樟叶越桔不定根的影响见表3。
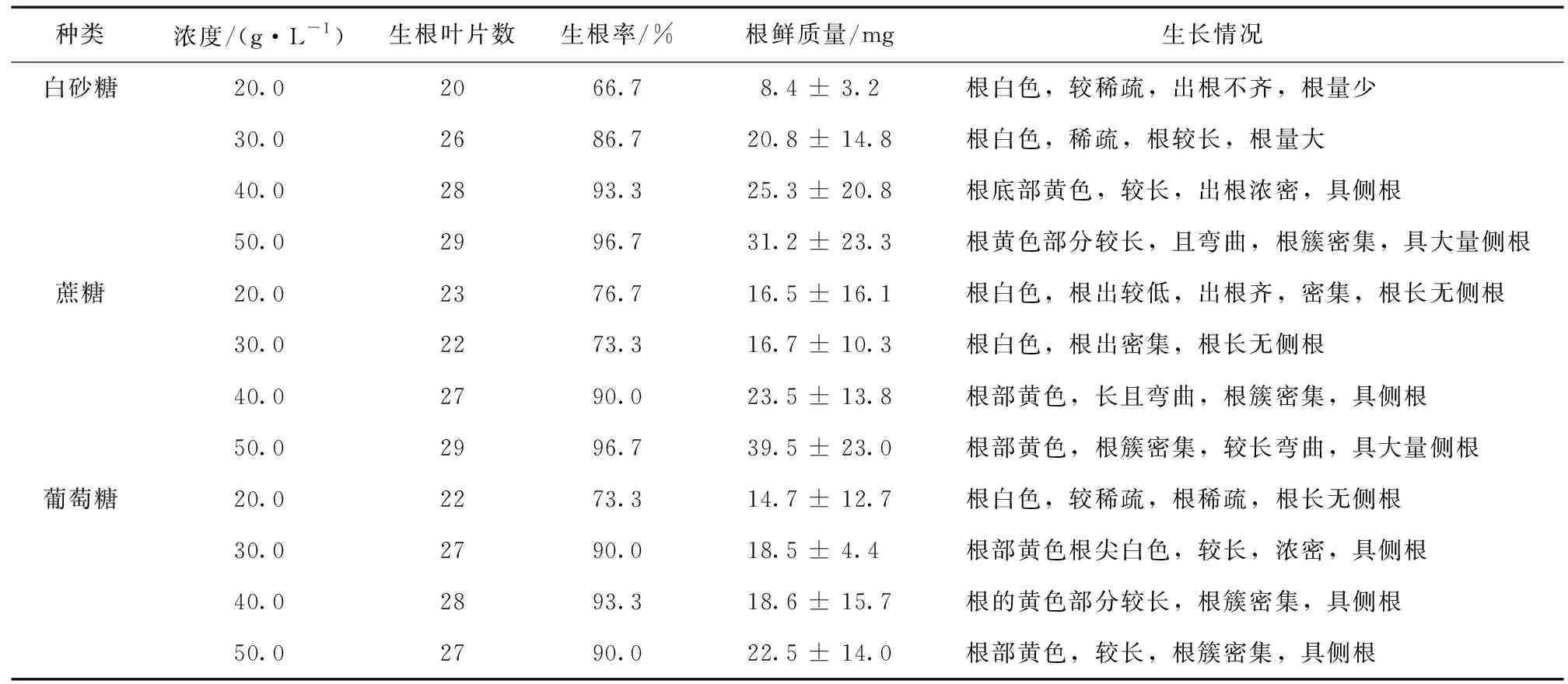
表3 不同碳源对樟叶越桔不定根的影响Table 3 Effects of different carbon source on adventitious roots of V.dunalianum
注:接种叶片数均为30片。
由表3可知,根的鲜质量随着碳源质量的增加而增加。白砂糖、蔗糖、葡萄糖分别为50 g/L时,其各自的不定根鲜质量最大,且均表现为根簇密集,较长,有弯曲状,具侧根。当40 g/L白砂糖作为碳源时,不定根的鲜质量高于同质量蔗糖下的鲜质量。从综合经济成本和不定根生长情况考虑,选择白砂糖作为碳源为宜。
2.4 不同培养基对不定根的影响
不同培养基对樟叶越桔不定根的影响见表4。

表4 不同培养基对樟叶越桔不定根的影响Table 4 Effects of different culture medium on adventitious roots of V.dunalianum
注:接种叶片数均为30片。
由表4可知,WPM和MS培养基都能使樟叶越桔叶片诱导生根,其中WPM培养基的鲜质量最大,1/4MS培养基的鲜质量最小。因此,选用WPM作为樟叶越桔不定根诱导基本培养基。
2.5 正交实验结果
不同培养条件对樟叶越桔不定根的影响见表5。
由表5可知,3因素3水平9个正交处理组中,其根的鲜质量都较高。方差分析显示,暗培养时间、IBA浓度和碳源质量三者之间对于樟叶越桔不定根诱导的影响不显著。在3个因素中,对不定根的影响大小依次为IBA浓度 > 暗培养时间 > 碳源质量。其中处理组WPM + 1.0 mg/L IBA + 50 g/L白砂糖 + 暗培养15 d培养条件对不定根诱导效果最佳,不定根平均鲜质量可达56.6 mg,生根率达96.7%,且出根一致,根簇密集,根底部黄色,根尖白色,较长,具侧根 (图1)。

表5 不同培养条件对樟叶越桔不定根的影响Table 5 Effects of different culture conditions on adventitious roots of V.dunalianum
A. 暗培养20 d;B. 0.5 mg/L IBA;C. 50 g/L白砂糖;D. WPM培养基;E. WPM + 1.0 mg/L IBA + 50 g/L白砂糖 + 暗培养15 d。
图1樟叶越桔不定根
Fig.1 The adventitious roots ofV.dunalianum
3 结论与讨论
本实验通过研究不同暗培养时间、激素配比、碳源以及培养基等影响因子对不定根诱导的影响,建立了樟叶越桔叶片诱导不定根的培养体系,并采用正交试验设计筛选出樟叶越桔叶片直接诱导不定根的最适条件为WPM + 1.0 mg/L IBA + 50.0 g/L白砂糖 + 暗培养15 d,其生根率达96.7%,每培养瓶平均根鲜质量达56.6 mg。
暗培养对于根的诱导具有决定性的作用,孙清荣等[15]对中国樱桃 (Cerasuspseudocerasus) 生根进行研究发现,一定时间的暗培养比未做暗处理的生根率明显提高。宋刚等[16]认为蓝莓 (Vacciniumspp.) 组培苗在暗培养条件下有利于细胞快速完成脱分化并促使根的分化形成,随着暗培养时间的增长,根的生物量也逐渐增加,但暗培养时间过长会导致根生长势减弱。本实验结果表明,暗培养15、20 d和25 d,不定根的鲜质量较大,出根时间一致,在叶片伤口处出根密集,根长且有侧根发生,这与魏国芹等[17]的研究结果相似。IBA对樟叶越桔不定根的诱导能力比NAA强,较低质量浓度的IBA (0.5 mg/L) 即能获得较高的生根率 (93.3%) 和根鲜质量 (51.2 mg),这与高先富等[9]对三七 (P.notoginseng) 不定根的研究结果和孙书伟[18]在蓝莓试管生根中发现IBA是诱导蓝莓组培养苗生根最好的外源生长素相符合。本实验比较了不同质量浓度下的白砂糖、蔗糖、葡萄糖作为碳源的不定根诱导情况,并发现WPM培养基的不定根诱导效果明显优于MS培养基,同样也与马怀宇等[19]对高丛蓝莓 (Vacciniumcorymbosum) 离体叶片再生的研究结果相符合。
在植物组织培养中,不定根的诱导通常是首先通过植物叶片诱导出丛生芽形成植株,再由形成植株的茎段进一步诱导不定根的生成。席培宇等[20]采用金铁锁茎段作为外植体建立植株再生,进而促进茎段不定根的生长。近年的文献报道发现,同属植物蓝莓的组培苗试管内生根较慢,生根率低,而组培苗试管外生根则相对延长了驯化移栽成活时间,且对技术人员要求更高,需具备更好的管理经验[19,21-22]。本研究发现,樟叶越桔组培苗叶片生根相对较为容易,生根率高,其叶片不定根发生的能力较强,生根速度快,出根整齐。本实验建立并优化了樟叶越桔叶片直接诱导不定根的培养体系,将为进一步开展咖啡酰熊果苷类物质进一步的生产调控及其开发利用提供基础。此外,本实验还发现个别叶片诱导出的不定根稀疏甚至不产生不定根,导致各试验处理组10个重复中根鲜质量的相对平均偏差较大,这很可能是因为各叶片切口处不定根起源细胞周围的内源激素积累水平不一所致[23],值得进一步开展其不定根发生机理的深入研究。
[参 考 文 献]
[1] 候昭宽. 中国种子植物科属词典 [M]. 北京: 科学出版社, 1998: 509-510.
[2] 中国科学院昆明植物研究所. 云南种子植物名录:下册[M]. 昆明: 云南人民出版社, 1984: 1138-1145.
[3] 方瑞征. 中国越桔属的研究[J]. 云南植物研究, 1986, 8(3): 239-258.
[4] 罗旭璐, 张德国, 李永和, 等. 樟叶越橘阴干果实的营养成分[J]. 江苏农业科学, 2014, 42(1): 242-243.
[5] Zhao P, Tanaka T, Hirabayashi K, et al. Caffeoyl arbutin and related compounds from the buds ofVacciniumdunalianum[J]. Phytochemistry, 2008, 69(18): 3087-3094.
[6] Xu M, Lao Q C, Zhao P, et al. 6′-O-Caffeoylarbutin inhibits melanogenesis in zebrafish[J]. Natural Product Research, 2014, 28(12): 932-934.
[7] 尹双双, 高文远, 王娟, 等. 药用植物不定根培养的影响因素[J]. 中国中药杂志, 2012, 24(3): 3691-3694.
[8] 陈巍, 郭肖红, 高文远, 等. 丹参不定根离体培养的研究[J]. 中国中药杂志, 2006, 31(17): 1409-1412.
[9] 高先富, 徐朝晖, 刘佳键, 等. 三七不定根的离体诱导与培养[J]. 中国中药杂志, 2006, 31(18): 1485-1488.
[10] 袁媛, 吕冬梅, 黄璐琦, 等. 苍术不定根诱导培养的研究[J]. 中国中药杂志, 2007, 32(1): 65-66.
[11] 柴素真, 洪汉君, 张宗申, 等. 一种金铁锁不定根培养体系的建立与扩大培养方法: 201210293609.3[P]. 2012-11-14.
[12] 梁玉勇, 廖玲, 左北梅, 等. 太子参不定根诱导及增殖培养研究[J]. 北方园艺, 2013, 37(2): 147-149.
[13] 李美阳. 轮叶党参不定根的诱导培养[J]. 安徽农业科学, 2015, 43(1): 27-28.
[14] 罗旭璐, 唐军荣, 李娜, 等. 樟叶越桔的组织培养与快速繁殖[J]. 植物生理学报, 2014, 50(11): 1717-1720.
[15] 孙清荣, 孙洪雁, 赵红军. 中国樱桃抗病毒选系试管苗生根的研究[J]. 园艺学报, 2000, 27(1): 57-58.
[16] 宋刚, 徐银, 宋金耀, 等. 蓝莓试管苗不定根的诱导研究[J]. 江苏农业科学, 2011, 39(6): 89-91.
[17] 魏国芹, 梁美霞, 李鼎立, 等. 平邑甜茶与M7离体叶片不定芽再生的研究[J]. 青岛农业大学学报 (自然科学版), 2009, 26(2): 103-108.
[18] 孙书伟. 蓝莓组培苗瓶内生根的探讨[J]. 湖北农业科学, 2009, 48(4): 786-788.
[19] 马怀宇, 李亚东, 刘庆忠, 等. 高丛越橘离体叶片再生植株研究初报[J]. 东北农业大学学报, 2004, 35(2): 212-215.
[20] 席培宇, 王虹, 刘燕, 等. 金铁锁不定根培养体系建立[J]. 种子, 2017, 36(2): 131-134.
[21] 姚平, 孙书伟. 蓝莓组织培养瓶内复壮瓶外生根快繁技术[J]. 北方园艺, 2009, 33(4): 161-162.
[22] 韩德伟. IBA对蓝莓组培苗瓶内生根的影响[J]. 江苏农业科学, 2013, 41(7): 38-40.
[23] 张焕欣, 董春娟, 李福凯, 等. 植物不定根发生机理的研究进展[J]. 西北植物学报, 2017, 37(7): 1457-1464.
