链格孢菌毒素对中国月季主要营养物质含量的影响
2018-06-25李云仙李永梅杨发忠
李云仙 李永梅 杨发忠 李 靖
(1. 云南农业大学植物保护学院,云南 昆明 650201;2. 西南林业大学化学工程学院,云南 昆明 650224;3. 云南农业大学资源与环境学院,云南 昆明 650201;4. 西南林业大学生命科学学院,云南 昆明 650224)
植物体进化了一系列防御机制来防止昆虫的取食,这些机制主要分为两类:组成型防御反应和诱导型防御反应,组成型防御反应是植物固有的防御反应,具有特异性,以储存化合物、结合化合物或活化化合物前体的形式存在,这些物质都很容易受伤害诱导激发,迄今为止,大多数的防御反应都是组成型的防御反应。诱导型防御反应仅发生在植物被伤害之后,例如,当植物遭遇食草动物侵袭时,体内茉莉酸水平迅速升高,促使植物中许多参与反应的蛋白质合成[1-3]。植物受病原物侵染后,其体内的蛋白质含量会发生变化[4],植物病原菌的入侵能引起寄主植物产生一系列的生理生化和代谢变化,如一些专性寄生真菌侵染后常会使寄主植物叶绿体的非环式电子传递受到抑制[5]。中国月季感染白粉菌后,体内蛋白质、糖的含量以及矿质元素的种类和含量均发生了变化[6-7]。在侵染后期,许多病原物可引起寄主植物的质膜透性改变,叶表的保护组织受到破坏,导致水分大量流失,造成寄主植物局部坏死,尤其是寄主在感染锈病后,表皮被成熟的锈孢子突破甚至撕裂,表皮层和角质层受到了损害,失去了保护叶片的作用,蒸腾作用会大大加强[8],使植物的生长发育受到影响。
有研究发现,病原菌侵染对昆虫存在有利或者不利影响,例如象虫 (Apiononopordi) 在锈菌 (Pucciniapunctiformis) 感染的田蓟 (Cirsiumarvense) 上,比在健康田蓟上有更高的存活率[9];甜菜夜蛾 (Spodopteraexigua) 对感染白粉病 (Sphaerothecapannosa) 的中国月季 (Rosachinensis) 取食和产卵量均明显下降[10]。目前,对于病虫之间通过寄主植物的介导作用而进行的间接相互作用的研究很少见报道,特别是对这种通过病原真菌毒素诱导寄主植物产生对植食性昆虫抗性的机理的研究还未见报道。
链格孢菌 (Alternariatenuissima) 属真菌门、半知菌亚门、丝孢纲、丝孢目,是一类自然界中普遍存在的植物致病菌,其致病的主要机理是通过产生多种毒素,造成被侵染植物组织的病理反应和伤害,链格孢菌毒素能破坏质膜、叶绿体、以及线粒体的结构,从而影响细胞正常代谢[11]。链格孢菌 (Alternariasp.) 粗毒素处理中国月季对月季长管蚜有十分明显的抑制作用[12-13]。毒素处理后的中国月季对月季长管蚜表现出明显的趋避作用的机理目前仍然不清楚。在病虫互作关系的研究中,寄主植物介导的间接病虫互作关系的影响机理仍不清楚,需要对寄主植物生理生化方面进行进一步研究,本实验对进一步探讨寄主、病害、虫害三者互作机理具有重要的参考意义。
1 材料与方法
1.1 实验材料
样品采自云南省昆明市呈贡、昆阳等月季种植基地,选取无病虫害生长基本一致的植株于大棚中培养50 d后备用;链格孢菌是从斗南中国月季种植基地的月季上按照常规方法分离纯化得到。仪器及试剂主要有:自动凯氏定氮仪 (瑞典FOSSTECATOR公司,2300型);样品消化器 (瑞典FOSSTECATOR公司,2300型);盐酸标准溶液准储备液;40%氢氧化钠溶液;浓硫酸 (分析纯);高纯氩气 (99.999%);微波消解仪 (美国CEM,Mars5);VISFA-MPX型电感耦合等离子体发射光谱仪 (美国VARIAN公司);可见分光光度计;各种矿质元素标准储备溶液 (国家钢铁材料测试中心),浓度为1 000 μg/mL;硝酸、双氧水为优级纯;超纯水;玻璃仪器均经10%HNO3浸泡过夜,用超纯水清洗。
1.2 实验方法
1.2.1链格孢菌粗毒素的提取及细交链孢菌酮酸的分离制备
将分离纯化的链格孢菌株种在PDA培养基上,倒置培养至菌落铺满平板。3平板为一组,将菌株连同培养基用刀片划成1 cm × 1 cm大小的小块放置于锥形瓶内,向锥形瓶内倒入有机提取液 (V(乙酸乙酯)∶V(甲醇)∶V(冰醋酸)=80∶15∶5),使提取液刚好没过菌株和培养基。重复提取3次,合并提取液。在旋转蒸发仪上蒸干,用4 mL甲醇将固体萃取物溶解,装在5 mL冻存管中,4 ℃保存。
提取到的粗毒素经0.45 μm滤膜过滤后,进样到HPLC中进行分析制备,流动相为100%乙腈,流速为0.6 mL/min;进样量20 μL;检测波长280 nm。当目标峰出现时,收集流出物,通过多次收集目标组分的洗脱液,并在旋转蒸发仪上蒸干后,就获得了高浓缩的洗脱液,合并浓缩后的洗脱液,-20 ℃保存备用。将获得的TeA用高效液相色谱再次分析,与标准品对比验证所得目标产物是否一致。
1.2.2毒素细交链孢菌酮酸处理月季
用一定浓度的细交链孢菌酮酸 (TeA) 溶液均匀喷洒经温室大棚培养的无病虫害月季 (每天喷洒1次),选择月季植株中间的1株复叶喷洒,位于这株复叶以上和以下的复叶不做处理,测定2, 6, 10, 14, 20 d后叶片中蛋白质、糖、水分和矿质元素的含量。以相应健康植株叶片作为对照。
1.3 测定方法
1.3.1叶片蛋白质含量的测定
健康和TeA处理后的中国月季叶片洗净烘干粉碎后装袋备用。称取0.1 g样品于洗净干燥的消化管内,每个试样做3个平行对照,称取配制好的m(K2SO4)∶m(CuSO4)比例为5∶1的催化剂,吸取浓硫酸10 mL于消化管中,将加好试剂的消化管放到消化炉上预热30 min (200 ℃),消化温度为420 ℃,消化至反应液呈透明蓝绿色,消化时间为1.5 h左右,取出冷却15~20 min,将消化管放入2300型全自动凯氏定氮仪,关上安全门,仪器自动进行蒸馏、滴定、计算最后记录结果。
1.3.2叶片可溶性糖含量的测定
可溶性糖含量的测定用葸酮比色法,测定步骤如下。
1) 葡萄糖标准曲线的绘制:葡萄糖在80 ℃烘箱中烘至恒质量,精确称取2.000 0 g,加蒸馏水溶解,并定容至1 L,4 ℃保存。使用时稀释10倍。得到含糖量为0.2 mg/mL的标准液,用蒸馏水将标准葡萄糖溶液稀释成一系列0~100 μg/mL的不同浓度的标准溶液,放入7支具塞试管中,分别吸取1 mL标准溶液于试管中,各加入5 mL蒽酮试剂,混匀,沸水浴10 min,冷却,用分光光度计测定625 nm处的吸光度,绘制标准曲线。
2) 样品中可溶性糖的提取:称取样品0.5 g左右,剪碎研磨至匀浆,倒入三角瓶中。加入10 mL 80%乙醇;80 ℃水浴20 min,不断搅拌,冷却;4 000 r/min离心5 min,残渣中加5 mL 80%乙醇。重复在80 ℃水浴中提取2次,合并上清液;加入10 mg活性炭,80 ℃水浴15 min,过滤,定容至25 mL,取0.2 mL样品提取液;加入0.8 mL蒸馏水,混合;再加入5 mL蒽酮试剂,小心混合,沸水浴10 min,冷却。用分光光度计测定625 nm处的吸光度的值,从标准曲线上的方程得到提取液中糖含量。
1.3.3叶片水分的测定
水分含量测定参考[14]的方法稍作改动,采用烘箱烘干的方法进行测定。把采集到的健康和毒素TeA处理后的中国月季叶片洗干净然后晾干,精密称取一定量的新鲜叶片,60 ℃烘干至恒质量,根据失去水分的质量计算出叶片的含水率。健康和毒素TeA处理后的叶片各平行测定5次,取平均值。
1.3.4叶片矿质元素的测定
1) 样品消解。采集毒素处理后的月季叶片和健康月季叶片,于烘箱中80 ℃烘干,烘干后的样品取出用研钵研碎,然后分别精确称取0.2~0.3 g样品倒入消解罐中,精确到0.1 mg,依次加入5 mL浓硝酸,2 mL双氧水,然后把消解罐置于微波消解仪中。按表1程序进行消解,消解完成后待温度冷却至室温,将消解罐中的液体转移到50 mL容量瓶中,用5%硝酸定容。平行测定3次并做空白试验[15]。
2) 分析谱线的选择。为了避免待测矿质元素之间相互影响和干扰谱线,每个元素均选取2~3条特征谱线进行测定,综合强度分析、干扰情况、稳定性等因素,选择干扰比较小、精密度比较高的适合待测样品的分析线作为仪器的工作分析谱线。
3) 工作曲线的建立。分别吸取标准空白溶液和不同浓度的各种矿质元素标准工作溶液,注入电感耦合等离子体光谱仪 (ICP-OES) 中,在选定的仪器参数下,用标准系列浓度的溶液进样5次,以平均吸收强度对各元素浓度做标准工作曲线的回归方程,并获得相应的相关系数R2应不小于0.999。
4) 加标回收实验。各待测元素的标准溶液按一定的量分别加入到实验样品中,按消解样品的方法进行消解,按照样品测定方法重复测定5次。加标回收率=(加标试样测定值-试样测定值)/加标量 × 100%;相对标准偏差 (RSD)=标准偏差 (SD)/计算结果的算术平均值 (X)×100%。
2 结果与分析
2.1 毒素处理后月季叶片中蛋白质含量变化
毒素处理月季叶片蛋白质含量的时间和空间变化见图1。
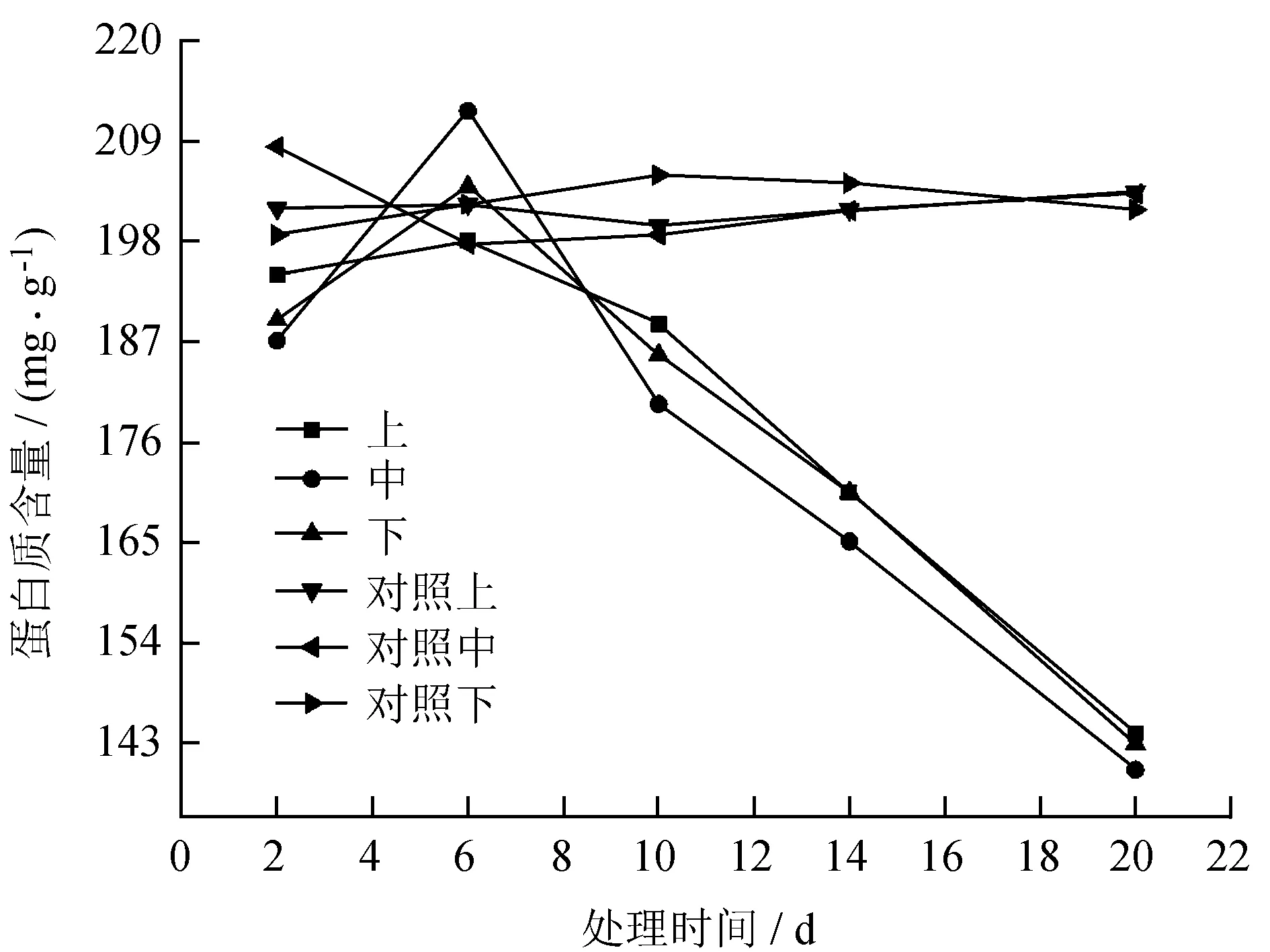
图1毒素处理月季叶片蛋白质含量的时间和空间变化
Fig.1 Temporal and spatial changes of protein content in leaves ofR.chinensiswith toxin
从图1可看出,与健康叶片相比,处理2 d后叶片内蛋白质含量已经下降,但是感病6 d后,叶片中蛋白质含量突然增高,后随处理时间延长而进一步降低,从208.41 mg/g降低至145.09 mg/g,差异达显著水平 (P< 0.05)。毒素处理月季对其叶片中蛋白质含量存在一定的空间效应,而且对上方空间影响大于下方,处理20 d时,上方月季叶片中蛋白质含量下降比下方月季叶片中蛋白质含量大。总体来看,蛋白质的含量随着处理时间的延长而逐渐降低,3个部位的蛋白质含量都与处理时间呈负相关关系。
2.2 毒素处理后月季叶片中可溶性糖含量变化
毒素处理前后月季叶片中可溶性糖含量的时间和空间变化变化见图2。
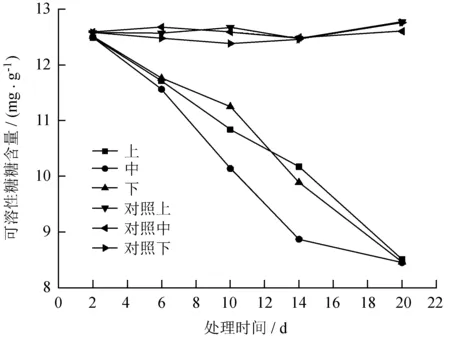
图2毒素处理前后月季叶片中可溶性糖含量
的时间和空间变化变化
Fig.2 Temporal and spatial changes of soluble sugar content in leaves ofR.chinensistreated with toxin
由图2可以看出,随TeA处理时间的增加,叶片内可溶性糖含量呈下降趋势,呈明显负相关关系。且处理部位可溶性糖下降量显著高于处理部位以上和以下的叶片,3个部位可溶性糖含量均下降,说明TeA处理对月季叶片可溶性糖含量的影响存在时空效应。
2.3 毒素处理后月季叶片中水分含量变化
毒素处理月季叶片水分含量的时间和空间变化见图3。
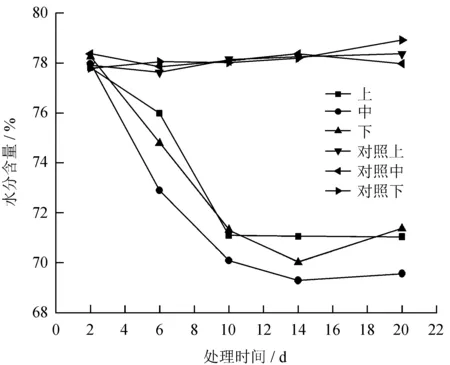
图3毒素处理月季叶片水分含量的时间和空间变化
Fig.3 Temporal and spatial changes of water content in leaves ofR.chinensiswith toxin
从图3可知,链格孢菌毒素对月季叶片水分含量的影响很大,毒素处理2 d后,月季叶片含水量开始明显下降,并随处理时间的增加而显著降低,到20 d时,与健康叶片相比,水分含量下降8.04%左右。同时,毒素处理月季对其叶片中水分含量存在明显的空间效应,位于处理叶片上方和下方的叶片含水量也随之下降,处理时间在10 d以前,与处理时间呈负相关关系。10 d以后,水分含量几乎不再变化。
2.4 毒素处理前后月季中矿质元素含量的变化
用电感耦合等离子体光谱仪 (ICP-OES) 测定了链格孢菌毒素TeA处理中国月季植株后,月季叶片中矿质元素的含量,测定结果见表1~2。
由表1~2可知,健康中国月季叶片和用链格孢菌毒素处理后的月季叶片中均检测出17种元素,Ca、Mg、K、S、P在2种叶片中含量都很高,与健康叶片对比,Ca、Mg、K、S、P、Sn、Zn在毒素处理后的叶片中含量均明显下降 (P< 0.05),且下降量随处理时间的增加而增大。Al、B、Cu、Mn、Na、Si、Sr 7种元素在毒素处理后的叶片内含量高于健康叶片,在处理6 d后,B、Cu、Mn、Na、Si、Sr 6种元素含量显著高于健康叶片 (P< 0.05);由此可以看出,中国月季用链格孢菌毒素 (TeA) 处理后多种矿质元素含量发生变化,10种元素含量降低,有7种元素含量升高,含量降低的矿质元素主要是一些对植物生命代谢起着重要作用的元素,例如Ca、Mg、K、S、P,下降幅度比较大。Al、B、Cu、Mn、Na、Si、Sr在毒素处理后的叶片中含量升高,其中Na含量增大较多,TeA处理后的第2天,Na含量由53.37 μg/g上升1 015.42 μg/g,增加了将近20倍,之后有所下降,但仍然比对照高10倍以上;Ba、Be、Ca、Mg、K、Mn、Fe等元素变化较复杂,呈现先降低后又升高之后又降低的趋势;Al和Si含量在第20天最高,分别为46.19 μg/g和203.21 μg/g,Mn元素在处理2天后,含量降低,之后又直线升高;位于处理部位上方和下方的叶片中矿质元素的变化和链格孢菌毒素 (TeA) 处理部位叶片中矿质元素含量的变化一致,说明TeA处理对月季叶片矿质元素含量的变化存在一定的空间效应。与处理部位叶片中矿质元素含量不同之处有:Al元素含量在第10天达到最高,之后又下降;Na元素含量增高的量远远小于处理部位,Mn元素含量增大量比处理部位高。矿质元素的这种变化趋势可能与植物抗虫性有关,需要进一步研究。
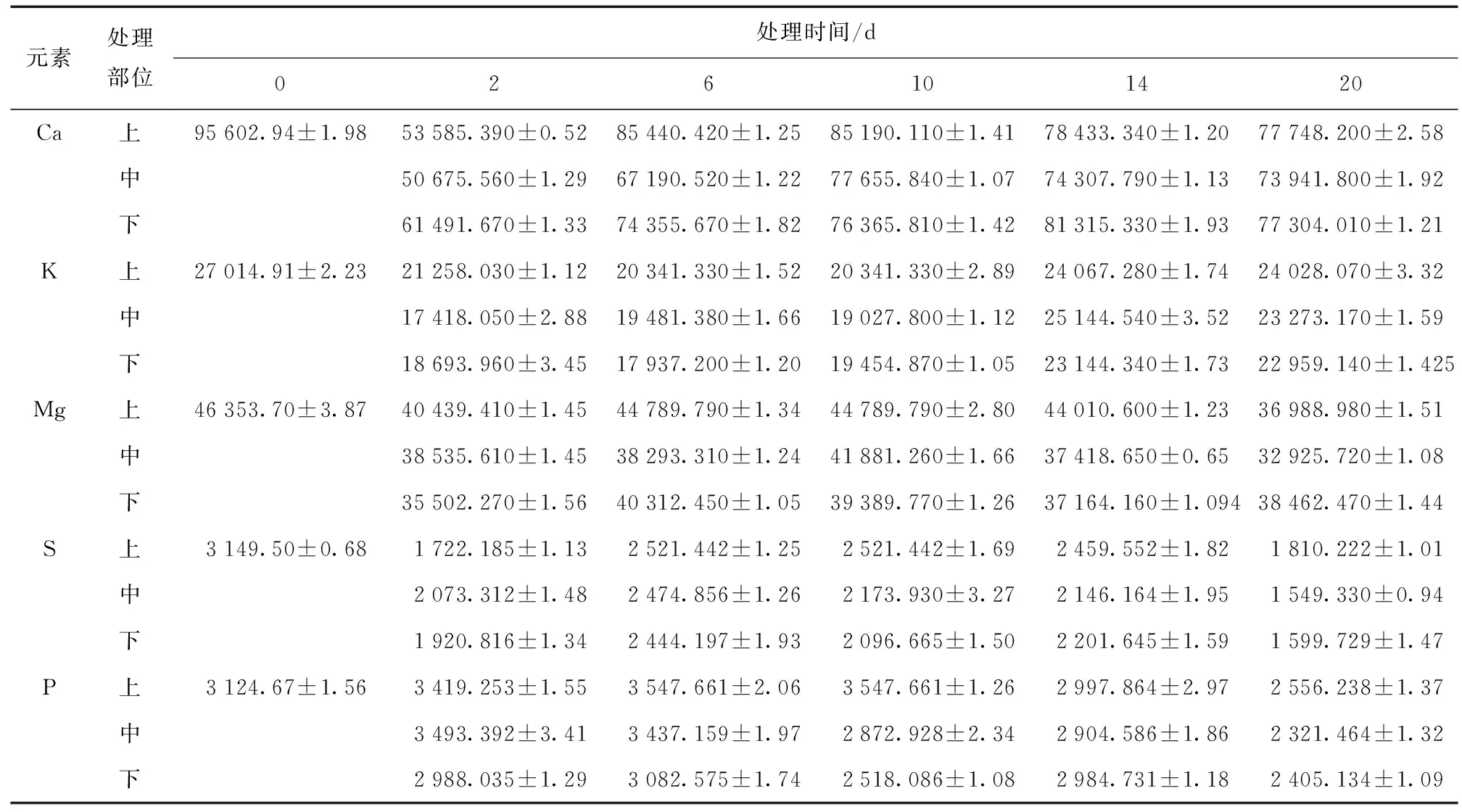
表1 链格孢菌毒素TeA处理中国月季后叶片大量元素时间和空间的含量变化 (μg/g)Table 1 Temporal and spatial changes of major elements contents in leaves of R.chinensis leaves treated with TeA
注:处理部位为 “中”,上、下表示位于处理部位以上和以下的叶片,0、2、6、10、14、20表示处理时间,0为健康叶片 (对照)。

表2 链格孢菌毒素TeA处理中国月季后叶片微量元素时间和空间的含量变化 (μg/g)Table 2 Temporal and spatial changes of microelements contents in leaves of R.chinensis treated with TeA
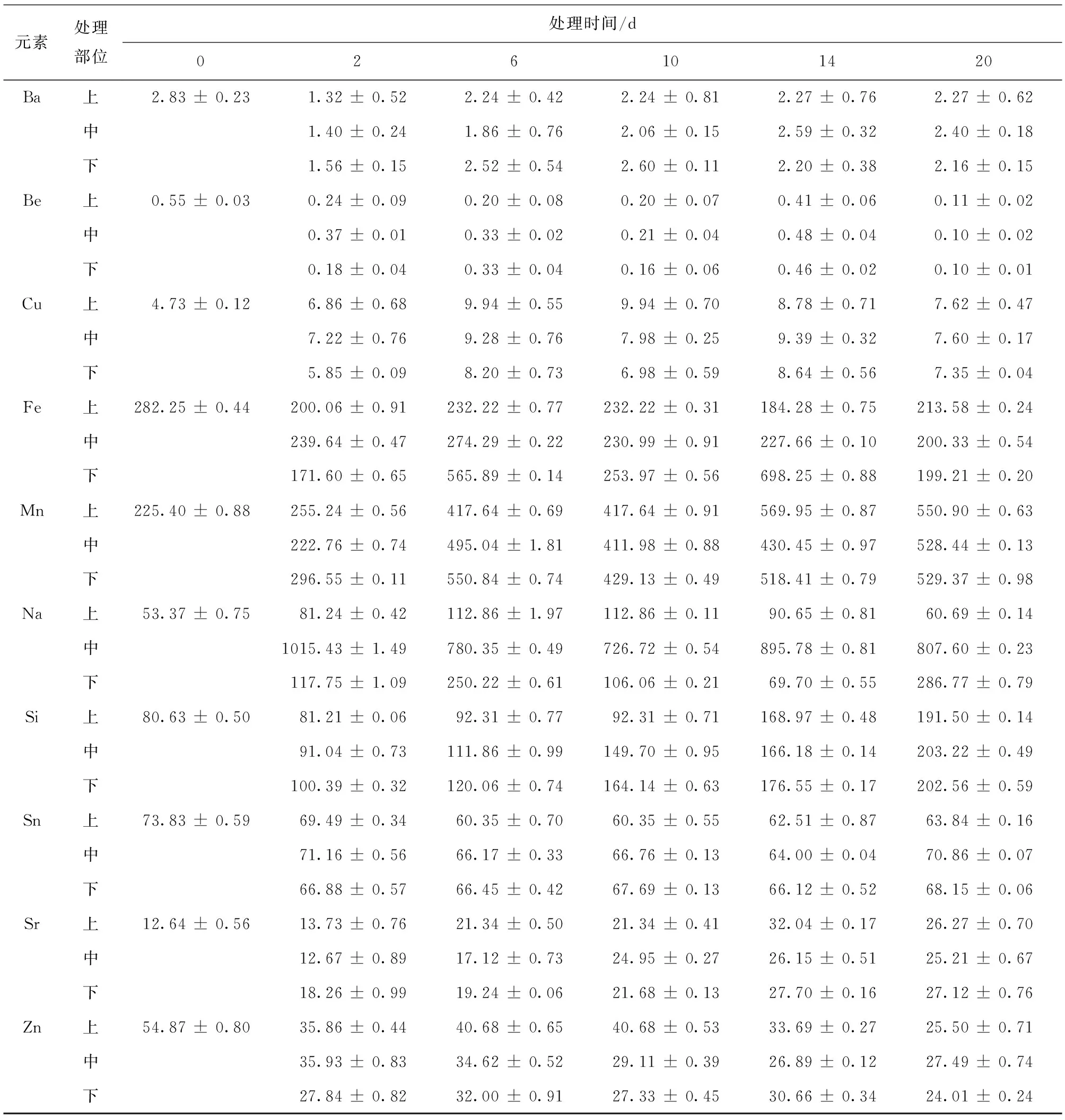
续表2
注:处理部位为 “中”,上、下表示位于处理部位以上和以下的叶片,0、2、6、10、14、20表示处理时间,0为健康叶片 (对照)。
3 结论与讨论
中国月季用链格孢菌毒素TeA处理后,叶片内蛋白质、可溶性糖、水分含量与健康叶片相比均明显下降,并且链格孢菌毒素TeA侵染中国月季叶片后,三者都存在时间和空间效应,随处理天数的增加,水分和可溶性糖含量下降程度增大,蛋白质含量变化则呈现出较复杂的一个变化趋势,在处理6 d后月季叶片蛋白质含量高于健康叶片,之后又明显下降,这个现象可能是因为,月季受病
原菌侵染后,体内茉莉酸水平迅速升高,促使植物中许多参与反应的蛋白质合成,是植物主动防御的一个表现,之后,蛋白质含量显著下降,可能是毒素进入叶片影响质膜通透性,造成叶片细胞程序性死亡,进而也导致叶片水分丧失,水分含量降低。Ca、Mg、K等矿质元素对昆虫正常的生长发育起着关键的作用,与健康叶片相比,TeA处理后的月季叶片中,Ca、Mg、K、S、P、Zn这几种元素含量显著降低,表明链格孢菌毒素对月季生长发育、生理代谢有较大影响,这可能是毒素处理月季叶片后影响月季长管蚜搜寻寄主及生长发育的重要原因之一。月季叶片中Al、B、Cu、Mn、Na、Si、Sr 7种元素在毒素处理后含量大幅增高,这可能与植物抗病性有关,有研究表明:病原菌侵染中国月季后,月季体内Al、B、Cu、Mn元素含量增高;月季外施矿质元素后提高了月季对长管蚜的抗性,矿质元素通过植物介导影响蚜虫与月季生理代谢。Al、Cu 2种元素均为对昆虫毒性很强,所以可能这2种元素含量的变化与月季长管蚜对链格孢菌毒素处理后的月季叶片取食量减少有关,这2种元素的量增加不利于昆虫的取食。为什么链格孢菌毒素TeA处理中国月季后Al、Cu元素含量会增大,以及这两种元素在植物抗病性方面是否有什么作用,这些问题值得进一步深入研究。这些是值得深入研究的问题。
目前,对于植物病原菌危害对寄主植物营养成分影响的研究很少,其中也有一些研究表明,植物被病原菌侵染后各营养成分发生了变化。比如,白粉菌浸染中国月季后,中国月季叶片中可溶性蛋白质和总糖含量都明显下降[6],Ca、Mg、K等元素含量也显著下降,Al、Cu、B 、Mn含量增高[7],这些研究结果与本研究得出的结论基本一致,这说明即使是不同种类的病原菌,其侵染对寄主植物营养成分含量造成的影响规律也是类似的。
本研究试图从植物营养成分变化的角度阐明链格孢菌毒素TeA诱导月季对月季长管蚜产生不利影响的机理。结果显示,TeA对中国月季叶片内水分、蛋白质、可溶性糖和重要矿质元素的含量均显著下降,表明营养成分含量变化是月季长管蚜避免取食的重要原因之一。目前关于植物介导产生的病虫互作关系的研究缺乏寄主植物生理生化变化方面的直接证据,本实验对进一步研究病害对寄主植物防御虫害的机理具有重要意义。
[1] 宋纯鹏, 王学路, 周云, 等. 植物生理学 [M]. 5版. 北京: 科学出版社, 2015.
[2] 禹海鑫, 叶文丰, 孙民琴, 等. 植物与植食性昆虫防御与反防御的3个层次[J]. 生态学杂志, 2015, 34(1): 256-262.
[3] Howe G A, Jander G. Plant immunity to insect herbivores[J]. Annual Review of Plant Biology, 2008, 59: 41-66.
[4] 曾永三, 杨寿坚, 麦燕玲, 等. 番木瓜感染环斑花叶病毒后蛋白质和还原糖的变化[J]. 亚热带植物科学, 2005, 34(4): 10-13.
[5] Bethenod O, Le Corre M, Huber L, et al. Modelling the impact of brown rust on wheat crop photosynthesis after flowering[J]. Agricultural and Forest Meteorology, 2005,131: 41-53.
[6] 杨发忠, 杨德强, 杨斌. 中国月季感染白粉菌后的蛋白质和糖类含量变化[J]. 贵州农业科学, 2016, 44(2): 81-84.
[7] 杨发忠, 董智森, 肖春. 中国月季感染白粉菌后矿质元素种类和含量的变化[J]. 江苏农业科学, 2016, 44(6): 304-306.
[8] Lakso A N, Pratt C, Pearson R C, et al. Photosynthesis, transpiration and water use efficiency of mature grape leaves infected with uncinula necator (powdery mildew) [J]. Phytopathology, 1982, 72: 232-236.
[9] Bacher S, Friedli J, Schär I. Developing in diseased host plants increases survival and fecundity in a stem-boring weevil[J]. Entomologia Experimentalis et Applicata, 2002,103: 191-195.
[10] Yang F Z, Li Y, Yang B. The inhibitory effects of rose powdery mildew infection on the oviposition behaviour and performance of beet armyworms[J]. Entomologia Experimentalis Et Applicata, 2013, 148(1): 39-47.
[11] Lorenzini M, Zapparoli G. Characterization and pathogenicity ofAlternariaspp. strains associated with grape bunch rot during post-harvest withering[J]. International Journal of Food Microbiology, 2014, 186: 1-5.
[12] 李贝贝, 陈玉惠, 赵宁, 等. 链格孢菌0845菌株粗提物对月季长管蚜的抑制活性[J]. 贵州农业科学, 2013, 41(4): 89-91.
[13] 李莉. 链格孢菌毒素对月季及月季长管蚜影响研究[D]. 昆明: 西南林业大学, 2011: 6.
[14] 王海霞, 周文婷, 林萍, 等. NIRS在广金钱草水分含量测定中的应用[J]. 江苏农业科学, 2014, 42(7): 324-326.
[15] 李云仙, 郑志峰, 刘琳, 等. 5种柑橘类水果矿质元素的测定[J]. 食品工业, 2016, 37(7): 281-284.
