8种美洲黑杨无性系抗寒性评价
2018-06-25樊军锋张锦梅
田 星 樊军锋 张锦梅
(西北农林科技大学林学院,陕西 杨凌 712100)
杨树隶属于杨柳科 (Salicaceae)、杨属 (Populus),在世界范围内分布广泛且适应性强。在北半球温带、寒温带,从低海拔到4 800 m的高海拔、北纬22°~70°均有分布[1]。作为用途广泛的加工业原料、防护林树种、能源树种,杨树越来越受到市场的青睐[2]。近年来,随着人工杂交优良杨树品种和丰产栽培技术的广泛应用,中国已成为世界上杨树人工林最大的国家[3]。气温骤降对植物伤害极大[4],在我国北方地区,杨树在生长过程中常会受到低温胁迫,而目前大部分速生丰产系不耐低温。杨树本身属于耐寒树种,但由于其品系不同,抗寒性也存在较大差异[4-5]。因此,探讨杨树的抗寒机理,分析其抗寒性,筛选出不同抗寒品种,对杨树引种和栽培推广具有较高的实践价值和指导意义。
国内外学者筛选鉴定不同抗寒性杨树品种的途径有3个:一是杨树天然杂种选择,世界各知名杨树研究机构均从天然杨树杂种中筛育出了众多优异抗逆品种,如意大利杨树研究机构经由欧美杨 (Populus×euramericana) 天然杂种筛育出知名抗寒品种I-214,其特性优异并被广泛引种于各杨树栽植地域[6];二是杨树天然杂交育种选择,徐纬英等[7]采用青杨 (Populuscathayana)×钻天杨 (P.nigra) 筛育出知名抗寒品系北京杨 (P.beijingensis),徐纬英等[8]经由小叶杨 (P.simonii)× 钻天杨筛育出知名抗寒品系合作杨 (P.opera);三是杨树基因工程育种选择,近年杨树基因工程育种在我国发展迅速,如杨树经由拟南芥 (Arabidopsisthaliana) Fe SOD基因显著提升了转化植株的低温逆境抗性表现[9],Jouanin等[10]经由 CHS 基因显著提升了转化杨树植株的抗寒性。
经过育种选择后的新品种需要进一步测定方可推广和应用。目前,评定林木抗寒性的主要指标有形态、生理生化和代谢指标[8]。本研究以8个黑杨品种为试验材料,通过测定与其生理生化密切相关的生理指标,如半致死温度 (LT50)、超氧化物歧化酶 (SOD) 活性、过氧化物酶 (POD) 活性、可溶性蛋白质量分数、丙二醛 (MDA) 质量摩尔浓度等,并结合隶属函数方法对8个无性系抗寒情况进行比较与评价,探讨杨树抗寒性结构指标的筛选方法,为抗寒造林树种的选择提供科学依据,促进杨树优良种质资源的推广和应用。
1 材料与方法
1.1 试验材料
西北农林科技大学林学院林木育种课题组以2013年营造的美洲黑杨试验林为研究对象,在该试验林中选择5个无性系为供试材料,以长期在陕西地区广泛栽培、前期试验已初步证明具有耐寒品质的69杨、陕林3号、南抗杨为CK品种,共8个均来自于渭河地区品种为试验材料 (表1)。

表1 试验材料遗传背景Table 1 Experiment materials and their genetic background
1.2 试验方法
2016年12月中旬,在渭河试验站中选择各品种地径接近2 cm、无任何疾病、生长情况一致的1年生休眠苗进行研究。8个黑杨无性系各 15株,去除顶梢干枯的部分,自上向下截取至1.5 m处、修剪为20 cm枝段并平均分成 6部分,一份60枝,各温度设置10枝重复。枝段先用自来水冲洗,再用离子水多次洗涤,滤纸吸干。清洗时注意刮掉部分木栓,但不致使树皮遭到破坏。之后将枝段置于超低温冰箱中进行低温处理,低温处理时间为24 h,处理温度分别设定为-15、-20、-25、-30、-35 ℃,降温速率为 4 ℃/h,以常温 (试验站采样后直接测定) 作为CK温度。由于冰箱通常的降温速率为4 ℃/h,且降温需要有个过程,因此选择4 ℃/h为降温速率。此外,已有成果表明这种降温速率增加了品种适应过程,可以更好地反映各个梯度下酶的活性。达到所需温度后继续维持24 h,每间隔5 ℃取出一批枝条用于相对电导率、MDA质量摩尔浓度、SOD活性、POD活性和可溶性蛋白质量分数的测定。
1.3 测定方法
1.3.1半致死温度测定
把经过低温处理的各品种枝条切为0.5 cm的小段,用天平称取1.0 g置于100 mL的容器里,加入去离子水适量,充分摇匀之后于温度为25 ℃的摇床中震荡1 d,震荡之后通过电导设备获取电导情况E1,随后把试验品置于沸水里水浴35 min,水浴之后进行冷却至室温,测定电导率E2[11],按公式 (1) 计算相对电导率 (y),重复3次。采用不同温度设置下的相对电导率和Logistic方程相结合的方法确定[12-13],如公式 (2)。其中,Logistic方程运用四点法求出拟合曲线,其拟合方程见公式 (3)。按公式 (4) 和 (5) 求解k以及方程参数a、b。
y=∣E2-E1∣
(1)
LT50=ln(a)/b
(2)
y=k/(1+ae-bx)
(3)
k=[y1y4(y2+y3)-y2y3(y1+y4)]/
(y1y4-y2y3)
(4)
x2+x3=x1+x4
(5)
式中:y为相对电导率,x为处理的温度 (℃),k为细胞的饱和伤害情况。
1.3.2酶活性测定
粗酶通过含0.5% Triton100的磷酸盐缓冲液 (PBS) 获取,SOD活性参照李合生[14]提出的方法测定,POD活性参照邹琦[15]提出的方法测定。
1.3.3可溶性蛋白质量分数、MDA质量摩尔浓度测定
参照邹琦[15]提出的方法进行,各无性系重复3次。
1.4 评价方法
通过隶属函数法,计算各生理指标综合隶属函数值 (∑Tij),对各生理指标抗寒性开展定量评价[16]。按公式 (6) 计算各指标隶属函数,如果某个指标和系统的分析情况属于负相关,则通过反隶属函数实施转换,如公式 (7)。综合隶属函数值 (∑Tij) 计算方法参考许桂芳等[17]研究结果。
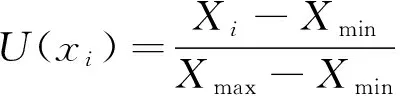
(6)
(7)
式中:U(xi)为隶属函数的大小;Xi为无性系特定项指标测定值;Xmin、Xmax为全部参试无性系里某个指标的最高值以及最低值。
1.5 数据分析
试验数据采用SPSS 19.0统计软件进行方差分析和多重比较,采用DPS 7.05完成数据的差异显著性检验。
2 结果与分析
2.1 低温胁迫对无性系各生理指标的影响
2.1.1半致死温度
由表2可知,各无性系在低温中的Logistic方程拟合度极显著 (P< 0.01),拟合度最高的为无性系 ‘08H4-5’,拟合度为0.987 8;拟合度最低的为无性系 ‘08H11-11’,拟合度为0.920 1,说明各黑杨无性系LT50和相对电导率差异显著 (P< 0.05)。根据各无性系枝条LT50,无性系可分为3类:第1类LT50为-40 ℃左右,仅有南抗杨,其低温逆境生理抗性表现最强;第2类 LT50为-30 ℃~-35 ℃,包括 ‘08H1-6’、 ‘08H11-11’、‘03S4-1’,其低温逆境的生理抗性表现强;第3类LT50为-25 ℃~-30 ℃,其低温逆境生理抗性表现较弱。LT50由低到高依次排序为:南抗杨 < ‘08H1-6’ < ‘03S4-1’ < ‘08H11-11’ < 69杨 < ‘08H2-16’ < ‘08H4-5’ < 陕林3号。其中,南抗杨的LT50最小,这表明其在所有无性系中抗寒性最强。有研究表明,主要原因是不同无性系在不同处理温度下电解质渗出率表现差异显著,随着温度降低,各无性系电导率出现不同程度的升高,抗寒性强的品种在较低温度下电解质渗出率出现较大增幅[11]。

表2 各无性系低温下的Logistic方程和LT50Table 2 The Logistic equation and LT50 under low temperature of each clones
注:不同小写字母表示差异显著;**表示拟合度达到极显著水平。
2.1.2低温处理对各无性系酶活性的影响
由表3可知,随着温度的降低,各个无性系SOD活性先增强后减弱,且不同无性系达到活性峰值及活性变化的速率是不同。具体来讲,在CK温度下, ‘08H4-5’ 的SOD活性与其他7个无性系之间存在显著差异 (P< 0.05),同时,南抗杨与 ‘08H2-16’、陕林3号、 ‘03S4-1’、69杨之间也存在显著差异 (P< 0.05)。当处理温度为-20 ℃时,‘03S4-1’ 的SOD活性达到峰值,其余7个无性系SOD活性达到最大值时的温度均为-25 ℃。在-25 ℃下, ‘08H4-5’ 与 ‘08H2-16’、 ‘03S4-1’ 以及南抗杨存在显著差异 (P< 0.05)。在-35 ℃下,SOD活性最弱的为 ‘08H4-5’,活性最强的为南抗杨。尤为明显的是, ‘08H4-5’ 与南抗杨在每个温度条件下的SOD活性均存在显著差异 (P< 0.05),可见两者抗寒能力差异显著 (P< 0.05)。
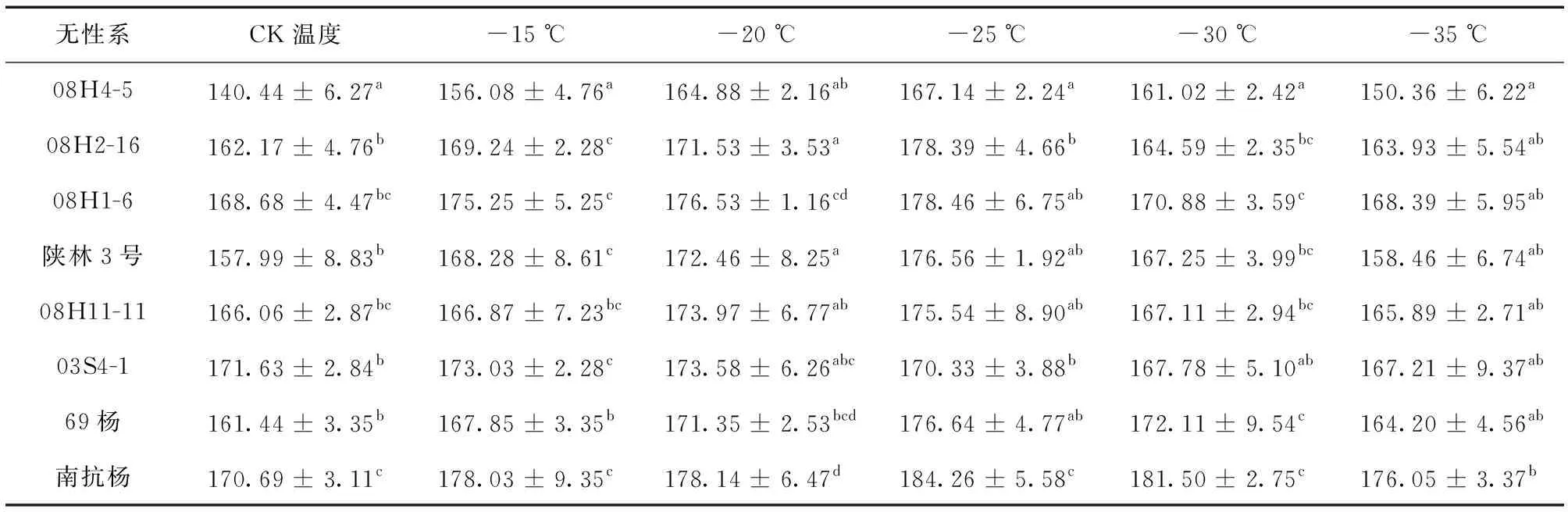
表3 低温作用下各无性系SOD活性Table 3 SOD activity of each clone under the effect of low temperature U/g
注:不同小写字母表示差异显著。
由表4可知,在低温处理下,POD活性变化与SOD 活性变化趋势基本一致,随着温度的降低,POD活性变化先增强后减弱。在CK温度下,各无性系POD活性无显著差异。在-25 ℃时,除69杨以外的7个无性系POD活性均达到最大值,无性系间差异不显著;在-35 ℃时,POD活性最弱的是陕林3号,活性最强的是 ‘03S4-1’。在低温胁迫下,植物体内大量积累的活性氧使膜脂发生过氧化作用,造成膜系统结构的破坏和功能的紊乱。生物为了应对活性氧对机体的伤害形成了复杂的酶类抗氧化系统,如SOD、POD、CAT等,这些保护酶与植物的抗寒性呈线性关系。随着温度的变化,各个无性系均因温度的降低而产生应激反应,产生不等量的抗氧化酶,随着温度的进一步降低,这些抗氧化酶因低温而失活等原因不再应对损伤,由于各无性系抗寒能力的不同,这些抗氧化酶到达活性的临界温度也不同。

表4 低温作用下各无性系POD活性Table 4 POD activity of each clone under the effect of low temperature U/(g·min)
注:不同小写字母表示差异显著。
2.1.3低温处理对各无性系可溶性蛋白质量分数的影响
由表5可知,处于低温环境里,同一无性系可溶性蛋白质量分数出现一定的变化,不同无性系彼此之间存在差异性。所有的无性系随着处理温度的降低,植株体内检测到的可溶性蛋白质量分数逐渐增加,并且大部分在-25 ℃时达到最高点,这表明此温度下给试验材料造成的负面影响较大,试验材料出现了应激反应。具体来讲, ‘08H1-6’、陕林3号在-20 ℃可溶性蛋白质量分数达到最大值,分别为16.7 mg/g和13.8 mg/g,增加了4.32倍和3.17倍,与其它6个无性系差异显著 (P< 0.05)。其它6个无性系均在-25 ℃可溶性蛋白质量分数达到最大值,其中 ‘03S4-1’ 无性系增幅较大,为原值的9.17倍; ‘08H4-5’ 无性系在整个过程中增幅较小,-25 ℃含量为12.69 mg/g,增幅为原值的3.73倍。有研究表明,渗透调节物质如可溶性糖、可溶性蛋白等的积累能够提高植物的抗寒能力[8]。本研究发现,可溶性蛋白的渗透调节能力是受温度限制的,不同无性系达到可溶性蛋白最大质量分数时所处的温度不同。其后由于可溶性蛋白质量分数急剧减少,各无性系的抗低温胁迫能力也会相应降低。
2.1.4低温处理对丙二醛质量摩尔浓度的影响
由表6可知,随着温度不断降低,8个无性系MDA质量摩尔浓度先升高后降低,但变化速率有差异。其中 ‘08H4-5’ 与其他无性系间存在显著差异 (P< 0.05),增加迅速且含量最多,与CK温度相比,增幅为43%;增加最为缓慢的为 ‘08H2-16’,增加了9.7%。在CK温度下, ‘08H4-5’、‘08H2-16’、‘08H1-6’、陕林3号和69杨的MDA质量摩尔浓度与 ‘08H11-11’、‘03S4-1’ 和南抗杨存在显著差异 (P< 0.05)。此外,在-20 ℃温度下,陕林3号MDA质量摩尔浓度最高,且与其它无性系差异达显著水平 (P< 0.05)。除陕林3号以外,7个无性系在-25 ℃下的MDA质量摩尔浓度达到最大值。在-35 ℃下,MDA质量摩尔浓度最高的为 ‘08H4-5’,最低的为南抗杨。

表5 低温作用下各无性系可溶性蛋白质量分数Table 5 Soluble protein mass fraction of each clone under the effect of low temperature mg/g
注:不同小写字母表示差异显著。

表6 低温作用下各无性系MDA质量摩尔浓度Table 6 MDA molality of each clone under the effect of low temperature mmol/g
注:不同小写字母表示差异显著。
2.2 各无性系抗寒能力综合评价结果
由表7可知,8个美洲黑杨无性系Tij大小依次为南抗杨 > ‘08H1-6’ > ‘03S4-1’ > ‘08H11-11’ > 陕林3号 > ‘08H2-16’ > 69杨 > ‘08H4-5’。Tij越大说明其抗寒性越强,在8个无性系中,Tij最大的为南抗杨,说明其在所有无性系中抗寒性最强;Tij最低的为‘08H4-5’,说明其在所有无性系中抗寒性最差。
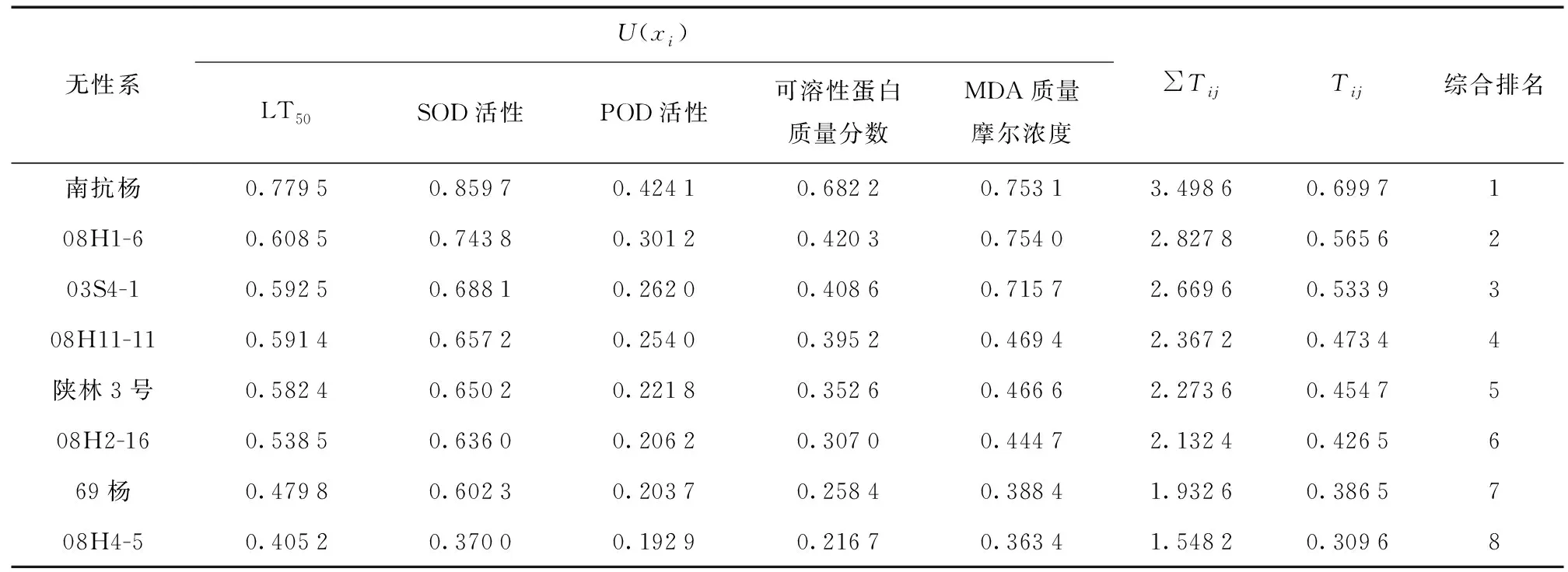
表7 无性系抗寒能力综合评价Table 7 Comprehenvis evaluation on cold resistance of each clones
3 结论与讨论
20世纪很多研究人员发现,低温导致植物细胞中结冰、细胞膜损坏,但植物的抗寒性却使它们对低温表现出不同的适应性,也会产生不同的抗寒生理机制[18]。胡建芳等[4]在研究国内外抗寒性进展和方法的基础上,发现通过对相对电导率、脯氨酸、可溶性蛋白、MDA及保护酶系统等指标的具体分析,能够对植物的抗寒性做出科学判断。电导率测定是使用最多的方法[19],低温下细胞的膜透性增大,造成电解质外渗,温度愈低,电解质渗透率越大,相对电导率越大[20]。此外,抗氧化酶系统中SOD、POD、PPO等酶活性变化情况也是最近被大量使用当作分析抗寒性的关键数据,并且这些酶的变化属于低温状况下植物进行自我保护的机制[21]。同时,MDA也被作为分析膜透性的指标用于植物抗寒性的研究[22]。
本研究根据实际情况选择LT50、SOD活性、POD活性、可溶性蛋白质量分数、MDA质量摩尔浓度5项指标对8个供试杨树无性系的抗寒性进行评价。结果表明,8个供试杨树无性系的耐寒情况从高到低排序为南抗杨 > ‘08H1-6’ > ‘ 03S4-1’ > ‘08H11-11’ > 陕林3号 > ‘08H2-16’ > 69杨 > ‘08H4-5’。这与通过LT50判断的抗寒能力结果一致,说明通过电导率测定计算LT50可以判断植物的抗寒性强弱,与相关研究一致[23]。同时,各无性系的LT50可以为以后的适地引种提供借鉴。南抗杨抗寒性显著高于其他无性系 (P< 0.05); ‘08H1-6’、‘08H11-11’、‘03S4-1’ 的抗寒性介于陕林3号与南抗杨之间,可以作为优良抗寒种质资源加以推广和应用; ‘08H2-16’ 其抗寒性介于69杨和陕林3号之间,也可作为杨树栽培过程中较为理想的材料。
低温导致植物出现抗寒性反应十分复杂,被很多因素所影响[24-25]。自然环境复杂多变,人工低温胁迫不可能完全反映出自然条件的冻害情况。本研究在模拟低温环境下进行,能够对不同植物的抗寒性做出一定的判断,但可能与各无性系实际抗寒性存在偏差[26-29]。因此,对于导致抗寒生理生化改变的分子机制、通过转基因技术彻底提高抗寒性的相关研究,仍是今后重要的研究方向。
[1] 刘文国, 张旭东, 黄玲玲, 等. 我国杨树生理生态研究进展[J]. 世界林业研究, 2010, 23(1): 50-55.
[2] Hasegawa M, Bressan R, Pardo J M. The dawn of plant salt tolerance genetics[J]. Trends in Plant Science, 2000, 5(8): 317-319.
[3] 林善枝, 张志毅. 杨树抗冻性的研究现状[J]. 植物学通报, 2001, 18(3): 318-324.
[4] 胡建芳, 陈建中, 姚延梼. 杨树抗寒性研究进展[J]. 世界林业研究, 2011, 24(3): 32-36.
[5] 李晓宇, 杨成超, 彭建东, 等. 杨树苗期抗寒性综合评价体系的构建[J]. 林业科学, 2014, 50(7): 44-51.
[6] 朱之悌, 林惠斌, 康向阳. 毛白杨异源三倍体B301等无性系选育的研究[J]. 林业科学, 1995, 31(6): 499-505, 579.
[7] 徐纬英. 三个杨树新品种培育成功[J]. 林业实用技术, 1958(9): 5.
[8] 徐纬英, 佟永昌. 新杂交种: 群众杨[J]. 林业科学, 1984, 20(2): 122-131.
[9] Ferrari C D S, Valente L L, Brod F C A, et al. Evaluation of polymerase chain reaction and DNA isolation protocols for detection of genetically modified soybean[J]. International Journal of Food Science & Technology, 2007, 42(10): 1249-1255.
[10] Jouanin L, Bonadé-Bottino M, Girard C, et al. Transgenic plants for insect resistance[J]. Plant Science, 1998, 131(1): 1-11.
[11] 周永学, 龚月桦, 樊军锋. 4种松树抗寒性的比较[J]. 西北林学院学报, 2011, 26(5): 69-71.
[12] 朱根海, 刘祖祺, 朱培仁. 应用Logistic方程确定植物组织低温半致死温度的研究[J]. 南京农业大学学报, 1986(3): 11-16.
[13] 殷祚云. Logistic曲线拟合方法研究[J]. 数理统计与管理, 2002, 21(1): 41-46.
[14] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000.
[15] 邹琦. 植物生理学实验指导[M]. 北京: 中国农业出版社, 2000.
[16] Wang W J, Chen Y Z, Liu M Q, et al. Effects of cold-hardening on compatible solutes and antioxidant enzyme activities related to freezing tolerance inAmmopiptanthusmongolicusseedlings[J]. Forestry Studies in China, 2008, 10(2): 101-106.
[17] 许桂芳, 张朝阳, 向佐湘. 利用隶属函数法对4种珍珠菜属植物的抗寒性综合评价[J]. 西北林学院学报, 2009, 24(3): 24-26.
[18] 史清华, 高建社, 王军, 等. 5个杨树无性系抗寒性的测定与评价[J]. 西北植物学报, 2003, 23(11): 1936-1940.
[19] 林艳, 郭伟珍, 徐振华, 等. 大叶女贞抗寒性及冬季叶片相对电导率变化研究[J]. 天津农业科学, 2012, 18(5): 145-149.
[20] 李小琴, 彭明俊, 段安安, 等. 低温胁迫对8个核桃无性系抗寒生理指标的影响[J]. 西北林学院学, 2012, 27(6): 12-15.
[21] 张钢. 国外木本植物抗寒性测定方法综述[J]. 世界林业研究, 2005, 18(5): 16-22.
[22] 姚延梼. 华北落叶松营养元素及酶活性与抗逆性研究[D]. 北京: 北京林业大学, 2006.
[23] 张纪林, 谢晓金, 教忠意, 等. 几种冬青属植物抗冻能力比较[J]. 园艺学报, 2005, 32(3): 477-481.
[24] 曹佳乐, 延娜, 樊军锋, 等. 4个白杨派新无性系抗寒性鉴定和综合评价[J]. 西北林学院学报, 2016, 31(2): 130-134, 139.
[25] 李轶冰, 杨顺强, 任广鑫, 等. 低温处理下不同禾本科牧草的生理变化及其抗寒性比较[J]. 生态学报, 2009, 29(3): 1341-1347.
[26] 江锡兵. 美洲黑杨与大青杨杂种无性系遗传变异研究[D]. 北京: 北京林业大学, 2011.
[27] 江锡兵, 宋跃朋, 马开峰, 等. 低温胁迫下美洲黑杨与大青杨杂种无性系若干生理指标变化研究[J]. 北京林业大学学报, 2012, 34(1): 58-63.
[28] 江锡兵, 郭斌, 宋跃朋, 等. 美洲黑杨与大青杨杂种无性系耐寒性的初步研究[J]. 植物生理学报, 2011, 47(8): 771-776.
[29] Azzarello E, Mugnai S, Pandolfi C, et al. Comparing image (fractal analysis) and electrochemical (impedance spectroscopy and electrolyte leakage) techniques for the assessment of the freezing tolerance in olive[J]. Trees, 2008, 23(1): 159-167.
