牛粪堆肥过程中土霉素降解及其与微生物群落结构的关系
2018-06-19,,,,,
,,,, ,
(黑龙江省寒区环境微生物与农业废弃物资源化利用重点实验室 黑龙江八一农垦大学 生命科学技术学院,黑龙江 大庆 163319)
0 引 言
我国是养殖业大国,集约化养殖发展迅速。据统计,截止到2015年年底我国大牲畜饲养量约为1.2亿头,所产生的畜禽粪便高达2.5亿吨[1-2]。大量产生的畜禽粪便如果处理不当会严重污染生态环境[3]。
近年来在畜禽养殖业中,为了预防和治疗动物疾病而大量使用抗生素[4]。2013年我国年抗生素使用量高达16万吨,其中兽用抗生素占比达52%[5]。与发达国家相比,我国的抗生素使用量是美国等发达国家的5倍之多[6]。由于抗生素大多属于水溶性,在家畜肠道内的吸附利用率低,导致30%~90%的抗生素最终以母体的形式被排出到环境中[7-9]。这些抗生素在环境中长期积累导致耐药基因的产生,造成生态污染[10]。而且,畜禽粪便的处理不当以及抗生素的大量残留对生态环境造成复合污染。在众多抗生素中,土霉素是目前作为兽用抗生素最为广泛的四环素类抗生素,我国每年由养殖业产生的粪便中,抗生素残留量高达2 170 t[11],其所产生的污染亟待解决。堆肥化处理不仅可以有效解决畜禽粪便污染问题,同样也可有效地降低抗生素含量[12-16]。目前对于抗生素在堆肥过程中的降解研究主要集中在抗生素的降解动力学方面[13-14,17-19],以及在抗生素污染环境中分离抗生素降解菌等方面[20-22],而在堆肥过程中抗生素降解与微生物多样性方面的研究较少。马骏[23]通过Biolog微平板法研究发现四环素会在堆肥高温期抑制微生物活性,而在腐熟期活性恢复。Su[24]研究利用定量PCR和16S rRNA发现在污泥堆肥中放线菌门在堆肥后期属于绝对优势菌种。此外温度普遍被认为是影响抗生素降解的主要因素[25-26],而堆肥体系中复杂的微生物生境常被忽视。
本研究系统地分析了堆肥过程中土霉素的降解对微生物群落的影响,明确堆肥过程中土霉素降解与微生物群落变化之间的关系,找到优势微生物菌群,并通过相关性分析温度的影响,在减少土霉素残留造成生态污染的同时,为进一步解释土霉素生物降解机理提供理论依据。
1 材料与方法
1.1 试验材料
实验原料所用新鲜牛粪购置于大庆市卧里屯奶牛场,柳树叶采自黑龙江八一农垦大学校园落叶,通过液相色谱检测均不含土霉素。土霉素(25万单位),购于大庆福斯特药店,理化参数如表1所示。

表1 牛粪堆肥原料的理化性质Table 1 Physical and chemical properties of cattle manure composting materials
1.2 堆肥体系的建立
将牛粪与柳树叶按照体积比1∶1混合均匀,调节C/N为25~30之间,含水70%左右。根据土霉素初始含量设置两组实验,即对照组(CK):土霉素初始含量为0,处理组(TG):土霉素初始含量为60 mg·kg-1,每组3个重复。制成下体直径1.2 m,高0.8 m的堆体,堆制周期共进行63 d。
1.3 堆肥样品采集及理化参数测定
堆置周期内,每天对堆体温度进行测定,分别测定堆肥深层、中层和表层不同位置温度,取平均温度作为当天堆体温度,同时对环境温度进行测定。根据堆体温度变化,分别在第0、3 d、7 d、14 d、28 d及63 d从堆体中不同深度采用五点取样法进行取样,混合均匀后,将堆肥样品加等体积PBS缓冲液(pH=7.02)放置于-20 ℃保存,用于微生物等实验项目分析。
1.4 土霉素含量测定
土霉素含量测定采用高效液相色谱-质谱连用法进行检测。液相色谱色谱柱采用Innoval ODS-2(150×4.6 mm,5 μm)不锈钢柱,流动相为乙腈∶水(含0.1%甲酸)(3∶7,V/V),进样量20 μL,流速1 mL·min-1。质谱仪喷雾电压为3.5 Kv,辅助气压10 arb,毛细管温度为300 ℃,碎裂能量CID 35%,分别采用监测离子m/z 461-m/z 426、m/z 461-m/z 443进行定性以及定量分析。
1.5 样品高通量测序
分别取堆肥原料、堆肥高温期(14 d)以及堆肥腐熟期(63 d)样品作为堆肥典型时期样品用于分析微生物多样性变化。每个样品称取0.2~0.5 g,采用改良的氯苯法对样品总DNA进行提取[26]。所提取的DNA样品经1 %琼脂糖凝胶电泳用于检测DNA完整性,使用Nanodrop 2000c(Thermo Fisher Scientific,American)进行浓度检测,所测OD260/280在1.8~2.2之间,浓度大于10 ng·ul-1,总量大于500 ng,凝胶电泳图谱显示主带清晰。将提取合格的DNA样品送至北京百迈客生物科技有限公司进行建库测序。
1.6 微生物多样性分析
测序数据的获取及分析:利用Qiime(version 1.9.0)对原始序列进行过滤处理,所有优质序列,随后利用Usearch(version 8.0)去除所得嵌合体已获得有效序列。
OTU聚类:利用Qiime中cd-hit方法对所有样品的有效序列进行聚类,以97%相似度为阈值将序列聚类成OTU,同时选取OTU的代表序列,并去除其中的singleton(所有样品中只有一条序列的OTU)。
物种注释:利用RDP Classifier(version 2.0)对OTU代表序列进行物种注释分析。
Alpha多样性分析:利用Qiime对ACE指数、Chao1指数、Simposn指数和Shannon指数进行计算。
2 结果与分析
2.1 堆肥过程中温度变化
整个堆肥过程中TG和CK温度变化趋势相同,呈现先迅速升高随后下降的趋势,见图1。在堆肥前期,两组实验温度迅速升高至50 ℃以上,并分别持续了16 d和18 d。两组实验最高温均出现在第7 d,其中TG最高温度为62.0 ℃,CK最高温度为61.5 ℃,随后温度下降并趋于稳定。
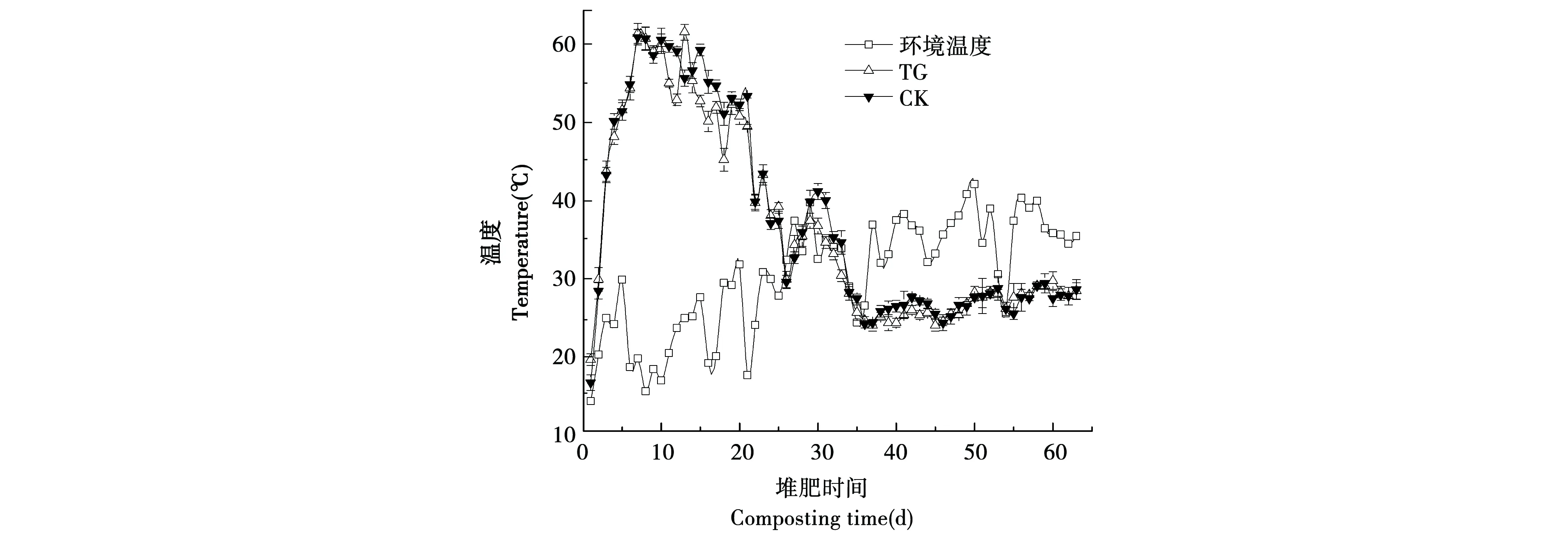
图1 堆肥过程中温度变化Fig.1 Temperature changes during composting
2.2 堆肥过程中土霉素含量变化
土霉素降解率随堆肥的进行呈上升趋势,在高温期时土霉素降解速率最快,堆肥后期趋于平缓,见图2。堆肥前14 d共降解了68.3%的土霉素,截止到堆肥结束时,土霉素检出量为2 mg·kg-1,土霉素去除率为96.7%。
2.3 堆肥过程中微生物群落多样性分析
实验根据不同温度共采集5个样品的DNA,经高通量测序共获得 732 409对原始序列,经双端拼接、过滤后共产生573 931条优质序列,平均每个样品产生114 786条。全部测序按相似度97%聚类分析中共得到896个OTUs,分属于17个细菌门,43个纲,84个目,168科,341个属,单样品信息见表2。
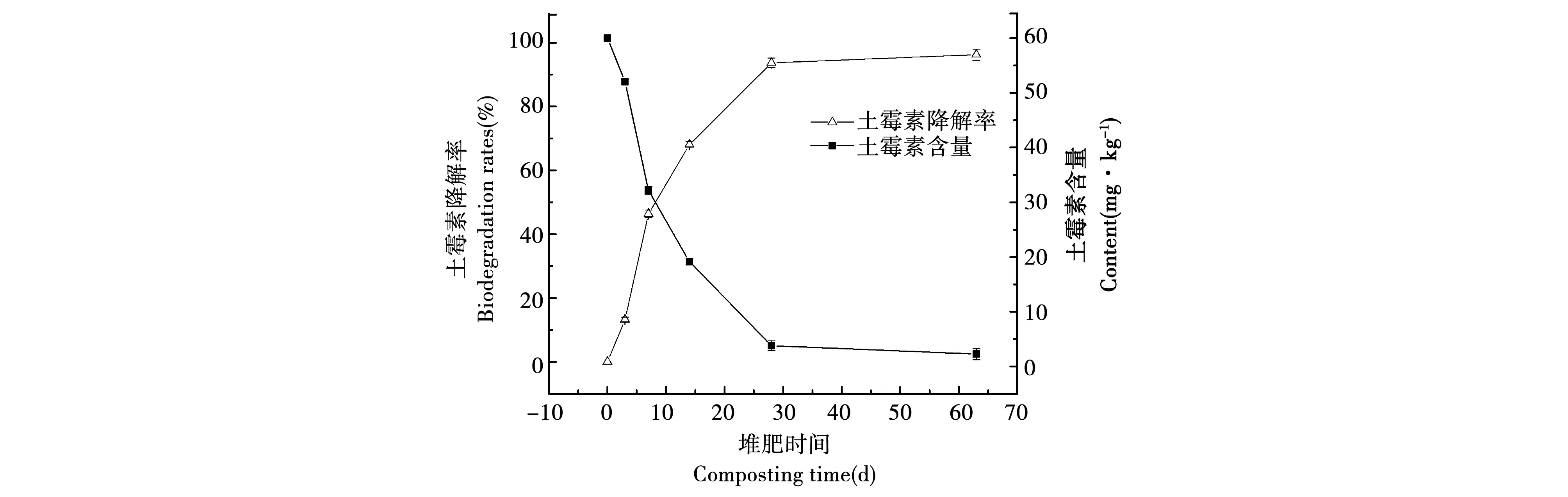
图2 堆肥过程中TG处理组土霉素变化情况Fig.2 Oxytetracycline changes with TG treatment during composting

表2 样品测序数据处理结果统计Table 2 Statistics of sample sequencing data
注:Material为原料样本;CK 14和CK 63分别为空白组高温期及腐熟期样本;TG 14和TG 63为土霉素处理高温期及腐熟期样本。
Note: Material was the sample of raw materials;CK 14 and CK 63 as the sample of blank group at high temperature stage and maturity stage,respectively;TG 14 and TG 63 for oxytetracycline treatment group at high temperature stage and maturity stage,respectively.
基于α多样性分析各样品间物种丰富度和多样性指数,其中ACE和Chao用来估计群落中含有OTU数目的指数,ACE和Chao指数越大,说明OTUs越高,见表2。在本研究中,各样品按ACE和Chao排序依次为CK 14>TG 14>CK 63>TG 63>Material,说明CK 14 OTUs最高,这也验证了OTUs所得到的结果。在微生物多样性方面,从Shannon中可以发现,在堆肥高温期(CK 14及TG 14)微生物多样性高于堆肥腐熟期(CK 63及TG 63)。
2.4 堆肥过程中细菌菌群分布及比较
基于高通量测序技术,通过物种注释,在门的分类水平上5个样本共检测到17个细菌门,其中变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)和绿弯菌门(Chloroflexi)在所有样本中均为优势细菌门(图3a),这些细菌门相对丰度之和在所有样本中均占比90%以上,在原料中占比高达99%。
整个堆肥过程,在土霉素处理中变形菌门、厚壁菌门以及拟杆菌门较空白组相比,变化趋势明显不同。变形菌门在原料中占比42.9%(图3a),属于绝对优势菌群,随堆肥进行,在没有土霉素的空白组中呈现缓慢上升趋势,截止到堆肥63 d其相对丰度为46.0%,而在土霉素污染胁迫下(TG组),变形菌门趋势与之相反,由初始的42.9%下降到高温期的37.5%,尽管在堆肥腐熟期土霉素污染减弱(2 mg·kg-1),其相对丰度仍继续下降至23.0%,丧失了其优势菌群的地位。反观厚壁菌门可以清楚的发现,在没有土霉素堆肥过程中,厚壁菌门的生长呈现下降趋势,由初始的21.9%下降到堆肥腐熟时12.9%,而在土霉素污染胁迫下,厚壁菌门的相对丰度呈现上升趋势,截止到堆肥腐熟期,其相对丰度为40.5%,成为主要优势菌群。拟杆菌门在空白组中相对丰度由初始的9.44%上升到高温期的17.6%,随后稳定在17%,而在高土霉素污染下(高温期)其相对丰度下降,由初始的9.44%下降到7.62%,当土霉素污染减弱时(腐熟期),其相对丰度又出现上升,其丰度为15.7%,见图3a。
尽管变形菌门在高土霉素浓度下表现出低耐受性,但在变形菌门中假黄色单胞菌属(Pseudoxanthomonas)、水微菌属(Aquamicrobium)、Chelatococcus及Luteimonas等细菌属在高土霉素浓度下相对丰度上升(图3b)。其中水微菌属、Chelatococcus以及假黄色单胞菌属在高浓度土霉素条件下上升明显,分别由初始的1.11%、0、0上升到6.02%、6.41%、2.38%,但随土霉素的降解,在堆肥腐熟期时,这三种菌相对丰度明显下降,且低于空白组见图3b。
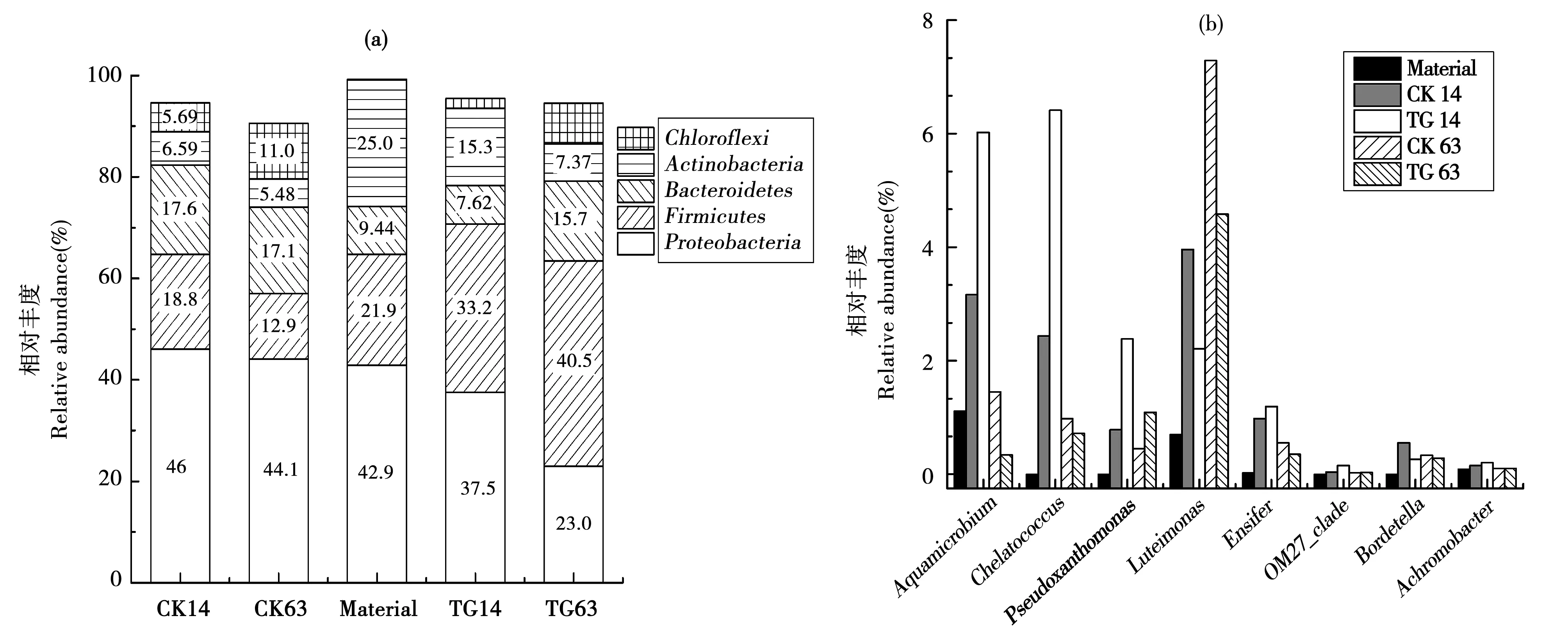
图3(a) 门水平上主要微生物类群(相对丰度>5%);(b) 变形菌门属水平上丰度上调主要微生物类群Fig.3(a) Major microbial groups at phylum level(relative abundance of >5%);(b) Major up-regulated microbial groups at proteobacteria level
在属的水平上5个样本共有341个属被鉴定,其中在可注释到的微生物中,丰度大于1%的共含有43个不同的细菌属,见图4a。随堆肥进行,在高温期14 d时,类芽孢杆菌属(Paenibacillus)、Thermobacillus、芽孢杆菌(Bacillus)在内的部分细菌属表现出不同程度的上调(图4b,表3),表现出较强的耐受性,由初始的0.04%、0、0上升至4.25%、1.68%和1.16%,而在没有土霉素处理的空白组中其相对丰度仍保持在较低水平(相对丰度<0.1%)。在原料中占比较大的动性微菌属(Planomicrobium)和Arthrobacter在高温期两组实验中呈现下降趋势,见图4b,表3。
2.5 基于土霉素降解相关性分析
为了探究温度、不同微生物类群与土霉素降解之间相关性,以土霉素处理组为研究样本,采用Correlation coefficient分析温度(非生物因素)、微生物类群和土霉素降解之间相关系数(表4),从表中我们可以发现芽孢杆菌属、短芽孢杆菌属(Brevibacillus)和Chelatococcus与土霉素降解之间表现出较强的相关性,随后是温度(非生物因素)、水微菌属、假黄色单胞菌属及Thermobacillus等,而动性微菌属、Arthrobacter和Luteimonas表现出负相关关系。
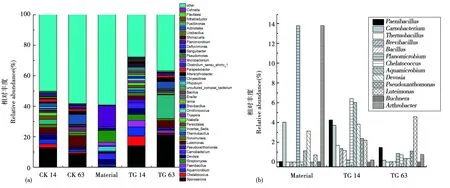
图4(a) 属水平上主要微生物类群(相对丰度>1%);(b) 土霉素处理组中主要变化微生物类群Fig.4(a) Major microbial groups at genus level(relative abundance of >5%);(b)Major microbial groups in oxytetracycline treated group
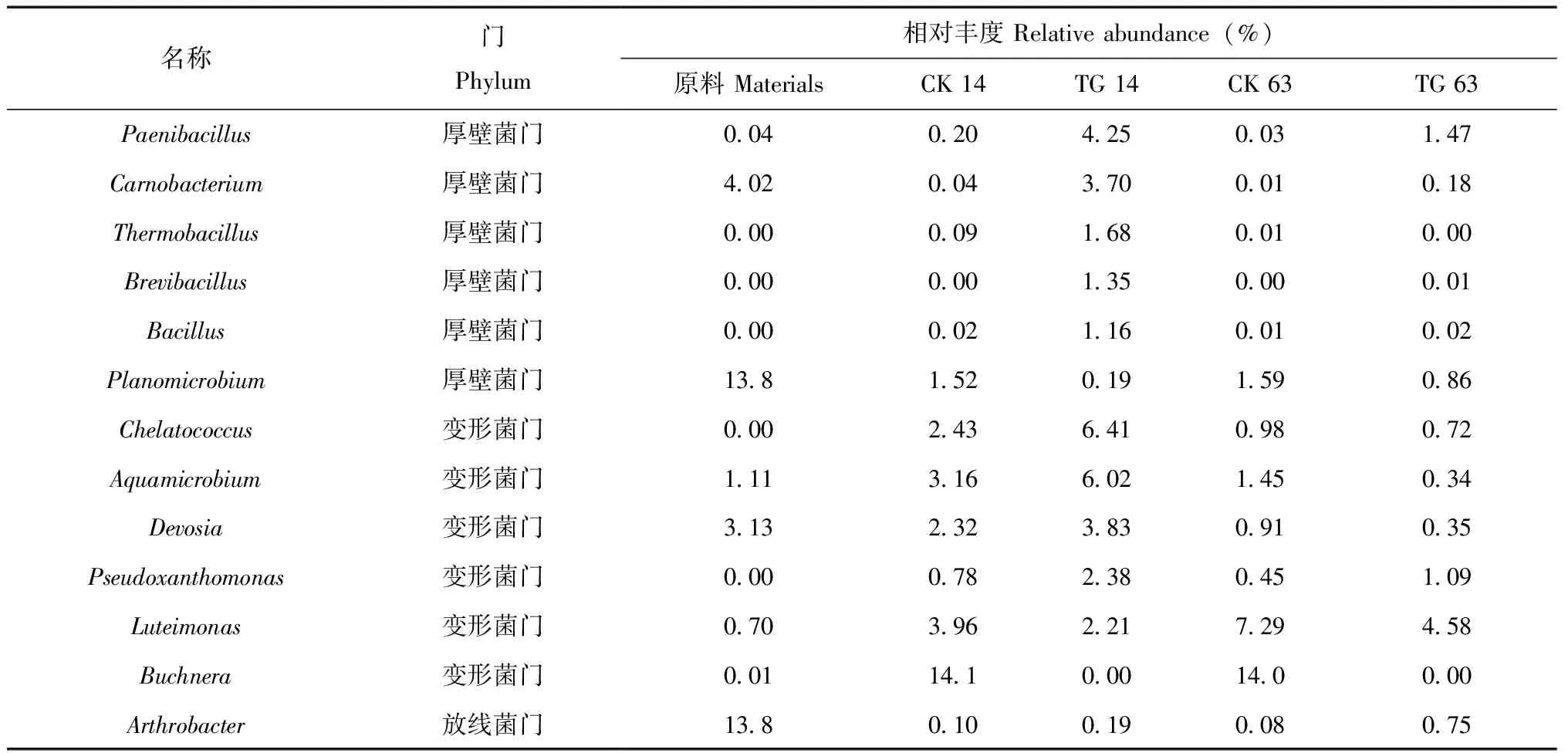
表3 属水平上主要差别细菌属Table 3 The major microbial difference at genus level

表4 温度以及不同微生物类群与土霉素降解之间相关性Table 4 Correlations between temperature,different microbial groups and terramycin degradation
3 讨 论
Wang等[19]在研究粪便及土壤中土霉素降解中,通过绘制一级动力学降解曲线证明,随温度的升高,土霉素降解速率加快,整个动力学实验最高温度为45 ℃。本研究发现,牛粪堆肥过程中,最高温度达到50℃以上,而且堆肥高温期土霉素降解速率最大,因此,堆肥所产生的高温可能会加速土霉素的降解。Arikan等[14]在研究堆肥过程中土霉素降解时同样发现热降解是土霉素降解的关键因素。在本研究中,通过分析温度、不同微生物类群与土霉素降解之间相关性,我们发现,芽孢杆菌属、短芽孢杆菌属及Chelatococcus等细菌属对土霉素降解过程具有较大的响应,说明土霉素在热降解的同时,微生物驱动的生物降解也可能表现出较强的作用,这可能是堆肥过程中土霉素降解的另一个关键因素。
通过系统分析堆肥过程中微生物变化,发现土霉素污染下抑制了变形菌门的生长,厚壁菌门则表现出较强耐受性,更具有竞争优势。孔维栋[27]通过DGGE研究土培条件下土霉素对于土壤微生物的影响中发现,在土霉素组中微生物类群主要为变形菌门、放线菌门以及厚壁菌门等。整个堆肥过程CK组中变形菌门丰度相对变化不大,而土霉素处理组中厚壁菌门的竞争优势随堆肥进行而增强,到堆肥后期变为第一优势菌群,说明厚壁菌门可能对土霉素更具有耐受性。
本研究发现,芽孢杆菌属、类芽孢杆菌属、肉食杆菌属(Carnobacterium)及假黄色单胞菌属等在高土霉素胁迫下表现出较高丰度,而在空白组中这些微生物丰度较低,这可能是由于这些微生物能够利用土霉素等进行自身的增殖。徐莲[20]和王志强[21]分别富集培养到可降解土霉素的菌株,经鉴定为芽孢杆菌属。在以不同土霉素底物浓度探究芽孢杆菌属对土霉素降解能力中发现,芽孢杆菌属最高可降解200 mg·L-1土霉素[21]。在堆肥过程实际应用中,同样有研究证明,添加芽孢杆菌生物复合剂可以促进堆肥过程中四环素类抗生素的降解[28],这与本实验结果相一致。而且,我们发现芽孢杆菌对土霉素的降解作用要高于温度,同样证明了土霉素的生物降解在堆肥过程中起到了重要的作用。Selvam等[16]在利用DGGE研究堆肥对不同兽用抗生素的降解中同样在高温期检测到芽孢杆菌属和假黄色单胞菌属等,其中假黄色单胞菌属在高温期DGGE条带颜色变浅,而本研究中其相对丰度升高。这可能是由于整个堆肥过程中土霉素抑制了某些优势菌的生长,而假黄色单胞菌属在总OTUs下降的环境下,其相对丰度上升。于浩[29]同样通过微生物富集培养的方法,在畜禽粪便污染的土壤中分离得到土霉素降解菌类芽孢杆菌属,在本研究中高温期同样检测到高相对丰度的类芽孢杆菌属(4.25%),而在添加土霉素的正常堆肥中,其相对丰度仅为0.03%。Thermobacillus属嗜热菌,在本研究中主要存在于高温期。王桂珍[30]研究发现,芽孢杆菌属和Thermobacillus对降解土霉素具有促进作用。成洁等[22]同样发现芽孢杆菌属和无色菌属(Achromobacter)可以降解土霉素,在本研究中无色菌属在高土霉素条件下,其相对丰度较低,在空白与处理实验中均低于0.2%,这可能是因为此时堆肥处于高温期,说明高温不利于无色菌属的生长。在土霉素污染胁迫下变形菌门整体丰度下降而假黄色单胞菌属、水微菌属和Chelatococcus却呈现丰度的短暂上升,可能是潜在的土霉素降解菌。Xu等[31]和Sugawara等[32]均发现水微菌属可以有效地降解多氯联苯等污染物,同样有研究发现假黄色单胞菌属中Pseudoxanthomonasspadix BD-a59[33]、Pseudoxanthomonassp.DMVP2[34]、Pseudoxanthomonassp.R-28[35]分别可以降解苯系物、菲等污染物以及纤维素等农业废弃物,而Chelatococcus尚没有报道与抗生素或污染物降解有关。尽管如此假黄色单胞菌属、水微菌属和Chelatococcus是否能够降解土霉素仍需进一步深入研究。
4 结 论
(1)堆肥可以有效的降解畜禽粪便中的土霉素,微生物驱动的土霉素生物降解是堆肥过程中土霉素降解一个关键因素。
(2)在土霉素胁迫下,堆肥过程中所含总体OTUs数目下降,变形菌门相对丰度下降,而厚壁菌门相对丰度上升。Bacillus和Paenibacillus可以作为土霉素降解菌在堆肥过程中对土霉素的降解起到作用,假黄色单胞菌属、水微菌属和Chelatococcus可能是潜在的土霉素降解菌,但仍需进一步研究。
参考文献(References):
[1] 农业部,中华人民共和国国家统计局.第一次全国污染源普查公报[R].北京: 国家统计局,2010.
Ministry of Agriculture,National Bureau of Statistics of the Peoples Republic of China.The first national survey on pollution sources[R].Beijing:National Bureau of Statistics,2010.
[2] 中华人民共和国国家统计局.中国统计年鉴2016[M].北京: 中国统计出版社,2016.
National Bureau of Statistics of People′s Republic of China.China statistical yearbook 2016[M].Beijing:China Statistics Press,2016.
[3] 仇焕广,廖绍攀,井 月,等.我国畜禽粪便污染的区域差异与发展趋势分析[J].环境科学,2013,34(7): 2766-2774.
QIU H G,LIAO S P,JING Y,et al.Regional differences and development tendency of livestock manure pollution in China[J].Environmental Sciences,2013,34(7): 2766-2774.
[4] MITEMA E S,KIKUVI G M,WEGENER H C,et al.An assessment of antimicrobial consumption in food producing animals in Kenya[J].Journal of Veterinary Pharmacology and Therapeutics,2001,24(6):385-390.
[5] ZHANG Q Q,YING G G,PAN C G,et al.Comprehensive evaluation of antibiotics emission and fate in the river basins of China:Source analysis,multimedia modeling,and linkage to bacterial resistance[J].Environmental Science and Technology,2015,49(11):6772-6782.
[6] YING G G,HE L Y,YING A J,et al.China must reduce its antibiotic use[J].Environmental Science and Technology,2017,51(3):1072-1073.
[7] ALCOCK R E,SWEETMAN A,JONES K C.Assessment of organic contaminant fate in waste water treatment plants.I: Selected compounds and physicochemical properties[J].Chemosphere,1999,38(10): 2247-2262.
[8] CHADHA T.Biotic relationships:Distribution of antibiotic resistance genes in nosocomial pathogens[J].American Journal of Microbiological Research,2014,2(4):118-121.
[9] SARMAH A K,MEYER M T,BOXALL A B.A global perspective on the use,sales,exposure pathways,occurrence,fate and effects of veterinary antibiotics(VAs) in the environment[J].Chemosphere,2006,65(5):725-759.
[10] STOKES H W,GILLINGS M R.Gene flow,mobile genetic elements and the recruitment of antibiotic resistance genes into Gram-negative pathogens[J].FEMS Microbiology Reviews,2011,35(5): 790-819.
[11] ZHAO L,DONG Y H,WANG H.Residues of veterinary antibiotics in manures from feedlot livestock in eight provinces of China[J].Science of the Total Environment,2010,408(5): 1069-1075.
[12] 吴晓凤.猪粪生物处理过程中残留四环素类抗生素与重金属铜的迁移转[D].北京:中国科学院大学,2011.
WU X F.The behavior of residual tetracyclines and Cu during the biological treatment of swine manure[D].Beijing: University of Chinese Academy of Sciences,2011.
[13] MITCHELL S M,ULLMAN J L,BARY A,et al.Antibiotic degradation during thermophilic composting[J].Water Air and Soil Pollution,2015,226(2):13.
[14] ARIKAN O A,SIKORA L J,MULBRY W,et al.Composting rapidly reduces levels of extractable oxytetracycline in manure from therapeutically treated beef calves[J].Bioresource Technology,2007,98(1): 169-176.
[15] WU X F,WEI Y S,ZHENG J X,et al.The behavior of tetracyclines and their degradation products during swine manure composting[J].Bioresource Technology,2011,102(10):5924-5931.
[16] SELVAM A,XU D L,ZHAO Z Y,et al.Fate oftetracycline,sulfonamideandfluoroquinoloneresistance genes and the changes in bacterial diversity during composting of swine manure[J].Bioresource Technology,2012,126:383-390.
[17] 李 杰,潘兰佳,余广炜,等.污泥中抗生素热解特性及动力学分析[J].环境工程学报,2017,11(9):5213-5219.
LI J,PAN L J,YU G W,et al.Pyrolysis characteristics and kinetics analysis of several antibiotics in sludge[J].Chinese Journal of Environmental Engineering,2017,11(9):5213-5219.
[18] RAY P Q,CHEN C Q,KNOWLTON K F,et al.Fate and effect of antibiotics in beef and dairy manure during static and turned composting[J].Journal of Environmental Quality,2017,46(1):45-54.
[19] WANG Q Q,YATES S R.Laboratory study of oxytetracycline degradation kinetics in animal manure and soil[J].Journal of Agricultural and Food Chemistry,2008,56(5): 1683-1688.
[20] 徐 莲,张丽萍,刘怡辰,等.功夫菊酯降解菌GF-3的筛选鉴定及其降解特性研究[J].农业环境科学学报,2009,28(7): 1545-1551.
XU L,ZHANG L P,LIU Y C,et al.Isolation,identification and characteristics of acyhalothrin-degrading bacterium GF-3[J].Journal of Agro-environment Science,2009,28(7): 1545-1551.
[21] 王志强,张长青,王维新.土霉素降解菌的筛选及其降解特性研究[J].中国兽医科学,2011,41(5): 536-540.
WANG Z Q,ZHANG C Q,WANG W X.Screening and characterization of oxytentracycline degrading bacterium[J].Chinese Veterinary Science,2011,41(5): 536-540.
[22] 成 洁,杜慧玲,张天宝,等.四环素类抗生素降解菌的分离与鉴定[J].核农学报,2017,31(5): 884-888.
CHENG J,DU H L,ZHANG T B,et al.Isolation and identification of tetracyclines degrading bacteria[J].Acta Agriculturae Nucleatae Sinica,2017,31(5): 884-888.
[23] 马 骏.四环素在堆肥过程中的降解及其对堆肥中微生物群落功能多样性的影响[D].杨凌:西北农林科技大学,2016.
MA J.Degration of tetracycline and its effect on functional diversity of microbial communities during composting[D].Yangling: Northwest N&F University,2016.
[24] SU J Q,WEI B,OUYANG W Y,et al.Antibiotic resistome and its association with bacterial communities during sewage sludge composting.[J].Environmental Science and Technology,2015,49(12): 7356-7363.
[25] 韦 蓓,黄福义,苏建强.堆肥对污泥中四环素类抗生素及抗性基因的影响[J].环境工程学报,2014,8(12):5431-5438.
WEI B,HUANG F Y,SU J Q.Effect of composting on tetracyclines and tetracycline resistance genes in sewage sludge[J].Chinese Journal of Environmental Engineering,2014,8(12):5431-5438.
[26] ZHU H,QU F,ZHU L H.Isolation of genomic DNAs from plants,fungi and bacteria using benzyl chloride[J].Nucleic Acids Research,1993,21(22):5279-5280.
[27] 孔维栋.土霉素在土壤-植物系统中的行为及对土壤微生物群落的影响[D].北京: 中国科学院大学,2006.
KONG W D.Behaviors of oxytetracycline in soil-plant system and its impact on soil microbial communities[D].Beijing: University of Chinese Academy of Sciences,2011.
[28] 张树清,张夫道,刘秀梅,等.高温堆肥对畜禽粪中抗生素降解和重金属钝化的作用[J].中国农业科学,2006,39(2): 337-343.
ZHANG S Q,ZHANG F D,LIU X M,et al.Degradation of antibiotics and passivation of heavy metals during thermophilic composting process[J].Scientia Agricultura Sinica,2006,39(2):337-343.
[29] 于 浩.畜禽粪便无害化处理中土霉素高效降解菌的筛选及其对微生物多样性的影响[D].沈阳:沈阳大学,2017.
YU H.Screening of highly effective oxytetracycline degeneration bacterium and their effects on microbial diversity in innocent treatment of excrements of livestocks[D].Shenyang: Shenyang University,2017.
[30] 王桂珍.鸡粪堆肥中土霉素的快速降解及其微生态机理研究[D].北京: 中国农业科学院,2013.
WANG G Z.Microbial ecology mechanism for quick degradation of oxytetracycline during chicken feces composing[D].Beijing: Chinese Academy of Agricultural Sciences,2013.
[31] XU C F,ZHANG L,HUANG J W,et al.Aquamicrobiumsolisp.nov.,a bacterium isolated from a chlorobenzoate-contaminated soil[J].Antonie Van Leeuwenhoek,2017,110(3):305-312.
[32] SUGAWARA H,KOYAMA D,SAWADA K,et al.Purification and degradation characteristics of Biphenyl degrading enzyme BphC fromAquamicrobiumsp.SK-2[J].Journal of Japan Society of Civil Engineers Ser G,2015,71(7):413-419.
[33] CHOI E J,JIN H M,LEE S H,et al.Comparative genomic analysis and benzene,toluene,ethylbenzene,ando-,m-,andp-xylene(BTEX) degradation pathways ofPseudoxanthomonasspadixBD-a59[J].Applied and Environmental Microbiology,2013,79(2):663-671.
[34] PATEL V,CHETURVEDULA S,MADAMWAR D.Phenanthrene degradation byPseudoxanthomonas,sp.DMVP2 isolated from hydrocarbon contaminated sediment of Amlakhadi canal,Gujarat,India[J].Journal of Hazardous Materials,2012,201(202): 43-51.
[35] KUMAR M,REVATHI K,KHANNA S.Biodegradation of cellulosic and lignocellulosic waste byPseudoxanthomonassp R-28[J].Carbohydrate Polymers,2015,134: 761-766.
