混合寄生真菌发酵液对大豆胞囊线虫的毒力和防效
2018-06-19,,,2,
,, ,2,
(1.中国科学院 东北地理与农业生态研究所,黑龙江 哈尔滨 150081;2.哈尔滨商业大学,黑龙江 哈尔滨 150028)
0 引 言
大豆胞囊线虫(Soybean cyst nematode,SCN)病是大豆产区普遍发生的土传病害,其病原为大豆胞囊线虫(Heteroderaglycines)。由于大豆胞囊线虫以胞囊形式存在于土壤中,造成连作大豆胞囊线虫病危害加重[1-2],但Hartwig[3]和Chen等[4]报道连续多年种植大豆感病品种,可减少大豆胞囊线虫在土壤中的密度,称此现象为 “大豆胞囊线虫自然衰退”,出现这种现象的土壤被称为“线虫抑制性土壤”,这种现象在我国大豆主产区也有报道[5-8],孙玉秋等研究发现,大豆长期连作后土壤中胞囊数量接近轮作土壤中的胞囊数量,并且胞囊中的卵量也降低[9]。孙漫红等研究发现,抑制性土壤中的空胞囊数量增加,并认为土壤中具有抑制因子可导致大豆胞囊线虫衰退,并初步确定是食线虫真菌的作用[10]。在美国也有报道大豆胞囊线虫病土壤中雌虫的寄生真菌有辅助链枝菌(Catenariaauxiliaris)、嗜雌线虫菌(Nematophthoragynophila)和厚垣轮枝菌(Verticilliumchlamydosporium)[11],这些真菌对降低大豆胞囊线虫种群密度起了重要作用。2002年孙漫红等发现在大豆连作多年土壤中胞囊定殖真菌数量较多,如淡紫拟青霉菌(Paecilomyceslilacinus)和厚垣轮枝菌[12]。Song等采用盆栽试验在21年大豆连作土壤中加入真菌抑制剂匹马霉素和细菌抑制剂硫酸链霉素,证明了抑制性土壤中的真菌对控制大豆胞囊线虫的作用大于细菌的作用[13];宋洁等[14]研究发现大豆连作20多年后,土壤中大豆胞囊线虫不同虫态上的厚垣轮枝菌和淡紫拟青霉菌分离数量明显高于3 年连作和22 年轮作的。Song 等采用DGGE技术分析也得到了相同的结果[15]。陈立杰等报道连作6年的大豆田间土壤中镰孢菌(Fusariumspp.)的分离频率最高,认为镰孢菌与连作田中不饱满胞囊数量增多有关[16]。近年来有许多研究证明了厚垣轮枝菌、镰孢菌和淡紫拟青霉菌等对大豆胞囊线虫的寄生和抑制具有一定的影响[17-18]。
淡紫拟青霉菌是一种重要的线虫寄生真菌,能寄生在多种植物病原线虫卵、幼虫和成虫中,其代谢产物中含有一定浓度的乙酸等可杀线活性物质,抑制线虫卵孵化和二龄幼虫活性[19]。有研究表明,实验室条件下尖孢镰孢芬芳变种(Fusariumoxysporumvar.redolens)和禾谷镰孢菌(F.graminearum)发酵液,可有效地抑制大豆胞囊线虫卵孵化,并对二龄幼虫具有致死作用[20]。也有报道提出,厚垣轮枝菌发酵液同样可抑制大豆胞囊线虫卵孵化,使线虫的二龄幼虫致死[18,21]。Khan等研究表明,淡紫拟青霉菌的培养液能产生几丁质酶和丝氨酸蛋白酶,并通过这两种酶的作用破坏根结线虫(Meloidogynejovanica)卵壳,而使菌丝侵入根结线虫的卵并寄生于卵内,因而有效地降低根结线虫卵孵化成幼虫[22]。但以往研究多集中于某种单一寄生真菌或发酵液对大豆胞囊线虫的作用,由于大豆田土壤中微生态环境复杂,多种微生物并存。因此,本研究为了明确寄生真菌对大豆胞囊线虫作用,采用大豆胞囊线虫优势寄生菌群,探讨其发酵液混合后对大豆胞囊线虫的毒性大小,旨在为生产中大豆胞囊线虫的生物生态防控提供依据。
1 材料和方法
1.1 供试寄生真菌、线虫及大豆品种
寄生真菌为淡紫拟青霉菌4个菌株(P-1、P-V、P-40和P-E)、镰孢菌属4个菌株(F-1、F-5、F-9和F-V)和厚垣轮枝菌4个菌株(V-1、V-2、V-21和 V-25)。供试真菌由中国科学院黑土区农业生态重点实验室从大豆胞囊线虫抑制性土壤中分离、保存,并鉴定其对寄生大豆胞囊线虫的致病性,结果显示供试菌株寄生大豆胞囊线虫胞囊、卵后可有效抑制线虫孵化并使二龄幼虫(J2)致死[23]。测定供试菌株的单独发酵液对大豆胞囊线虫毒力也表明其对大豆胞囊线虫胞囊、卵和J2的毒性[20,24]。
供试线虫为大豆胞囊线虫3号生理小种,该小种是我国大豆主产区优势小种。盆栽试验,供试大豆品种为合丰25,该品种对大豆胞囊线虫3号生理小种感病。供试培养基为马铃薯葡萄糖琼脂培养基(PDA)、马铃薯葡萄糖培养液(PDB)[25]和水琼脂培养基(WA)。
1.2 寄生真菌发酵液制备
将每个供试菌株分别挑取菌丝在PDA培养基上活化7 d后打取直径为4 mm的菌块15块,接种于100 mL PDB培养液中,30 ℃、180 r·min-1震荡培养24 h作为种子液。取4 mL种子液,接种到120 mL PDB培养液中,相同条件下震荡培养5 d,在4 ℃条件下离心20 min (10 000 r·min-1),上清液用细菌过滤器过滤,即为寄生真菌发酵原液。
1.3 大豆胞囊线虫胞囊分离和卵及二龄幼虫(J2)悬液制备
取田间5~20 cm耕层大豆根围土,进行线虫胞囊分离。将新鲜土在烧杯中加清水搅拌,浸泡1 h后过套筛(20目和80目),将80目筛上的残留物用63%蔗糖收集到离心管中,离心5 min(2 500 r·min-1),将残留物过滤,挑取成熟饱满的线虫胞囊,放4 ℃冰箱保存。
将饱满胞囊放入套筛(200目和500目)中研磨,收集残留物,用0.5% NaClO溶液消毒,清水冲洗,用灭菌水制备卵悬液,调整浓度到5 000个·mL-1,放4 ℃冰箱保存。
将线虫卵置于420目筛网布上,放入含0.4 mmol·L-1ZnCl2溶液的孵化池中,25 ℃培养箱中进行孵化。
1.4 混合寄生真菌发酵液对大豆胞囊线虫毒力测定
按1.2方法制备的3种寄生真菌发酵液按1∶1∶1比例混合[26],采用正交试验,筛选优势寄生菌组合,见表1。
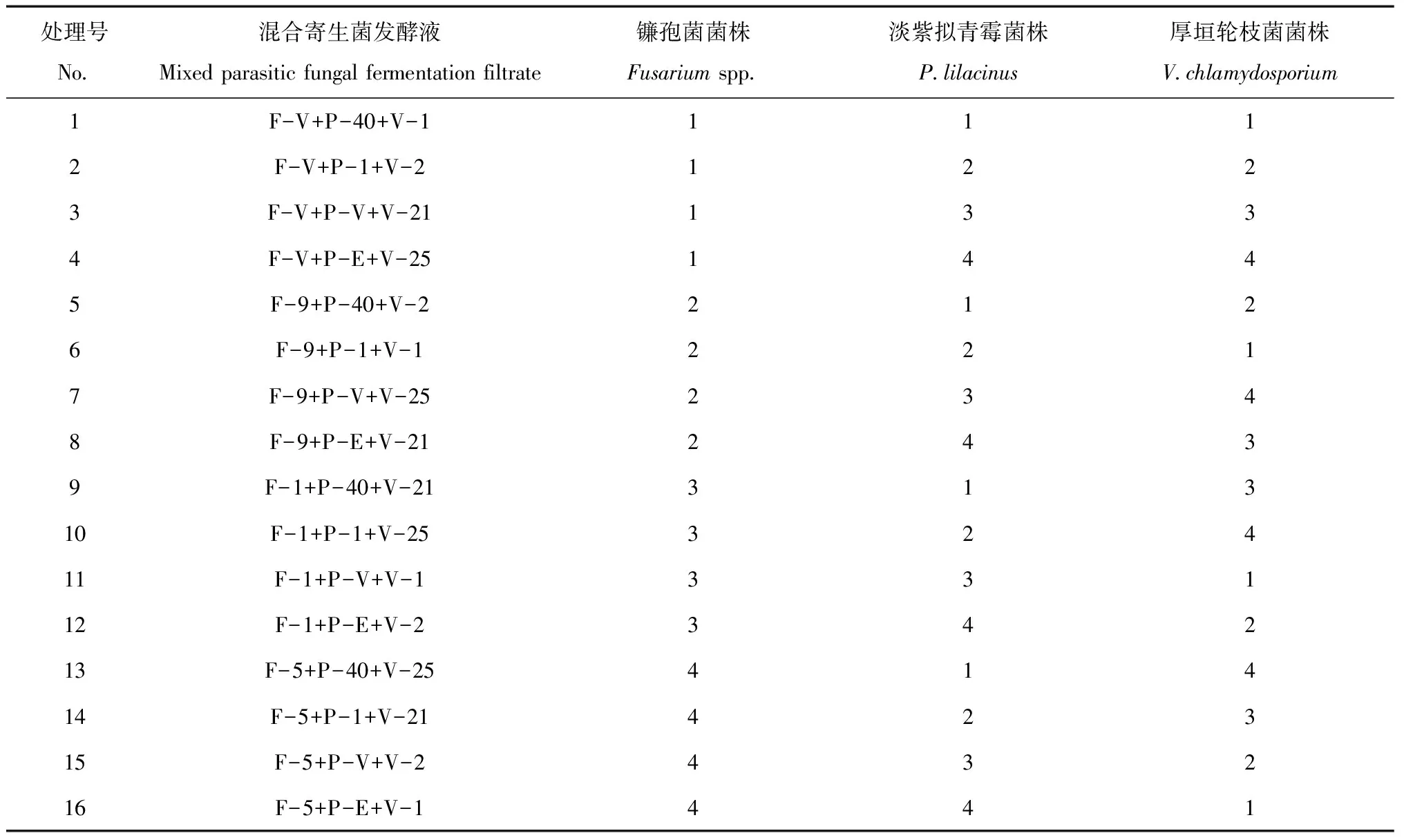
表1 菌株混合方式正交表Table 1 Orthogonal table of mixed parasitic fungal strains
1.4.1 混合寄生真菌发酵液对SCN胞囊孵化的影响。新鲜饱满的线虫胞囊分别置于24孔细胞培养板中(每孔10个),每孔加入2 mL混合寄生真菌发酵液,以空白培养液为对照,每个处理3次重复,置于25 ℃恒温培养箱中培养。每隔3 d记录孵化的线虫数,计算孵化抑制率。
孵化抑制率(%)=(对照孵化线虫数-处理孵化线虫数)/对照孵化线虫数×100%
1.4.2 混合寄生真菌发酵液对SCN卵孵化的影响。在24孔细胞培养板中加入线虫卵悬液,每孔0.4 μL(约200粒),每孔加入2 mL混合寄生真菌发酵液,以空白培养液为对照,每个处理3次重复,置于25 ℃培养箱中培养。每隔3 d记录孵化的线虫数,计算孵化率和相对抑制率。
孵化率(%)=孵化线虫数×100/供试卵数
相对抑制率(%)=(对照孵化率-处理孵化率)×100/对照孵化率
1.4.3 混合寄生真菌发酵液对SCN J2毒力测定。在24孔细胞培养板中加入线虫J2(每孔约50条),每孔加入2 mL混合寄生真菌发酵液,以空白培养液为对照,每个处理3次重复,置于25 ℃培养箱中培养。分别在1 h、6 h、12 h、24 h、48 h和72 h后记录线虫死亡数量,计算线虫死亡率。
线虫死亡率(%)=死亡线虫数/供试线虫数×100%
1.5 寄生真菌发酵液对大豆胞囊线虫防效
试验设3种处理:空白对照、接种大豆胞囊线虫J2、施入混合寄生真菌发酵液+接种大豆胞囊线虫J2。选择室内测定结果中对大豆胞囊线虫3种虫态毒力强的真菌发酵液4个组合,进行温室盆栽试验,接种二龄幼虫35 d后调查混合寄生真菌发酵液对大豆胞囊线虫的防治效果。
试验用土取自菜地,经分离测定无大豆胞囊线虫胞囊,土和河沙均过20目孔筛,经121 ℃高压灭菌1 h。将土和沙子按2∶1比例混合,盆中加入300 cm3灭菌沙土。花盆底径7 cm、口径10 cm、高8 cm。在温室内无菌蛭石中播种大豆,7 d后每盆移栽豆苗2株,置于温室中生长,4次重复。大豆胞囊线虫J2接种量为1 500条·株-1,混合寄生真菌发酵液施入量为100 mL[27]。大豆出苗35 d后扣盆,用清水冲洗掉根系土壤,测定大豆株高、大豆地上和根系鲜重。清水冲洗根系后计数根表大豆胞囊线虫雌虫数量。
大豆根内J2、胞囊及卵分离和测定:将新鲜去土的大豆根在-20 ℃冰箱中冷冻24 h,取出室温下融化,加适量水后在组织捣碎机中捣碎。将溶液转移到套筛网上(80目和500目),500目筛上物用蔗糖离心法分离[28],同时将黏在离心管壁和盖内的线虫进行收集清洗。体式显微镜下计数J2数量。胞囊及卵分离测定同1.3。
1.6 数据统计与分析
采用Microsoft Excel 2007和SPSS17.0进行数据分析处理。
2 结果与分析
2.1 混合寄生真菌发酵液对胞囊孵化的影响
对大豆胞囊线虫在混合寄生真菌发酵液中胞囊孵化结果调查表明,16组混合寄生真菌发酵液均对胞囊孵化具有强烈抑制作用,孵化抑制率在59.1%~87.8%,与对照差异极显著(P<0.01),见表2。

表2 混合寄生真菌发酵液组合的大豆胞囊线虫胞囊孵化抑制率Table 2 Inhibition rates of SCN cyst hatch in mixed fermentation filtrate
注:数字后字母为Duucan′S新复极差测验结果,不同英文字母表示差异极显著(P<0.01)。下表同。
Note:Means in column followed by the different capital letter(s)indicate significant differences according to the Duucan′S multiple range test at 0.01 level.The same is as below.
其中F-V+P-V+V-21、F-V+P-E+V-25、F-9+P-V+V-25和 F-9+P-E+V-21处理的孵化抑制率均为80%以上,极显著高于其他处理;F-1+P-40+V-21、F-1+P-1+V-25、F-5+P-1+V-21、F-5+P-V+V-2和F-5+P-E+V-1处理的混合寄生真菌发酵液的孵化抑制率稍低一些,抑制率在59%~60%。
2.2 混合寄生真菌发酵液对卵孵化影响
16个混合寄生真菌发酵液组合均对大豆胞囊线虫卵孵化均具有显著抑制作用,处理的卵孵化率在2.3%~4.2%,均极显著低于空白对照,见表3;卵孵化相对抑制率在72.1%~84.7%。其中F-V+P-V+V-21、F-V+P-E+V-25、F-9+P-V+V-25和F-9+P-E+V-21孵化相对抑制率为81%~85%,显著高于其他处理(P<0.05),与胞囊孵化试验结果一致,说明对大豆胞囊线虫的抑制效果稳定。
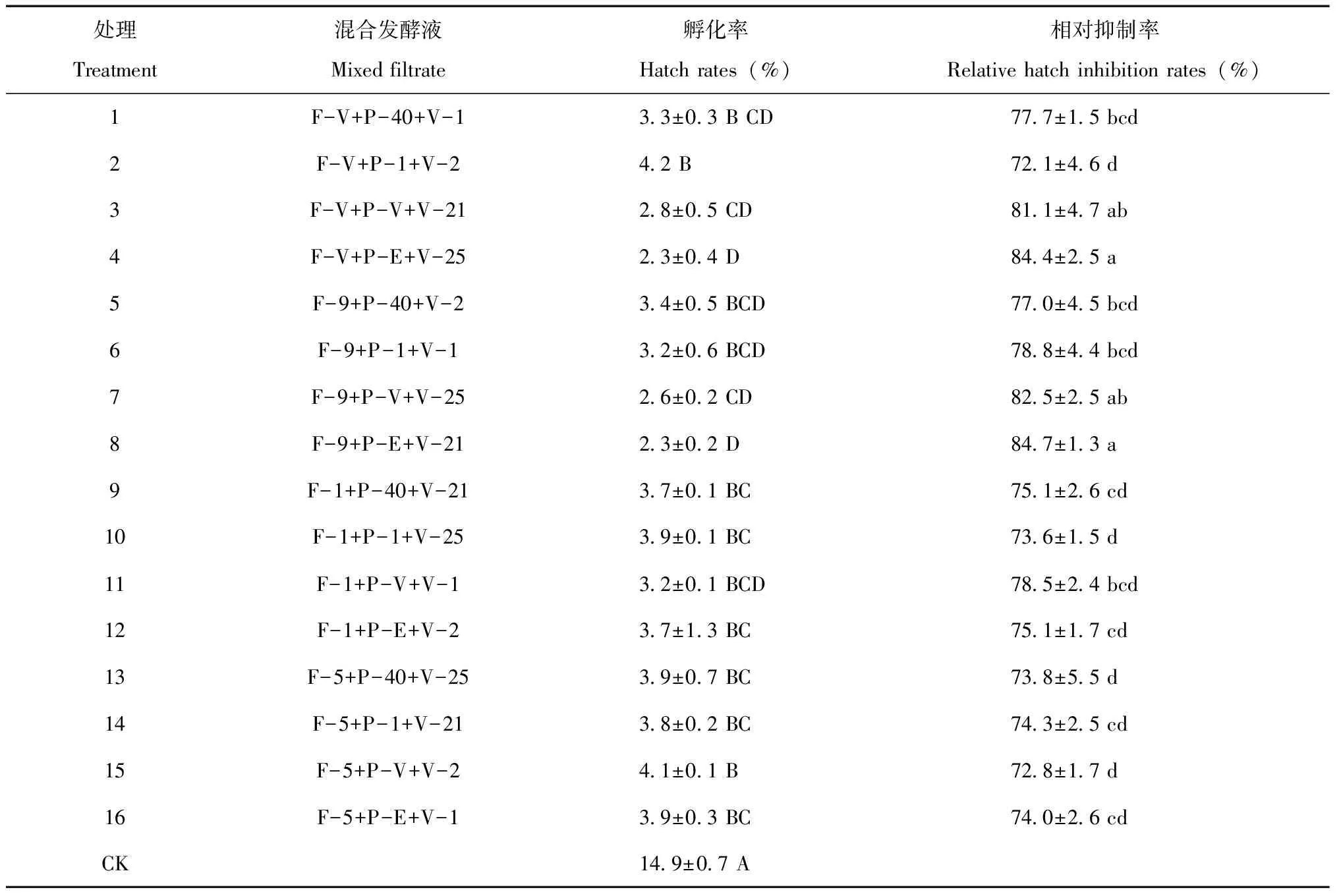
表3 混合寄生真菌发酵液中大豆胞囊线虫卵孵化率和相对抑制率Table 3 The SCN egg hatch rates and relative hatch inhibition rates of in mixed fermentation filtrates
注:大写英文字母表示差异极显著(P<0.01),小写英文字母表示差异显著(P<0.05)。下表同。
Note:Captial letters mean significant differences at 0.01 level;Small letters mean significant differences at 0.05 level.The same is as below.
2.3 混合寄生真菌发酵液对J2毒力
试验结果表明16组混合寄生真菌发酵液均对大豆胞囊线虫二龄幼虫有致死作用,见图1。混合寄生真菌发酵液对J2的致死作用随作用时间延长而增强,在1 h就显现出致死作用,二龄幼虫死亡率在13%~31%,24 h增至63%以上,48 h增至94%以上,72 h达到了100%。16个处理中对大豆胞囊线虫二龄幼虫毒力较强的仍是F-V+P-V+V-21、F-V+P-E+V-25、F-9+P-V+V-25和 F-9+P-E+V-21组合,1 h时4个处理使二龄幼虫迅速死亡,死亡率25.2%~31.3%,显著高于其他处理;到24 h时,这4个处理的二龄幼虫死亡率均高达90%以上;在48 h即达到了100%的二龄幼虫死亡率,较其他处理提前了24 h。F-V+P-V+V-21、F-V+P-E+V-25、F-9+P-V+V-25和 F-9+P-E+V-21处理与对胞囊和卵的抑制作用非常吻合。

图1 寄生真菌发酵液中大豆胞囊线虫二龄幼虫死亡率Fig.1 Death rate of SCN J2 in mixed fermentation filtrates
2.4 混合寄生真菌发酵液对大豆胞囊线虫防治效果
盆栽试验结果显示,施用混合真菌发酵液可明显降低盆内线虫密度,见表4。施用混合真菌发酵液后,大豆根表雌虫数量防效27.9%~40.7%,胞囊数量防效33.5%~41.2%,卵量防效36.3%~45.3%,根内J2数量防效17.3%~38.3%,其中8号处理(F-9+P-E+V-21)对根表雌虫、胞囊、卵量和根内J2防效均在40%左右,综合防治效果最为显著。

表4 混合寄生真菌发酵液对大豆胞囊线虫控制效果Table 4 Control effects of mixed parasitic fungal fermentation filtrate on SCN
注(Note):3:F-V+P-V+V-21;4:F-V+P-E+V-25;7:F-9+P-V+V-25;8:F-9+P-E+V-21
2.5 混合寄生真菌发酵液对大豆生长发育的影响
盆栽试验调查结果显示,接种J2同时施用混合真菌发酵液与只接种J2处理相比,可增加大豆株高,提高大豆植株鲜重、根重及总鲜重,总鲜重增加范围在17.9%~26.9%。混合真菌发酵液4个处理组合中,以8号(F-9+P-E+V-21)发酵液对大豆生长影响较为明显,但不同混合发酵液组合间差异不显著;除3号处理(F-V+P-V+V-21)外,4号、7号和8号施用混合发酵液处理的株高均显著高于只接种J2对照的株高;在只施用混合发酵液处理中,大豆植株总鲜重是8.1~8.7 g,植株高度范围在25.4~26.0 cm,均与不施用混合发酵液对照(CK)差异不显著(P>0.05)(表5),说明4个处理均未对大豆生长造成负面影响。
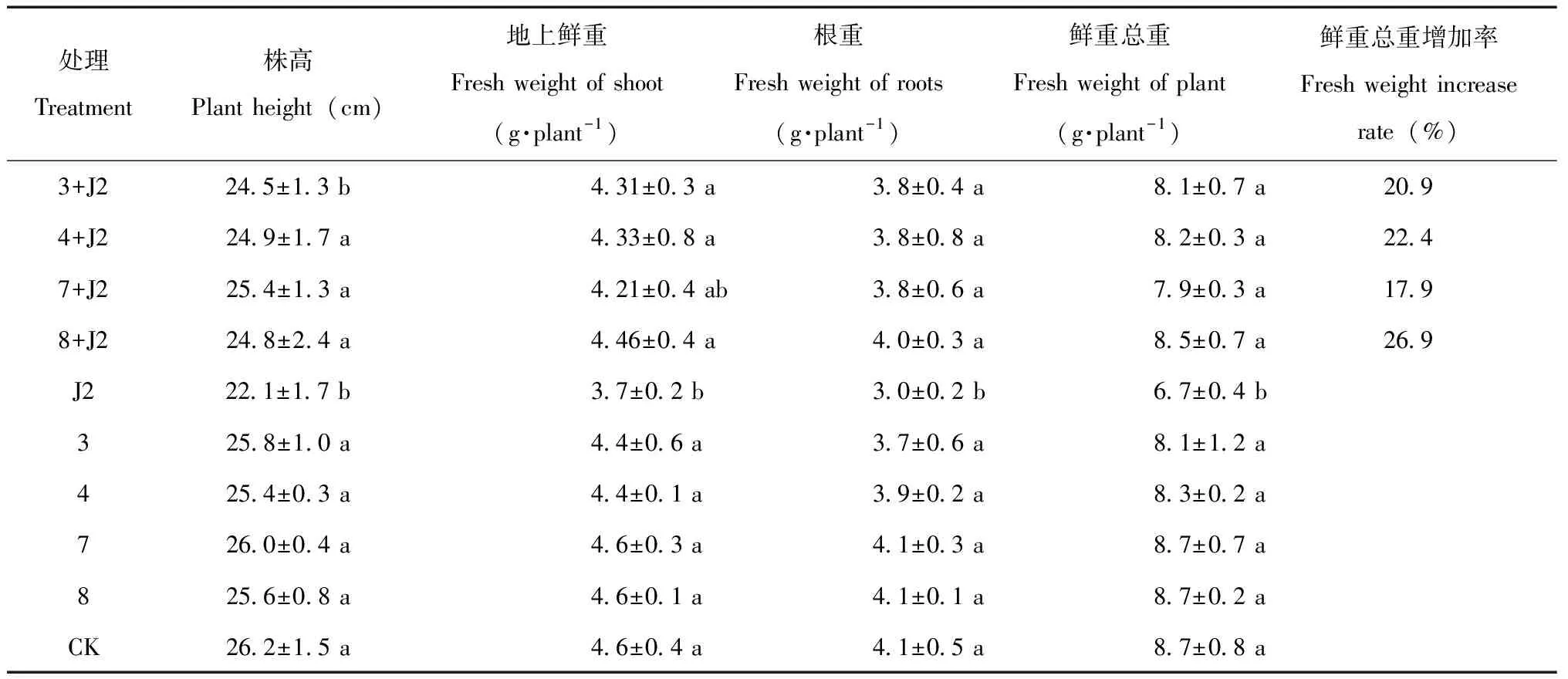
表5 混合寄生真菌发酵液对大豆生长发育的影响Table 5 Effects of mixed parasitic fungal fermentation filtration on the growth and development of soybean
注(Note):3:F-V+P-V+V-21;4:F-V+P-E+V-25;7:F-9+P-V+V-25;8:F-9+P-E+V-21
3 结论和讨论
本研究发现,淡紫拟青霉菌、厚垣轮枝菌和镰孢菌的混合寄生真菌发酵液,可显著降低盆栽中大豆胞囊线虫各种虫态的数量,对二龄幼虫具有致死毒性,对SCN有显著的抑制作用。而且,筛选出的4个组合不仅对大豆胞囊线虫离体毒力强,而且对土壤中大豆胞囊线虫的防控具有稳定的效果。
淡紫拟青霉菌、厚垣轮枝菌和镰孢菌这3种真菌在大豆田中普遍存在,尤其在长期连作大豆田中[14]。有研究认为大豆胞囊线虫寄生真菌可产生酶类物质、毒素及对线虫有毒害的其他次生代谢物质[29]。不同真菌产生不同的代谢产物,杀线活性也不尽相同,而且不同的大豆胞囊线虫寄生真菌都有其独特的作用方式和机制。林茂松等[30]发现,淡紫拟青霉菌培养滤液的代谢产物的生理活性物质存在于蛋白组分中。此外,淡紫拟青霉菌能够产生代谢物乙酸,该菌可寄生线虫的卵而影响幼虫生长发育,致使线虫在胚胎中产生气泡,从而使线虫造成畸形或停止发育,甚至麻痹而死[22]。厚垣轮枝菌也可寄生在大豆胞囊线虫的各虫态中,对控制田间植物寄生线虫种群密度起着重要的作用,也是欧洲燕麦胞囊线虫衰退的主要原因[5]。也有报道轮枝菌产生一些替代物会导致南方根结线虫(Meloidogyneincognita)卵表面收缩并无活力,说明有几丁质降解酶或者一些其他活性物质的产生[31]。Chen等[32]报道在线虫胞囊上分离的茄腐镰孢菌(Fusariumsolani)的发酵液对二龄幼虫具有毒力。本研究采用这些大豆胞囊线虫寄生真菌代谢物混合,可充分发挥单个寄生真菌的作用,从不同作用方式对大豆胞囊线虫进行抑制。室内试验中F-V+P-V+V-21、F-V+P-E+V-25、F-9+P-V+V-25和 F-9+P-E+V-21组合对大豆胞囊线虫的胞囊、卵孵化抑制和对J2的致死作用非常一致,说明这些组合作用稳定,此4组混合菌液对大豆胞囊线虫的作用都很强。而且,发酵液可促进大豆生长,降低其对大豆生长发育造成的危害,室内抑制作用与土壤中施用效果反应一致。因此,应用不同生物活性的发酵液组成混合制剂能提高其环境适应性而加强对线虫的防治效果,值得进一步应用开发。
目前对大豆胞囊线虫生物防治的研究多集中在实验室条件下对线虫的抑制作用及某种真菌活体菌剂的应用,而发酵液对线虫作用更直接迅速,对发酵液制备技术的研发和多种生防菌混合发酵液的开发需深入探讨。应用生防菌剂防治大豆胞囊线虫等土传病害,关键在于作物根际的生态环境,该微环境非常复杂,作物根际-线虫-真菌相互关系、土壤温湿度、pH、作物残体、其它微生物的代谢产物、除草剂和农药等化学物质的干扰,都会影响到生防真菌在田间应用过程中防效的稳定性,今后应加强这些方面的研究。
致 谢
中国科学院“十三五”信息化专项科学大数据工程项目(XXH13505-07)。
参考文献(References):
[1] 刘增柱,周玉芝,韩静淑.大豆连、轮作土壤微生物生态分布与大豆孢囊线虫群体动态的研究[J].大豆科学,1990,9(3):206-212.
LIU Z Z,ZHOU Y Z,HAN J S.Study on ecological distribution of soil microorganisms and colony dynamics cyst-forming nematodes in continuous and rotation cropping systems of soybean[J].Soybean Science,1990,9(3):206-212.
[2] 许艳丽,韩晓增.大豆重迎茬研究[M].哈尔滨: 哈尔滨工程大学出版社,1995:136-139.
XU Y L,HAN X Z.Study on continuous cropping and alternate-year of soybean[M].Harbin: Harbin Engineering University Press,1995:136-139.
[3] HARTWIG E E.Breeding productive soybean cultivars resistant to the soybean cyst nematode for the southern United States[J].Plant Disease,1981,65(4): 303-307.
[4] CHEN S Y.Suppression ofHeteroderaglycinesin soils from fields with long-term soybean monoculture[J].Biocontrol Science and Technology,2007,17(2): 125-134.
[5] 刘杏忠,张东升,武修英,等.定殖于大豆孢囊线虫孢囊内真菌的初步研究[J].北京农业大学学报,1991,17(3):87-91.
LIU X Z,ZHANG D S,WU X Y,et al.Preliminary studies on the parasitic from the cyst ofHeteroderaglycines[J].Acta Agriculture Universitatis Pekinensis,1991,17(3): 87-91.
[6] 靳学慧,辛惠普,郑 雯,等.长期轮作和连作对土壤中大豆胞囊线虫数量的影响[J].中国油料作物学报,2006,28(2): 189-193.
JIN X H,XIN H P,ZHENG W,et al.The influence of soil on the long-term rotation and continuous cultivation on soybean cyst nematode[J].Chinese Journal of Oil Crop Science,2006,28(2): 189-193.
[7] 许艳丽.土壤环境对大豆胞囊线虫卵孵化影响及线虫分子诊断研究[D].哈尔滨: 东北农业大学,2004:41-47.
XU Y L.The effects of soil environment on soybean cyst nematode egg hatch and nematode molecular diagnosis[D].Harbin: Northeast Agricultural University,2004:41-47.
[8] 马承铸,顾真容,钱振官,等.种植制对大豆孢囊线虫群体密度和真菌区系的影响[J].上海农业学报,1994,10(2): 62-66.
MA C Z,GU Z R,QIAN Z G,et al.Effects of cropping system on mycoflora and population density of soybean cyst nematodeHeteroderaglycines[J].Acta Agriculturae Shanghai,1994,10(2): 62-66.
[9] 孙玉秋,许艳丽,李春杰,等.作物轮作系统对土壤中大豆胞囊线虫胞囊量和单胞囊卵量的影响[J].农业系统科学与综合研究,2011,27(2): 248-252.
SUN Y Q,XU Y L,LI C J,et al.Influence of cropping rotation systems on the volume of cysts and eggs in a single-cyst of soybean cyst nematode[J].System Science and Comprehensive Studies in Agriculture,2011,27(2): 248-252.
[10] 孙漫红,刘杏忠.连作土壤中大豆胞囊线虫种群数量减少的原因探讨[J].植物病理学报,2000,30(4):353-356,363.
SUN M H,LIU X Z.Suppressive soil of soybean cysts nematode in China[J].Acta Phytopathologica Sinica,2000,30(4): 353-356,363.
[11] CRUMP D H,SAYRE R M,YOUNG L D.Occurrence of nematophagous fungi in cyst nematode populations[J].Plant Disease,1983,67(1): 63-64.
[12] 孙漫红,刘杏忠,晋治波.淡紫拟青霉对大豆胞囊线虫卵及2龄幼虫的影响[J].植物保护学报,2002,29(1):57- 61.
SUN M H,LIU X Z,JIN Z B.EffectPaecilomyceslilacinuson egg hatching and juvenile mortality ofHeteroderaglycines[J].Journal of Plant Protection,2002,29(1):57- 61.
[13] SONG J,LI S X,WEI W,et al.Assessment of parasitic fungi for reducing soybean cyst nematode with suppressive soil in soybean fields of northeast China[J].Acta Agriculturae Scandinavica,Section B — Soil and Plant Science,2017,67(8): 730-736.
[14] 宋 洁,许艳丽,姚 钦.大豆胞囊线虫主要寄生真菌对大豆耕作系统的响应[J].大豆科学,2016,35(3):461-467.
SONG J,XU Y L,YAO Q.Response of major parasitic fungi of soybean cyst nematode on different cultivation systems[J].Soybean Science,2016,35(3):461-467.
[15] SONG J,LI S X,XU Y L,et al.Diversity of parasitic fungi from soybean cyst nematode associated with long-term continuous cropping of soybean in black soil[J].Acta Agriculturae Scandinavica,Section B — Soil and Plant Science,2016,66(5):432-442.
[16] 陈立杰,刘晓杰,段玉玺,等.轮作和连作田大豆胞囊线虫胞囊上真菌定殖动态[J],大豆科学,2009,28(2):266-270.
CHEN L J,LIU X J,DUAN Y X,et al.Dynamics of fungal colonization on cyst in rotation and continuous cropping of soybean[J].Soybean Science,2009,28(2):266-270.
[17] 林茂松.土壤真菌防治大豆胞囊线虫的效果测定[J].中国油料,1990,12(3):63-65.
LIN M S.Control effect to soybean cyst nematode by fungi from eggs ofHeteroderaglycines[J].Chinese Oil,1990,12(3):63-65.
[18] 范圣长,段玉玺,陈立杰.大豆胞囊线虫胞囊内寄生真菌研究[J].大豆科学,2004,23(1):71-74.
FAN S C,DUAN Y X,CHEN L J.The research on the cyst entoparasitic fungi of soybean cyst nematode[J].Soybean Science,2004,23(1):71-74.
[19] FITTERS P F L,DEN BELDER E.A time-lapse technique to study the effect of fungal products on embryogenesis of nematode eggs[J].Mededelingen van de Faculteit Landbouwwetenschappen-Rijksuniversiteit Gent,1993,58(2B):751-756.
[20] 赵晓晖,许艳丽.镰刀菌发酵液对大豆胞囊线虫的抑制作用[J].大豆科学,2011,30(3):468-470,474.
ZHAO X H,XU Y L.Inhibition ofFusariumspp.fermented filtrates on soybean cyst nematode[J].Soybean Science,2011,30(3):468-470,474.
[21] 赵晓晖,许艳丽.厚垣轮枝菌发酵液对大豆胞囊线虫的抑制作用[J].大豆科技,2011,20(4):20-23.
ZHAO X H,XU Y L.Inhibition ofVerticilliumchlamydosporiumfermented filtrates on soybean cyst nematode[J].Soybean Science and Technology,2011,20(4):20-23.
[22] KHAN A,WILLIAMA K L,NEVALAINEN H K M.Effect ofPaecilomyceslilacinusprotease and chitinase on the eggshell structure and hatching ofMeloidogynejovanicajuveniles[J].Biological Control 2004,31(3):346-352.
[23] 宋 洁.连作土壤寄生真菌多样性及对大豆胞囊线虫抑制作用[D].哈尔滨:东北农业大学,2016:58-64,75-92.
SONG J.Diversity and suppressive effect of parasitic fungi on soyrean cyst nematode in soybean monoculture soil[D].Harbin: Northeast Agricultural University,2016:58-64,75-92.
[24] 鲁建聪.寄生真菌代谢物对大豆胞囊线虫抑制及防治[D].哈尔滨:东北农业大学,2015:16-28.
LU J C.Suppressness and biocontrol of parasitic fungal fermentation filtrate on soybean cyst nematode[D].Harbin: Northeast Agricultural University ,2015:16-28.
[25] 鲁建聪,许艳丽,宋 洁.土壤扰动对寄生真菌代谢物温室防治大豆胞囊线虫的影响[J].大豆科学,2016,35(1):106-111.
LU J C,XU Y L,SONG J.Effect of soil disturbance to the biological control of fermentation filtrate of parasitic fungi on soybean cyst nematode in glasshouse[J].Soybean Science,2016,35(1):106-111.
[26] 王 波,李红梅,王 碧,等.淡紫拟青霉与放线菌代谢物复配对南方根结线虫的防治[J].南京农业大学学报,2009,32(1): 55-60.
WANG B,LI H M,WANG B,et al.Biological control ofMeloidogyneincognitaby combination ofPaecilomyceslilacinusandActinomycetesspp.[J].Journal of Nanjing Agricultural University,2009,32(1): 55-60.
[27] KLEIN E,OFEK M,KATAN J,et al.Soil suppressiveness toFusariumdisease: Shifts in root microbiome associated with reduction of pathogen root colonization[J].Biological Contral,2013,103(1):23-33.
[28] JENKINS W R.A rapid centrifugal-flotation technique for separating nematodes from soil[J].Plant Disease Reporter,1964,48(9):692.
[29] ABALLAY E,PRODAN S,MRTENSSON A,et al.Assessment of rhizobacteria from grapevine for their suppressive effect on the parasitic nematodeXiphinemaindex[J].Crop Protection,2012,42:36-41.
[30] 林茂松,沈纪冬,文 玲,等.淡紫拟青霉代谢产物生物测定和生理活性物质分析[J].江苏农业学报,1999,15(4):226-228.
LIN M S,SHEN J D,WEN L,et al.Bioassay of metabolic products ofPacilomyceslilacinusand analysis of its physiologically active substance[J].Jiangsu Journal of Agricultural Science,1999,15(4):226-228.
[31] REGAIEG H,CIANCIO A,RAOUANI N H,et al.Effects of culture filtrates from the nematophagous fungusVerticilliumleptobactrumon viability of the root-knot nematodeMeloidogyneincognita[J].World Journal of Microbiology and Biotechnology,2010,26(12): 2285-2289.
[32] CHEN S Y,DICKSON D W,MITCHELL D J.Viability ofHeteroderaglycinesexposed to fungal filtrates[J].The Journal of Nematology,2000,32(2):190-197.
