常规腹腔镜与3D腹腔镜在肾癌切除术中的临床应用比较*
2018-03-17魏澎涛吕文伟孙建涛
张 寒,魏澎涛,吕文伟,孙建涛
(洛阳市中心医院,河南 洛阳,471000)
随着人们健康意识的提高及影像学技术的发展进步,肾癌尤其直径4 cm以内的肿瘤检出率显著提高;面对这一形势,外科术式亦逐渐由肾脏根治切除向部分切除转变[1]。同时腹腔镜技术成熟、术者操作熟练度提高,使得腹腔镜肾部分切除替代开放手术成为早期局限性肾癌临床治疗的首选方案,在最大限度保留肾脏功能、降低术后并发症发生方面令人满意[2-3]。近年,3D腹腔镜技术逐渐得到应用,但较常规腹腔镜技术能否在疗效、安全性方面取得优势仍无明确定论[4]。本文选择2015年3月至2017年3月收治的100例保留肾单位肾癌切除术的患者作为研究对象,分别采用常规腹腔镜与3D腹腔镜手术治疗,以探讨两种腹腔镜手术方案对行保留肾单位肾癌切除术相关临床指标、炎性应激反应及术后并发症的影响,现将结果报道如下。
1 资料与方法
1.1 临床资料 选取2015年3月至2017年3月我院收治的行保留肾单位肾癌切除术的100例患者,以随机数字表法分为对照组与观察组,每组50例。纳入标准:(1)经手术病理活检确诊肾癌;(2)18~75岁;(3)单发病灶;(4)手术切缘冰冻病理活检确认阴性;(5)方案经医院伦理委员会批准,且患者及家属签署知情同意书。排除标准:(1)有腹腔手术史;(2)淋巴结转移;(3)侵犯肾上腺;(4)合并下腔静脉癌栓;(5)合并其他系统恶性肿瘤;(6)重要脏器功能障碍;(7)血液系统疾病;(8)临床资料不全。两组患者一般资料差异无统计学意义(P>0.05);见表1。
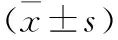

组别例数(n)性别(n)男女年龄(岁)BMI(kg/m2)位置(n)左侧右侧肿瘤直径(cm)对照组50272354.14±9.7229.54±2.7731193.12±0.82观察组50252554.67±9.8029.39±2.7328222.99±0.78χ2/t值1.270.780.931.100.83P值0.690.910.840.760.87
1.2 手术方法 采用全身静脉复合麻醉,患者取健侧卧位,腰部垫高。腋后线肋缘下做长2 cm切口,钝性分离至腹膜后,置入气囊扩张器,注入500 ml气体,建立腹膜后操作区,分别于腋前线肋缘下、髂棘上穿刺12 mm、10 mm Trocar,建立气腹,压力维持在15 mmHg。腹腔镜直视下完成腹膜外脂肪钝性分离及清除,腰肌前方与腰肌平行位置纵切肾周筋膜并达腰肌前间隙。在分离肾上极、上段输尿管的基础上,有效暴露肿物,观察周围粘连及毗邻情况后,继续游离出肾背侧及腹侧,显露肾蒂血管及肾动脉,暂时阻断肾动脉并记时。用弯剪剥除肿瘤组织及外围约0.5 cm正常肾脏组织,缝合肾脏切口并在缝线两端夹闭固定,松开肾动脉,确定创面无活动性出血后完成手术。对照组采用高清2D腹腔镜系统;观察组采用高清光学双通道3D腹腔镜系统。
1.3 观察指标 (1)记录手术时间、术中热缺血时间、术中出血量、术后胃肠蠕动恢复时间、术后拔除引流管时间及住院时间,计算平均值;(2)炎性应激指标包括促肾上腺皮质激素、皮质醇及β-内啡肽,检测仪器采用全自动生化分析仪,观察时间点为术前与术后第1天;(3)记录术后短暂血肌酐升高与发热例数,计算百分比。
1.4 统计学处理 采用SPSS 20.0软件进行数据分析;其中计量资料采用t检验,以(均数±标准差)表示;计数资料采用χ2检验,以百分比(%)表示;检验水准为α=0.05。
2 结 果
观察组手术时间、术中热缺血时间及术中出血量均显著优于对照组(P<0.05);两组患者术后胃肠蠕动恢复时间、术后拔除引流管时间及住院时间差异无统计学意义(P>0.05),见表2;观察组术后炎性应激指标水平均显著低于对照组(P<0.05),见表3。观察组术后发生短暂血肌酐升高1例(2%),对照组发热2例(4%),两组患者术后并发症发生率差异无统计学意义(P>0.05)。
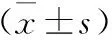

组别例数(n)手术时间(min)术中热缺血时间(min)术中出血量(ml)术后胃肠蠕动恢复时间(d)术后拔除引流管时间(d)住院时间(d)对照组50115.72±19.4824.64±5.31192.45±23.602.57±0.763.65±0.786.98±0.85观察组5084.14±11.0616.96±3.03177.36±20.572.42±0.733.57±0.716.34±0.80t值3.913.752.821.290.830.96P值0.000.000.000.670.880.82


组别促肾上腺皮质激素术前术后第1天皮质醇术前术后第1天β-内啡肽术前术后第1天对照组15.27±2.9460.92±9.47*10.95±3.7825.71±7.45*140.24±27.39182.93±36.35*观察组15.12±2.8943.05±7.16*11.03±3.8318.69±5.62*138.78±27.01159.46±30.23*t值0.773.780.614.240.703.59P值0.840.000.990.000.900.00
*P<0.05 vs.术前
3 讨 论
保留肾单位肾癌切除术是早期局限性肾癌临床治疗的首选方案之一[5];早在20世纪90年代初期即已完成全球第一例腹腔镜保留肾单位手术,随着肾脏低温保护、肾实质止血及肾脏缝合技术的不断发展,保留肾单位手术在临床取得普及应用[6]。大量临床报道显示[7-8],T1期肾癌患者行保留肾单位肾癌切除术后,随访无进展生存率与根治性肾切除术接近,但能更有效地保护肾脏功能,降低手术并发症发生率与远期心血管意外的发生风险,从而提高总体生存质量。研究证实[9],早期肾癌行保留肾单位切除术能否有效保留肾脏功能与术中热缺血时间关系密切;以往临床研究认为,术中肾脏热缺血时间应<30 min,如时间过长可对肾脏功能造成不可逆的损伤;但最新研究显示肾脏热缺血时间应进一步缩短,以20 min内最佳,这对术者的操作水平提出更大挑战[10]。国外有关肾小动脉阻断手术报道提示,术中需充分暴露肾脏血管,操作难度进一步提高[11]。
3D腹腔镜是新型微创腔镜技术,首先被应用于胆囊切除术,但早期存在头套式显示成像效果差,不利于术中操作等问题;随着手术器械的不断改进与发展,3D腹腔镜技术已实现立体视野成像,可更有效地观察组织、器官结构,空间定位更准确,有助于对血管、神经进行精细分离。
国外学者报道,3D腹腔镜手术用于保留肾单位手术可有效减少手术时间,避免术中误操作的发生;而本研究中,观察组手术时间、术中热缺血时间及术中出血量均显著优于对照组(P<0.05);同时观察组术后炎性应激指标水平均显著低于对照组(P<0.05),与以往报道基本一致[12]。操作经验相对缺乏的临床医师更容易掌握3D腹腔镜技术,术者操作过程中可看到清晰、逼真的三维立体图像,能更快速完成操作。保留肾单位手术需明确分离肾脏各层面及血管,同时在有效控制热缺血时间的条件下切除肿瘤组织;而常规腹腔镜所形成的2D图像术者需具备丰富的空间想象力、熟练的腹腔镜操作经验,且术后更易出现医源性损伤,增加了围手术期并发症发生风险[13]。而3D腹腔镜下可更清晰地观察血管、周围组织,还有助于准确判断微小血管的位置与走行,降低了术中误伤的发生率;而即使发生出血,在清晰视野中亦可提高止血准确度与止血速率[14]。而两组患者术后胃肠蠕动恢复时间、术后拔除引流管时间及住院时间差异无统计学意义(P>0.05);两组患者术后并发症发生率差异亦无统计学意义(P>0.05)。笔者认为这可能与2D、3D腹腔镜手术均具有良好的微创效应,3D腹腔镜尽管可在一定程度上减少医源性创伤,但在小样本下并未达到统计学差异,因此有待更大规模的临床研究证实。
保留肾单位肾肿瘤切除术的关键技术之一是肾血管的控制;本研究中使用腹腔镜无损伤肠钳钳夹肾蒂控制血管,其弧形与肾内侧相符,不容易损伤肾蒂,同时有助于肾脏固定,并可根据手术需要随时灵活开放或关闭血管,使肾脏得到有效保护;因术中整束控制肾蒂,因此手术时需充分暴露肾蒂,但无需完全分离肾动静脉;本研究中1例患者曾行体外冲击波碎石术,肾脏粘连明显,分离困难,肾蒂暴露不充分,钳夹肾蒂后未夹住肾动脉,导致切除肿瘤时出血较多,撤除肾蒂钳后出血减少,但手术创面不清晰导致手术困难;因此术中我们先分离暴露肾蒂、安置好肾蒂钳后在随时控制出血的情况下再分离肾脏、肿瘤,进而安全切除肿瘤并清理血肿。本研究中进行锐性切除,手术切面干净,更容易判断手术切除范围,5 min内即可完成肿瘤切除,增加了创面处理时间,减少了肾脏热缺血时间,继而降低了对肾功能的损坏。
综上所述,3D腹腔镜用于保留肾单位肾癌切除术可有效缩短手术时间,减少术中医源性创伤,降低炎性应激反应水平,安全性值得认可,价值优于常规腹腔镜手术。但鉴于纳入样本量不足、随访时间短及单一中心等因素制约,结论仍待更大规模随机对照研究证实。
[1] Ljungberg B,Bensalah K,Canfield S,et al.EAU guidelines on renal cell carcinoma:2014 update[J].Eur Urol,2015,67(5):913-924.
[2] Khoshabeh R,Juang J,Talamini MA,et al.Multiview glasses-free 3-D laparoscopy[J].IEEE Trans Biomed Eng,2012,59(10):2859-2865.
[3] Bansal RK,Tu HY,Drachenberg D,et al.Laparoscopic management of advanced renal cell carcinoma with renal vein and inferior vena cava thrombus[J].Urology,2014,83(4):812-816.
[4] Miyake H,Furukawa J,Hinata N,et al.Significant impact of R.E.N.A.L. nephrometry score on changes in postoperative renal function early after robot-assisted partial nephrectomy[J].Int J Clin Oncol,2015,20(3):586-592.
[5] 那彦群,叶章群,孙颖浩,等.2014版中国泌尿外科疾病诊断治疗指南手册[M].北京:人民卫生出版社,2014:6-10.
[6] Morgan M,Olweny EO,Cadeddu JA.LESS and NOTES instrumentation:future[J].Curr Opin Urol,2014,24(1):58-65.
[7] Minervini A,Siena G,Antonelli A,et al.Open versus laparoscopic partial nephrectomy for clinical T1a renal masses:a matched-pair comparison of 280 patients with TRIFECTA outcomes (RECORd Project)[J].World J Urol,2014,32(1):257-263.
[8] Benway BM,Bhayani SB,Rogers CG,et al.Robot assisted partial nephrectomy versus laparoscopic partial nephrectomy for renal tumors:a multi-institutional analysis of perioperative outcomes[J].J Urol,2009,182(3):866-872.
[9] Longo N,Minervini A,Antonelli A,et al.Simple enucleation versus standard partial nephrectomy for clinical T1 renal masses:perioperative outcomes based on a matched-pair comparison of 396 patients (RECORd project)[J]. Eur J Surg Oncol,2014,40(6):762-768.
[10] Fan X,Xu K,Lin T,et al.Comparison of transperitoneal and retroperitoneal laparoscopic nephrectomy for renal cell carcinoma:a systematic review and meta-analysis[J].BJU Int,2013,111(4):611-621.
[11] Luciani LG,Porpiglia F,Cai T,et al.Operative safety and oncologic outcome of laparoscopic radical nephrectomy for renal cell carcinoma >7 cm:a multicenter study of 222 patients[J].Urology,2013,81(6):1239-1244.
[12] Serni S,Vittori G,Frizzi J,et al.Simple enucleation for the treatment of highly complex renal tumors:Perioperative,functional and oncological results[J].Eur J Surg Oncol,2015,41(7):934-940.
[13] Larson JA,Johnson MH,Bhayani SB.Application of surgical safety standards to robotic surgery:five principles of ethics for nonmaleficence[J].J Am Coll Surg,2014,218(2):290-293.
[14] Minervini A,Tuccio A,Masieri L,et al.Endoscopic robot-assisted simple enucleation (ERASE) for clinical T1 renal masses:description of the technique and early postoperative results[J].Surg Endosc,2015,29(5):1241-1249.
