成年果蝇大脑解剖及荧光染色方法的研究
2018-03-08王瓜秀
王瓜秀
(湖南大学 生物学院, 长沙 410082)
果蝇作为模式生物用于各方面研究有着其他生物无法比拟的优势。近年来,果蝇大脑已广泛用于神经生物学的研究,特别是研究行为神经环路的基础[1]。果蝇基因组小,神经元数量少,神经系统相对简单,便于研究;另一方面,果蝇表现出复杂多样的行为,如学习记忆[2]、节律睡眠[3-4]、社会交往[5]及情绪[6-9]等。另外它强大的遗传操作,使得果蝇不仅在正常的功能研究中很重要,而且在一些神经系统疾病研究中也起巨大的作用,在果蝇大脑内发现的很多关键突触分子也被发现在哺乳类大脑中,比如中枢神经系统兴奋突触[10-11]。在发育生物学中,果蝇大脑中的神经元对于基因功能分析越来越常见,比如神经元极化、轴突和树突的增长,以及轴突和树突之间建立联系[12-14]等。用Gal4/UAS增强子[15]可以标记果蝇大脑内的神经元从而高分辨率分析野生型或者转基因果蝇内的基因[16]。Gal4/UAS都来源于酵母,Gal4是一个转录激活子可以识别UAS (upstream activating sequence)序列并激活UAS后面基因的表达。它们被引入果蝇组成一个二位系统,即实验时需要把两种果蝇杂交在一块,一种携带有组织特异性表达的Gal4,而另一种果蝇中则将感兴趣基因X置于UAS的下游(图1)。这样一个二位系统的最大好处就在于,当需要在不同的组织中表达时,只需将同一个UAS转基因果蝇与不同的Gal4品系杂交即可。比如一个增强型绿色荧光蛋白(EGFP)被用来检验这一套诱导表达系统的有效性,杂交后的子代中,在果蝇的脑中便显现强烈的绿色荧光[17]。
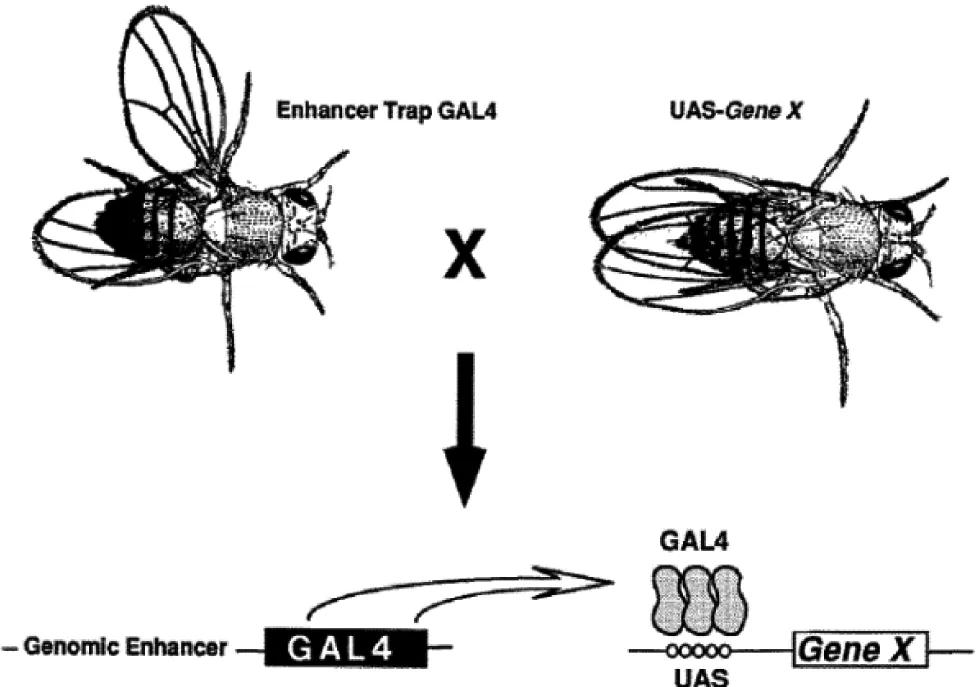
图1 果蝇GAL4/UAS表达系统
果蝇脑科学已成为全球脑科学研究领域的重中之重,但是对于成年果蝇大脑解剖的很少,对果蝇幼虫大脑解剖较多。果蝇幼虫大脑主要应用于发育生物学,但是成年果蝇大脑对于遗传和成像都会日渐重要[19]。果蝇的大脑很合适做免疫荧光技术,此种技术需要特定的一抗来与大脑中特定的蛋白质结合,然后荧光标记的二抗与一抗结合,再进行荧光扫描。相比其他技术如免疫过氧化物酶染色来说,免疫荧光的优势是荧光染色法允许高分辨率共焦或多光子成像获取果蝇大脑深层结构。这给出了具体的成年果蝇大脑的解剖及荧光染色的方法,之后给出的例子是果蝇嗅觉学习系统中的蘑菇体及神经系统中的胶质细胞。
1 材料与试剂
1.1 实验对象
野生型果蝇w1118 (isoCJ1),简称wt,白眼;GAL4驱动子:MB247,repo Gal4;UAS品系:UAS-GFP-RpL-10A ,UAS-CD8::GFP;MB247-dsred。以上果蝇品系均来自Bloomington Drosophila Stock Center。
1.2 实验耗材
精细镊子2把、普通镊子一把、解剖盘1个、载玻片1个、体视显微镜1台,共聚焦显微镜1台。
1.3 试剂
PBS缓冲液(0.01 mol/L): 2.7 mmol/L KCl (0.2 g)+4.3 mmol/L Na2HPO4(1.42 g)+1.8 mmol/L KH2PO4(0.27 g)+137 mmol/L NaCl(8 g),加800 mL去离子水充分搅拌溶解,调pH 7.4,加去离子水定容到1 L。
固定液: 4%多聚甲醛溶于PBS,用0.01 mmol/L的PBS配制,100 mL PBS加4 g多聚甲醛,磁力搅拌器加热搅拌,温度控制在60℃以下,用细粉末的多聚甲醛,不溶滴加NaOH,最后调pH 7.4左右。
Penetration/Blocking buffer:PBST 0.2%+NGS(山羊血清)10%+SA(NaN3)0.02%;PBST缓冲液:0.2%的Triton X-100+PBS;一抗: mouse anti-nc82;Rabbit anti-GFP;mouse-anti-repo;二抗:goat anti-mouse Alexa Fluor488; goat anti-rabbit AlexaFluor488。 DAPI,即用型。
2 方法
2.1 果蝇的饲养
1)将所需要的果蝇保种和传代。
2)挑选处女蝇。一般是挑UAS品系的处女蝇(哪种作为雌蝇并不影响结果),每种品系的果蝇挑选5只处女蝇即可。
3)果蝇杂交。将挑选好的UAS处女蝇与GAL4雄蝇放入一个食物瓶杂交,做好标记,放入培养室培养。每瓶最好5雄5雌(多一点更好)。在培养过程中要经常观察,是否亲本雌雄都充足,是否污染,是否有产卵、孵化等。
2.2 果蝇的解剖
1)果蝇的准备。选取所需年龄、基因型的果蝇2~4只,放置到通有持续性CO2的平台上,在体视镜下分离头和身体。
2)果蝇大脑的解剖。在盛满PBS缓冲液(最好是冰的PBS缓冲液,保证果蝇大脑解剖在低温下进行)的解剖盘中解剖,用一只镊子夹住果蝇头,防止漂浮到水面,另一只镊子拔去果蝇的口器,漏出一个小洞,随后用镊子A按住头部,镊子B的一个镊瓣从这个小孔的中间穿入并贴着果蝇大脑内壁达到一边的眼睛,然后镊子A迅速上来和镊子B 一起小心扯去包裹在其上面的角质膜,另一半也同样操作。此时果蝇大脑正面完全浮现出来,果蝇成年大脑上有很多气管和白色的丝,要小心清除脑组织外面的气管和其他脏东西(注意:扯角质膜的力不能太大,以免大脑被扯破;清除气管时一定要小心,不要将大脑弄坏)。
3)取出果蝇。将果蝇从解剖盘移到小孔板中(此处采取的方法是用200 μL的移液枪调到很小的量程然后吸出)。

图2 果蝇大脑解剖图
A:果蝇大脑的概要图,前卫像[10],灰色的区域就是果蝇大脑所在区域,红色标记为果蝇嗅觉附件;B~E:果蝇解剖过程图;F:解剖出来的果蝇大脑
A:Schematic of theDrosophilahead (anterior view), with the brain in dark gray. Olfactory appendages are shown in red.(Joy S Wu & Liqun Luo,2006);B-E:The process ofDrosophilabrain dissection;F:The Drosophila brain after dissection
2.3 果蝇大脑免疫染色
1)固定。取出事先分装好的4%的PA(多聚甲醛),将大脑固定20~30 min(多聚甲醛覆盖大脑即可,但要小心大脑干掉,多聚甲醛有剧毒,戴手套操作)。
2)抽真空。吸去4%的PA,加入PBST缓冲液(0.2% Triton x-100+4% PA),置于抽真空的干燥器内,抽取真空2次,每次10 min。抽真空的目的是抽取果蝇气管内的空气,使成像效果更好。
3)封闭。弃去PBST,加入适量Penetration/Blocking buffer,4℃处理2 h,以封闭非特异性结合位点。
4)孵育一抗。弃去Penetration/Blocking buffer,将一抗以1∶100的比例在Penetration/Blocking buffer中稀释后,加到放置大脑的皿中,放到4℃冰箱孵育过夜。
5)孵育二抗。弃去一抗的孵育液,用PBST洗3遍,每次10 min,然后加入以1∶100的比例在Penetration/Blocking buffer中稀释的二抗,加到放置大脑的皿中,放到4℃冰箱孵育过夜。可在周围添加水分防止果蝇大脑干燥(超过6 h即可);用铝箔覆盖,减少荧光漂白。
6)弃去二抗的孵育液,用PBST洗3遍,每次10 min。
7)加入DAPI,室温下孵育10 min。
8)弃去DAPI,用PBST洗3遍,每次10 min。
9)封片:用两层中间有孔的圆形标签纸贴在一起做个小槽,滴加VECTASHIELD mounting media,用微量移液枪将大脑吸出放在载玻片上,盖上盖玻片,然后用指甲油封片。
2.4 共聚焦显微镜检测果蝇脑荧光图谱

图3 MB247Gal4与UAS-GFP-RpL-10A,repoGAL4品系与UAS-CD8::GFP;MB247-dsred杂交的果蝇大脑中表达的荧光图谱
Fig 3 Immunofluorescence of MB247Gal4>UAS-GFP-RpL-10A and repo Gal4>UAS-CD8::GFP;MB247-dsred flies
A、B、E为果蝇大脑蘑菇体形状,A和B用的mouse anti-nc82抗体;C~H为果蝇大脑神经胶质细胞,C使用的是anti-repo抗体,D使用的anti-GFP抗体,F是染的DAPI(染所有细胞核),G为C、D、E、F的合并图,H为放大倍数后的图
(A,B,E) Structure of mushroom body inDrosophila,mouse anti-nc82 was used in A andB(C-H)Glial cells ofDrosophila;mouse anti-repo was used in C; Rabbit anti-GFP antibody was used in D.(F)DAPI was used in theDrosophilabrain.(G)The merge of C,D,E,F.(H)Enlarged view of G. Scale bars,100μm
3 结语
通过描述的解剖果蝇大脑及对果蝇大脑免疫染色的方法可以看到成年果蝇大脑内蘑菇体和胶质细胞结构,可以对单个果蝇大脑单个神经元染色。另外应注意几个事项:
在解剖的时候,果蝇大脑会漂浮在缓冲液里而不沉下去,这可能是空气进入果蝇大脑气管所导致的,所有解剖的时候要小心地去掉这层气管;解剖最好在冰上进行,果蝇大脑固定的时间最好不超过1 h,因为会导致组织的降解,固定的时间过长也会导致图像模糊;成像的时候背景信号过强,这可能是二抗稀释的不够造成的,所以二抗尽量浓度低一点;荧光信号变弱,可能是因为装片暴露在灯光下或者荧光下过长时间导致了荧光猝灭,所以要保证样品不要在房间放太久;样品置于盛放冰的PBS解剖盘中解剖时,可保持果蝇大脑不涣散,所以要使解剖过程处于较低温度。
该方法除了可作为果蝇脑科学研究的新解剖技术外,由于能够完整地收集果蝇大脑,能够直接观察到头部大脑处于果蝇头部的位置,因此也可作为教学上果蝇解剖的一种新方法,从而增强学生对脑部结构的认识。
对于果蝇大脑研究领域来说,荧光染色显得尤为重要,这也可以作为一种基础实验为以后各种实验做铺垫。
[1]KAZAMA H. Systems neuroscience inDrosophila: conceptual and technical advantages[J]. Neuroscience, 2015, 296: 3-14.
[2]WEIR P T, DICKINSON M H. Functional divisions for visual processing in the central brain of flyingDrosophila[J]. Proceedings of the National Academy of Sciences, 2015, 112(40): E5523-E5532.
[3]DUBOWY C, SEHGAL A. Circadian rhythms and sleep inDrosophilamelanogaster[J]. Genetics, 2017, 205(4): 1373-1397.
[4]DONELSON N C, SANYAL S. Use ofDrosophilain the investigation of sleep disorders[J]. Experimental Neurology, 2015, 274: 72-79.
[5]NILSEN S P, CHAN Y B, HUBER R, et al. Gender-selective patterns of aggressive behavior inDrosophilamelanogaster[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(33): 12342-12347.
[6]VOSSHALL L B. Into the mind of a fly[J]. Nature, 2007, 450(7167): 193-197.
[7]ANDERSON D J, ADOLPHS R. A framework for studying emotions across species[J]. Cell, 2014, 157(1): 187-200.
[8]邱 蓉, 孙元捷, 刘 力, 等. 果蝇复杂脑功能研究进展[J]. 生物化学与生物物理进展, 2016, 43(4): 330-336.
[9]田庆平. 适于快速高分辨成像的果蝇全脑样品制备方法研究[D]. 武汉:华中科技大学,2015.
[10]BUDNIK V. Synapse maturation and structural plasticity atDrosophilaneuromuscular junctions[J].Current Opinion in Neurobiology, 1996, 6(6): 858-867.
[11]SMITH R, TAYLOR J P. Dissection and imaging of active zones in theDrosophilaneuromuscular junction[J]. JoVE (Journal of Visualized Experiments), 2011(50):e2676.
[12]LEE T, LUO L. Mosaic analysis with a repressible cell marker for studies of gene function in neuronal morphogenesis[J]. Neuron, 1999, 22(3): 451-461.
[13]WU J S, LUO L. A protocol for mosaic analysis with a repressible cell marker (MARCM) inDrosophila[J]. Nature Protocols, 2006, 1(6): 2583-2589.
[14]WU J S, LUO L. A protocol for dissectingDrosophilamelanogasterbrains for live imaging or immunostaining[J]. Nature Protocols, 2006, 1(4): 2110-2115.
[15]DEL VALLE RODRGUEZ A, DIDIANO D, DESPLAN C. Power tools for gene expression and clonal analysis inDrosophila[J]. Nature Methods, 2012, 9(1): 47-55.
[16]KEENE A C, WADDELL S.Drosophilaolfactory memory: single genes to complex neural circuits[J]. Nature Reviews Neuroscience, 2007, 8(5): 341-354.
[17]AWASAKI T, LAI S L, ITO K, et al. Organization and postembryonic development of glial cells in the adult central brain ofDrosophila[J]. Journal of Neuroscience, 2008, 28(51): 13742-13753.
[18]BRAND A H, PERRIMON N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes[J]. Development, 1993, 118(2): 401-415.
[19]REIN K, ZÖCKLER M, MADER M T, et al. TheDrosophilastandard brain[J]. Current Biology, 2002, 12(3): 227-231.
