云南省疟疾报告病例恶性疟原虫PfKelch13基因突变与青蒿素耐药性的关联性分析
2018-03-08孙艾明陈梦妮徐艳春毛祥华
孙艾明, 王 剑, 董 莹, 陈梦妮, 徐艳春, 邓 艳, 毛祥华
(1. 大理大学 病原与媒介生物研究所普洱分部,普洱 665000; 2. 云南省寄生虫病防治所 云南省疟疾研究中心 云南省虫媒传染病防控研究重点实验室,普洱 665000)
青蒿素是中国药学工作者20世纪70年代从菊科植物黄花蒿叶中提取分离到的倍半萜内酯类化合物,是一种高效、迅速且副作用小的新型抗疟药[1-2]。世界卫生组织推荐以青蒿素联合疗法(ACTs)作为治疗恶性疟疾最有效的一线抗疟药,在降低疟疾相关疾病的发病率和死亡率中起到了不可或缺的作用,显著降低了全球范围内的疟疾负担[3]。但自2008年首次在柬埔寨地区报道青蒿素耐药性虫株以来[4],东南亚的缅甸、泰国边境等地也陆续检测到青蒿素耐药性虫株[4-9],目前,柬埔寨、老挝、缅甸、泰国及我国云南省处于青蒿素耐药性泛滥的中心地带[10-11]。云南省的恶性疟流行区主要局限在中缅边境地区[12],其中80%以上的恶性疟疾病例在缅甸境内感染形成,而缅甸大部分地区均为青蒿素耐药性恶性疟流行区[13],青蒿素使用历史已超过30年[14],持续的青蒿素类耐药性恶性疟原虫的传播将对全球疟疾控制和消除造成严重威胁。
青蒿素及其衍生物是恶性疟原虫磷脂酰肌醇-3-激酶(Plasmodiumfalciparumphosphatidylinositol-3-kinase,PfPI3K) 的强效抑制剂[15],Mbengue等[16]发现,PfKelch13的某些位点突变,可通过PfPI3K的信号变化,介导青蒿素耐药性产生。Imwong等[17]、Wang等[18]和Huang等[19]进一步证实,缅甸恶性疟原虫分离株PfKelch13基因kelch结构域的F446I突变型基因,对青蒿素耐药性产生有一定影响,但研究均未对两者间的关联性进行分析,针对我国云南省的恶性疟报告病例的类似研究更是匮乏。本研究采用群体遗传学评价与遗传关联性研究相结合的方法,对恶性疟原虫不同种群分离株的PfKelch13基因分化进行了分析,间接评估了云南省恶性疟原虫分离株PfKelch13基因突变与青蒿素耐药性之间的关联程度,为恶性疟原虫青蒿素耐药性分子监测标志提供了一定的理论依据。
1 材料
1.1 研究对象及血样采集
1.1.1 云南省疟疾报告病例血样来源
实验所采用的病例血样来源于2013年1月—2015年12月,经云南全省卫生医疗机构参照《中华人民共和国卫生行业标准——疟疾诊断标准(WS259—2006)》[20]和经基因检测方法[21]确诊,属于“中国疾病预防控制信息系统”登记管理的恶性疟疾报告病例,采其0.6 mL静脉血制作滤纸血膜,采集范围见图1。通过流行病学调查判定其感染来源地,疟疾发作潜伏期之前无云南省外流动史者为云南本地病例,有缅甸、非洲国家流动史者为缅甸、非洲感染病例。
1.1.2 缅甸境内病例血样来源
实验所采用的病例血样来源于2009年1月—2012年12月,经显微镜检查和基因检测确诊,且长期定居缅甸拉咱及周边的缅籍恶性疟现症病例,采其静脉血0.6 mL制作滤纸血膜,采集范围见图1。
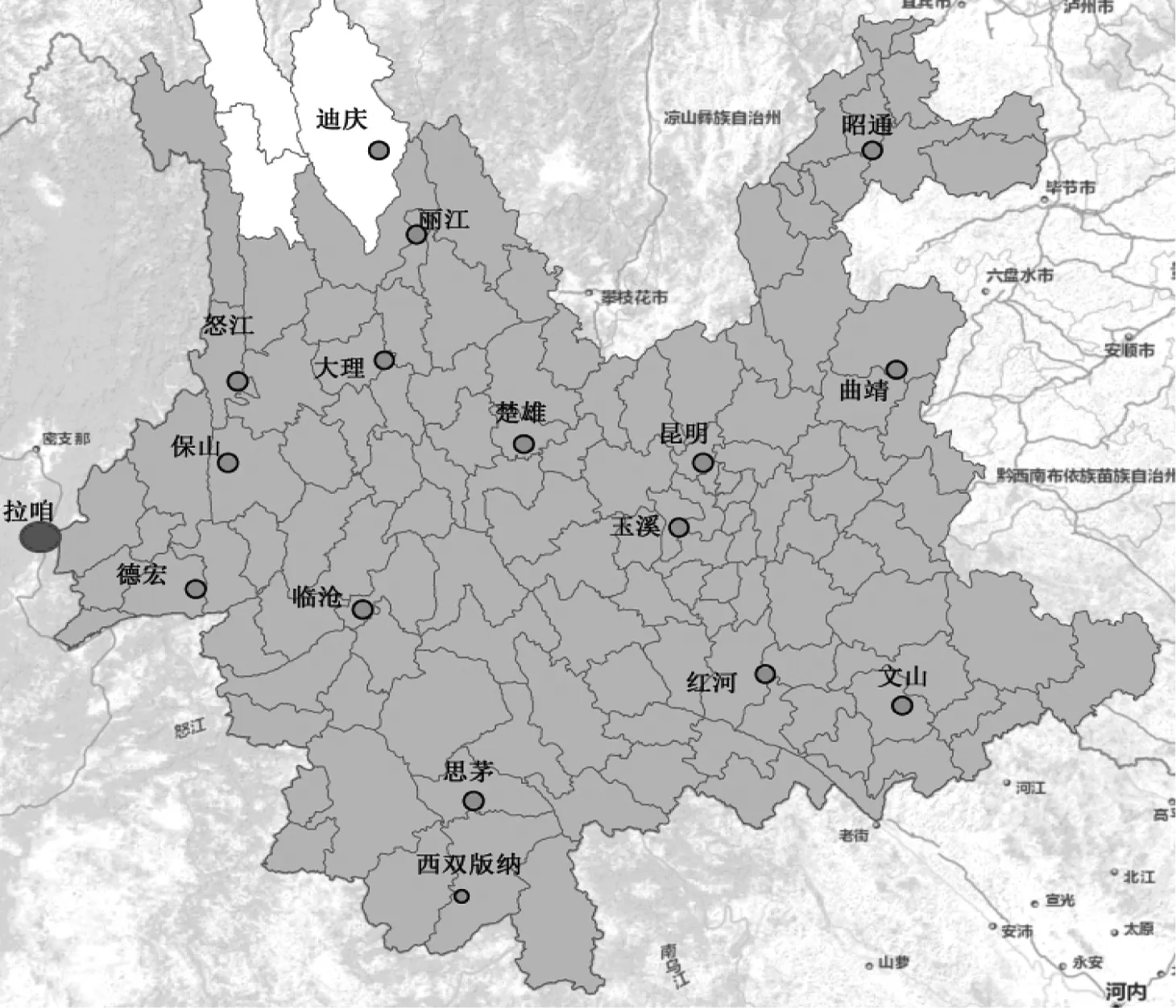
图1 本研究恶性疟现症病例血样采集范围
Fig 1 The range of blood sample collection ofPlasmodiumfalciparumin this study
注:“”为云南疫情病例血样采集中心;“”为缅甸境内血样采集中心;“”为地州、县政府驻地
1.2 青蒿素敏感性体内试验
缅甸境内病例血样年龄为2~60岁,2周内无抗疟药或/和抗菌药服药史者同时接受青蒿琥酯耐药性体内测试。药物及治疗方案参考文献[22],疗效评价采用参考文献[23],以上内容均获得病人知情和签字认可。
2 方法
2.1 疟原虫DNA提取
参照试剂盒说明书提取基因组DNA,-20℃保存备用。
2.2 巢式PCR扩增疟原虫PfKelch13基因kelch结构域
参照文献[8,24-25]的引物和条件扩增PfKelch13基因kelch结构域,目的基因片段749~850 bp[26]。
2.3 PfKelch13基因序列多态性及突变位点进化分析
测序结果在DNAStar Lasergene 7.1拼接或转换后经NCBI BLAST与恶性疟原虫PfKelch13基因参比序列(ID:PF3D7-1343700)进行比对,比对正常的DNA序列在MEGA5.04软件进行氨基酸转换和文件格式调整。用Clustal X2.1软件多重比对DNA序列,确认错义突变和同义突变。PfKelch13基因kelch结构域446、578、556、676、458、574、16、469、449、566、538、481、483、492和76等15个等位基因位点的野生型基因为“F446A578E556A676N458P574S16C469G449V566G538A481F483L492Y76”。用Arlequin 3.01软件分析基因片段单倍型及期望杂合度(He)、基因多态系数(H)和群体间遗传分化指数(Fst)等,Fst采用分子方差分析法(AMOVA)计算,检验水平为α=0.05。
2.4 统计分析
采用Epi Data 3.1软件建立数据库,在IBM®SPSS®21软件进行统计分析,对PfKelch13基因kelch结构域突变型构成比进行χ2检验,检验水平为α=0.05,并计算恶性疟原虫分离株PfKelch13基因kelch结构域突变型与青蒿素治疗失败的比值比(OR)及其95%CI。
3 结果
3.1 样本信息及PfKelch13基因kelch结构域PCR扩增
云南省恶性疟疾报告病例血样202份,其中192份PfKelch13基因kelch结构域PCR扩增阳性,测序成功190例。缅甸境内恶性疟病例血样382份, 289份PCR扩增阳性,测序成功194例,其中,包括60例接受青蒿琥酯疗效评价病例血样的53条序列,样本使用流程如图2。
恶性疟原虫分离株的PfKelch13基因kelch结构域PCR扩增产物如图3,在750 bp处可见电泳条带。
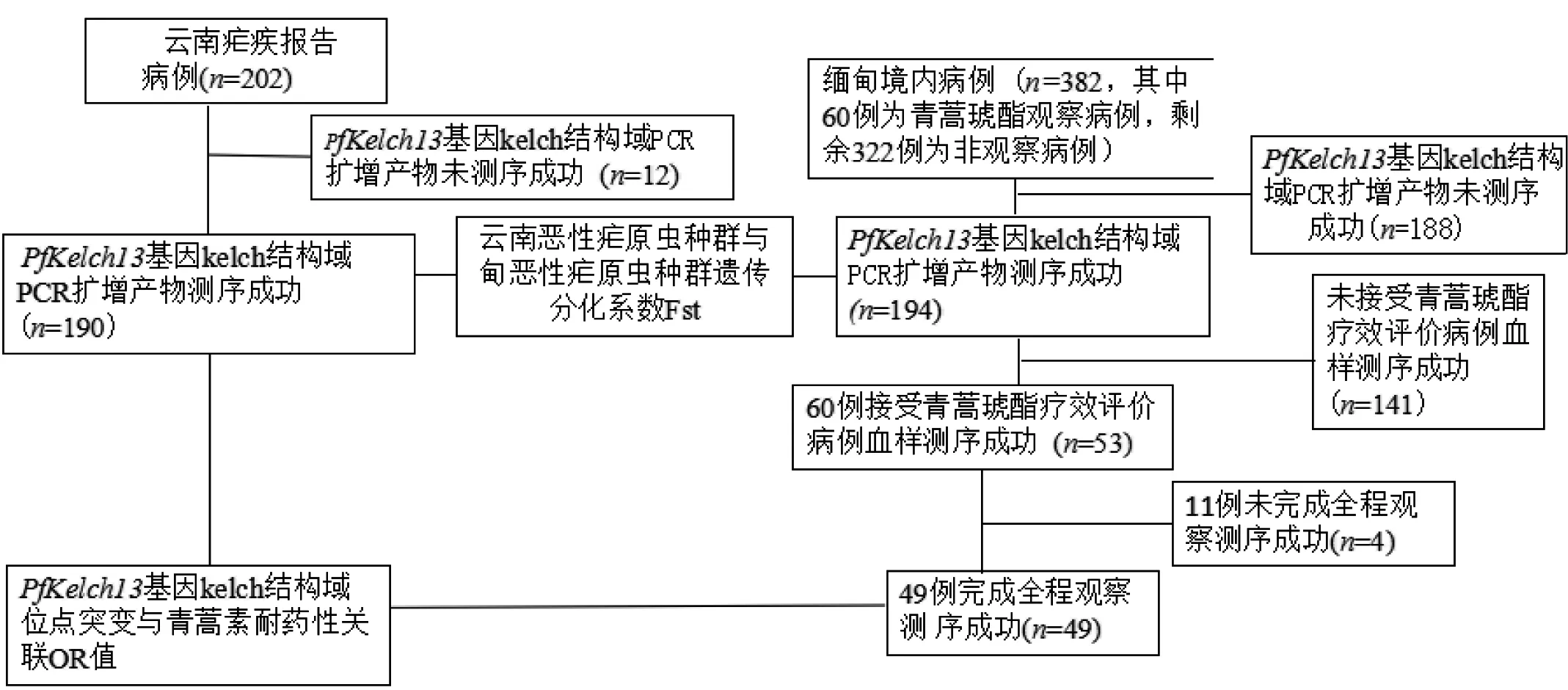
图2 本研究恶性疟现症病例的血样使用流程图
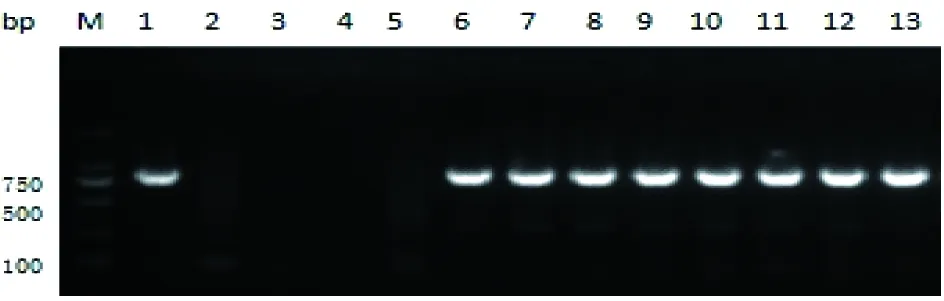
图3 恶性疟现症病例血样PfKelch13基因kelch结构域巢式PCR扩增电泳图
M:DNA标志物;1:恶性疟原虫阳性对照;2:间日疟原虫阳性对照;3:第1轮PCR阴性对照;4:第2轮PCR阴性对照;5:阴性样本;6~13:阳性样本
3.2 PfKelch13基因突变型分析
190例测序成功的云南省疟疾报告病例DNA序列中,66例序列检出10种氨基酸突变型,均为单位点错义突变,突变率 34.7%(66/190),10种氨基酸突变型为F446I、A578S、N458Y、P574L、A676D、G449A、C469Y、V566I、E556D和S16L,各型突变所占比如图4。
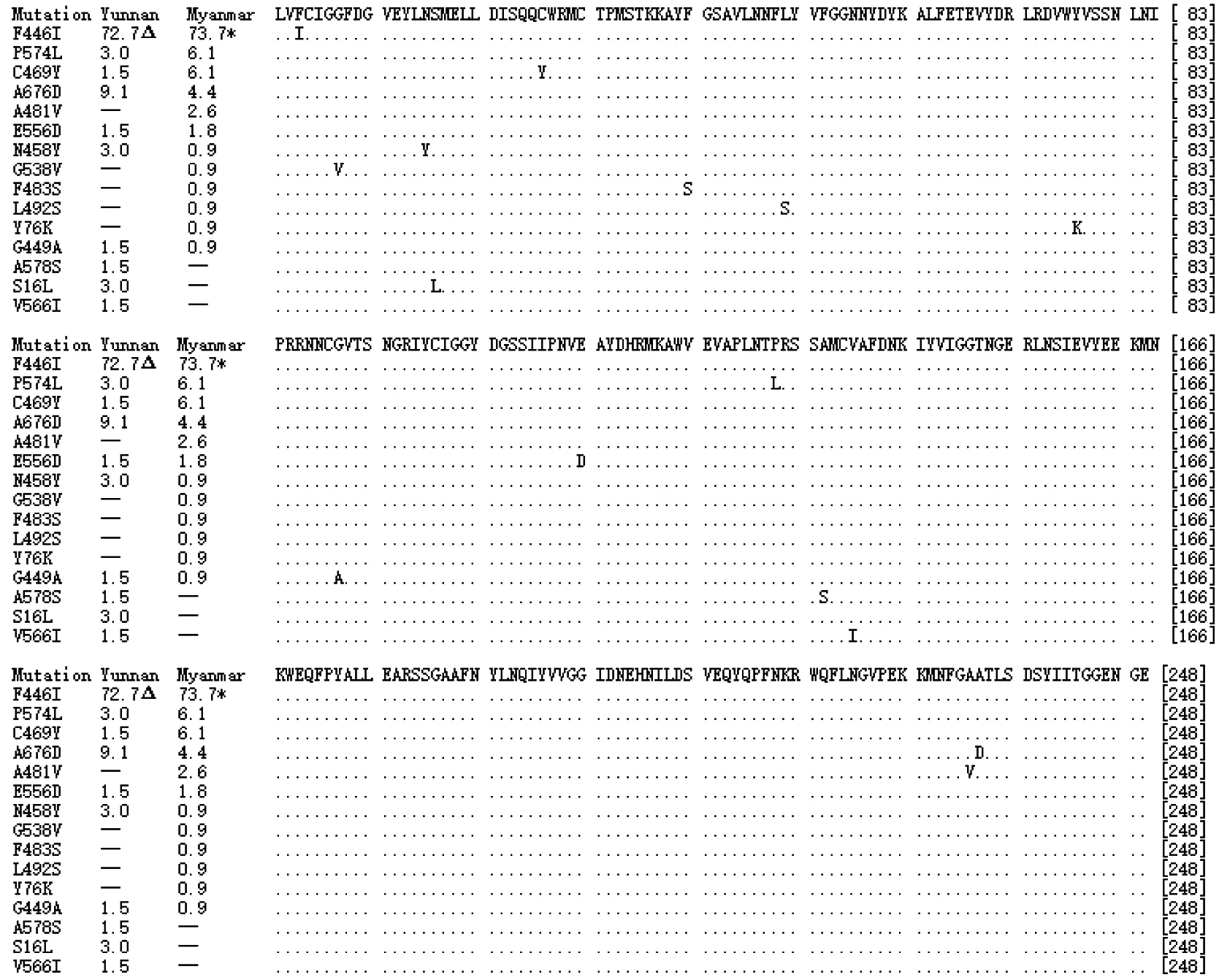
图4 云南省和缅甸两地感染恶性疟原虫PfKelch13基因kelch结构域氨基酸编码突变类型及比例(n=16)
“Δ”:云南分离株构成比;“*”:缅甸分离株构成比
测序成功的194例缅甸境内病例DNA序列中,114例序列检出12种氨基酸突变型,均为错义突变,突变率为58.8%(114/194),且每例序列均为单一突变。12种突变型为F446I、P574L、C469Y、A676D、A481V、E556D、N458Y、F483S、L492S、G538V、G449A和Y76K,各型突变所占比例如图4。
3.3 PfKelch13基因突变及单倍型分析
测序成功的云南省病例血样的PfKelch13基因kelch结构域DNA序列共有13种单倍型,He、H分别为0.0481和0.5183,缅甸境内病例血样的PfKelch13基因kelch结构域DNA序列共有19种单倍型,He、H分别为0.0440和0.6510。两地恶性疟原虫种群间的Fst=0.0410(P<0.05)(见表1)。来自群体内的变异占95.90%,群体间变异比例占4.10%,群体内遗传变异大于群体间遗传变异。
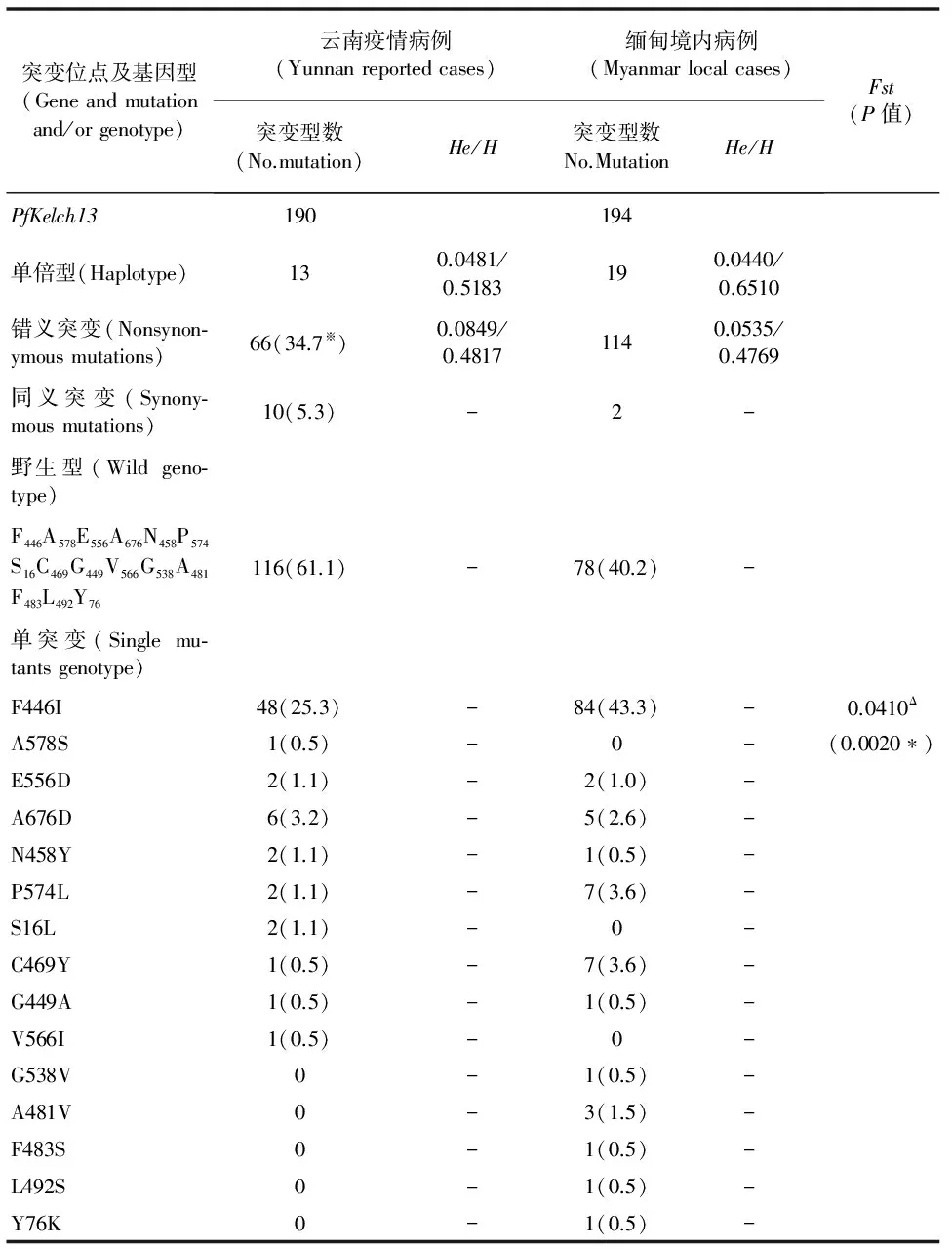
表1 云南及缅甸境内恶性疟病例分离株PfKelch13基因 kelch结构域的等位多态性分析
“※”:百分数; “Δ”:1 组与2组配对分析; “*”:P<0.05
3.4 PfKelch13基因kelch结构域位点突变与青蒿素耐药性关联程度分析
60例缅甸境内病例接受青蒿琥酯疗效评价,其中49例完成全程随访。完成全程随访病例中,28例病例血样检出PfKelch13基因kelch结构存在5种位点突变,突变率为57.1%(28/49),突变型为F446I 、C469Y 、A676D 、N458Y 和P574L,所占比例分别为46.9%(23/49)、4.1%(2/49)、2.0%(1/49)、2.0%(1/49)和2.0%(1/49)。
缅甸境内恶性疟病例青蒿琥酯治疗失败与PfKelch13基因kelch结构域突变位点间的关联程度分析如表2。

表2 缅甸境内病例恶性疟原虫分离株PfKelch13基因kelch结构域突变位点与青蒿素耐药性关联程度分析
4 讨论
本研究中,尽管云南报告病倒恶性疟原虫种群与缅甸境内病例恶性疟原虫种群PfKelch13基因的位点突变类型、单倍型种类及其数量均存在不同(表1),但两种群间的遗传分化系数较小(Fst=0.0410,P<0.05),且群体内变异贡献率占95.9%,群体间变异贡献率只占4.1%,故可认为云南及缅甸境内恶性疟疾病例种群具有相似的遗传背景,因而以缅甸境内病例虫株求得的PfKelch13基因突变对青蒿素耐药性的风险程度(表2),可以用于评估云南疟疾报告病例PfKelch13基因突变与青蒿素耐药性之间的关联性,即感染PfKelch13基因F446I突变型或感染所有突变型位点的恶性疟虫株病例,其青蒿素治疗无效的风险是感染PfKelch13基因野生型恶性疟原虫的1.640倍(95%CI:1.284~2.095)和1.840倍( 95%CI:1.412~2.398),其中,单一F446I突变型位点是PfKelch13基因的主导型突变(图4),与Tun等[14]、Wang等[18]、Huang等[19]和Ye等[27]的研究结果一致。虽然本研究中的关联性评价并不能完全揭示基因突变与耐药性产生的因果关系,但仍提示PfKelch13基因多态性突变位点特别是F446I突变位点可以作为云南地区的恶性疟原虫青蒿素耐药性分子水平的监测标志。
本研究的局限性也不容忽视。首先,我们进行遗传关联性研究的样本量仍不足够大,PfKelch13基因突变的危险程度如何,需进一步进行论证;其次,本研究中接受表型测试的对象为缅甸境内的外国人种,与云南本地疟疾报告病例之间可能存在遗传异质性,加之本实验中的表型研究地区——缅甸拉咱仍为疟疾高度流行区,因此,不同恶性疟流行区使用本研究所获得的微观评价指标时须谨慎理解。下一步除需扩大同质研究样本量外,可适当开展相关的系统分析研究,以期高效揭示PfKelch13基因突变与青蒿素耐药性之间的遗传关联性。
致谢:感谢云南省德宏、保山、昆明、普洱、临沧、大理、怒江、丽江、西双版纳、玉溪、楚雄、红河、昭通、迪庆、曲靖、文山16个州/市级及其辖区内各县级疾病预防控制中心的倾力支持。
[1]TU Y. The discovery of artemisinin (qinghaosu) and gifts from Chinese medicine[J]. Nat Med, 2011, 17(10):1217-1220.
[2]MILLER L H, SU X. Artemisinin: discovery from the Chinese herbal garden[J]. Cell, 2011, 146(6):855-858.
[3]张逸龙,潘卫庆.恶性疟原虫对青蒿素产生抗性的研究进展[J].中国寄生虫学与寄生虫病杂志,2015,33(6):418-424.
[4]NOEDL H, SE Y, SCHAECHER K, et al. Evidence of artemisinin-resistant malaria in western Cambodia[J]. N Engl J Med, 2008, 359(24): 2619-2620.
[5]AMARATUNGA C, SRENG S, SUON S , et al. Artemisinin-resistantPlasmodiumfalciparumin Pursat province, western Cambodia: a parasite clearance ratestudy [J]. Lancet Infect Dis, 2012, 12(11):851-858.
[6]PHYO A P, NKHOMA S, STEPNIEWSKA K, et al. Emergence of artemisinin-resistant malaria on the western border of Thailand: a longitudinal study [J]. Lancet, 2012, 379(9830):1960-1966.
[7]KYAW M P, NYUNT M H, CHIT K, et al. Reduced susceptibility ofPlasmodiumfalciparumto artesunate in southern Myanmar [J]. PLoS One, 2013, 8(3):e57689.
[8]ASHLEY E A, DHORDA M, FAIRHURST R M, et al. Spread of artemisinin-resistance inPlasmodiumfalciparummalaria[J]. N Engl J Med, 2014, 371(5):411-423.
[9]DONDORP A M, NOSTEN F, YI P, et al. Artemisinin-resistance inPlasmodiumfalciparummalaria [J]. N Engl J Med, 2009, 361(5):455-467.
[10]WOOTTON J C, FENG X, FERDIG M T, et al. Genetic diversity and chloroquine selective sweeps inPlasmodiumfalciparum[J]. Nature, 2002, 418(6895): 320-323.
[11]GETHING P W, PATIL A P, SMITH D L, et al. A new world malaria map:Plasmodiumfalciparumendemicity in 2010 [J]. Malar J, 2011, 10:378.
[12]周水森, 王 漪, 房 文, 等. 2008年全国疟疾形势[J]. 中国寄生虫学与寄生虫病杂志, 2009, 27(6): 455-457.
[13]TUN K M, IMWONG M, LWIN K M, et al. Spread of artemisinin-resistantPlasmodiumfalciparumin Myanmar: across-sectional survey of the K13 molecular marker [J]. Lancet Infect Dis, 2015,15(4):415-421.
[14]李华宪, 陈国伟, 杨沅川, 等.云南省2001-2005 年疟疾疫情分析[J].中国寄生虫学与寄生虫病杂志, 2008, 26(1):46-49.
[15]MOK S, ASHLEY E A, FERREIRA P E, et al. Population transcriptomics of human malaria parasites reveals the mechanism of artemisinin resistance[J]. Science, 2005, 347:431-435.
[16]MBENGUE A, BHATTACHARGRR S, PANDHARKAR T,et al. A molecular mechanism of artemisinin resistance inPlasmodiumfalciparummalaria[J]. Nature , 2015, 520:683-687.
[17]TUN K M, JEEYAPANT A, IMWONG M, et al.Parasite clearance rates in upper Myanmar indicate a distinctive artemisinin-resistance phenotype: a therapeutic efficacy study [J]. Malar J, 2016, 15:185.
[18]WANG Z, SHRESTHA S, LI X, et al. Prevalence of K13-propeller polymorphisms inPlasmodiumfalciparumfrom China-Myanmarborder in 2007 2012 [J]. Malaria J, 2015, 14: 168.
[19]HUANG F, TAKALA-HARRISON S, JACOB C G, et al. A single mutation in K13 predominates in Southern China and is associated with delayed clearance ofPlasmodiumfalciparumfollowing artemisinin treatment [J]. J Infect Dis, 2015, 212(10):1629-1635.
[20]中华人民共和国卫生部. 中华人民共和国卫生行业标准:疟疾诊断标准(WS259—2006)[S]. 北京: 人民卫生出版社, 2006.
[21]董 莹, 毛祥华, 陈梦妮, 等. 2012—2014年云南省疟疾实验室诊断质量分析[J]. 中国寄生虫学与寄生虫病杂志, 2015, 33(3): 191-195.
[22]王 剑, 徐艳春, 孙晓东, 等. 缅甸北部三热病人的三日疟诊断与治疗分析[J]. 中国病原生物学杂志, 2016, 11(8): 723-727.
[23]WHO. Monitoring antimalarial drug resistance: Report of a WHO consultation [R]. Geneva: World Health Organization, 2002.
[24]NYUNT M H, HLAING T, OO H W, et al. Molecular assessment of artemisinin-resistance markers, polymorphisms in the K13 propeller and a multidrug-resistance gene, in eastern and western border areas of Myanmar [J]. Clin Infect Dis, 2014, 60(8): 1208-1215.
[25]孙艾明,董 莹,陈梦妮,等. 云南省恶性疟原虫青蒿素耐药性相关基因K13序列多态性的分析[J].中国寄生虫学与寄生虫病杂志,2016,34(4):339-345.
[26]WERNSDORFER W H,LANDGRAF B,WIEDERMANN G,et al. Chloroquine resistance ofPlasmodiumfalciparum: a biological advantage[J]. Trans R Trop Med Hyg, 1995, 89(1):90-91.
[27]YE R, HU D, ZHANG Y, et al. Distinctive origin of artemisinin resistantPlasmodiumfalciparumon the China-Myanmar border[J]. Sci Rep, 2016, 6:20100.
