苦参热应激蛋白HSP17.8的体外表达及生物信息学分析
2018-03-08赵德蕊胡雪瑞吴家文
廖 怡, 赵德蕊, 胡雪瑞, 吴家文
(1. 安徽中医药大学 研究生院,合肥 230012; 2. 安徽中医药大学 新安医学教育部重点实验室 科研实验中心, 合肥 230038; 3. 安徽中医药大学 药学院, 合肥 230012; 4. 安徽道地药材品质提升协同创新中心, 合肥 230038; 5. 安徽中医药科学院, 合肥 230038)
当生物有机体受到环境中的应激原(一般为热刺激)刺激后,可以产生高度保守的防御性蛋白质,从而产生对抗外界逆境因素的保护性反应,这些防御性蛋白质称为热应激蛋白(heat stress proteins, HSPs),又名热休克蛋白(heat shock proteins, HSPs)。一般根据相对分子质量和同源程度将热应激蛋白分为HSP100家族、HSP90(83~90 ku)家族、HSP70(66~79 ku)家族、HSP60家族以及小分子HSP(15~30 ku)家族[1-2]。其中研究最深入的是HSP90和HSP70家族,他们具有高度保守性,在机体正常情况下低量表达,当遇到外界不利因素的刺激后,可以大量表达。
热应激蛋白是进化上高度保守、功能上至关重要和在生物体内与抗逆紧密相关的一类存在于整个生物界(从低等原核到高等动植物)的十分重要的蛋白质[3]。
对动物而言,高温、低氧、创伤、重金属离子等逆境因素可以诱导热应激蛋白的产生,以维护细胞生存和内环境的稳定。例如鲍恩东等[4]研究发现HSP70在急性热应激损伤的肉鸡心肌纤维胞浆内分布密集,说明HSP70的含量高低对心肌组织功能有影响且在心肌纤维内行使重要生理功能。Yu等[5]发现用2-去氧葡萄糖饲养的老鼠因缺血而引起缺氧时,HSP70的表达量会提高,从而减轻因低氧对机体的损伤,起到保护作用。Wang等[6]发现注射HSP47-反义脱氧核苷酸对手术创伤的新生鼠可有效抑制HSP47的表达及皮肤I型胶原的累积,且有效减轻创面愈合所需的胶原纤维紊乱。表明HSP47-反义脱氧核苷酸可能具有抑制皮肤瘢痕形成的治疗潜力。沈骅等[7]发现鲫鱼肝脏内HSP70的诱导表达受重金属离子Cu2+、Zn2+浓度的影响显著,表明HSP70可作为重金属污染物生物标志物。
对植物而言,当外界环境温度比正常生长温度高10℃左右时,植物体内就会有热应激蛋白的产生。植物热应激蛋白对植物在逆境胁迫下引起的伤害具有很大的减缓作用,是植物短期适应逆境的必需组成成分,相关逆境因素如高温、冷冻、干旱等均能诱发HSPs产生。陈忠等[8]发现高温诱导豌豆幼苗中热激蛋白Hpc60的产生对抗坏血酸过氧化物酶具有保护作用,表明高温下植物产生的热应激蛋白可以对机体重要的酶或蛋白质起保护作用从而使植物获得耐热性。近年的研究表明,在低温刺激下,也能诱导HSPs的产生,例如HSPs和植物耐冷性的直接关系由Collins等[9]首先证实。虽然冷热应激在植物体内属于不同的反应过程,但这两种逆境都可以诱导热应激蛋白的表达。Coca等[10]研究发现向日葵受水分胁迫时小分子热应激蛋白HSPl7.6和HSPl7.9基因高表达,且体内水分丧失程度与其mRNA表达水平呈正性相关。
以上研究均表明应激蛋白的产生与生物外界逆境密切相关,研究应激蛋白对探索降低逆境对动植物的伤害和研究动植物体内重要的抗逆机制有着非常重要的理论和实践意义。
中药苦参(SophoraflavescentsAit)是一种有着悠久历史的豆科槐属植物。具有清热燥湿,杀虫和利尿作用,在临床上,它主要用于热痢,便血,黄疸尿闭,赤白带下,外阴肿胀瘙痒,湿疹,外治滴虫性阴道炎[11]。据报道,苦参具有多种药理活性,如抗肿瘤[12],抗菌,抗炎和镇痛作用[13]。
本研究中,作者以苦参为研究对象首次克隆了苦参小分子量的应激蛋白hsp17.8的编码序列,在大肠杆菌内实现了体外表达,并进一步对其理化性质、进化关系及结构特点等进行了分析。
1 材料
1.1 植物材料、菌株与载体
新鲜苦参组织取自安徽中医药大学药物园,由杨青山老师鉴定;大肠杆菌E.coliDH5α、表达载体pET22b(+)由中国科学技术大学生命科学院施蕴渝教授惠赠;大肠杆菌E.coliBL21(DE3)、扩增载体pMD19-T Vector分别购自北京索莱宝科技有限公司、TaKaRa公司。
1.2 各种酶、试剂及试剂盒
rTaqDNA聚合酶、限制性核酸内切酶NdeⅠ、XhoⅠ、T4 DNA连接酶,DL2000 DNA Marker、异丙基-β-D-硫代吡喃半乳糖苷(isopropyl-β-D-1-thiogalactoside, IPTG),蛋白Marker均购自TaKaRa公司。RNA提取试剂盒[E.Z.N.A Plant RNA Kit (50)]为OMEGA产品、逆转录试剂盒(RevertAid First Strand cDNA Synthesis Kit)购自Thermo公司、质粒小抽试剂盒[AxyPrepTMPlasmid miniprep Kit (50 prep)]和胶回收试剂盒[AxyPrepTMDNA Gel Extraction Kit (50 prep)]购自Axygen Scientific公司。
2 方法
2.1 苦参RNA的提取及cDNA的合成
从-80℃超低温冰箱取新鲜苦参叶片在液氮中充分研磨成粉末,用RNA提取试剂盒提取苦参总RNA,将提取的总RNA取2 μL用DEPC水稀释1000倍,在酶标仪(Microplate Reader)上测定260 nm、280 nm处的吸光度值(即光密度值OD), 计算刚刚提取的苦参总RNA浓度,并分析其纯度;核酸电泳用来检测苦参总RNA 的完整性。按照逆转录试剂盒的说明书将经检测了的纯度高完整性好的RNA用来合成cDNA。合成的cDNA保存于-20℃冰箱,用于后续PCR扩增。
2.2 引物设计与合成
根据华大基因公司测序的苦参转录组数据,从中筛选出hsp,利用Primer 5.0软件设计出一对特异性的PCR引物来获得hsp17.8的编码序列。引物序列为H1:5′-CATATGATGGGAAAGGCACGCACCATTGG GGT-3′(下划线为NdeⅠ的酶切位点),H2:5′-CTCGAGCTGCCTGGAATTGGAAGATTGGTTTCC-3′(下划线为XhoⅠ的酶切位点),引物由上海生工生物公司合成。
2.3 PCR扩增目的基因hsp17.8
以合成的cDNA为模板,设计的H1、H2为引物对hsp17.8进行PCR扩增。25 μL反应体系:ddH2O 16 μL,10×PCR Buffer 2.5 μL,dNTP Mixture 1 μL,引物H1和H2 (5 μmol/ L)各1 μL,cDNA 2 μL,rTaqDNA聚合酶(5 U/μL) 1.5 μL。PCR条件为:94℃预变性3 min;94℃变性30 s,40℃退火30 s,72℃延伸1 min,共10个循环;接着94℃变性30 s,50℃退火30 s,72℃延伸1 min,共25个循环;循环结束后在72℃下再延伸10 min。用核酸电泳对PCR扩增产物进行鉴定。
2.4 pMD19T-hsp17.8扩增质粒的构建
在紫外灯下用干净的手术刀切下核酸胶中的目的DNA亮带,此条带用胶回收试剂盒纯化(纯化结果用核酸电泳检测),然后在16℃水浴下连接到pMD19-T Vector,连接体系:回收纯化的DNA 11 μL,10×T4 DNA Ligase Buffer 1.5 μL,pMD19-T Vector 1.5 μL和T4 DNA Ligase 1 μL。用42℃,90 s热激法将连接产物转化到实验室新制备的感受态细胞E.coliDH5α,先预培养1.5 h再涂布于Amp+的LB平板。次日,挑单克隆扩大培养。对菌液进行PCR鉴定,PCR体系和条件同上。同时用质粒小抽试剂盒制备重组质粒,为接下来的NdeⅠ和XhoⅠ双酶切做准备,双酶切在37℃水浴下进行,体系为:Plasmid DNA 30 μL,10×H Buffer 3.8 μL,NdeⅠ 2 μL,XhoⅠ 2 μL。用核酸电泳检测是否出现目的条带。阳性菌液送上海生工生物技术有限公司测序。
2.5 pET22b-hsp17.8表达质粒的构建
将阳性重组扩增载体pMD19T-hsp17.8双酶切后的带有酶切位点的目的片段切割回收纯化,与经NdeⅠ和XhoⅠ双酶切的表达载体 pET22b(+)于16℃连接过夜。连接体系为:回收纯化的带有酶切位点的DNA 9.5 μL,10×T4 DNA Ligase Buffer 1.5 μL,pET22b(+) 3 μL和T4 DNA Ligase 1.2 μL。转化、挑单克隆、菌液PCR鉴定、质粒抽提、NdeⅠ/XhoⅠ双酶切鉴定操作同上。用核酸电泳检测是否出现目的条带。阳性克隆送测序分析(上海生工生物技术有限公司)。
2.6 重组表达菌的诱导表达
将重组表达质粒pET22b-hsp17.8转化E.coliBL21(DE3)感受态细胞,挑取克隆于37℃,220 r/min振荡培养过夜。将震荡过夜培养的原核表达菌取3 mL接种到200 mL含Amp+的LB液体培养基里,37℃、220 r/min震荡培养至OD600=0.6左右时,加入IPTG使其终浓度为0、0.1、0.5和1 mmol/L(其中0 mmol/L为不添加 IPTG的对照组),将其分别在3个温度(16℃、25℃和37℃)下诱导表达24 h、8 h和6 h,转速为150 r/min。由于大肠杆菌在16℃、24h,25℃、8 h和37℃、6 h均达到生长稳定期,延长时间蛋白质表达量不再增加,所以我们选择了这些参数作为诱导蛋白产生的条件;高浓度的IPTG有毒性,会杀死细胞,且会增加外源蛋白表达速度,容易造成包涵体的形成,所以一般选择IPTG终浓度为0.1~1 mmol/L,我们选择了IPTG最小终浓度0.1 mmol/L和最大终浓度1 mmol/L以及它们的中间浓度0.5 mmol/L作为实验组,以0 mmol/L为对照组,对热应激蛋白的表达量做了比较。诱导结束后,8000 r/min 离心25 min收集菌体,用30 mL PBS(含500 mmol/L NaCl)/300 μL PMSF混匀收集的细菌,样品放置冰上保持低温,超声(超声1 s,停顿3 s,破碎次数共120次)将细菌完全破碎裂解。13 000 r/min离心30 min收集上清。样品分别加入相应量的5×SDS-PAGE蛋白上样缓冲液,95℃煮沸5 min,进行后续的Western blot检测。
2.7 Western blot
制备15%分离胶和5%浓缩胶,加样,75V电泳30 min后切换115 V电泳90 min,电泳结束后切胶,转膜、封闭、附一抗His-Tag 抗体 (1/1000)过夜、洗膜、附二抗anti-mouse IgG HRP(1/2500)、洗膜、曝光。
2.8 生物信息学分析
首先用在线翻译工具(https://www.bioinformatics.org/sms2/translate.html)对hsp17.8进行基因序列翻译,接下来用在线软件(http://web.expasy.org/protparam/)对HSP17.8蛋白的等电点、分子质量等物理化学性质进行预测。HSP17.8蛋白的潜在功能位点使用Motif scan (http://hits.isb-sib.ch/cgi-bin/motif_scan/)进行预测。使用SMART BLAST (http://blast.ncbi.nlm.nih.gov/smartblast/smartBlast.cgi)工具对HSP17.8进行同源序列的搜索,基于BLAST搜索结果用BoxShade Server (http://www.ch.embnet.org/software/BOX_form.html)、Clustalx1.83和MEGA5.0软件对HSP17.8进行同源蛋白的比对及进化树分析。利用在线蛋白折叠识别工具PHYRE2 (http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)对HSP17.8的二级结构和三级结构进行预测和模拟,用PyMOL program软件对HSP17.8蛋白的3D模型进行绘制。
3 结果与分析
3.1 苦参RNA的提取鉴定
从新鲜苦参叶片中提取的RNA经超纯水稀释1000倍,在酶标仪上测定其OD在260 nm和280 nm处的值,计算OD260/OD280的比值为1.92,结果在1.8和2.0之间,说明提取的RNA纯度较好;同时对新提取的苦参总RNA进行核酸电泳检测,紫外灯下显示所提RNA有3条可见的明亮条带,说明苦参RNA的完整性较好。双重检测的RNA基本无降解,可以用来合成cDNA (图未显示)。
3.2 目的基因hsp17.8的PCR鉴定
以合成的苦参cDNA为模板,H1、H2为引物,用rTaqDNA聚合酶做两步PCR。PCR结果如图1-A所示,凝胶上有分子质量在500 bp左右的明亮条带,表明得到了预期大小的hsp17.8目的条带。
3.3 pMD19T-hsp17.8扩增质粒的鉴定
将核酸胶上的hsp17.8目的条带切割下来纯化浓缩,与pMD19-T Vector连接,转化入实验室新制备感受态细胞E.coliDH5α培养,用菌液PCR和NdeⅠ、XhoⅠ双酶切对培养的重组菌进行双重鉴定,结果如图1-B和1-C所示,在分子质量500 bp左右处均出现清楚的目的条带,说明pMD19T-hsp17.8扩增质粒构建成功。生工生物技术有限公司测序结果比对显示此序列与苦参转录组数据里的序列(TR2941)完全匹配。
3.4 pET22b-hsp17.8表达质粒的鉴定
将经过NdeⅠ、XhoⅠ双酶切的pET22b(+)和同样经过NdeⅠ、XhoⅠ双酶切的目的基因用T4 DNA Ligase进行连接,转化入实验室新制备的感受态细胞E.coliDH5α,取单个克隆进行菌液PCR和NdeⅠ、XhoⅠ双酶切双重鉴定,结果如图1-D和1-E所示,在分子质量500 bp左右处也均出现清楚的目的条带,说明pET22b-hsp17.8表达质粒构建成功。经生工生物技术有限公司再次测序,结果显示此序列与上次测序结果完全匹配。
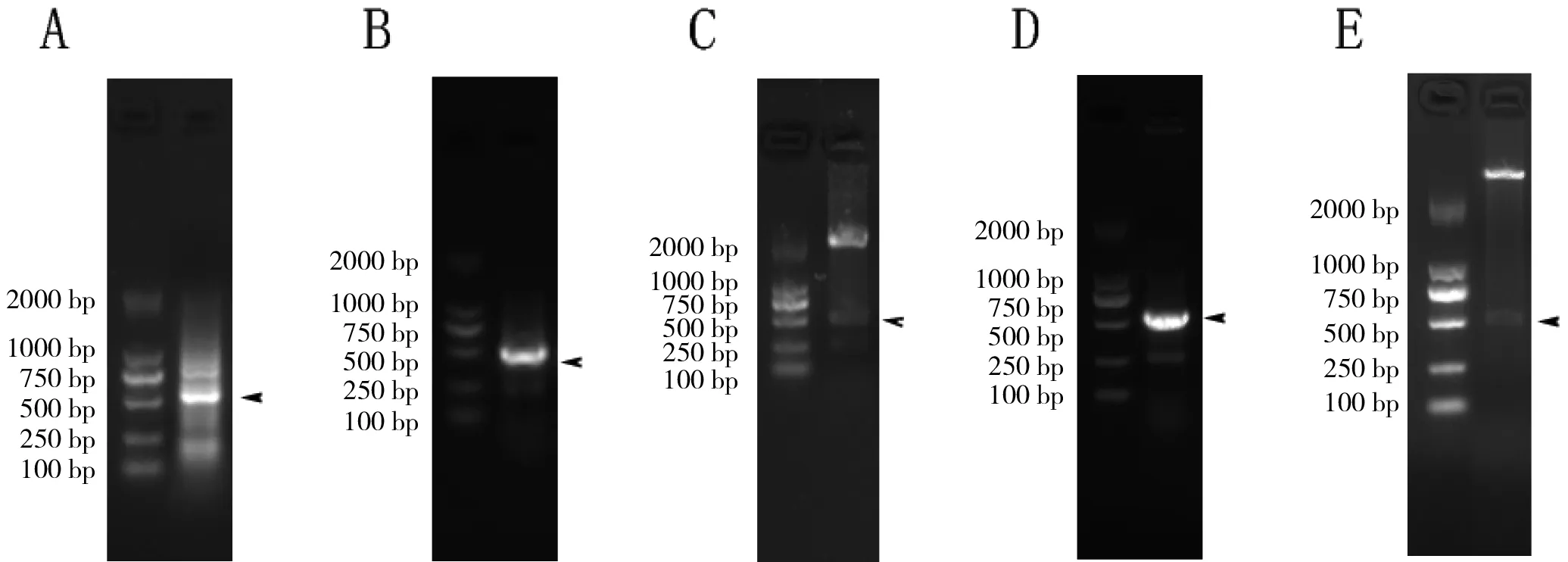
图1 hsp17.8的克隆与重组载体的构建
A:hsp17.8的PCR扩增;B:含有pMD19T-hsp17.8重组质粒的菌液PCR;C:pMD19T-hsp17.8重组质粒的双酶切结果;D:含有pET22b-hsp17.8重组质粒的菌液PCR;E:pET22b-hsp17.8重组质粒的双酶切结果。箭头示意目的条带
3.5 Western blot结果分析
将上述重组表达质粒pET22b-hsp17.8转入E.coliBL21(DE3)感受态细胞。在不同温度、时间下用不同浓度的IPTG诱导表达,其蛋白表达情况通过Western blot检测,检测结果如图2-A所示,在分子质量约17.8 ku处有明显的条带,与理论分子质量值相符,蛋白在上清中的表达量远远高于沉淀中的表达量(沉淀蛋白表达图片未显示),说明此蛋白为可溶性蛋白。基于Western blot检测结果,用GraphPad Prism 6.0软件对HSP17.8表达量进行绘图分析,如图2-B显示,在温度为16℃、IPTG终浓度为1 mmol/L,25℃、IPTG终浓度为0.5 mmol/L和37℃、IPTG终浓度为0.1 mmol/L条件下,HSP17.8蛋白表达量比较高,但总体比较结果是:在25℃、0.5 mmol/L IPTG条件下,苦参HSP17.8蛋白的表达量最高(*表示),因此25℃、终浓度为0.5 mmol/L IPTG是HSP17.8的最佳体外表达条件。
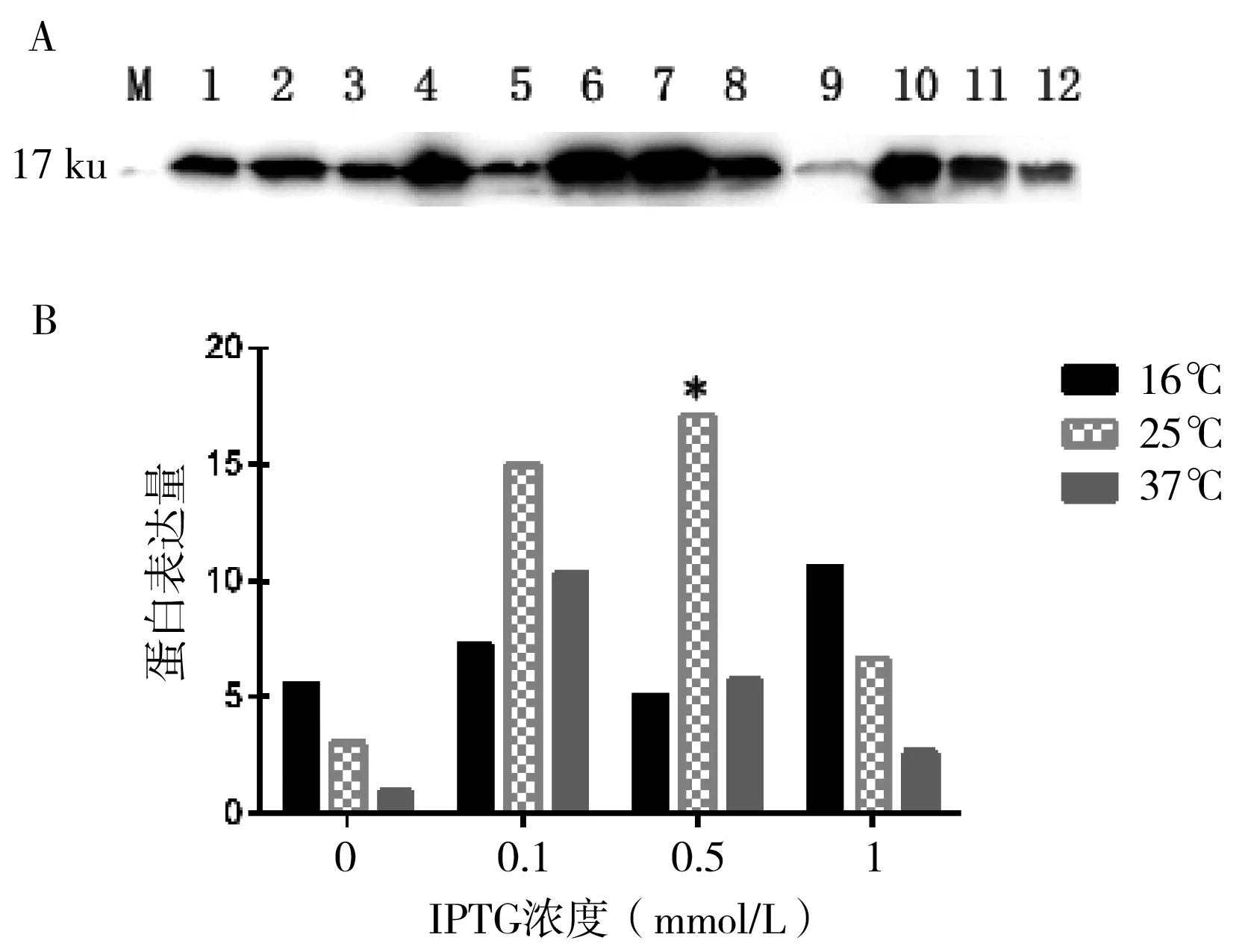
图2 热应激蛋白HSP17.8的诱导表达情况及表达量的分析
A:Western blot结果(M为蛋白Marker;1、2、3、4代表在16℃下IPTG终浓度为0、0.1、0.5和1 mmol/L时的蛋白表达情况;5、6、7和8代表在25℃下IPTG终浓度为0、0.1、0.5和1 mmol/L时的蛋白表达情况;9、10、11和12代表在37℃下IPTG终浓度为0、0.1、0.5和1 mmol/L时的蛋白表达情况)。B:HSP17.8蛋白表达量的分析(*标示了最高表达量)
3.6 生物信息学分析
3.6.1 HSP17.8蛋白的物理化学性质分析
将HSP17.8编码序列用在线工具(The Sequence Manipulation Suite)翻译成氨基酸,再将氨基酸序列通过ProtParam (ExPaSy)软件分析得到HSP17.8蛋白的分子质量、分子式、等电点、电荷性等一系列物理化学性质,结果如下表1所示。此蛋白的不稳定性指数为26.44 (小于40),说明此蛋白很稳定,不容易降解;它的总平均亲水性为-0.066,属于负值,说明此蛋白为亲水性蛋白,与Western blot结果显示一致,即为可溶性蛋白。
3.6.2 HSP17.8蛋白的潜在功能位点预测
Motif Scan分析HSP17.8蛋白的氨基酸序列,发现一个3-磷酸甘油醛脱氢酶、辅酶结合域、3个蛋白激酶C磷酸化位点、2个N-蛋白质豆蔻酰化位点、3个酪蛋白激酶II磷酸化位点和3个N-糖基化位点,具体位置见表2;且K3-K157氨基酸序列与两个应激蛋白非常相似,E值分别为3e-19和9.3e-19,远远小于10-6,说明此蛋白与应激蛋白同源性非常高,应该属于应激蛋白家族中的一员。
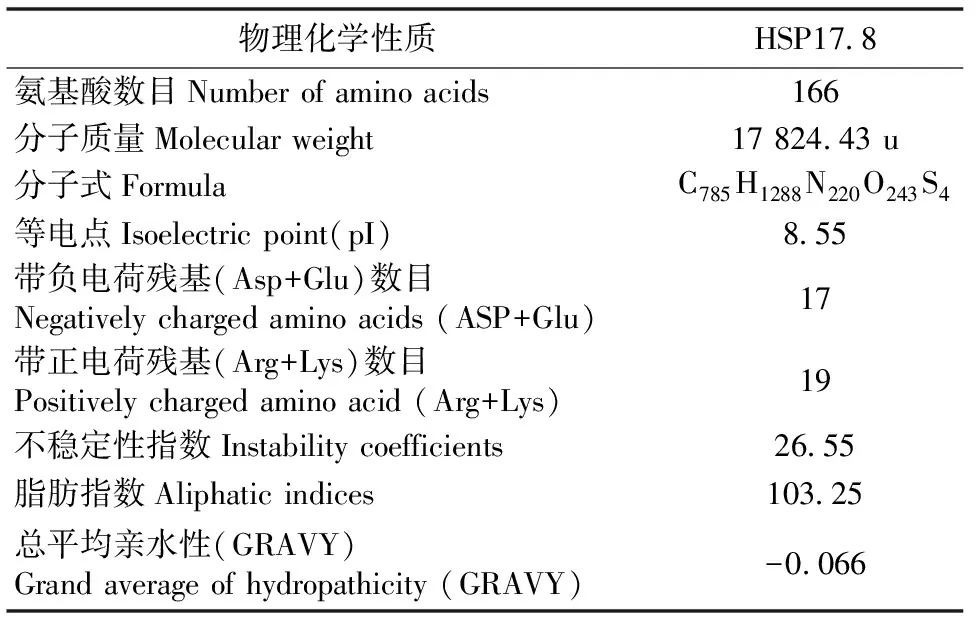
表1 HSP17.8蛋白的物理化学性质
3.6.3 HSP17.8同源序列比对及进化树构建
通过SMART BLAST在线软件分析,根据蛋白的同源性在NCBI数据库中搜索到HSP17.8蛋白相似度最高的13个同源蛋白,它们的序列号分别为大豆(Glycinemax),NP_001237890.1;羽扇豆(Lupinusangustifolius),XP_019459376.1;木豆(Cajanuscajan),XP_020234148.1;豇豆(Vignaradiatavar.radiate),XP_014504733.1;野生大豆(Glycinesoja),KHN39491.1;蒺藜苜蓿(Medicagotruncatula),XP_003616191.1;赤豆(Vignaangularis),XP_017430444.1;赤豆(Vignaangularis),XP_017430443.1;菜豆(Phaseolusvulgaris),XP_007141947.1;地三叶草(Trifoliumsubterraneum),GAU36776.1;蒺藜苜蓿(Medicagotruncatula),XP_013454197.1;百脉根(Lotusjaponicas),AFK43932.1;大豆(Glycinemax),KRH72936.1。发现苦参HSP17.8与各种豆类的HSP同源性较高,这与苦参属于豆科植物是一致的。用在线软件BoxShade Server 和Clustalx1.83对HSP17.8及其相似度最高的13个同源蛋白进行比对,如图3-A所示。使用MEGA5.0软件的邻接法(Neighbor-joining Method, NJ),步长值(Bootstrap values)设为1000的重复性对HSP17.8及其13个同源蛋白进行进化树分析,如图3-B所示,苦参的HSP17.8与羽扇豆的应激蛋白在同一个子分支中,相似度达到了90%,说明苦参与羽扇豆的应激蛋白同源性最高,两物种之间的亲缘关系最近。
3.6.4 苦参HSP17.8的二级结构分析及三级结构模拟
通过PHYRE2在线软件,以得分最高的d1mjha为模板,获得了HSP17.8蛋白的二级结构信息及三维结构模型(图4),氨基酸序列覆盖率为86% (覆盖HSP17.8的142个氨基酸残基,它们分别为1M、4A-45A、63L-161S),序列一致性为28%,可信度为99%。图4-A结果显示HSP17.8具有4个α螺旋(15A-27N、62P-93T、109E-114E、140S-148N)、5个β折叠(6T-10A、Q34-40V、97V-105G、121D-124V、153V-156V)。用三级结构绘图软件PyMOL对HSP17.8蛋白的3D结构进行绘制,如图4-B所示,可以看出HSP17.8蛋白富含α螺旋和β折叠,α螺旋和β折叠依次出现,形成了β1-α1-β2-α2-β3-α3-β4-α4-β5的折叠方式,5个β折叠相同方向,被α螺旋包裹在内部,构成了蛋白质立体结构的内部框架。

表2 HSP17.8蛋白的潜在功能位点
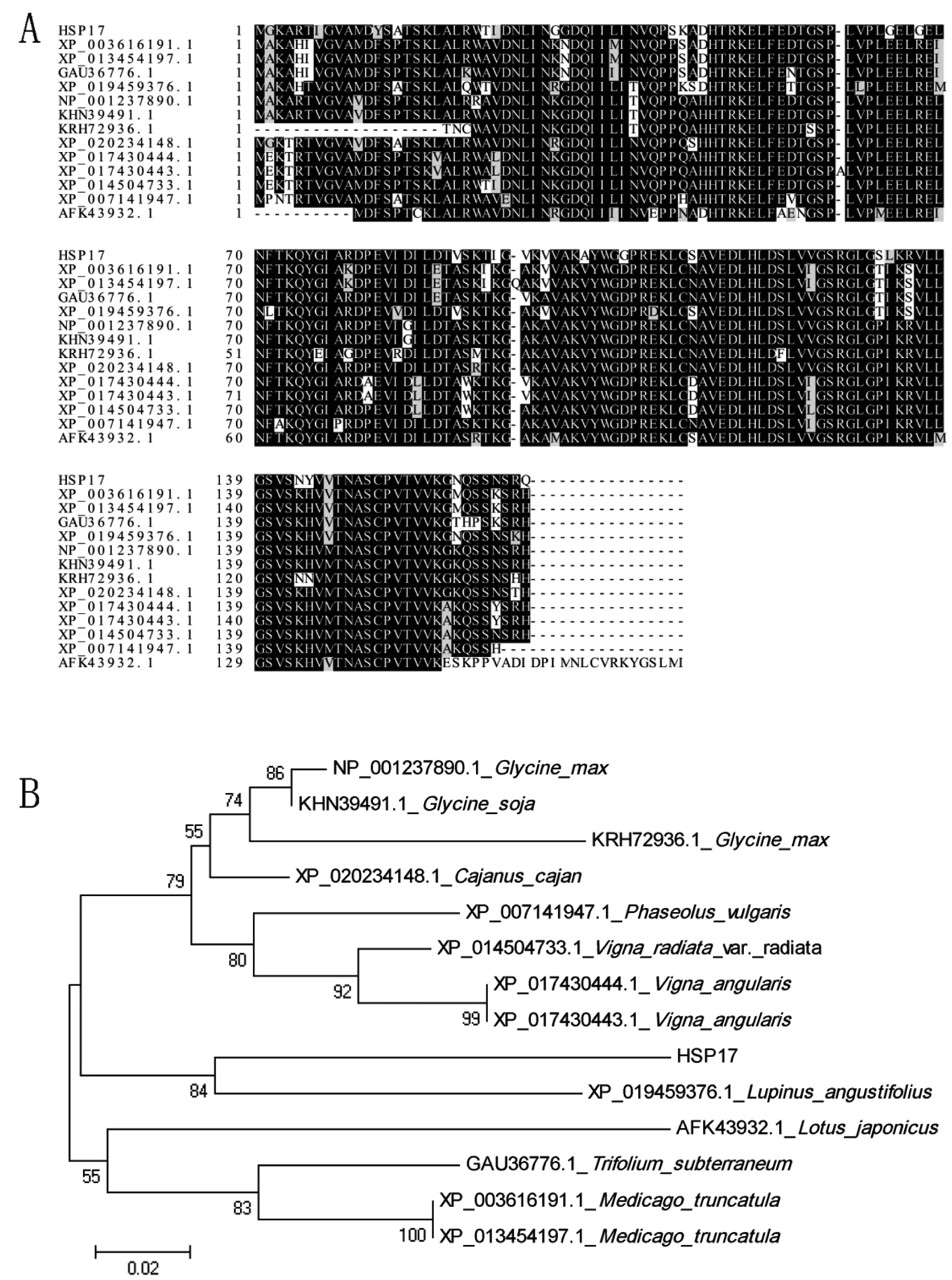
图3苦参HSP17.8的同源蛋白比对及进化树分析
Fig 3 Homologous alignment and phylogenic tree of HSP17.8
A:HSP17.8与13个同源性最高的蛋白比对图。B:HSP17.8的进化关系图(0.02表示遗传距离;枝干数字表示分支支持率)
4 讨论
植物小分子热激蛋白(small heat shock proteins, sHSP)在植物受到逆境胁迫下表达量明显增加,提高了植物对各种逆境因子胁迫的防御能力,是一类重要的胁迫诱导蛋白[14],被认为是植物抗逆过程中的第一道防线[15]。刘箭等[16]利用Northern杂交法发现高温胁迫下,番茄花药中细胞质和线粒体sHSP基因转录明显,认为sHSP基础含量的增加可减缓快速升温对热敏性花药的伤害。Lund等[17]研究结果表明,在热激诱导下玉米线粒体小分子HSP22相比大分子HSP70含量发生了明显变化,认为线粒体小分子热应激蛋白HSP22在分子水平、蛋白质水平和细胞器水平上对植物主要起保护功能,直接影响植物线粒体耐热性。Sun等[18]研究发现过表达的At-HSP17.6A能够提高拟南芥的耐盐性和抗旱性,说明sHSP对逆境生理研究有着重要意义。
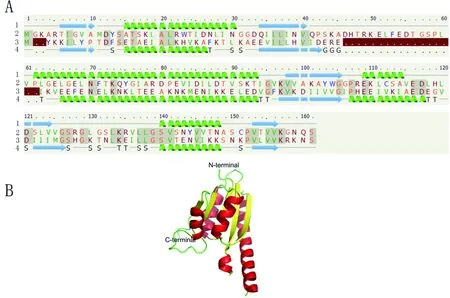
图4 HSP17.8的二级结构及空间构型图
A:苦参HSP17.8的二级结构图(1、2、3、4分别代表预测的HSP17.8二级结构、HSP17.8的氨基酸序列、模板d1mjha的氨基酸序列、模板d1mjha的已知二级结构;绿色螺旋状为α螺旋,浅蓝色箭头为β折叠)。B:苦参HSP17.8的3D模型图(黄色箭头表示β折叠;红色螺旋表示α螺旋;绿色为无规卷曲;N-terminal为HSP17.8蛋白的氨基末端;C-terminal为HSP17.8蛋白的羧基末端)
基于sHSP的重要的生物学功能及其巨大的应用潜力,作者利用分子生物学手段首次从苦参中克隆了长度为498 bp的热应激蛋白小分子家族HSP17.8基因,其编码166个氨基酸,GenBank登录号为MF101468,并成功在体外诱导其表达,该蛋白分子质量约为17.8 ku,等电点为8.55,是稳定亲水性蛋白。我们进一步筛选了其最佳的体外诱导表达条件,分析了该蛋白的理化性质、进化关系以及空间结构特点等,发现该蛋白与羽扇豆的应激蛋白同源性达到了90%,亲缘关系最近,这与苦参是豆科植物是一致的。本研究为今后探索植物小分子热激蛋白的诱导机理、结构功能以及在植物体内的抗逆机制奠定了基础。
[1]GEORGOPOULOS C, WELCH W J. Role of the major heat shock proteins as molecular chaperones [J]. Annual Review of Cell Biology, 1993, 9:601-634.
[2]MOSELEY P L. Heat shock proteins and heat adaptation of the whole organism [J]. Journal of Applied Physiology, 1997, 83(5):1413-1417.
[3]KIANG J G, TSOKOS G C. Heat shock protein 70 kDa: molecular biology, biochemistry, and physiology [J]. Pharmacology Therapeutics, 1998, 80(2):183-201.
[4]鲍恩东, 龚远英, HARTUNG J, 等. 肉鸡热应激病理损伤与应激蛋白(HSP70)相关性研究[J]. 中国农业科学, 2004, 37(2): 301-305.
[5]YU Z F, MATTSON M P. Dietary restriction and 2-deoxyglucose administration reduce focal ischemic brain damage and improve behavioral outcome: evidence for a preconditioning mechanism [J]. Journal of Neuroscience Research, 1999, 57(6):830-839.
[6]WANG Z, INOKUCHI T, NEMOTO T K, et al. Antisense oligonucleotide against collagen-specific molecular chaperone 47-kDa heat shock protein suppresses scar formation in rat wounds [J]. Plastic & Reconstructive Surgery, 2003, 111(6):1980-1987.
[7]沈 骅, 王晓蓉, 张景飞. 应用应激蛋白HSP70作为生物标志物研究锌、铜及其联合毒性对鲫鱼肝脏的影响[J]. 环境科学学报, 2004, 24(5): 895-899.
[8]陈 忠, 苏维埃, 汤章城. 豌豆热激蛋白Hpc60对酶的高温保护功能及其机理[J]. 科学通报, 1999, 44(20):2171-2175.
[9]COLLINS G G, NIE X L, SALTVEIT M E. Heat shock proteins and chilling sensitivity of mung bean hypocotyls [J]. Journal of Experimental Botany, 1995, 46(288):795-802.
[10]COCA M A, ALMOGUERA C, THOMAS T L, et al. Differential regulation of small heat-shock genes in plants: analysis of a water-stress-inducible and developmentally activated sunflower promoter [J]. Plant Molecular Biology, 1996, 31(4):863-876.
[11]国家药典委员会. 中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2015:附录202-203.
[12]WANG W, YOU R L, QIN W J, et al. Anti-tumor activities of active ingredients in compound Kushen injection [J]. Acta Pharmacologica Sinica, 2015, 36(6):676-679.
[13]JIN J H, KIM J S, KANG S S, et al. Anti-inflammatory and anti-arthritic activity of total flavonoids of the roots of Sophoraflavescens[J]. Journal of Ethnopharmacology, 2010, 127(3):589-595.
[14]WANG W, VINOCUR B, SHOSEYOV O, et al. Role of plant heat-shock proteins and molecular chaperones in the abiotic stress response[J]. Trends in Plant Science, 2004, 9(5):244-252.
[15]SUN W, VAN MONTAGU M, VERBRUGGEN N. Small heat shock proteins and stress tolerance in plants [J]. Biochimicaet Biophysica Acta, 2002, 1577(1):1-9.
[16]刘 箭, 庄野真理子. 小分子热激蛋白基因在番茄花药中的转录[J]. 园艺学报, 2001, 28(5): 403-408.
[17]LUND A A, BLUM P H, BHATTRAMAKKI D, et al. Heat-stress response of maize mitochondria [J]. Plant Physiology, 1998, 116(3):1097-1110.
[18]SUN W, BERNARD C, VAN DE COTTE B, et al. At-HSP17.6A, encoding a small heat-shock protein in Arabidopsis, can enhance osmotolerance upon overexpression [J]. Plant Journal for Cell & Molecular Biology, 2001, 27(5):407-415.
