不同粗化处理对超细晶纯钛表面性能的影响
2017-11-30丰帆辛海涛吴玉禄刁晓鸥窦晨云
丰帆 辛海涛 吴玉禄 刁晓鸥 窦晨云
不同粗化处理对超细晶纯钛表面性能的影响
丰帆 辛海涛 吴玉禄 刁晓鸥 窦晨云
目的研究不同粗化处理对超细晶纯钛表面性能及成骨细胞黏附和增殖的影响。方法将超细晶纯钛棒切割为直径7 mm、厚度2 mm的试件,按不同喷砂压力(0.2~0.8 MPa)分组,对其表面进行喷砂酸蚀处理,对照组为普通纯钛。通过表面形貌、粗糙度、亲水性研究材料的表面性能,然后将大鼠胚胎成骨细胞(MC3T3-E1)接种到各组钛片表面,观察细胞初期黏附形态,测定其增殖密度。结果超细晶纯钛粗化处理后,表面呈现出由喷砂和酸蚀所形成的大小不同的弹坑状双层结构。随着喷砂压力增大,超细晶纯钛表面坑孔直径和粗糙度逐渐增大,但二者均小于普通纯钛对照组(Plt;0.05)。超细晶纯钛亲水性也随喷砂压力变化而改变,当喷砂压力为0.6 MPa时表现出最佳表面亲水性能。接种细胞后,实验组细胞初期黏附形态优于对照组,当喷砂压力为0.6 MPa时细胞增殖密度最大。结论对超细晶纯钛喷砂酸蚀处理,喷砂压力为0.6 MPa时,材料表面形貌优于普通纯钛,粗糙度适宜,亲水性良好,更有利于细胞黏附和增殖。
喷砂酸蚀; 超细晶纯钛; 细胞黏附; MC3T3-E1
目前临床使用的种植体多采用纯钛材料因其具有优异的生物相容性。但纯钛机械强度较低,临床使用中会出现种植体折断和破坏,影响种植义齿的成功率和使用寿命。有研究报道采用等通道挤压技术使纯钛发生剧烈塑性变形,使其晶粒得到细化从而达到提高纯钛材料机械性能的目的[1-2]。本课题组前期实验证明纯钛经等通道挤压后其晶粒由微米级细化至纳米级,硬度和屈服强度明显提高,生物安全性和生物相容性试验也表明,超细晶纯钛具有良好的安全性,能促进细胞黏附和增殖,适合作为口腔种植材料[3-4]。
为了增大种植体与牙槽骨的接触面积,促进骨结合,临床中所使用的种植体均要进行表面处理[5]。尽管种植体表面粗化处理的方法较多[6-8],但喷砂酸蚀法是目前临床常用的种植体表面处理方法,该方法所形成的坑与微孔结构大大提高了材料的表面粗糙度[9],增加了种植体骨结合[10]。虽然普通纯钛表面喷砂酸蚀处理的研究报道很多,但有关超细晶纯钛表面喷砂酸蚀的研究报道还较少,喷砂酸蚀条件的不同对超细晶纯钛表面性能及生物相容性的影响还未见报道。为了将超细晶纯钛材料应用于口腔种植领域,还需要对其表面进行喷砂酸蚀处理,研究该粗化处理方法处理超细晶纯钛的可行性,并筛选出最适宜的喷砂酸蚀处理参数。
本实验将探究在不同喷砂压力下,超细晶纯钛表面形貌、粗糙度、亲水性的改变以及对其表面黏附细胞的形态、数量的影响,并分析在相同喷砂条件下与普通纯钛的差异,为其在口腔种植领域的应用提供实验依据。
1 材料与方法
1.1 主要材料和设备
商业纯钛(CP Ti)(99.5%,2 级)、超细晶纯钛(UFG Ti)(西北工业大学制备),喷砂机(Renfert公司,德国),金相研磨抛光机(MTI;Unipol-830),扫描电子显微镜(S-4800, Hitachi 公司,日本),三维形貌扫描仪(NANOVEA,美国),激光共聚焦显微镜(FV10i,Olympus 公司,日本); DZF-6050 电热真空干燥箱(上海精宏实验设备有限公司), EASY DROP K100 型接触角测试仪(KRUSS 公司,德国),CO2孵箱(Heraeus 公司,德国)。
1.2 试件的制备
将2 种材料制成直径7 mm、厚度2 mm的圆盘状试件,每种材料的试件随机分为4 组,每组10 片。试件用600~2000 目的SiC砂纸逐级抛光。抛光后的试件用110 μm的Al2O3颗粒在距离试件1 cm处对其表面垂直喷砂30 s,UFG Ti-SLA 0.2组和CP Ti-SLA 0.2组的喷砂气压为0.2 MPa,UFG Ti-SLA 0.4组和CP Ti-SLA 0.4组的喷砂气压为0.4 MPa,UFG Ti-SLA 0.6组和CP Ti-SLA 0.6组的喷砂气压为0.6 MPa,UFG Ti-SLA 0.8组和CP Ti-SLA 0.8组的喷砂气压为0.8 MPa。喷砂后用混合酸(37%盐酸、98%硫酸和去离子水以2∶1∶1比例配置)在80 ℃的条件下对试件进行酸蚀,酸蚀时间5 min。依次用丙酮、无水乙醇、去离子水超声波震荡清洗3 次,每次5 min。在40 ℃条件下用烘干机干燥。高温高压消毒备用。
1.3 表面性能检测
对8 组处理过的钛片进行检测:①表面形貌观察:采用扫描电镜(SEM)观察材料的表面微观形貌;②表面粗糙度测量:采用三维形貌扫描仪对试件表面进行扫描后测量每组钛片的表面粗糙度;③水接触角测量:用接触角测量仪测量每组钛片的水接触角。
1.4 细胞黏附实验
将钛片置于48 孔板内,每孔1 片,每组2 片,共16 片。取生长良好的细胞以105cell/ml的密度接种至试件表面,每孔0.5 ml培养液,细胞接种后的24 h每组分别取出2 枚钛片,PBS漂洗钛片表面细胞2 次,每次8~10 min,2.5%戊二醛固定,4 ℃过夜,吸出固定剂,用PBS浸洗2 次,每次8~10 min,酒精梯度脱水,干燥,喷金,扫描电镜观察细胞黏附形态。
1.5 细胞增殖实验
将钛片置于48 孔板内,每孔1 片,每组3 片,共24 片。取生长良好的细胞以105cell/ml的密度接种至试件表面,每孔0.5 ml培养液,细胞接种后1、3、5 d每组各取出1 枚钛片,PBS漂洗钛片表面细胞2 次,每次8~10 min,4 ℃条件下2.5%戊二醛固定30 min,吸出固定剂,用PBS浸洗2 次,每次8~10 min,加入0.1% Triton-100处理5 min以增加细胞膜通透性,DAPI染液避光染色10 min,激光共聚焦显微镜观察,每个钛片随机选取5 个视野进行细胞计数。
1.6 统计学分析
采用SPSS 19.0统计软件对数据进行统计分析。若数据正态分布且方差齐性,则每种材料各样本均数间的比较采用LSD-L检验,相同处理条件下2 种材料间样本均数的比较采用t检验;若数据呈非正态分布或方差不齐,则采用Kruskal-WillsH检验进行组间比较;检验水准α=0.05。
2 结 果
2.1 材料表面性能
2.1.1 扫描电镜观察 UFG Ti-SLA组表面喷砂坑大小约为3~5 μm,且随着喷砂压力增大喷砂坑逐渐清晰,在喷砂形成的大孔周围可见酸蚀形成的小孔,双层结构明显。CP Ti-SLA组表面喷砂坑大小约为8~10 μm,喷砂坑清晰,但酸蚀形成的小孔不如超细晶纯钛清晰,双层结构不明显(图 1)。
2.1.2 三维形貌 图 2显示各组材料表面均形成高低起伏的规则表面,当喷砂压力为0.2 MPa时,超细晶纯钛与普通纯钛表面起伏数量相当,随喷砂压力增大试件表面形成的起伏逐渐增多,当喷砂压力为0.4、0.6、0.8 MPa时普通纯钛表面起伏多于超细晶纯钛。
2.1.3 表面粗糙度 随着喷砂压力增大两组材料的表面粗糙度均逐渐增大,超细晶纯钛组除0.4 MPa喷砂压力下粗糙度与相邻2 组间差异无统计学意义,其余组之间粗糙度均有差异(Plt;0.05),普通纯钛组各组之间差异均有统计学意义(Plt;0.05),相同喷砂压力条件下普通纯钛的表面粗糙度大于超细晶纯钛(Plt;0.05)(表 1)。

图 1 超细晶钛片与普通钛片表面微观形态(SEM,×5 000)
Fig 1 The surface micromorphology of UFG Ti and CP Ti(SEM,×5 000)

图 2 超细晶钛片与普通钛片表面三维形貌
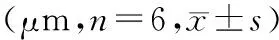
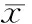
Tab 1 Surface roughness parameters of 2 groups (μm,n=6,±s)
2.1.4 亲水性能 各组材料表面水接触角测量值见表 2。超细晶纯钛与普通纯钛接触角随喷砂压力增大呈现先减小后增大的趋势, 超细晶纯钛在喷砂压力为0.6 MPa时、普通纯钛在喷砂压力为0.4 MPa时接触角最小,亲水性最好,与各组间差异有统计学意义(Plt;0.05)。
2.2 材料表面细胞活性
2.2.1 细胞初期黏附形态 各组材料表面细胞初期黏附形态见图 3。由图可见,细胞在喷砂坑内生长,均伸出伪足与喷砂坑边缘突起部分相连,呈峰峰搭桥型。超细晶纯钛表面黏附的成骨细胞在24 h时已经完全伸张, 呈平铺样,细胞多边形;普通纯钛表面成骨细胞伸展不如超细晶纯钛彻底,仍可看到细胞边缘丝状伪足或带状伪足离心生长。
2.2.2 细胞增殖密度 各组材料表面黏附细胞的细胞核染色结果见图 4、表 3。由图 4可知,不同喷砂压力作用下,超细晶纯钛表面细胞黏附数量均多于普通纯钛;由表 3可知,喷砂压力为0.6 MPa时,超细晶纯钛表面细胞增殖密度最大,与其他组差异有统计学意义(Plt;0.05);喷砂压力为0.4 MPa时,普通纯钛表面细胞增殖密度最大,与其他组之间差异有统计学意义(Plt;0.05)。
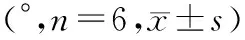
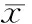
Tab 2 The water contact angle on the surface of 2 groups (°,n=6,±s)
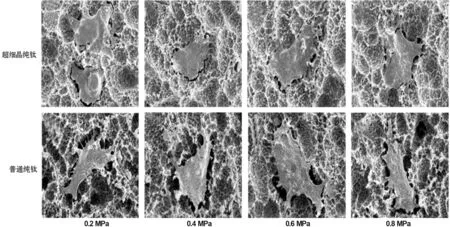
图 3 材料表面MC3T3-E1细胞黏附形态(SEM, ×2 000)
Fig 3 The adhension of MC3T3-E1 cells on the surface of UFG Ti and CP Ti(SEM, ×2 000)

图 4 材料表面MC3T3-E1细胞DAPI染色(激光共聚焦显微镜, ×200)
Fig 4 DAPI staining of MC3T3-E1 cells on UFG Ti and CP Ti(Laser confocal microscope, ×200)
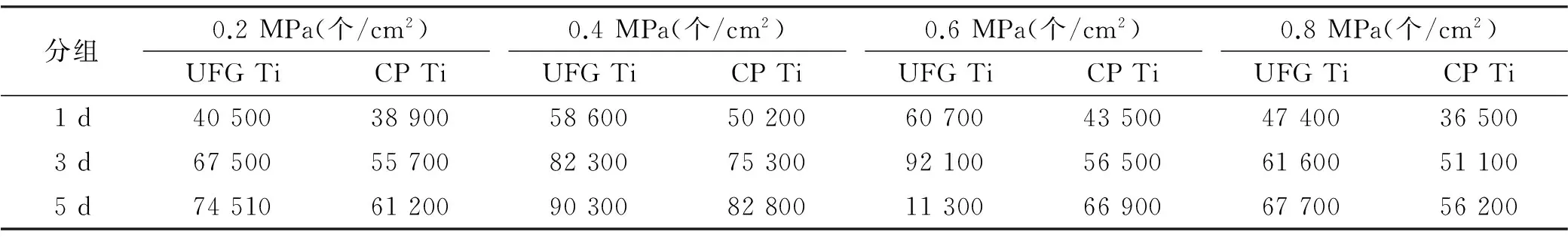
表 3 超细晶纯钛和普通纯钛表面的细胞密度实验
3 讨 论
纯钛经等通道挤压后晶粒得到细化,机械强度明显提高[11-12]。课题组前期研究也证实超细晶纯钛在弹性模量未改变的前提下,其强度和硬度明显优于纯钛[3],生物安全性和生物相容性实验也表明超细晶纯钛可以作为牙科种植体材料[4,13]。为了将超细晶纯钛应用于临床种植修复,还要对其表面进行处理以提高种植体骨结合。尽管种植体表面处理方法很多,如喷砂酸蚀、微弧氧化、磷灰石表面涂层等[14-15],但喷砂酸蚀依然是临床常用的种植体表面处理方法。为了探明喷砂酸蚀对超细晶纯钛表面性能的影响,本实验将研究在不同喷砂压力下,超细晶纯钛表面形貌、粗糙度、亲水性的改变,观察其表面成骨细胞黏附形态和数量,优化出最佳喷砂酸蚀处理条件,为其在口腔种植领域的应用提供实验依据。
3.1 喷砂压力对超细晶纯钛表面形貌和粗糙度的影响
种植体材料的表面微观形貌、粗糙度和亲水性与细胞行为之间的关系一直是学者们研究的热门问题[16-17],成骨细胞对与种植体材料的反应依赖于这些表面特征,表面性能好的种植体材料可以在其周围形成良好的生物学环境,以利于细胞在其表面黏附、增殖和分化[18]。细胞黏附是细胞与种植体接触的第一步,种植体表面的粗糙度和亲水性会对成骨细胞黏附形态与数量产生影响,进而影响其进一步的分化和增殖[19]。而种植体表面粗糙度又与材料的机械性能以及喷砂处理条件密切相关[20]。本研究的三维形貌结果显示超细晶纯钛与普通纯钛表面起伏数量随喷砂压力增大而增多,从而使其粗糙度也逐渐增大,但超细晶纯钛表面起伏数量及粗糙度小于相同喷砂压力处理后的普通纯钛。微观形貌研究显示,超细晶纯钛与普通纯钛表面均形成双层孔洞结构,该双层结构由喷砂所形成的大坑以及酸蚀所形成的小孔组成。随着喷砂压力增大,2 组材料表面喷砂坑逐渐增大,但超细晶纯钛的喷砂坑明显小于普通纯钛。这是由于超细晶纯钛的机械强度高于普通纯钛,也是形成二者粗糙度差异的主要原因。酸蚀处理后超细晶纯钛表面所形成的双层孔洞结构明显,且分布均匀,表面微观形貌特征优于普通纯钛,其主要原因可能是超细晶纯钛晶粒比普通纯钛小,晶界相对较多,由于晶界易被酸蚀,故超细晶纯钛更容易形成酸蚀孔,从而影响其双层结构。但是,酸蚀条件的改变可能会对超细晶纯钛的结构及晶界产生较大影响,进而改变其表面性能,因此,本实验未改变酸蚀条件,只采用普通纯钛常用酸蚀方法对超细晶纯钛进行处理,后期还将研究酸蚀条件的改变对超细晶纯钛表面性能的影响,为超细晶纯钛的喷砂酸蚀处理提供实验依据。
3.2 超细晶纯钛表面亲水性的影响因素
种植体表面的亲水性也是影响成骨细胞黏附的关键因素[21]。材料的亲水性不但取决于材料的组成与结构,也与材料表面微观形貌和粗糙度相关[22]。本研究也发现,超细晶纯钛表面亲水性能优于普通纯钛,原因可能是由于超细晶纯钛晶界较多,酸蚀后晶界暴露,水分子易通过毛细现象进入酸蚀后的晶界内,从而改善超细晶纯钛的亲水性。有研究表明,粗糙度的变化会影响材料亲水性能的改变,但并不是粗糙度越大,材料的亲水性越好[21]。在本研究中,随喷砂压力增大,超细晶纯钛表面粗糙度逐渐增大,但其亲水性并没有相应地提高,而是在喷砂压力为0.6 MPa时亲水性能最好,只有当材料表面粗糙度与亲水性达到良好匹配时,才可能更有利于细胞黏附。
3.3 超细晶纯钛表面性能对细胞黏附和增殖的影响
适宜的粗糙度和良好的亲水性能促进细胞黏附与增殖。材料表面越粗糙,表面积越大,表面活性点多,越有利于细胞黏附[20]。但Wennerberg等[23]研究发现,适宜粗糙度的材料表面比光滑或过度粗糙的表面更有利于种植体与骨组织发生反应。亲水性能良好的表面更易吸附大分子蛋白,从而与细胞受体结合,促进细胞黏附[22]。本实验也发现,当喷砂压力为0.6 MPa时,超细晶纯钛表面粗糙度并不是最大,但其亲水性能良好,细胞黏附数量最多,并且优于普通纯钛。研究结果表明,超细晶纯钛表面进行喷砂酸蚀处理时,喷砂压力应大于普通纯钛,才能使其表面具有适宜的粗糙度和良好的亲水性,以适应成骨细胞黏附与增殖。
综上所述, 超细晶纯钛材料具有良好的机械性能,作为种植体材料进行表面粗化处理时,当喷砂压力为0.6 MPa,材料表面具有良好的形貌特征和适宜的粗糙度与亲水性,有利于细胞黏附和增殖,可以作为喷砂酸蚀表面处理的参考依据。
[1] Elias CN, Meyers MA, Valiev RZ, et al. Ultrafine grained titanium for biomedical applications: An overview of performance[J]. J Mater Res Technol,2013,2(4):340-350.
[2] Mishnaevsky L, Levashov E, Valiev RZ, et al. Nanostructured titanium-based materials for medical implants: Modeling and development[J]. Mater Sci Eng,2014,81(1):1-19.
[3] 张强,辛海涛,吴玉禄,等. 等通道挤压超细晶纯钛材料生物安全性研究[J]. 实用口腔医学杂志, 2014, 30(3):302-305.
[4] 安佰利,李至睿,刁晓鸥,等. 喷砂酸蚀对超细晶纯钛表面MC3T3-E1细胞粘附与增殖的影响[J]. 口腔医学研究, 2016, 32(1):26-30.
[5] Barfeie A, Wilson J, Rees J. Implant surface characteristics and their effect on osseointegration[J]. Br Dent J,2015,218(5):E9.
[6] Ogawa ES, Matos AO, Beline T, et al. Surface-treated commercially pure titanium for biomedical applications: Electrochemical, structural, mechanical and chemical characterizations[J]. Mater Sci Eng C Mater Biol Appl, 2016, 65: 251-261.
[7] Jung SC, Kang L, Kim BH. Biocompatibility of plasma polymerized sandblasted large grit and acid titanium surface[J]. Thin Solid Films,2012,521(18):150-154.
[8] 刘智勇,穆亚星,杨海欧,等. 成骨细胞在激光立体成形多孔钛表面的附着、增殖及ALP活性[J]. 实用口腔医学杂志, 2015, 31(5): 603-606.
[9] Jemat A, Ghazali MJ, Razali M, et al. Surface modifications and their effects on titanium dental implants[J]. Bio Med Res Int,2015,2015: 791725.
[10]Rønold HJ, Lyngstadaas SP, Ellingsen JE. Analysing the optimal value for titanium implant roughness in bone attachment using a tensile test[J]. Biomaterials,2003,24(25):4559-4564.
[11]Kim TN, Balakrishnan A, Lee BC, et al.Invitrofibroblast response to ultra fine grained titanium produced by a severe plastic deformation process[J]. J Mater Sci Mater Med,2008,19(2):553-557.
[12]Estrin Y, Kasper C, Diederichs S, et al. Accelerated growth of preosteoblastic cells on ultrafine grained titanium[J]. J Biomed Mater Res A,2009,90(4):1239-1242.
[13]贾晓瑞,辛海涛,张强,等. 超细晶纯钛种植体表面微弧氧化处理的实验研究[J]. 牙体牙髓牙周病学杂志, 2015, 25(3):158-161.
[14]Yao ZQ, Ivanisenko Y, Diemant T, et al. Synthesis and properties of hydroxyapatite-containing porous titania coating on ultrafine-grained titanium by micro-arc oxidation[J]. Acta Biomater,2010,6(7):2816-2825.
[15]Medvedev AE, Ng HP, Lapovok R, et al. Effect of bulk microstructure of commercially pure titanium on surface characteristics and fatigue properties after surface modification by sand blasting and acid-etching[J]. J Mech Behav Biomed Mater,2016,57:55-68.
[16]Li HF, Wang YB, Zheng YF, et al. Osteoblast response on Ti- and Zr-based bulk metallic glass surfaces after sand blasting modification[J]. J Biomed Mater Res B Appl Biomater,2012,100(7):1721-1728.
[17]Keller JC, Schneider GB, Stanford CM, et al. Effects of implant microtopography on osteoblast cell attachment[J]. Implant Dent,2003,12(2):175-181.
[18]Albrektsson T, Wennerberg A. Oral implant surfaces: Part 1-review focusing on topographic and chemical properties of different surfaces andinvivoresponses to them[J]. Int J Prosthod, 2004,17(5):536-543.
[19]王亚敏,周震,宋光保,等. 不同粗化亲水纯钛表面对人成骨细胞粘附水平的影响[J]. 广东牙病防治, 2015, 23(11):565-569.
[20]梁迎春,宋代平,陈明君,等. 钛系生物医用材料表面粗糙度影响细胞黏附的新进展[J]. 机械工程学报, 2008, 44(7):6-15.
[21]Rupp F, Gittens RA, Scheideler L, et al. A review on the wettability of dental implant surfaces I: Theoretical and experimental aspects[J]. Acta Biomater,2014,10(7):2894-2906.
[22]Gittens RA, Scheideler L, Rupp F, et al. A review on the wettability of dental implant surfaces II: Biological and clinical aspects[J]. Acta Biomater,2014,10(7):2907-2918.
[23]Wennerberg A, Albrektsson T. Effects of titanium surface topography on bone integration: A systematic review[J]. Clin Oral Implants Res,2009,20(Suppl 4):172-184.
(收稿: 2016-10-30 修回: 2017-02-20)
Thesurfacecharacterizationofultrafinegrainedtitaniumafterroughnesstreatmentofdifferenttypes
FENGFan,XINHaitao,WUYulu,DIAOXiaoou,DOUChenyun.
710032Xi'an,StateKeyLaboratoryofMilitaryStomatologyamp;NationalClinicalResearchCenterforOralDiseasesamp;ShaanxiKeyLaboratoryofStomatology,DepartmentofProsthodontics,SchoolofStomatology,TheFourthMilitaryMedicalUniversity,China
Objective: To investigate the surface characterization ,cell adhension and proliferation of ultrafine grained titanium(UFG Ti) after different sand blasting and acid-etching(SLA).MethodsThe billets of UFG Ti and commercially pure titanium Ti(CP Ti) were incised into cylindrical specimens with 7 mm in diameter and 2 mm in height. The specimens were sand blasted at the air pressure of 0.2,0.4,0.6 and 0.8 MPa respectively(n=10) and then acid-etched. The surface morphology, roughness and surface wettability of the specimens were examined. Rat embryo osteoblasts MC3T3-E1 were cultured on the speciments for 1 d,3 d and 5 d respectively, the cell morphology and cell density were observed.ResultsThe different hierarchical porous topographies were formed on the surface of UFG and CP Ti after modified by SLA. The sizes of blasted holes on the surface and the surface roughness of both materials increased with the increase of blast pressure, but the values of UFG Ti were lower than those of CP Ti correspondingly(Plt;0.05). The surface wettability of them was also changed with the blast pressure, but the values of UFG Ti was significantly smaller than those of CP Ti(Plt;0.05). When the blast pressure was 0.6 Mpa, the UFG Ti exhibited excellent wettability, the cell density was the highest, the morphology of MC3T3-E1 cells on UFG Ti was superior to that on CP Ti.ConclusionUFG Ti exhibits proper surface morphology, roughness and excellent wettability, which is more appropriate for adhension and proliferation of MC3T3-E1 cells after modification by SLA at blast pressure of 0.6 Mpa.
Sandblastandacidetching;Ultrafinegraintitanium;Celladhension;MC3T3-E1
国家自然科学基金面上项目( 编号: 11672327) ; 陕西省社会发展科技攻关项目( 编号: 2016SF-155)
710032 西安,军事口腔医学国家重点实验室,口腔疾病国家临床医学研究中心,陕西省口腔医学重点实验室,第四军医大学口腔医院修复科
辛海涛029-84776464 E-mail: xhthmj@ fmmu.edu.cn
R783.1
A
10.3969/j.issn.1001-3733.2017.02.006
