新型钛种植体涂层构建及体外生物安全性评价
2017-11-30马瑞沈鹏刘一帆高勃吴江
马瑞 沈鹏 刘一帆 高勃 吴江
新型钛种植体涂层构建及体外生物安全性评价
马瑞 沈鹏 刘一帆 高勃 吴江
目的构建一种新型钛种植体涂层,检测其表面形貌及体外生物安全性。方法采用明胶作为交联剂,以本课题组前期制备的包裹SDF-1和rhBMP-2的双层载药纳米微球为基础,通过振荡渗涂交联法将微球交联至微弧氧化涂层的微孔中,在钛种植体表面构建出新型功能性涂层,观察其表面形貌。通过细胞毒性试验、口腔黏膜刺激试验及溶血试验对新型钛种植体涂层体外生物安全性进行初步检测。结果扫描电镜结果显示新型功能性涂层形貌良好。细胞毒性试验结果显示该涂层100%浸提液细胞毒性为1 级,溶血率为4.6%,口腔黏膜刺激试验结果显示该涂层对黏膜无刺激作用。结论通过振荡渗涂交联法构建的新型钛种植体表面涂层具有良好的表面形貌及生物安全性。
钛种植体; 载药微球; 涂层; 生物安全性
种植体相关感染仍是导致种植失败的重要原因之一[1]。感染导致的骨吸收,种植体松动甚至脱落都是临床的难题。如何寻求有效的方法抑制骨缺损区域的骨吸收,促进骨再生是当下研究的热点[2]。
基于缓释微球技术的种植体表面涂层的构建为其治疗注入了新理念,Wu等[3]在微弧氧化的纯钛表面构建了载卤代呋喃酮/聚乳酸缓释微球的新型抗菌涂层具有持久的抗菌性能和良好的成骨细胞相容性;Liu等[4-6]将羟基磷酸钙等涂层作为成骨药物BMP-2的载药系统,体外实验证实涂层具有成骨诱导性且有较长时效性。
本课题组前期成功制备了包裹SDF-1和rhBMP-2的双层载药微球,形态良好,体外释药较好[7]。本实验以新型壳聚糖双层缓释纳米微球为基础,采用振荡渗涂交联法在微弧氧化钛种植体表面构建出具有良好表面形貌的新型功能性涂层,并对其体外生物安全性进行初步评估。
1 材料与方法
1.1 主要实验材料及设备
冷冻干燥的包载BMP-2/SDF-1的双层载药纳米微球[(自制,粒径为542.33±14.38 nm)];β-甘油磷酸二钠盐五水(β-GP)、乙酸钙[CA(上海源叶生物科技有限公司)];纯钛板(TA2,宝钛集团有限公司);明胶(A型,Sigma-Aldrich公司);戊二醛(天津协和试剂公司);细胞培养相关试剂(包括DMEM培养基、双抗、胰蛋白酶、PBS缓冲液等,Hyclone);CCK-8试剂盒(日本同仁);旋涡振荡器(Vortex-5,北京恒奥德仪器仪表有限公司);超声波清洗器(TI-H160,Elma,德国);微量电子天平(BS-110S,德国);场发射扫描电子显微镜(S-4800,日立,日本);超声细胞粉碎仪(JY92-IIN,宁波新芝生物科技有限公司);恒温培养箱(Thermo,美国);流式细胞仪(FC-500,美国)。
1.2 新型钛种植体涂层的构建
1.2.1 试件制备 TA2商业纯钛板通过线切割制备成直径14.5 mm、厚度2 mm及直径5 mm、厚度1 mm的圆片,经碳化硅砂纸逐级打磨至1200 目,依次经丙酮、无水乙醇、去离子水超声清洗各10 min。以纯钛圆片为阳极,不锈钢为阴极,含有β-GP和CA的水溶液为电解液,电压300 V,占空比8%,频率600 Hz,采用脉冲直流电源微弧氧化处理5 min后立即用去离子水冲洗,吹干。
1.2.2 涂层构建 精确称取60 mg冷冻干燥的双层纳米载药微球置于1 ml、0.1%的明胶溶液,超声细胞粉碎仪乳化处理1 h;微量移液器吸取0.15 ml上述悬浊液滴至微弧氧化的试件表面,漩涡震荡仪上震荡1 h后4 ℃干燥,其后浸泡于2.5%的戊二醛溶液30 min,无水乙醇、去离子水清洗试件,4 ℃干燥。
1.3 材料浸提液制备
按照0.2 g/ml的材料质量与浸提介质比例,将涂层试件、微弧氧化试件完全浸泡于DMEM细胞培养液,37 ℃、5% CO2恒温箱孵育72 h。分别收集、过滤除菌。
1.4 细胞毒性试验[8]
全骨髓贴壁法分离培养SD大鼠骨髓间充质干细胞,培养至第3代采用流式细胞仪进行细胞鉴定。鉴定结果如图 1,参照GB/T 16886.5-2003,采用第3代对数生长期BMSC,配制成2.0×104/ml细胞悬液,每孔0.2 ml接种于96 孔板,细胞贴壁后分别置换为等量的不同浓度涂层试件及微弧氧化试件浸提液,设置阴性对照组(含10%FBS的DMEM),100%浸提液组,50%浸提液组,10%浸提液组,1%浸提液组,阳性对照组(含0.64%苯酚的培养液),每组设置6 个副孔,37 ℃孵箱连续培养,分别于第1、3、5天每孔加入20 μl CCK-8液,继续孵育2 h后,酶标仪于450 nm波长下测得吸光度值(A值)。计算各组的细胞相对增殖率。细胞相对增殖率=(实验组A值/阴性对照组A值)×100%。根据毒性评价标准转换为毒性分级。
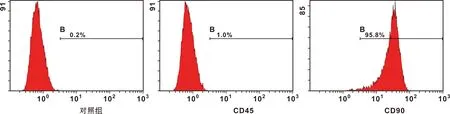
图 1 流式细胞鉴定结果
1.5 口腔黏膜刺激试验[9]
1.5.1 试验动物 健康成年新西兰兔10 只,双颊黏膜无病变,4~6 kg(第四军医大学动物中心)。
1.5.2 试验方法 高速涡轮手机于直径5 mm、厚度1 mm涂层试件及微弧氧化试件中间打2 个直径约0.5 mm圆孔,以备固定。牙胶片制备成同规格作为阴性对照组。参照YY/T 0279-1995采用将试件缝固在兔颊黏膜的方法进行试验。涂层试件与牙胶片纽扣式缝合固定于一侧颊黏膜(间隔3 mm以上),采用同样的方法将微弧氧化试件缝合于兔子另一侧颊黏膜,间隔3 mm以上未作任何处理处作为空白对照。
1.6 溶血试验[10-11]
1.6.1 试验动物 一只健康成年新西兰兔(第四军医大学动物中心)。
1.6.2 试验方法 参照YY/T 0127.1-1993和GB/T 16886.4-2003抽取兔耳血进行试验。涂层试件预先钴60灭菌处理。阴性对照组为10 ml 0.9%生理盐水组,阳性对照组为10 ml蒸馏水组,实验组为10 ml试件的生理盐水浸提液(按试件质量与生理盐水0.2 g/ml加入涂层试件,涂层试件需完全浸没于生理盐水中),每组设置3 个平行对照。溶血率lt;5%为该材料无溶血性。
1.7 统计学分析
2 结 果
2.1 新型钛种植体涂层表面形貌
试件喷金,场发射扫描电镜观察。结果如下:图 2显示微弧氧化后的试件表面呈现多孔状结构,孔径较均一,在1~10 μm之间,状如火山口状。图 3显示新型涂层试件表面形貌,低倍镜下可见纳米微球良好地分布于各个微孔中,孔隙覆盖率极高;高倍镜下可见微球与微球之间,微球与微孔壁间通过明胶紧密相连。

图 2 微弧氧化涂层扫描电镜图

图 3 新型涂层扫描电镜图
2.2 细胞毒性试验
流式细胞鉴定结果如图 1,第3代骨髓间充质干细胞CD90呈阳性表达,而CD45呈阴性表达,均符合骨髓间充质干细胞特征。图 4为细胞在100%浸提液中培养24 h的生长情况,图中可见细胞已完全贴壁,少许细胞变圆,大多呈梭形生长,细胞在100%浓度涂层试件浸提液中生长良好,细胞毒性实验结果见表 1~2。参考细胞相对增殖率,该材料细胞毒性反应分级为1 级,表明该材料基本不具有细胞毒性。

图 4 细胞在100%涂层试件浸提液的生长情况(×100)
Fig 4 BMSCs cultured in the leaching medium of the novel fuctional coating(×100)
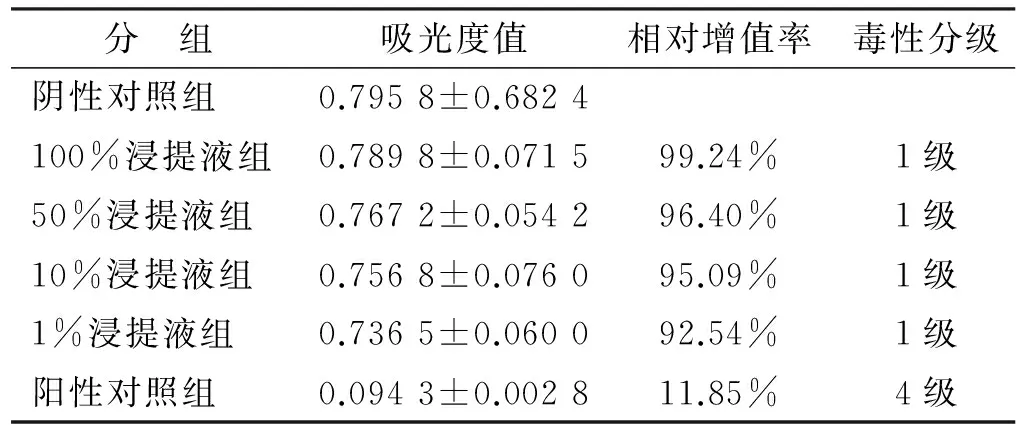
分 组吸光度值相对增值率毒性分级阴性对照组100%浸提液组50%浸提液组10%浸提液组0.7958±0.68240.7898±0.07150.7672±0.05420.7568±0.076099.24%96.40%95.09%1级1级1级1%浸提液组阳性对照组0.7365±0.06000.0943±0.002892.54%11.85%1级4级
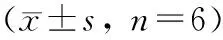
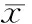
Tab 2 Cytotoxicity of microarc-oxidized titanium (±s, n=6)
2.3 口腔黏膜刺激试验
各组涂层试件与颊黏膜接触固位良好。1 只兔子的牙胶片脱落。肉眼观局部未见红肿、破溃等情况。组织病理学结果:涂层试件组、微弧氧化试件组与阴性及空白组相似,基底膜完整连续,固有层未见炎细胞浸润、血管增生等异常。组织学切片结果见图 5。
2.4 溶血试验
溶血试验结果如表 3,实验组溶血率=4.6%,该材料无溶血反应。
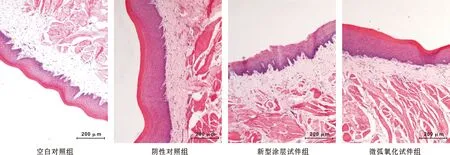
图 5 与试件相接触的兔颊黏膜组织观察(HE)
Fig 5 Morphology of mucous membrance at the contacted site of the test specimens(HE)
表 3 溶血试验结果(n=3)
Tab 3 Hemolysis of the groups (n=3)
3 讨 论
种植体周围炎对种植体的长期稳定产生很大的影响,引起骨吸收甚至种植失败[12]。目前研究较多的是种植体表面改性或涂层技术,比如改变植体表面能,释放金属离子或抗生素[13-15]。尤其是对于种植体周围炎出现炎性骨缺损时,如何抑制破骨效应、促进缺损骨组织内源性再生,是提高种植体远期成功率的重要问题。
研究表明基质细胞衍生因子(SDF-1)在干细胞归巢中具有关键作用,可以作为干细胞“归巢”的首选诱导因子[16]。同时,骨形态发生蛋白2能够在骨缺损区实现完整的骨再生,并且具有很强的异位成骨的能力[17]。基于上述研究,我们成功制备出包裹SDF-1和rhBMP-2的双层载药纳米微球并对其体外生物学性能进行了初步研究和证实。但常规种植体表面光滑,如何将载药纳米微球应用于种植体成为难题。微弧氧化是一种常用的种植体表面处理技术,能显著提高种植体的生物相容性和骨引导性,且多孔状的涂层形貌(孔径为1~5 μm)为与载药微球的结合提供了可能。若能够将包裹SDF-1和rhBMP-2的双层载药纳米微球黏附于微弧氧化微孔中,发挥SDF-1与BMP-2的联合作用,则有望实现种植体周围炎炎性骨缺损的修复。
Wu等[3]通过振荡渗涂交联法将载呋喃酮微球粒径为(408±14) nm加载于微弧氧化涂层的微孔中(孔径约为1~5 μm),结果显示复合涂层具有良好的表面形貌。本课题组前期成功制备的双层载药纳米微球粒径为(542.33±14.38) nm,与文献[3]中载呋喃酮微球粒径较接近,本实验借鉴上述方法,同样采用振荡渗涂交联法将双层载药纳米微球加载于微弧氧化涂层从而构建出一种新型功能性涂层。扫描电镜下观察结果显示新型涂层表面形貌良好,微球几乎全部位于微孔中,微孔与微孔之间的交界面微球黏附较少,微球的孔隙覆盖率极高,由于微球通过明胶黏附于微孔中,可以有效防止种植体植入过程中微球的脱落。但其是否可以作为种植体材料还需进行生物相容性实验。本实验通过体外细胞毒性试验、口腔黏膜刺激试验以及体外溶血试验对该新型种植体涂层的生物安全性进行初步评估。本文采用CCK-8法进行细胞毒性试验,CCK-8法较其他检测方法如MTT、WST法操作简便,结果更精确。细胞毒性结果显示BMSC细胞在不同浓度新型功能性涂层浸提液中吸光度值与阴性对照组无明显差异,新型功能性涂层组细胞毒性分级为1级,可以认为新型功能性涂层基本无细胞毒性;口腔黏膜刺激试验通过肉眼及组织学观察评估新型涂层试件以及其他对照试件对口腔黏膜的刺激作用,肉眼观察可见与各试件相接触的黏膜局部无红肿破溃等现象,组织病理学结果显示无炎细胞浸润及上皮异常增生现象,可认为新型涂层试件对口腔黏膜无刺激性。体外溶血试验多用于评价长期与骨或软组织接触的材料的体外急性溶血活性。本实验新型功能性涂层试件溶血率为4.6%,符合医用生物材料溶血率标准,可认为该材料无体外溶血作用。
综上所述,通过以上3 项实验结果,可初步认为该材料具有良好的生物安全性。我们将进一步对其体外促进成骨分化、抑制破骨细胞分化成熟及体内成骨等生物学活性进行深入研究,以期为促进骨缺损修复的治疗提供一种新思路。
[1] 任慧芳, 高勃, 程义成,等. 钛种植体表面新型抗菌涂层预防种植术后早期感染的动物实验研究术[J]. 临床口腔医学杂志, 2014, 30(3):143-146.
[2] Avila G, Misch K, Galindo-Moreno P, et al. Implant surface treatment using biomimetic agents[J]. Implant Dent, 2009,18(1):17-26.
[3] Wu J, Cheng Y, Gao B, et al. Fabrication andinvitrorelease behavior of a novel antibacterial coating containing halogenated furanone-loaded poly(L-lactic acid) nanoparticles on microarc-oxidized titanium[J]. Int J Nanomed, 2012, 7: 5641-5652.
[4] Liu Y, de Groot K, Hunziker EB. Osteoinductive Implants: The mise-en-scène for drug-bearing biomimetic coatings[J]. Ann Biomed Eng, 2003,32(3):398-406.
[5] Maus U, Andereya S, Gravius S, et al. BMP-2 incorporated in a tricalcium phosphate bone substitute enhances bone remodeling in sheep[J]. J Biomater Appl, 2008,22(6):559-576.
[6] Liu Y, Hunziker EB, de Groot K, et al. Introduction of ectopic bone formation by BMP-2 incorporated biomimetically into calcium phosphate coatings of titanium-alloy implants[J]. Key Eng Mater, 2003, 32(1): 240-242(1): 667-670.
[7] 沈鹏, 乔友备, 马瑞, 等. 包载rhBMP-2和SDF-1的双层纳米微球的构建及体外释药研究[J]. 实用口腔医学杂志, 2016, 32(2): 161-166.
[8] GB/T 16886.5-2003,中华人民共和国国家标准[S].医疗器械生物学评价:体外细胞毒性实验.
[9] YY/T 0279-1995,中华人民共和国医药行业标准[S].口腔材料生物学实验方法:口腔黏膜刺激实验.
[10]YY/T 0127.1-1993,中华人民共和国医药行业标准[S].口腔生物学实验方法:溶血试验.
[11]GB/T 16886.4-2003,中华人民共和国国家标准[S].医疗器械生物学评价:与血液相互作用实验选择.
[12] Warreth A, Boggs S, Ibieyou N, et al. Peri-implant Diseases: An overview[J]. Dent Update, 2015, 42(2):166-168, 171-174, 177-180.
[13] Norowski PA Jr, Bumgardner JD. Biomaterial and antibiotic strategies for peri-implantitis: A review[J]. J Biomed Mater Res Part B: Applied Biomaterials, 2009, 88(2): 530-543.
[14]Abdulkareem EH, Memarzadeh K, Allaker R P, et al. Anti-biofilm activity of zinc oxide and hydroxyapatite nanoparticles as dental implant coating materials[J]. J Dent, 2015, 43(12): 1462-1469.
[15]Massa MA, Covarrubias C, Bittner M, et al. Synthesis of new antibacterial composite coating for titanium based on highly ordered nanoporous silica and silver nanoparticles[J]. Mater Sci Eng C Mater Biol Appl, 2014, 45: 146-153.
[16]Shen W, Chen X, Chen J, et al. The effect of incorporation of exogenous stromal cell-derived factor-1 alpha within a knitted silk-collagen sponge scaffold on tendon regeneration[J]. Biomaterials, 2010, 31(28): 7239-7249.
[17]Hughes-Fulford M, Li CF. The role of FGF-2 and BMP-2 in regulation of gene induction, cell proliferation and mineralization[J]. J Orthop Surg Res, 2011, 6: 8.
(收稿: 2016-10-18 修回: 2017-01-04)
Fabricationandinvitrobiologicalsafetyofanovelfunctionalcoatingonmicroarc-oxidizedtitanium
MARui1,SHENPeng2,LIUYifan1,GAOBo1,WUJiang1.
1. 710032Xi'an,StateKeyLaboratoryofMilitaryStomatologyamp;NationalClinicalResearchCenterforOralDiseasesamp;ShaanxiKeyLaboratoryofStomatology,DepartmentofProsthodontics,SchoolofStomatology,TheFourthMilitaryMedicalUniversity,China; 2.OutpatientDepartmentofBeijingSpaceCity,AerospaceSystemsDivision,PLAStrategicSupportForce,Beijing
Objective: To fabricate and to study the surface morphology and biological safety of a novel coating on microarc-oxidized titanium.MethodsThe novel functional coating was fabricated by cross-linking the double-layer nanoparticles loading rhBMP-2 and SDF- 1 with gelatin on microarc-oxidation coating on titanium implant surface.The surface topography was observed and optimized, and the biological safety of the novel coating was primarily evaluated by cell toxicity test, oral mucosa stimulation test and hemolysis testinvitro.ResultsThe novel functional coating possesses excellent morphology. The coating showed the cytotoxicity of score 1 and no mucous membrane irritation, the hemolytic rate of the coating was 4.6%.ConclusionThe coating possesses good morphology and biological safety.
Titaniumimplant;Drug-loadedNanospheres;Coating;Biologicalsafety
国家自然科学基金(编号: 57311006)
710032 西安, 军事口腔医学国家重点实验室,口腔疾病国家临床医学研究中心,陕西省口腔医学重点实验室,第四军医大学口腔医院修复科(马瑞 刘一帆 高勃 吴江); 战略支援部队航天系统部航天门诊部(沈鹏)
吴江 029-84666469 E-mail:wujiang@fmmu.edu.cn
R783.1
A
10.3969/j.issn.1001-3733.2017.02.004
