花生种子萌发过程中子叶内肽酶活性研究
2017-10-12孔倩莹宾金华
李 诺,孔倩莹,宾金华
(1.嘉应学院生命科学学院,广东 梅州 514015;2.华南师范大学生命科学学院,广东 广州 510631)
花生种子萌发过程中子叶内肽酶活性研究
李 诺1,孔倩莹2,宾金华2
(1.嘉应学院生命科学学院,广东 梅州 514015;2.华南师范大学生命科学学院,广东 广州 510631)
探讨花生种子在萌发过程中子叶内肽酶的活性及其同工酶数量的变化,研究金属型蛋白酶抑制剂EDTA与不同温度对内肽酶的活性的影响。采用直立玻板法萌发花生种子,运用分光光度法测定内肽酶的活力,结果发现内肽酶活力在种子萌发6 d达到最大值;运用SDS-PAGE凝胶电泳法发现在种子萌发6 d出现5条内肽酶同工酶(其中2条是金属型内肽酶);在种子萌发8 d和10 d均出现7条内肽酶同工酶(其中4条是金属型内肽酶),这些内肽酶同工酶的最适温度约为40℃,EGTA对萌发6 d时存在的2种金属型内肽酶同工酶有明显抑制作用,但并不能完全抑制其活性。
花生;种子萌发;内肽酶;同工酶;种子活力;子叶
Abstract:The activity and isozyme of endopeptidases during peanut seeds germination were detected to research the activity of endopeptidase affected by different temperatures and inhibitors of metalloprotease EDTA.In this study,we used the standing boards to germinate peanut seeds,used spectrophotometry to determine the activity of endopeptidase during the germination of seeds. It was found that the ativity of endopeptidase reached the maximum at the sixth day. Using SDS-PAGE gel electrophoresis,we found 5 kinds of endopeptidase isoenzymes,in which there were two kind of metalloprotease of the 6 days of germination,and 7 kinds of endopeptidase isoenzymes,which there were 4 kind of metalloprotease after 8 days and 10 days of germination. The optimum temperature of these endopeptidase isozymes was about 40℃. Gelatin electrophoresis results showed that EGTA had inhibitory effect on two isozymes of metal type at 6 days of germination,but it did not completely inhibit the activity.
Key words:Arachis hypogaea L.;seed germination;endopeptidase;isoenzyme;seed vitality;cotyledon
种子萌发是种子植物发育的关键时期,其萌发过程经历着一系列复杂的生理生化变化,种子内的贮藏物质在水解酶作用下转变成供胚生长所需的物质[1]。因此在种子萌发的过程中,水解酶的活力会影响种子的萌发状况。花生种子萌发需要经过双激活过程,一方面是贮藏蛋白需要经过修饰成为可降解蛋白,另一方面是需要激活起主要降解作用的内肽酶。蛋白质降解需要水解酶的作用,蛋白水解酶的作用有多方面,主要包括参与植物生长发育过程中功能蛋白的降解和周转、清除逆境胁迫下非保护蛋白、参与降解丧失功能和不正常组装或聚积的蛋白质、加工剪接信号肽等[2-3]。蛋白水解酶可分为内肽酶(Endopeptidase)和外肽酶(Exopeptidase)两大类。一个蛋白要被彻底降解,首先要被内肽酶作用剪切成小肽,然后再被外肽酶作用降解为氨基酸。内肽酶在种子萌发时贮藏蛋白质动员过程中起关键作用[4]。在花生种子萌发过程中,子叶的内肽酶活性不断增强,降解种子发育过程积累的贮藏蛋白酶,降解产物将合成新的蛋白质以供种子萌发的需要。
内肽酶根据活性位点的性质以及对专一性抑制剂的敏感性的不同,又可分为丝氨酸蛋白酶(EC 3.4.21)、半胱氨酸蛋白水解酶(EC 3.4.22)、天门冬氨酸蛋白水解酶(EC 3.4.23)、金属蛋白酶(EC 3.4.24)、苏氨酸蛋白水解酶(EC 3.4.25)五类。其中,金属蛋白酶抑制剂可与金属蛋白酶的活性中心结合,使金属蛋白酶活力降低,甚至消失,但不使酶蛋白变性。EGTA是其中一种金属蛋白酶抑制剂,EGTA钙螯合物比较稳定,而EGTA镁螯合物稳定性较差[5-7]。
植物种子的内肽酶通常有多种同工酶,如浩浩巴(Simmondsia chinensis)有5条同工酶[8],大麦有 3 条同工酶[9]。宾金华等[10]从萌发5 d的花生种子子叶中分离提纯内肽酶,发现该酶有两条同工酶,均为半胱氨酸型内肽酶,并证明花生子叶的内肽酶不是在种子萌发的过程中重新合成,而是在种子发育的过程中合成并贮存于成熟种子中,这一发现也印证了种子萌发的双激活理论。但是关于内肽酶活性的表达机制及其在种子萌发过程中的变化情况目前还不清晰。为此,本研究深入探讨花生种子在萌发过程中子叶内肽酶的活性及其同工酶数量的变化,内肽酶的活性受金属型蛋白酶抑制剂和温度的影响等。
1 材料与方法
1.1 试验材料
供试花生品种为汕油523,由广东省农科院作物研究所提供;BSA、BAPNA、EGTA、牛血红蛋白等试剂均购自上海生化试剂厂。
1.2 试验方法
试验采用直立玻板发芽法萌发花生种子。选取完整、健壮、大小均一的花生种子,在1%的次氯酸钠溶液中浸泡10 min,超纯水冲洗6次,用直立玻板发芽法在28℃下暗萌发,每板10粒种子。在种子萌发 0、2、4、6、8、10 d分别取出其中的3板,每板种子作为一个重复,记录种子的萌发率。
测量并记录萌发种子下胚轴与胚根的生长情况,计算种子活力:

1.3 测定项目及方法
1.3.1 粗酶液提取 每个重复选取5片子叶,按1∶5(M/V)加入磷酸缓冲液(pH 7.2,0.02 mol/L,含0.01 mol/L β-巯基乙醇),在冰浴中研磨成匀浆,在4℃条件下浸提4 h后离心(12 096×g,30 min),上清液即为粗酶提取液。
1.3.2 可溶性蛋白质含量 采用考马斯亮蓝法测定萌发花生种子子叶可溶性蛋白质含量。按Bradford[11]的方法,用牛血清蛋白做标准曲线。将以上所得的子叶粗酶提取液分别稀释50倍,取25 μL稀释后的粗酶提取液和1.5 mL考马斯亮蓝G-250反应90 s,使用分光光度计测定OD595。
1.3.3 内肽酶活力 参照Harris等[12]的方法,以牛血红蛋白为底物测定萌发花生种子子叶内肽酶活力,以波长280 nm下OD值每分钟增加0.01为1个酶活力单位。
1.3.4 内肽酶同工酶检测 采用明胶电泳法检测萌发花生种子子叶内肽酶同工酶。按Jameel等[13]的方法,配制分离胶为12.5%的SDSPAGE,明胶按终浓度4%配制于胶中,样品与明胶上样缓冲液(体积比为1∶1)37℃温浴2 h后电泳。电泳在4℃冰箱中进行,在电泳结束后,用含有2%TritonX-100的Tris-HCl缓冲液处理凝胶45 min,用于去除SDS。用蒸馏水冲洗4次后,凝胶转入0.2 mmol/L pH 5.4的醋酸缓冲液中,40℃恒温处理12 h。反应结束后用考马斯亮蓝R250染色1 h,再用脱色液(含12%甲醇、7%冰醋酸)进行脱色,胶中亮白色的带即为内肽酶同工酶带。
1.3.5 EGTA对内肽酶活性的影响 采用分光光度法检测EGTA对萌发花生种子子叶内肽酶活性的影响。用浓度为0.1 mol/L的EGTA处理酶液,以BAPNA为底物测定内肽酶活性,参照Harris等[12]的方法,以波长410 nm下OD值每分钟增加0.01为1个酶活力单位。
1.3.6 EGTA对叶内肽酶同工酶的影响 采用明胶电泳法检测EGTA对萌发花生种子子叶内肽酶同工酶的影响。按Jameel[13]的方法,取10 μL酶液,加入0.2 mol/L EGTA溶液10 μL,于4℃下处理2 h,再加入20 μL明胶上样缓冲液,37℃温浴2 h后电泳,电泳后操作同1.3.4,胶中亮白色的带即为内肽酶同工酶带。
1.3.7 温度对内肽酶同工酶的影响 按Jameel[13]方法,分别于 20、30、40、50、60℃下测定萌发花生种子子叶内肽酶同工酶带。
2 结果与分析
2.1 花生种子活力的变化
花生种子置于垂直玻板盒中暗萌发处理,种子吸水膨胀,由静止的休眠状态恢复代谢生理活动,24 h后就能看出有胚根的长出,萌发6 d开始有侧根长出(图1,封二)。花生种子进入萌发状态,萌发前24 h是吸水膨胀的重要时期,继吸水24 h后大部分花生都呈现出芽状态,萌发2 d后超过50%的种子长出胚根,随着萌发时间的延长,花生的胚轴、胚根持续伸长,其中萌发2~4 d增长较为明显。萌发4 d后,种子活力指数的增长主要依赖于下胚轴与胚根的生长(表1)。从表1可以看出,花生种子的活力在萌发过程逐渐增加,萌发后2 d,种子吸胀明显,活力为0.40±0.11,萌发率为51.7%,下胚轴+胚根长为0.78±0.06 cm;萌发后4 d,萌发率达到100%,下胚轴+胚根长为1.89±0.20 cm,下胚轴+胚根长较萌发2 d时显著增加,是萌发后2 d的1.42倍,活力也明显增加。萌发4 d后,活力持续增加,但在萌发8 d后,活力增速减缓,萌发10 d的活力与萌发8 d差异不显著。

表1 萌发花生种子活力
2.2 萌发花生种子子叶可溶性蛋白质含量与内肽酶活力的变化
通过考马斯亮蓝法测量不同萌发天数的萌发花生子叶中的可溶性蛋白含量,使用分光光度法测量其内肽酶活性,结果见图2。种子萌发2 d与未萌发种子相比,子叶可溶性蛋白的含量下降十分明显,蛋白质含量减少49%,差异极显著(P = 0.007<0.01);至萌发4 d,蛋白含量依然呈现一个下降的趋势,但幅度相对较小;种子萌发4 d后,子叶可溶性蛋白含量开始增加,萌发6 d的蛋白含量比萌发4 d增加12.11%,差异显著(P = 0.035<0.05);萌发6 d后子叶中可溶性蛋白质含量增加缓慢,增长幅度小,差异不明显。

图2 花生种子萌发过程中子叶可溶性蛋白含量与内肽酶活性变化
与此同时,子叶内肽酶活性一直处于逐渐增强的状态。种子萌发0~10 d之间每隔2 d,内肽酶活性的增长率分别为2.72%、11.76%、34.15%、6.94%、3.73%。其中萌发4~6 d期间花生的内肽酶活性增强最为明显,差异极显著(P= 0<0.01),之后子叶的内肽酶活性增强幅度较小,差异不明显。内肽酶活性变化与种子活力指数变化相对比,可看出花生种子萌发的活力指数与子叶内肽酶活性呈正比关系。
2.3 萌发花生种子子叶内肽酶同工酶活性变化
花生种子萌发后6 d,出现了5条内肽酶同工酶带(EP1~2、EP5~7);萌发后8 d和10 d均出现7条内肽酶同工酶带(EP1~7),由此可见,随着萌发时间的延长,子叶内肽酶同工酶的种类有所增加(图4)。种子萌发6 d和8 d时,EP2、EP5、EP6、EP7这4种内肽酶的条带较其他条带清晰;萌发10 d,EP1和EP5的条带较之前清晰,但EP2、EP6和EP7条带亮度较之前降低。说明在萌发6~8 d时,EP2、EP5、EP6、EP7这4种内肽酶同工酶的活性较高,是降解蛋白质的主要内肽酶;而在萌发10 d时,EP2、EP6、EP7等同工酶的活性降低,而EP1和EP5活性增加,起主要的降解蛋白质的作用(图3)。由于分离胶中明胶浓度过大,或萌发0~4 d的种子内肽酶活性较弱,未出现条带。
2.4 EGTA对萌发花生种子子叶内肽酶活性的影响

图3 萌发花生种子子叶内肽酶同工酶凝胶图谱

图4 EGTA对萌发花生子叶内肽酶活性的影响

图5 EGTA对萌发花生种子子叶内肽酶同工酶的影响
由图4可知,EGTA对萌发0~4 d的子叶内肽酶活力无抑制作用,对萌发6~10 d的子叶内肽酶的抑制作用也不明显。从明胶电泳结果(图5)可以看出,萌发6 d时,EGTA对内肽酶同工酶EP1和EP6有抑制作用;萌发8 d时,EGTA对EP1、EP3、EP4、EP6有抑制作用;萌发10 d时,EGTA对条带显著增亮的EP1有明显的抑制作用,同时还抑制了EP3、EP4、EP6的活性。表明在萌发6 d时存在2种金属型内肽酶同工酶EP1、EP6,在萌发8 d和10 d时存在4种金属型内肽酶同工酶EP1、EP3、EP4、EP6,但在萌发6、8、10 d时,EGTA对EP6均不能完全抑制。
综合生化测定和明胶电泳的结果,花生种子萌发6 d存在2种金属型内肽酶同工酶,在萌发8 d和10 d时存在4种金属型内肽酶同工酶,但在花生种子萌发过程中,由于金属型内肽酶活性总体较弱,在生化测定中EGTA对内肽酶活力无明显抑制作用。
2.6 温度对萌发花生种子子叶内肽酶同工酶的影响
分别于 20、30、40、50、60℃测定内肽酶同工酶带,结果显示,萌发花生种子子叶内肽酶同工酶的最适温度约为40℃,温度过低或过高均会明显降低酶活力,甚至完全抑制某些内肽酶同工酶的活性(图6)。内肽酶同工酶EP2和EP5具有较强的温度适应性,其中EP2在20~60℃均显示出酶活力,酶活性受温度变化影响不大;EP5在20~50℃均显示出酶活力,但在60℃时酶活力消失,说明高于50℃时,EP5失去了酶活力;EP1在20℃和60℃时也具有酶活力;其余几种内肽酶同工酶在高于或低于40℃时酶活力均被抑制。因此在种子萌发的过程中应控制好萌发温度,使内肽酶活力达到最适的水平,利于种子萌发。
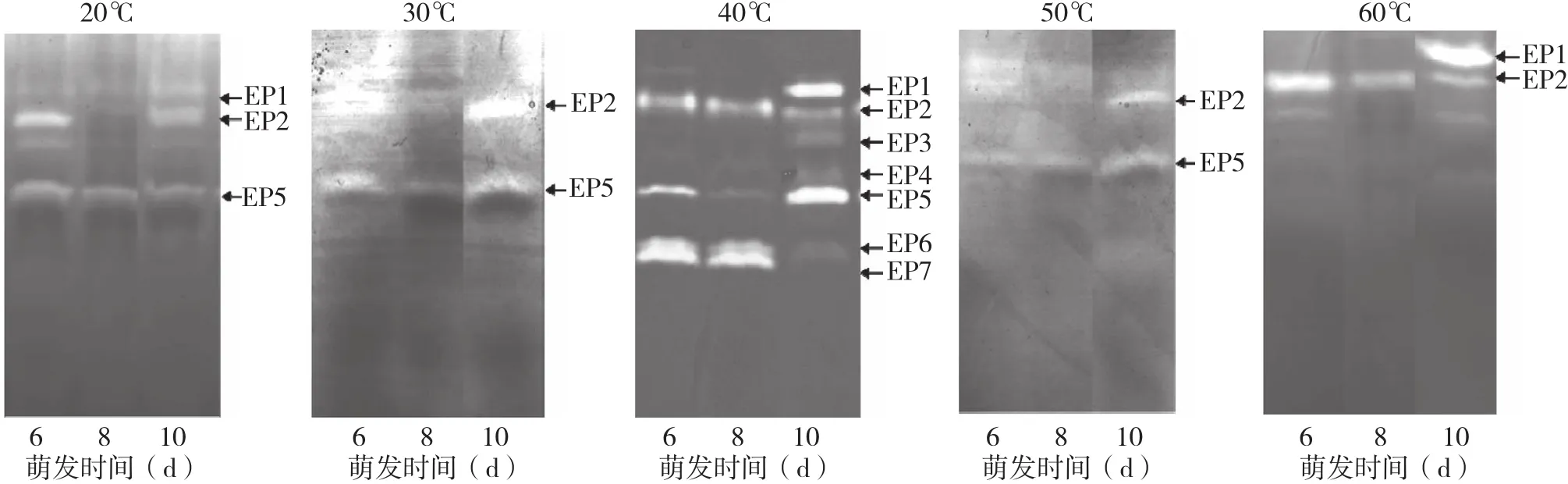
图6 温度对萌发花生种子内肽酶同工酶的影响
3 结论与讨论
内肽酶是在植物生长发育全过程中起着非常重要作用的蛋白水解酶,参与各项生命活动中蛋白质周转的过程[4]。因此,研究细胞内内肽酶的活性影响因素及其种类变化显得十分有必要。在萌发的过程中,种子的贮藏蛋白会被降解利用,在水解酶作用下转变成供胚生长所需的物质。在萌发初期,内肽酶活力显著增加,蛋白质被大量降解,其含量显著降低,被内肽酶降解成小肽的蛋白质在外肽酶的作用下进一步降解为氨基酸,植物体利用这些游离的氨基酸可以合成新的蛋白质,同时内肽酶活力有所降低,因此在种子萌发后期,蛋白质的含量有所增加。这与本研究结果一致,即花生种子萌发6~8 d可溶性蛋白质亦有轻微增加的趋势。
宾金华等[10]将花生子叶内肽酶经硫酸铵沉淀,Sephadex G-100凝胶层析,从萌发5 d的花生种子子叶中分离提纯内肽酶,发现该酶有两条同工酶,这两条内肽酶同工酶分子量非常接近,分子量分别为58 kD和55 kD,很可能是本试验中分离出来的两种内肽酶同工酶EP6和EP7。本研究明胶电泳的结果显示,EGTA对萌发6 d时存在的2种金属型内肽酶同工酶(EP1和EP6)有抑制作用,但并不能完全抑制EP6的活性,其原因可能是EGTA对花生的金属性内肽酶同工酶的抑制作用不明显,将酶液与EGTA混合处理后,EGTA与金属离子形成螯合剂的能力较弱,无法完全抑制金属型内肽酶同工酶的活性,活性较弱的金属型内肽酶同工酶则被EGTA抑制,活性较强的金属型内肽酶同工酶活性则无法完全被抑制,并由此推断EP 6酶活性中心很可能不含Ca2+。在萌发8 d和10 d时出现的EP3、EP4,以及在萌发10 d时活性明显增加的EP1均被EGTA完全抑制酶活力,由此可以推测金属型内肽酶EP1、EP3、EP4的活性中心含有Ca2+,与EGTA的螯合物能稳定存在,因此能被EGTA完全抑制[14]。金属型蛋白酶水分子的激活需要由二价金属离子,通常是Zn2+,有时是 Co2+或 Mn2+来完成[15-16]。同时,由于EGTA是一种钙螯合剂,与其他金属的螯合物稳定性较差,而EDTA几乎能够螯合所有的金属离子[14]。
本研究中,明胶电泳并没有发现萌发0~4 d的花生种子有内肽酶同工酶条带,但分光光度法测定内肽酶活性变化发现,萌发4 d时子叶内肽酶活性明显增加,这可能与分离胶中明胶浓度过大,或萌发0~4 d的种子内肽酶活性较弱有关。如果降低明胶的浓度,适当缩短酶与底物反应的时间,避免由于反应时间过长而使酶失活,内肽酶同工酶的条带会更为清晰。本研究结果表明,花生子叶内肽酶同工酶的最适温度约为40℃,温度过高或过低均会影响酶的活性。在萌发的过程中存在着一些温度耐受性较强且活性较高的内肽酶,如EP2和EP5,它们在种子萌发的过程中保持着较高的酶活力,其活性虽受到温度变化的影响,但温度在20~50℃范围内均不会使其完全失活,这些酶应该是花生种子萌发过程中起主要作用的内肽酶。通过本研究得知,萌发花生的子叶内肽酶存在着多种同工酶,这些同工酶的类型存在差异,内肽酶是促进蛋白质发生降解反应的重要蛋白酶,不同植物的内肽酶种类存在差异,同一植物在其不同的生长发育阶段内肽酶同工酶的种类和活性也会存在差异[17-18],在此方面还有很多未知的领域值得进一步深入探索。
[1] 杨寒霖,周峰,华春. 种子萌发阶段的代谢及其调控[J]. 种子,2016,35(9):51-54.
[2] 孙奎香,于遒功,张玉凤,等.水分胁迫对花生种子萌发过程中贮藏物质降解的影响[J]. 中国农学通报,2012,28(12):60-65.
[3] 刘衣男. 激素对花生种子萌发过程中储藏蛋白动员及内肽酶活性的影响[D]. 广州:华南师范大学,2011.
[4] 芮琪. 小麦叶片衰老过程中内肽酶同工酶变化和特性及Rubisco降解的研究[D]. 南京:南京农业大学,2004.
[5] Moses M A,Langer R. A metalloproteinase inhibitor as an inhibitor of neovascularization[J].Journal of Cellular Biochemistry,2010,47(3):230-235.
[6] Shi C,Xu L L. Characters of Cysteine endopeptidases in wheat endosperm during seed germination and subsequent seedling growth[J].Journal of Integrative Plant Biology,2009,51(1):52-57.
[7] Karmous I,Jaouani K,Ferjani E E,et al.Responses of proteolytic enzymes in embryonic axes of germinating bean seeds under copper stress[J]. Biological Trace Element Research,2014,160(1):108-123.
[8] Liu Q D,Zhu Y R,Li H T,et al. Changes of endopeptidase isoenzymes in Spirodela polyrrhiza Thallus during senescence and effect of exogenous L-Serine on endopeptidase isoenzymes[J]. Plant Physiology Communications,2010,46(3):241-244.
[9] Rui Q,Xu L. Characterization of endopeptidases in wheat leaves during dark—induced senescence[J]. Acta Botanica Sinica,2003,45(9):1049-1053.
[10] 宾金华,沈芸. 萌发花生种子子叶内肽酶的纯化和性质[J]. 热带亚热带植物学报,1996(4):66-73.
[11] Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein 2 dye binding[J].Ann Biochem,1976,72:1105-1112.
[12] Harris N,Chrispeels MJ. Histochemical and biochemical observations on storage proteinmobilization and protein body autolysis in cotyledons of germination mung bean seeds[J].Plant physiology,1975,56:292-299.
[13] Jameel S,Mcfadden BA. Gel Electrophoretic Profiles of Proteinases in Dark-Germinated Flax Seeds[J]. Plant Physiology,1984,76(3):730-734.
[14] 程艳,高静,徐红纳,等.螯合剂EDTA简介[J].化学教育,2009(5):4-6.
[15] Rayana S M,Anderson C J,José M R F,et al. Proteomic analysis of osmoprimed and heatshock-treated Eucalyptus urophylla seeds[J].Tree,2017,31(1):313–324.
[16] 赵喜亭. 失水胁迫对月季切花花瓣内肽酶种类及其活性的影响[D]. 北京:中国农业大学,2005.
[17] Inès K,Khadija J E,El F,et al. Responses of proteolytic enzymes in embryonic axes of germinating bean seeds under copper stress[J].Biological Trace Element Research,2014,160(1):108-115.
[18] Waleed A K,Mazhar U I,Muhammad W U. et al. Endogenous hydrolyzing enzymes:isolation,characterization,and applications in biological processes[J]. Polysaccharides,2015,6:535-579.
(责任编辑 邹移光)
Study on endopeptidase activity during peanut seeds germination
LI Nuo1,KONG Qian-ying2,BIN Jin-hua2
(1.School of Life Science,Jiaying University,Meizhou 514015,China;2.College of Life Science,South China Normal University,Guangzhou 510631,China)
S565.2;Q945.34
A
1004-874X(2017)06-0001-07
李诺,孔倩莹,宾金华.花生种子萌发过程中子叶内肽酶活性研究[J].广东农业科学,2017,44(6):1-7.
2017-03-16
广东省高等院校学科建设和教学质量与教学改革工程项目(415B0208)
李诺(1979-),女,硕士,讲师,E-mail:anorlee@126.com
宾金华(1962-),男,博士,教授,E-mail:binjh@scnu.edu.cn.
