大豆糖蜜中皂苷的提纯工艺及其抗氧化性质研究
2017-07-31倪春蕾张高鹏程建军
倪春蕾,徐 丽,张高鹏,程建军,高 亮
(东北农业大学食品学院,黑龙江哈尔滨 150030)
大豆糖蜜中皂苷的提纯工艺及其抗氧化性质研究
倪春蕾,徐 丽,张高鹏,程建军*,高 亮
(东北农业大学食品学院,黑龙江哈尔滨 150030)
为从大豆糖蜜中提取和纯化大豆皂苷,本研究通过单因素优化提取条件,探究AB-8树脂对大豆皂苷的吸附性能,利用乙醇的梯度洗脱对皂苷进行纯化;并通过测定大豆皂苷的羟自由基抑制能力、超氧自由基清除能力和总抗氧化能力对其抗氧化性质进行研究。结果表明:乙醇浓度为75%、料液比为1∶25、在70 ℃下提取4 h,大豆皂苷的得率最高,为(167.81±6.19) mg/g,此时皂苷纯度为42.57%±2.34%;AB-8树脂对皂苷的吸附率和解吸率分别为68.50%和49.99%;柱层析上样温度为25 ℃,皂苷提取液经AB-8树脂吸附和0~99%乙醇的梯度洗脱后,皂苷纯度提高到73.21%±1.05%;皂苷浓度在0.5~1.5 mg/mL内,其羟自由基抑制能力和总抗氧化能力随浓度的增加而提高,最高为(47.25±0.34) U/mg和(0.82±0.04) mmol/g,在2.0~4.0 mg/mL内,其抗超氧阴离子自由基能力随浓度增加而提高,最高为(28.93±1.07) U/g。本研究对于大豆糖蜜的利用及皂苷提纯具有参考价值。
大豆糖蜜,乙醇提取,大豆皂苷,柱层析,抗氧化性质
大豆糖蜜是醇法生产大豆浓缩蛋白过程中的副产品,是伴随着大豆浓缩蛋白的发展而发展起来的[1-2],其产量大且不易处理,常作为饲料廉价出售,易造成资源浪费和环境污染。大豆皂苷是大豆糖蜜中的主要非糖物质,约占大豆糖蜜干物质的6%~15%[3]。
大豆糖蜜中皂苷的提取以有机溶剂提取为主,其优点是方法成熟,但提取得到的皂苷纯度较低,很难直接应用,常需辅以各种纯化手段以获得大豆皂苷纯品。李成刚和张倩瑶分别采用乙醇和丙酮溶剂从大豆糖蜜中提取皂苷[4-5],辅以萃取、柱层析、低温离心等纯化手段得到大豆皂苷纯品。
AB-8树脂具有吸附容量大、选择性好、易于解吸附、机械强度大、再生处理方便、吸附速度快、价格便宜等优点,近年来在分离、浓缩和去除杂质上使用较多。刘燕和刘若瑜将大豆糖蜜预处理后,采用AB-8树脂从大豆糖蜜中分离大豆皂苷[6-7],再经有机溶剂萃取和重结晶得到大豆皂苷纯品。
大豆皂苷是糖分子环状半缩醛上的羟基和三萜类同系物的羟基失水缩合而成,属于三萜类齐墩果酸型皂苷,因此,可使用齐墩果酸作为标准品应用于比色法测定大豆皂苷含量[8]。国内外的研究[9-12]表明,大豆皂苷具有抗脂质氧化、抗自由基等多种生理功能。
本研究是以大豆糖蜜为原料,经酸沉、丙酮提取预处理去除杂质后,进行大豆皂苷的提取,采用柱层析和乙醇梯度洗脱对皂苷提取液进行纯化,对纯化后的大豆皂苷进行抗氧化性质研究。本研究的方法是提取和纯化大豆糖蜜中皂苷的一种生产成本较低的方法,且预处理过程中的酸沉和丙酮提取分别对低聚糖和异黄酮进行了分离,实现了大豆糖蜜中生物活性成分的连续分离,为大豆糖蜜的综合应用提供了理论基础,纯化后的皂苷也可应用到食品、医药和化妆品行业。
1 材料与方法
1.1 材料与仪器
大豆糖蜜(粗蛋白6.34%,粗脂肪4.97%,总糖54.59%,大豆皂苷8.79%,大豆异黄酮2.65%,灰分14.60%,以干基计) 大庆松嫩生物技术有限公司;齐墩果酸标品 Aladdin Industrail Corporation;AB-8树脂 南开大学化工厂;羟自由基测定试剂盒、抗超氧阴离子自由基测试盒、总抗氧化能力(T-AOC)测试盒 南京建成生物工程研究所;香草醛及其他试剂 分析纯。
电子分析天平 梅特勒-托利多仪器有限公司;数显搅拌水浴锅 常州赛普实验仪器厂;Allegra X-30R离心机 Beckman Counter;SHB-Ⅲ循环水式多用真空泵 郑州长城科工贸有限公司;R系列旋转蒸发仪 上海申生科技有限公司;PHM220 Lab pH meter Radiometer analytical SA;UVmini-1240分光光度计 日本岛津公司;玻璃层析柱(Ф20×300 mm),HL-2S恒流泵 上海嘉鹏科技有限公司。
1.2 实验方法
1.2.1 大豆糖蜜的预处理 调节大豆糖蜜固形物含量为10%,室温下用HCl调节pH2.5,于1500 r/min离心20 min,得到大豆糖蜜沉淀。
大豆糖蜜沉淀按料液比1∶10的比例加入丙酮和水(丙酮∶水=4∶1)的混合溶剂,调节pH=2.5,在温度55 ℃下提取2 h,得到的提取液于2500 r/min离心10 min,沉淀在105 ℃干燥3 h,得到皂苷粗品。
1.2.2 大豆皂苷含量测定 精密称取齐墩果酸标准品10 mg,置于50 mL容量瓶中用乙醇溶解,摇匀,得到浓度200 μg/mL的齐墩果酸标准品溶液。分别量取标准品溶液0.1、0.2、0.3、0.4、0.5 mL于具塞试管中,80 ℃水浴将溶剂挥干,然后分别加入5%的香草醛-冰醋酸溶液0.4 mL(取50 mg香草醛用冰醋酸定容于10 mL容量瓶中),再加入高氯酸1.6 mL,于70 ℃水浴中加热振荡15 min,取出后迅速用冰水冷却,加入4 mL乙酸乙酯稀释,用分光光度计于560 nm波长下测定吸光度,以吸光度为纵坐标,齐墩果酸浓度为横坐标绘制齐墩果酸溶液的标准曲线[13],得线性回归方程:y=0.0047x-0.0108,(R2=0.9943)。
通过校正曲线查得的是齐墩果酸的质量,齐墩果酸换算成大豆皂苷需要乘以换算系数2.2[13-15]。
大豆皂苷的得率和大豆皂苷的纯度由以下公式计算可得:
大豆皂苷的得率(mg/g)=提取液中大豆皂苷质量/提取用皂苷粗品质量
式(1)
式(2)
1.2.3 大豆皂苷提取条件优化 准确称取一定量皂苷粗品,加入适量乙醇在水浴中提取,提取液进行离心处理,得到的上清液即为皂苷的粗提液,进行皂苷含量的测定。
1.2.3.1 乙醇浓度对皂苷得率的影响 在提取温度70 ℃、提取时间2 h、料液比1∶20条件下,研究乙醇浓度(55%、65%、75%、85%、95%)对皂苷得率的影响。
1.2.3.2 料液比对皂苷得率的影响 在提取温度70 ℃、提取时间2 h、乙醇浓度75%条件下,研究料液比(1∶10、1∶15、1∶20、1∶25、1∶30)对皂苷得率的影响。
1.2.3.3 提取时间对皂苷得率的影响 在提取温度70 ℃、乙醇浓度2 h、料液比1∶25条件下,研究提取时间(1、2、3、4、5 h)对皂苷得率的影响。
1.2.3.4 提取温度对皂苷得率的影响 在乙醇浓度75%、提取时间4 h、料液比1∶25条件下,研究提取温度(40、50、60、70、80 ℃)对皂苷得率的影响。
1.2.4 AB-8树脂柱层析纯化大豆皂苷条件的确定
1.2.4.1 AB-8树脂对大豆皂苷吸附曲线和解吸曲线的绘制 取经预处理[16]的湿树脂2.0 g于具塞的磨口锥形瓶中,加入皂苷浓度为2 mg/mL的皂苷提取液20 mL,在25 ℃进行吸附,每15 min振荡一次,吸附24 h,前3 h每隔30 min取样一次,后面每1 h取样一次,测定其中的皂苷含量,绘制吸附动力曲线[17-20],并计算吸附率。
树脂吸附率(%)=(C0-C1)/C0×100
式(3)
将吸附饱和的树脂用95%乙醇溶液浸泡24 h,每1 h取样一次,测定皂苷含量,绘制解吸曲线,并计算解吸率。
树脂解吸率(%)=C2/(C0-C1)×100
式(4)
式中,C0为吸附提取液中皂苷的浓度,mg/mL;C1为吸附后皂苷的浓度,mg/mL;C2为解吸液中皂苷的浓度,mg/mL。
1.2.4.2 AB-8树脂柱层析吸附大豆皂苷温度的确定 取2.0 g湿树脂于具塞三角瓶中,加入4 mg/mL的皂苷提取液20 mL,在25、35、45 ℃分别静态吸附,作吸附等温线。24 h树脂完全达到吸附平衡,根据下式计算出吸附量(mg/g湿树脂)。以平衡浓度为横坐标,绘制吸附等温线。
Q=V0(C0-C1)/m
式(5)
式中,Q为吸附量,mg/g湿树脂;V0为样液体积,mL;C0为初始皂苷溶液浓度,mg/mL;C1为皂苷溶液的平衡浓度,mg/mL;m为湿树脂的质量,g。
1.2.4.3 AB-8树脂柱层析大豆皂苷上样量的确定 在25 ℃,以1 BV/h的流速对8 mg/mL皂苷提取液上AB-8层析柱,将样液连续注入层析柱,每5 mL为一个接取单位,测定流出液中皂苷浓度的变化,绘制动态吸附泄露曲线来考察其吸附特性,确定大豆皂苷的上样量。
1.2.4.4 乙醇梯度洗脱纯化大豆皂苷 乙醇为洗脱剂[21],浓度梯度为0、20%、40%、60%、80%、99%。以1 BV/h的流速,柱温25 ℃的条件下对树脂柱进行洗脱,按照浓度由低至高的顺序,0%和20%每10 mL为一管收集洗脱液,其余浓度每15 mL为一管收集洗脱液,用阿拉伯字母顺序标记收集试管号,测定洗脱液中大豆皂苷的含量。根据相似相溶原理,首先,样液中强极性的无机盐、糖和杂质在树脂上的吸附能力弱,易溶解在强极性的水和低浓度乙醇中(以Molish反应为阴性标志糖洗脱完全)。根据所得结果筛选皂苷浓度高的洗脱液,合并后得到的滤液用旋转蒸发仪于55 ℃减压脱溶,得大豆皂苷纯品。
1.2.5 大豆皂苷的抗氧化能力测定
1.2.5.1 大豆皂苷对羟自由基抑制能力的测定 将纯化后的皂苷稀释为0.5、1.0和1.5 mg/mL的不同浓度,按照羟自由基测定试剂盒说明书测定样品的羟自由基抑制能力。
抑制羟自由基能力(U/mg)=(对照OD值-测定OD值)/(标准OD值-空白OD值)×标准品浓度(8.824 mmol/L)÷[待测样品皂苷浓度(mg/mL)×取样量(0.2 mL)]
式(6)
1.2.5.2 大豆皂苷抗超氧阴离子自由基能力测定 将纯化后的皂苷稀释为2.0、3.0和4.0 mg/mL的不同浓度,按抗超氧阴离子自由基试剂盒说明书测定样品的抗超氧阴离子自由基能力。
抗超氧阴离子活力单位(U/g)=(对照OD值-测定OD值)/(对照OD值-标准OD值)×标准品浓度(0.15 mg/mL)×1000÷待测样品皂苷浓度(g/L)
式(7)
1.2.5.3 大豆皂苷总抗氧化能力(ABTS快速法)的测定 将纯化后的皂苷稀释为0.5、1.0和1.5 mg/mL的不同浓度,按照试剂盒方法配制应用液,按说明书添加各试剂,室温反应6 min,波长414 nm,测定各管吸光度值,并绘制标准品Trolox的标准曲线,经作图得:y=0.5513x+0.0611,(R2=0.9984)。
1.2.6 统计分析 每组实验均进行三次平行和重复实验,实验数据采用SPSS 17.0分析软件、Origin7.5绘图软件进行分析。
2 结果与分析
2.1 大豆皂苷的提取条件优化
2.1.1 乙醇浓度对皂苷得率的影响 由图1可知,随着乙醇浓度的升高,大豆皂苷的得率逐渐增加,当乙醇浓度达到75%时,得率为(133.93±3.12) mg/g,再增加乙醇的浓度,大豆皂苷的得率无显著性变化(p>0.05),原因是随着乙醇浓度的进一步升高,使一些非皂苷成分的醇溶性物质溶出增加[22],而影响了大豆皂苷的得率。因此,确定乙醇浓度75%为提取效果适宜浓度。
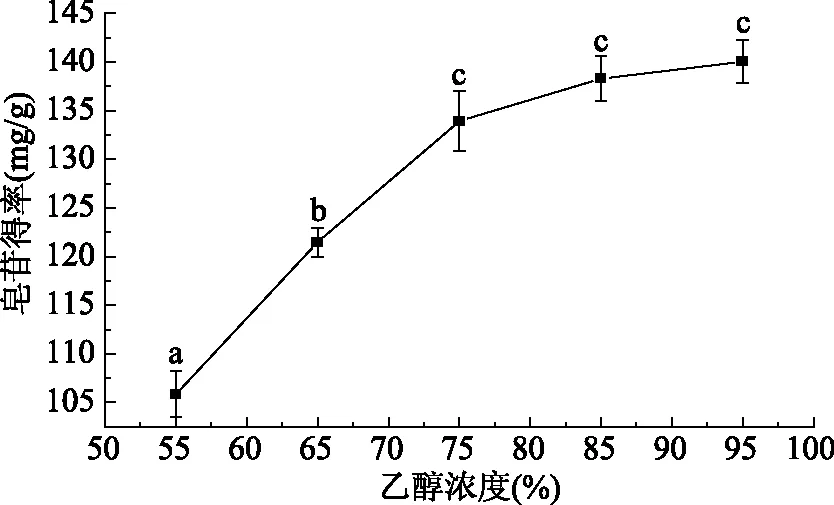
图1 乙醇浓度对大豆皂苷得率的影响Fig.1 Effect of ethanol concentration on the yield of soybean saponins注:不同字母表示有显著性差异(p<0.05)。图2~图4同。
2.1.2 料液比对皂苷得率的影响 由图2中可以看出,随着料液比的增加,大豆皂苷的得率逐渐增加,这主要由于料液比增加,增加了皂苷的溶出,当料液比为1∶25时,达到最高,为(152.79±5.86) mg/g,再增加料液比,大豆皂苷的得率无显著性变化(p>0.05),是由于溶剂的量增加,增加了其他物质的溶出[23],料液比过高会造成资源的浪费以及为后序工作带来不便。综合考虑料液比对大豆皂苷得率的影响,选择1∶25作为适宜提取料液比。

图2 料液比对大豆皂苷得率的影响Fig.2 Effect of solid-liquid ratio on the yield of soybean saponins
2.1.3 提取时间对皂苷得率的影响 由图3可以看出,随着提取时间的增加,大豆皂苷的得率呈现先上升后下降的趋势,这是由于在一定时间内,提取时间增加,可以增加大豆皂苷与溶剂的接触,增加了大豆皂苷的得率,在提取时间为4 h时,大豆皂苷的得率为(143.04±2.44) mg/g。而随着时间增加,大豆皂苷的得率出现微小的下降,这是在高温下,大豆皂苷在溶剂中发生部分的分解,降低了大豆皂苷的得率[10]。因此选定适宜提取时间为4 h。
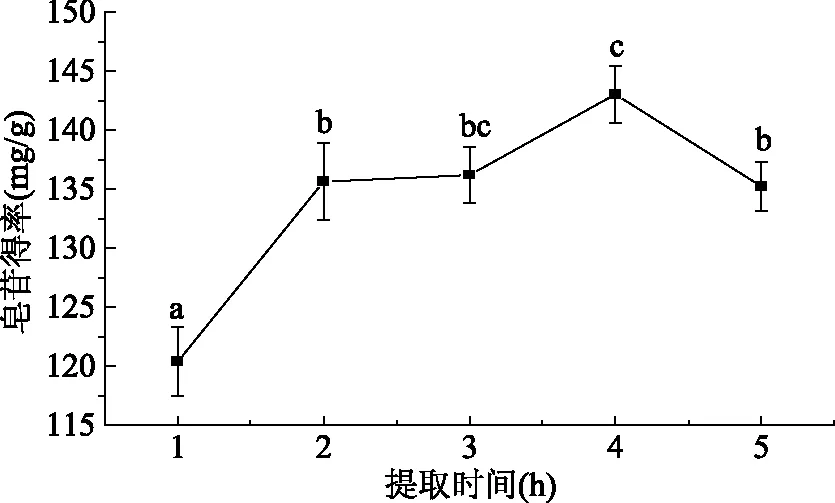
图3 提取时间对大豆皂苷得率的影响Fig.3 Effect of extraction time on the yield of saponins
2.1.4 提取温度对大豆皂苷得率的影响 由图4可以看出,随着提取温度的升高,大豆皂苷的得率增加,70 ℃时,大豆皂苷的得率为(167.81±6.19) mg/g,这是由于温度的提升可以加快大豆皂苷的溶解扩散速度,同时增加其在溶剂中的溶解度。但超过70 ℃以后,其得率无显著性变化(p>0.05),是由于温度的增加,一些大分子物质溶出,造成提取液的颜色变深,一些活性成分被破坏。从保持大豆皂苷的活性和减少能耗考虑,70 ℃的回流温度比较理想。
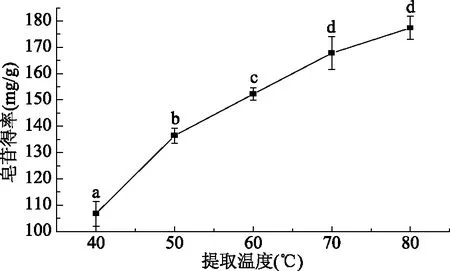
图4 提取温度对大豆皂苷得率的影响Fig.4 Effect of extraction temperature on the yield of saponins
综上所述,提取大豆皂苷的最佳条件为提取时间4 h,提取温度70 ℃,乙醇浓度75%,料液比1∶25,在此条件下大豆皂苷的得率最大,为(167.81±6.19) mg/g,大豆皂苷的纯度为42.57%±2.34%。
2.2 AB-8树脂柱层析大豆皂苷的条件确定及乙醇的梯度洗脱
2.2.1 AB-8树脂对大豆皂苷的吸附曲线和解吸曲线 由图5和图6可以看出,11 h为AB-8树脂对皂苷的吸附饱和点,经计算得吸附率为68.50%;9 h为95%乙醇对大豆皂苷的解吸终点,经计算的解吸率为49.99%。

图5 AB-8树脂对皂苷的吸附曲线Fig.5 Adsorption curve of AB-8 resin for saponins
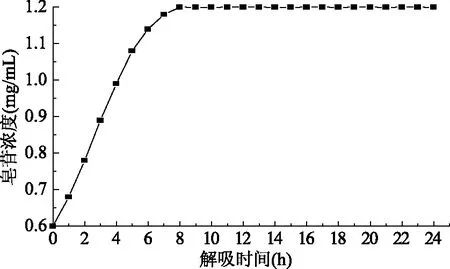
图6 AB-8树脂对皂苷的解吸曲线Fig.6 Desorption curve of AB-8 resin for saponins
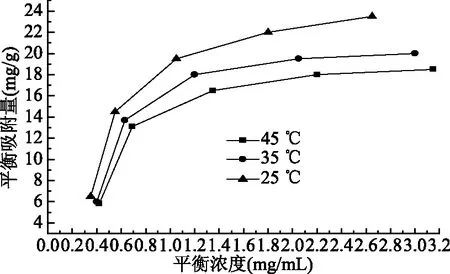
图7 AB-8树脂对大豆皂苷的吸附等温线Fig.7 The adsorption isotherms of resin AB-8 to saponins
2.2.2 AB-8树脂对大豆皂苷的吸附等温线 由图7可以看出,在25~45 ℃温度范围内,柱层析温度越低,AB-8树脂对大豆皂苷的吸附量越大,因为吸附是放热过程,所以温度升高不利于树脂的吸附,因此选用25 ℃为柱层析温度是适合的。
2.2.3 AB-8树脂柱层析大豆皂苷的上样量 由图8可知,AB-8树脂对皂苷的吸附过程在5~25 mL范围内,流出液中大豆皂苷的浓度缓慢升高,25 mL以后陡然上升,而后65 mL时AB-8树脂完全吸附饱和,说明AB-8树脂柱层析饱和点,因此,该树脂柱合适的上样量为20~25 mL。

图8 AB-8层析柱吸附穿透曲线Fig.8 The breakthrough curve of resin AB-8 dynamic state adsorption
2.2.4 乙醇梯度洗脱大豆皂苷 蒸馏水洗脱过程中,皂苷的浓度先增加后降低,

表1 不同浓度的大豆皂苷抑制羟自由基能力的测定结果Table 1 Determination of hydroxyl radical inhibition by different concentration of soybean saponins
注:不同字母表示有显著性差异(p<0.05),表2、表3同。

表2 不同浓度的大豆皂苷抗超氧阴离子自由基能力的测定结果Table 2 Determination of superoxide anion free radical inhibition by different concentration of soybean saponins

表3 不同浓度的大豆皂苷总抗氧化能力的测定结果Table 3 Determination of total antioxidant inhibition by different concentration of soybean saponins
洗脱至10号管,皂苷不再流失,Molish反应为阴性,说明此时水溶性糖类洗脱完全。从图9可以看出,水中大豆皂苷的溶解度很低,水洗脱的主要作用是除去皂苷提取液中的非皂苷成分,如可溶性蛋白质、糖类、类胡萝卜素等色素物质。

图9 乙醇溶液柱层析洗脱结果Fig.9 The results of column chromatography by ethanol eluting注:1~10为蒸馏水洗脱即乙醇浓度为0%,11~20为20%乙醇洗脱,21~30为40%乙醇洗脱,31~40为60%乙醇洗脱,41~50为80%乙醇洗脱,51~60为99%乙醇洗脱。
20%乙醇溶液洗脱过程中,皂苷浓度呈现先上升后下降的趋势,最大的皂苷浓度为0.29 mg/mL,洗至20号管时皂苷不再流失,Molish反应为阴性。
40%乙醇溶液洗脱过程中,皂苷浓度呈现出先增加后降低的趋势,总体浓度相对较小,说明此时洗脱出的物质是非皂苷成分,如异黄酮、类胡萝卜素等,洗至30号管时,皂苷不再流失,Molish反应为阴性,说明此时样液中的糖类洗脱完全。
60%乙醇溶液洗脱过程中,32~35号管中皂苷浓度相对较高,随后逐渐下降,洗至40号管时,皂苷不再流失,从36号管Molish反应开始为阴性,说明原料液中的醇溶性糖类已洗脱完全,34号管的皂苷浓度为0.98 mg/mL。
80%乙醇溶液洗脱过程中,洗脱液中皂苷的浓度比较集中,皂苷浓度呈现先增加后逐渐降低的趋势,洗至50号管时,皂苷浓度陡然下降,说明此浓度的洗脱效果比较明显,42号、43号和44号管的皂苷浓度分别为0.85、0.87、0.82 mg/mL。
99%乙醇溶液洗脱过程中,52号管的皂苷浓度陡然增加,随后逐渐降低,洗至60号管时洗脱完全,在此浓度下,洗脱液中大豆皂苷的浓度达到最大,52号管、53号管和54号管的皂苷浓度分别为1.26、1.15、0.89 mg/mL。
合并34、42、43、44、52、53和54号的皂苷收集溶液,减压浓缩后真空干燥[24],经测定得到纯度为73.21%±1.05%的大豆皂苷纯品。
2.3 大豆皂苷的抗氧化性质测定
不同浓度的大豆皂苷抑制羟自由基能力、抗超氧阴离子自由基的能力、总抗氧化能力的测定结果分别见表1、表2、表3。
由表1、表2、表3可看出,皂苷浓度在0.5~1.5 mg/mL内,其羟自由基抑制能力和总抗氧化能力随浓度的增加而提高,最高为(47.25±0.34) U/mg和(0.82±0.04) mmol/g;在2.0~4.0 mg/mL内,其抗超氧阴离子自由基能力随浓度增加而提高,最高为(28.93±1.07) U/g,且不同浓度之间的抗氧化能力差异显著[25-27](p<0.05)。
3 结论
通过单因素和正交实验优化了乙醇-水提取大豆皂苷的条件为乙醇浓度75%、料液比1∶25、提取温度70 ℃、提取时间4 h,在此条件下,大豆皂苷的得率达到最高,为(167.81±6.19) mg/g,此时皂苷的纯度为42.57%±2.34%。
AB-8树脂对皂苷的吸附率和解吸率分别为68.50%和49.99%,柱层析温度为25 ℃;皂苷提取液经AB-8树脂吸附和0~99%乙醇的梯度洗脱后,皂苷纯度提高到73.21%±1.05%。
皂苷浓度在0.5~1.5 mg/mL内,其羟自由基抑制能力和总抗氧化能力随浓度的增加而提高,最高为(47.25±0.34) U/mg和(0.82±0.04) mmol/g;在2.0~4.0 mg/mL内,其抗超氧阴离子自由基能力随浓度增加而提高,最高为(28.93±1.07) U/g。
[1]Arai S,Suzuki H,Fujimaki M,et al. Studies on Flavor Components in Soybean[J]. International Journal of Epidemiology,2014,37(5):923-932.
[2]方伟辉. 大豆糖蜜分离及低聚糖生物纯化的研究[D]. 无锡:江南大学,2004.
[3]蒋丽华,华欲飞. 大豆糖蜜综合利用[J]. 粮食与油脂,2006(8):12-14.
[4]李成刚. 大豆糖蜜中皂苷的提取纯化及生物活性的研究[D]. 哈尔滨:东北农业大学,2008.
[5]张倩瑶. 大豆糖蜜分离提取异黄酮和皂甙的研究[D]. 无锡:江南大学,2013.
[6]刘燕. 大豆糖蜜中功能成分的分离纯化[D]. 无锡:江南大学,2008.
[7]刘若瑜. 大豆糖蜜中功能性成分的分离与制备[D]. 郑州:河南工业大学,2012.
[8]王储炎,艾启俊,阚建全,等. 大豆皂苷的研究进展[J]. 粮食与食品工业,2005,12(6):31-34.
[9]Liwei Gu,Guanjun Tao,Wenying Gu,et al. Determination of Soyasaponins in Soy with LC-MS Following Structural Unification by Partial Alkaline Degradation[J]. Journal of Agricultural & Food Chemistry,2002,50(24):6951-6959.
[10]朱翠萍,刘国庆,罗敏,等. 大孔吸附树脂对大豆皂苷的吸附研究[J]. 离子交换与吸附,2003,19(4):318-323.
[11]Decroos K,Vincken J P,Heng L,et al. Simultaneous quantification of differently glycosylated,acetylated,and 2,3-dihydro-2,5-dihydroxy-6-methyl-4 H-pyran-4-one-conjugated soyasaponins using reversed-phase high-performance liquid chromatography with evaporative light scattering detection[J]. Journal of Chromatography A,2005,1072(2):185-193.
[12]胡学烟. 高品质大豆皂甙、大豆异黄酮的制备研究[D]. 无锡:江南大学,2001.
[13]滕燕平,张玉梅,刘颖,等. 分光光度法测定大豆总皂甙含量[J]. 中国食品卫生杂志,2000,12(4):10-13.
[14]Tani T,Katsuki T,Kubo M,et al. Histochemistry. V. Soyasaponins in soybeans(Glycine max MERRILL,seeds)[J]. Chemical & Pharmaceutical Bulletin,1985,33(9):3829-3833.
[15]Ireland P A,Dziedzic S Z,Kearsley M W. Saponin content of soya and some commercial soya products by means of HPLC of the sapogenins[J]. Journal of the Science of Food & Agriculture,1986,37(7):694-698.
[16]周尽花,周春山. 大孔吸附树脂法柚皮果胶脱色工艺研究[J]. 离子交换与吸附,2005,21(6):542-550.
[17]鲁桂华,朱瑞罡,王恒,等. 大孔吸附树脂纯化新疆大叶补血草根茎中总黄酮工艺考察[J]. 中国医院药学杂志,2015,35(16):1445-1449.
[18]崔翰明,张秋燕,林海,等. b三七总皂苷的大孔吸附树脂纯化工艺和质量分析研究[J]. 中草药,2012,43(11):2177-2182.
[19]张若洁,徐永霞,王鲁峰,等. 大孔树脂纯化芦笋总皂苷的工艺研究[J]. 中草药,2012(6):1097-1100.
[20]姚新成,张婷,唐辉,等. 大孔吸附树脂纯化新疆两色金鸡菊总皂苷[J]. 河北大学学报自然科学版,2016,36(3):242-248.
[21]董加宝,段丽萍,谭力,等. 苦瓜皂苷提取及纯化工艺的研究[J]. 食品研究与开发,2016,37(13):48-51.
[22]陈燕军,张毅贞,卢汝梅,等. 正交实验法优选从豆制品下脚料中提取大豆皂苷的工艺[J]. 中草药,2001,32(7):602-604.
[23]张佰荣,程曼. 超声波法提取大豆豆渣中大豆皂苷的工艺研究[J]. 吉林化工学院学报,2014,31(9):6-9.
[24]徐东伟,王绍辉,刘同祥. Box-Behnken响应面法优化通关藤总皂苷的超声提取工艺及其纯化工艺研究[J]. 中国药房,2016(25):3535-3538.
[25]李笑梅,王松. 菜豆皂苷抗氧化及抑菌活性研究[J]. 食品科学,2011,32(17):81-84.
[26]苏伟,赵利,刘建涛,等. 栀子总皂苷抗氧化能力的研究[J]. 食品科学,2009,30(15):75-77.
[27]汪海波. 大豆异黄酮及大豆皂甙的抗氧化性研究[J]. 食品研究与开发,2008,29(3):9-12.
Purification and the antioxidant properties of saponins in soy molasses
NI Chun-lei,XU Li,ZHANG Gao-peng,CHENG Jian-jun*,GAO Liang
(College of Food Science,Northeast Agricultural University,Harbin 150030,China)
Aiming to purify saponins from soybean molasses,single-factor experiments was carried out to optimize the extraction. The adsorption properties of AB-8 resin on saponins was studied,and the gradient elution was used to purify the saponins. The antioxidant properties of saponins were studied by the hydroxyl radical inhibition ability,superoxide radical scavenging capacity,and total antioxidant capacity. The optimized condition determined was that ethanol concentration of 75%,ratio of ethanol/water to raw material 25∶1,at 70 ℃ for 4 h,and the actual yield of saponins was(167.81±6.19) mg/g. Meanwhile,the purity of saponins was 42.57%±2.34%. The adsorption rate and desorption rate of AB-8 resin on saponins were 68.50% and 49.99%,respectively. The temperature was 25 ℃ of column chromatography. Moreover,the purity of saponins reached to 73.21% by AB-8 resin column chromatography and 0~99% ethanol gradient elution. Among the saponins concentration of 0.5~1.5 mg/mL,the hydroxyl radical inhibition ability and total antioxidant capacity increased with the increasing concentration,the maximum was(47.25±0.34) U/mg and(0.82±0.04) mmol/g,respectively. Among 2.0~4.0 mg/mL,the superoxide radical scavenging capacity increased with the increase of concentration,the maximum was(28.93±1.07) U/g. The study is valuable to the comprehensive utilization of soybean molasses and the purification of saponins.
soybean molasses;ethanol extraction;soybean saponins;column chromatography;antioxidant properties
2017-02-14
倪春蕾(1992-),女,硕士研究生,研究方向:粮食、油脂及植物蛋白工程,E-mail:xiaoxiao0225lei@163.com。
*通讯作者:程建军(1969-),男,博士,教授,研究方向:粮食、油脂及植物蛋白工程,E-mail:cheng577@163.com。
国家科技支撑计划课题(大豆产业链共性关键技术创新与示范2014BAD22B01)。
TS201.2
B
1002-0306(2017)13-0153-06
10.13386/j.issn1002-0306.2017.13.028
