山东生猪屠宰环节沙门氏菌血清型及耐药性测试
2017-06-28刘鲜鲜赵建梅曲志娜黄秀梅王玉东王君玮
王 娟,刘鲜鲜,,张 倩,赵建梅,曲志娜,黄秀梅,王玉东,邹 明,王君玮
山东生猪屠宰环节沙门氏菌血清型及耐药性测试
王 娟1,刘鲜鲜1,2,张 倩3,赵建梅1,曲志娜1,黄秀梅1,王玉东1,邹 明2,王君玮1
目的 了解山东省生猪屠宰感染沙门氏菌耐药状况,指导临床用药。方法 利用沙门氏菌血清型快速分型试剂盒鉴定血清型,微量肉汤稀释法对298株沙门氏菌进行8大类13种药物的药敏试验。结果 鉴定出9种血清型,以德尔卑、鼠伤寒沙门氏菌为主;298株沙门氏菌对13种药物的耐药状况不同,对四环素类药物多西环素、四环素的耐药率较高,分别为97.99%(292/298)、80.20%(239/298),对粘杆菌素E最为敏感,耐药率仅为2.01%(6/298),其次为奥格门丁和氧氟沙星,耐药率分别为2.35%(7/298)和4.03%(12/298),多重耐药率为81.88%(244/298),优势耐药谱型为四环素-多西环素。结论 山东省生猪屠宰环节沙门菌优势血清型为德尔卑沙门氏菌,对不同药物的耐药情况不同,不同屠宰环节的耐药性存在显著差异,多重耐药现象严重,耐药谱型种类繁多。
猪; 屠宰; 沙门菌; 血清型;耐药
Supported by the Program of Agricultural Product Quality Safety Risk Assessment(No.GJFP 201600703)
沙门氏菌(Salmonella)是一种重要的人兽共患病病原菌之一,每年因沙门氏菌感染而引起的食物中毒事件占食源性疾病的70%-80%[1]。沙门氏菌血清型众多,目前发现了2500多种,我国发现了292种,其中有20种左右的沙门氏菌血清型易引起人畜患病[2],危害较大的为鼠伤寒、肠炎以及猪霍乱沙门氏菌[3]。至今为止,沙门氏菌病的防治主要依靠抗生素类药物,但由于抗生素的不合理使用,使得沙门氏菌产生了耐药以及多重耐药现象,耐药谱型不断增多,给畜禽养殖以及人类生命安全造成威胁。猪肉产品作为沙门氏菌的主要载体之一,特对生猪屠宰环节沙门氏菌的血清型和耐药性进行研究。
1 材料与方法
1.1 试验菌株 2015年分离自山东生猪屠宰场不同屠宰环节猪胴体表面拭子样品的298株沙门氏菌和大肠杆菌标准菌株(ATCC 25922),由中国动物卫生与流行病学中心动物产品安全监测室保存。
1.2 主要试剂药品 胰蛋白大豆胨肉汤、MH(Mueller-Hinton)肉汤均购自北京陆桥生物技术有限公司;氯化钠购自天津市天大化工实验厂; GoTaq○RGreen Master Mix酶、DNA Marker DL1000购自TaKaRa公司,沙门氏菌血清型快速分型试剂盒(xMAP Salmonella Serotyping Assay RUO Kit)购自美国Luminex 公司。
含有青霉素类(氨苄西林/AM、奥格门丁/A/C);头孢类(头孢噻呋/CEF);氨基糖苷类(庆大霉素/GM、大观霉素/SPT);四环素类(四环素/TE、多西环素/DOX);氯霉素类(氟苯尼考/FFC);磺胺类(磺胺异恶唑/SF、新诺明/SXT);喹诺酮类(恩诺沙星/ENR、氧氟沙星/OFL);粘杆菌素(CLE)等13种药物的96孔药敏板,购自天津市金章科技发展有限公司。
1.3 主要仪器 生物安全柜(美国NUAIRE公司)、电热恒温培养箱(美国NUAIRE公司)、快速涡匀器(中外合资深圳南海北有限责任公司)、PCR仪(美国BIO-RAD公司)、Luminex 200液相芯片分析仪(美国Luminex 公司)。
1.4 方法
1.4.1 血清学鉴定 利用沙门氏菌血清型快速分型试剂盒和Luminex 200液相芯片分析仪对菌株进行血清型鉴定,PCR反应体系为25 μL,反应进行共30个循环,详细反应组分和反应程序见表1。
交联沙门氏菌O抗原、H抗原、AT抗原基因的微球需3.75倍稀释才能使用,稀释后的微球45 μL加PCR反应产物5 μL在95 ℃反应5 min,52 ℃反应30 min,52 ℃保存备用。在用Luminex 200液相芯片分析仪读取数据前仪器需预热至52 ℃,SAPE需稀释至6 μg/mL,在之前微球和PCR产物反应得到的混合物中每个样加50 μL SAPE,保持52 ℃ 10 min之后进数据读取、分析。
表1 PCR反应体系与程序
Tab.1 Reaction systems and procedures of PCR
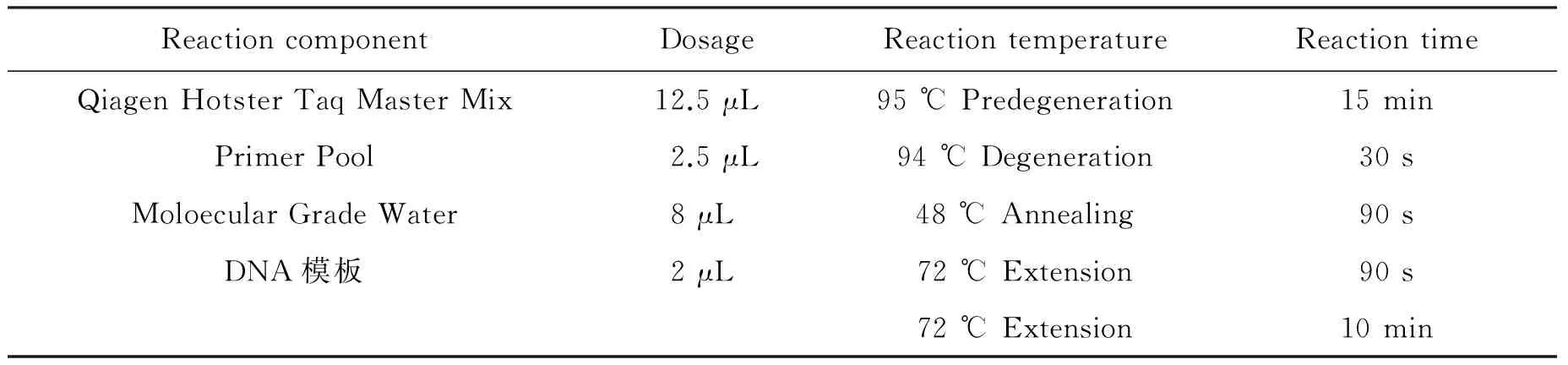
ReactioncomponentDosageReactiontemperatureReactiontimeQiagenHotsterTaqMasterMix12.5μL95℃Predegeneration15minPrimerPool2.5μL94℃Degeneration30sMoloecularGradeWater8μL48℃Annealing90sDNA模板2μL72℃Extension90s72℃Extension10min
1.4.2 药敏试验方法 按照国际通用标准-微量肉汤稀释法(MIC法)测定298株沙门氏菌对8类13种抗菌药物最小抑菌浓度。
首先从12mL MH肉汤中吸取100 μL加入药敏板的空白对照孔中,再挑取新鲜菌落制备0.5麦氏浊度的菌落,吸取10 μL菌液加入12mLMH肉汤中混匀,依次加入药敏板中,每孔100 μL,以大肠杆菌作为质控菌株,于37 ℃恒温培养箱中培养20 h。
结果判定参照CLSI文件VET01-S2(2013)和M100-S24(2014)标准,在质控菌株的最低抑菌浓度符合规定的前提下进行结果判定,凡细菌生长的孔内,呈弥散状混浊或底部有沉淀,无细菌生长的孔内所含最低抗菌药物浓度即为最低抑菌浓度。
2 结 果
2.1 血清型分型结果 利用沙门氏菌血清型快速分型试剂盒和Luminex 200液相芯片分析仪进行沙门氏菌的血清分型,能够准确鉴定出目前所有常见的沙门氏菌血清型,虽然成本较高但方便快捷,准确率高。本实验中共检测出9种血清型,分别为德尔卑沙门氏菌(n=78)、鼠伤寒沙门氏菌(n=59)、汤普逊沙门氏菌(n=45)、阿贡纳沙门氏菌(n=40)、肠炎沙门氏菌(n=25)、罗米他沙门氏菌(n=18)、策维埃沙门氏菌(n=15)、拉古什沙门氏菌(n=12)、奥里塔蔓林沙门氏菌(n=6),软件处理界面如图1所示,峰值最高的地方对应的因子即为该样品的抗原因子。不同屠宰环节沙门氏菌血清型不同,具体见表2。
图1 Luminex 200软件处理结果Fig.1 Result from Luminex 200
表2 不同环节血清型个数统计结果
Tab.2 Results of serum from different links in slaughter
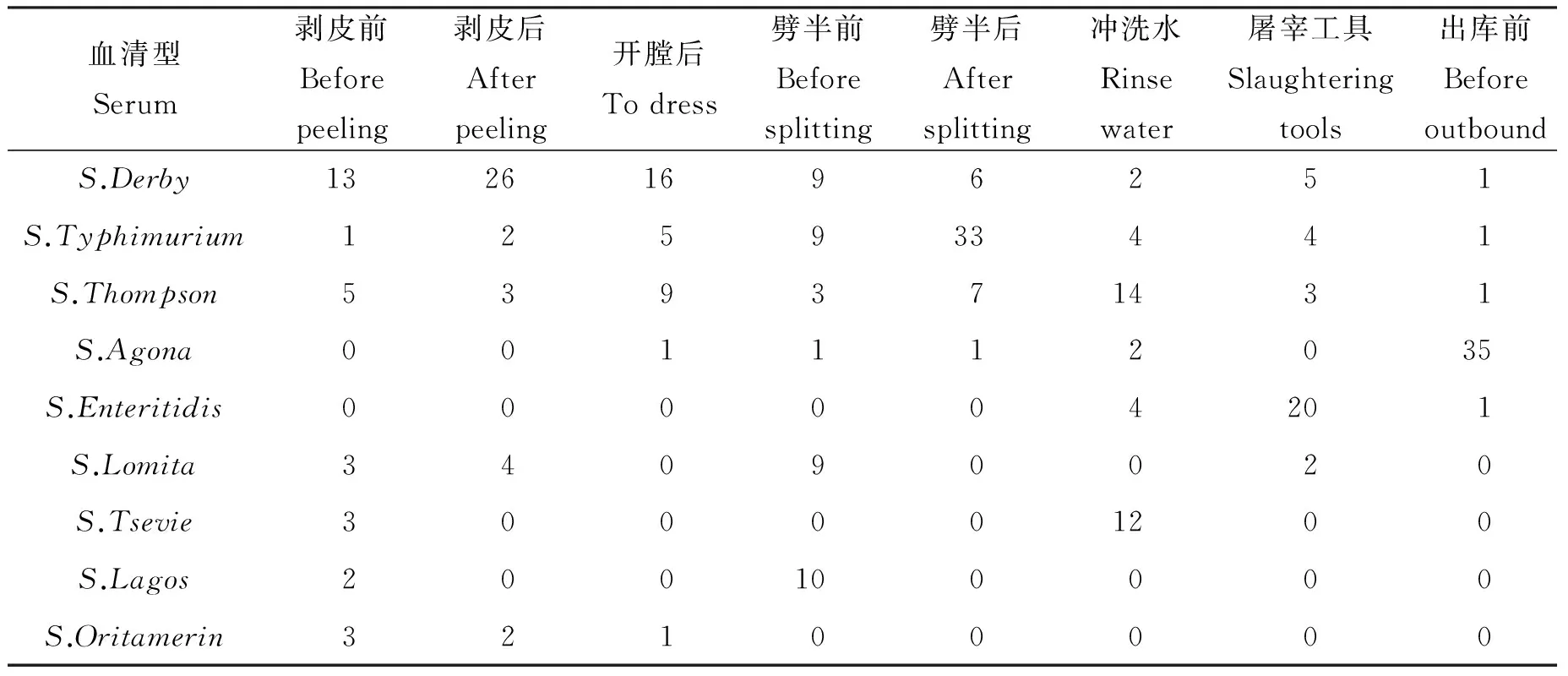
血清型Serum剥皮前Beforepeeling剥皮后Afterpeeling开膛后Todress劈半前Beforesplitting劈半后Aftersplitting冲洗水Rinsewater屠宰工具Slaughteringtools出库前Beforeoutbound合计TotalS.Derby1326169625178S.Typhimurium12593344159S.Thompson53937143145S.Agona00111203540S.Enteritidis00000420125S.Lomita3409002018S.Tsevie30000120015S.Lagos20010000012S.Oritamerin321000006
2.2 药敏试验结果
2.2.1 生猪屠宰环节整体耐药结果 298株沙门氏菌对13种药物耐药程度明显不同,耐药状况严重,其中对DOX的耐药程度最高,为97.99%,其次为TE,耐药率为80.20%;对GM、SPT、SF、SXT、AM耐药程度在50%左右;对CLE最为敏感,耐药率仅为2.01%;其次为A/C和OFL,耐药率分别为2.35%和4.03%;FFC、ENR、CEF的耐药率分别为30.54%、27.18%、23.49%。整体耐药率结果见表3。
298株沙门氏菌多重耐药(≥2)菌株高达81.88%(244/298),仅有6株菌对13种药物均敏感,未出现全部耐药,以1耐、2耐、7耐、10耐为主,分别DOX、TE-DOX、TE-GM-SPT-DOX-SF-SXT-AM、ENR-TE-GM-SPT-DOX-CEF-FFC-SF-SXT-AM为主导耐药谱型,优势耐药谱型为TE-DOX。298株沙门氏菌共产生了46种耐药谱型,耐药谱型种类较多,3耐、4耐均产生了7种耐药谱型,只有2耐仅有1种耐药谱型,多重耐药结果见表4,耐药谱型统计见表5。
表3 不同屠宰环节耐药率结果统计
Tab.3 Result of resistance rate of strains from different slaughtering link(%)
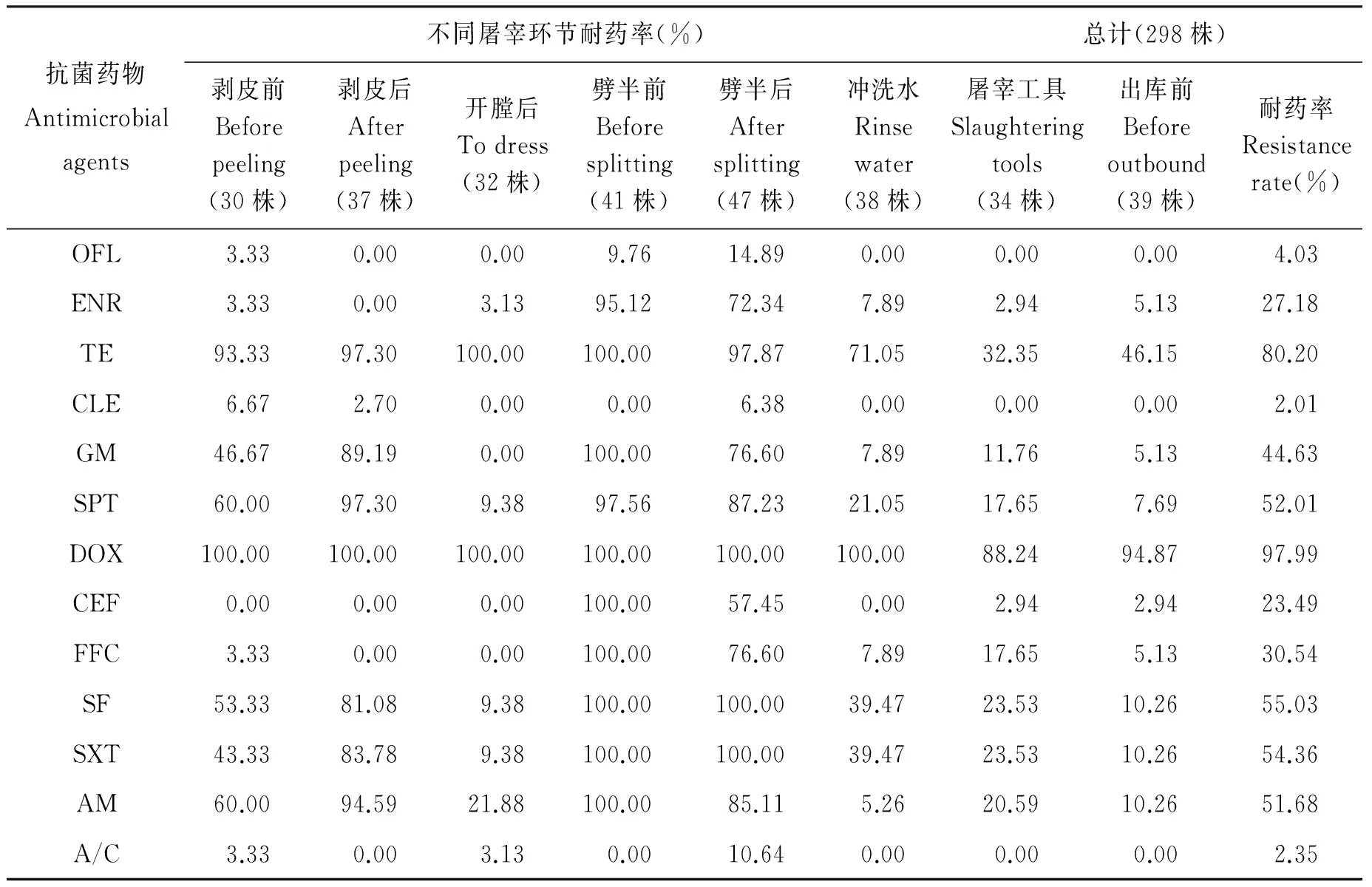
抗菌药物Antimicrobialagents不同屠宰环节耐药率(%)总计(298株)剥皮前Beforepeeling(30株)剥皮后Afterpeeling(37株)开膛后Todress(32株)劈半前Beforesplitting(41株)劈半后Aftersplitting(47株)冲洗水Rinsewater(38株)屠宰工具Slaughteringtools(34株)出库前Beforeoutbound(39株)耐药率Resistancerate(%)敏感率Sensitiverate(%)OFL3.330.000.009.7614.890.000.000.004.0372.48ENR3.330.003.1395.1272.347.892.945.1327.1842.28TE93.3397.30100.00100.0097.8771.0532.3546.1580.2019.80CLE6.672.700.000.006.380.000.000.002.0191.28GM46.6789.190.00100.0076.607.8911.765.1344.6355.37SPT60.0097.309.3897.5687.2321.0517.657.6952.0135.23DOX100.00100.00100.00100.00100.00100.0088.2494.8797.990.67CEF0.000.000.00100.0057.450.002.942.9423.4976.17FFC3.330.000.00100.0076.607.8917.655.1330.5464.09SF53.3381.089.38100.00100.0039.4723.5310.2655.0344.97SXT43.3383.789.38100.00100.0039.4723.5310.2654.3645.64AM60.0094.5921.88100.0085.115.2620.5910.2651.6847.65A/C3.330.003.130.0010.640.000.000.002.3539.93
2.2.2 不同屠宰环节耐药结果 不同屠宰环节的菌株对13种药物的敏感程度存在一定差异,如对CLE,只有剥皮前、剥皮后以及劈半后环节的菌株对其有一定程度的耐药,其余环节的菌株均表现为敏感,但是不同屠宰环节的菌株对13种药物均有不同程度的耐药,且耐药状况严重,具体结果见表3。
不同屠宰环节菌株多重耐药状况不同,除屠宰工具和出库前环节,其余环节均出现了0耐药菌株;而3株12耐菌株仅出现在劈半后;8株1耐菌株4株来自劈半前,4株来自劈半后环节;5耐的菌株除了劈半前环节未出现,其余环节均出现5耐菌株。各屠宰环节分别有14、8、7、4、15、7、9、7种耐药谱型,各环节的主导耐药谱型不同,如剥皮前的菌株为TE-GM-SPT—SF-SXT-AM,开膛后的主导谱型为TE-DOX。
3 讨 论
3.1 生猪屠宰环节沙门氏菌血清型 本文利用沙门氏菌血清型快速分型试剂盒和Luminex 200液相芯片分析仪进行沙门氏菌的血清分型,298株沙门氏菌的血清型均被确定。共检测出9种血清型,优势血清型为德尔卑沙门氏菌(n=78),与侯小刚[3]以及杨保伟等[4]研究中的优势血清型相同。不同屠宰环节沙门氏菌菌株的优势血清型不同,剥皮前、剥皮后、开膛后3个环节的优势血清型为德尔卑沙门氏菌,劈半前、劈半后、冲洗水、屠宰工具、出库前的优势血清型各不相同,分别为拉古什、鼠伤寒、汤普逊、肠炎、阿贡纳沙门氏菌。不同屠宰环节沙门氏菌血清型的显著差异表明,虽然生猪屠宰环节存在严重的交叉污染现象,但是每个环节中也会有其他来源的沙门氏菌污染,应该引起重视,并采取有效措施加以控制,减少其他来源沙门氏菌的污染。
3.2 生猪屠宰环节沙门氏菌耐药性分析 本实验298株沙门氏菌对DOX的耐药率最高,为97.99%,显著高于岳秀英等[5]对四川省猪源沙门氏菌的耐药性研究中对DOX的耐药率66.2%,以及张文宇等[6]对大连地区食源性沙门氏菌研究中猪源沙门氏菌对DOX的耐药率为66.7%,与宁昆[7]等上海市猪源沙门氏菌对DOX的耐药率84.62%较接近;其次为对TE的耐药率为80.20%(239/298),高于赖海梅[8]等对TE的耐药率51.39%,低于侯小刚[9]对TE 89.29%的耐药率。
本研究中,不同屠宰环节沙门氏菌对13种药物的耐药程度明显不同,劈半前与劈半后环节中沙门氏菌对所有药物的耐药率普遍较高,而屠宰工具以出库前环节中沙门氏菌的耐药率则较低,剥皮后环节中沙门氏菌对5种药物均敏感。不同屠宰环节沙门氏菌耐药性的不同,可以指导减少生猪屠宰环节沙门氏菌污染的来源,控制沙门氏菌对猪肉产品的污染,同时具有针对性的科学合理用药。298株沙门氏菌的多重耐药现象严重,多重耐药率达81.88%(244/298),明显高于李郁等[11]研究中沙门氏菌64.71%的多重耐药率。1耐、2耐、7耐、10耐的菌株较多,分别占所有菌株的16.11%、20.13%、15.10%、18.46%,主要是剥皮后、开膛后以及劈半前等环节的菌株。
298株沙门氏菌对8类13种抗生素药物共产生了46种耐药谱型,多于李郁等[10]2008年沙门氏菌对22种抗生素产生的24种耐药谱型,以及吕素玲等[11]2010年沙门氏菌对13种药物产生了24种耐药谱型,少于周佳等[12]2011年沙门氏菌对25种抗生素共产生了66种耐药谱型。这些报告与本实验相比,检测的抗菌药物种类较多,但产生的耐药谱型少,说明本实验所有菌株对所选13种药物的抗性比较分散。表明沙门氏菌对抗生素药物的耐药谱型种类逐渐增多,耐药性更加复杂,涉及抗菌药物增多,在生产过程中通过食物链的传递,可能最终影响人类对抗生素药物的敏感性。
[1] Yang BW, Shen JL, Xi ML,et al. Antibacterial susceptibility and subtypes ofSalmonellaisolates from retail chicken in Xi’an in 2007-2008[J].Food Science, 2011,32(19):130-136.(in Chinese)
杨保伟,申进玲,席美丽, 等. 2007—2008年西安地区鸡肉源沙门氏菌相关特性分析[J]. 食品科学,2011,32(19):130-136.
[2] Huang K, Chen SJ, Huang J, et al. Analysis of antibiotic resistance ofSalmonellaisolated from animals and identification of its florfenicol resistant gene[J]. China Animal Husbandry & Veterinary Medicine, 2015,02:459-466.(in Chinese)
黄凯,陈素娟,黄 骏, 等. 动物源性沙门氏菌的耐药性分析及氟苯尼考类耐药基因的鉴定[J]. 中国畜牧兽医,2015,02:459-466.
[3] Hou XG, Liu SL, Han XF, et al. Isolation and identification ofSalmonellafrom pork industry chains in partial areas of Sichuan Province[J].Food Science, 2013,34(11):250-253.(in Chinese)
侯小刚, 刘书亮, 韩新锋, 等. 四川部分地区猪肉产业链中沙门菌的分离及其鉴定[J].食品科学,2013,34(11):250-253.
[4] Yang BW, Zhang XL, Qu D, et al. Serotypic and genotypic characterization ofSalmonellaserovars from retails meat in shanxi province in 2007-2008[J]. Journal of microbiology, 2010,05:654-660.(in Chinese)
杨保伟, 张秀丽, 曲 东,等. 2007-2008陕西部分零售畜禽肉沙门氏菌血清型和基因型[J]. 微生物学报,2010,05:654-660.
[5] Yue XY, Ge R, Wang KY, et al. Prevalence of antimicrobial resistance inSalmonellafrom pig in Sichuan Provincev[J]. Sichuan Journal of Zoology, 2015,05:707-713.(in Chinese)
岳秀英, 葛荣, 汪开毓, 等. 四川省猪源沙门氏菌及耐药性变迁调查[J]. 四川动物,2015,05:707-713.
[6] Zhang WY, Du XW, Yue WW, et al. Test on resistance ofSalmonellafrom Foodborne in Dalian Area[J]. Information of Animal husbandry and veterinary science,2014,02:35-36.(in Chinese)
张文宇, 杜雄伟, 岳威威. 大连地区食源性沙门氏菌耐药性检测[J]. 畜牧兽医科技信息,2014,02:35-36.
[7] Ning K, Zhang WY, Shen LP, et al. Research on drug-resistance and genotyping ofSalmonellafrom pig in Shanghai by pulsed-field gel electrophoresis[J]. China Animal Health Inspection, 2015,02:78-81.(in Chinese)
宁昆, 张维谊, 沈莉萍,等. 上海市猪源沙门氏菌耐药性及脉冲场凝胶电泳分型研究[J]. 中国动物检疫,2015,02:78-81.
[8] Lai HM, Zhou LK, Liu SL, et al. Analysis on correlation of resistant gene between resistant[J]. Science and Technology,2015,07:187-191.(in Chinese)
赖海梅,邹立扣,刘书亮,等. 肉鸡屠宰生产链中沙门氏菌耐药基因检测与耐药相关性分析[J]. 食品工业科技,2015,07:187-191.
[9] Hou XG. Isolation and Identification Analysis of antibiotic resistance and genotyping by PFGE ofSalmonellafrom product link of main meal food[D]. Sichuan Agriculture University, 2012.(in Chinese)
侯小刚. 四川主要肉品生产链中沙门氏菌的分离鉴定、耐药性分析及PFGE分型[D].四川农业大学,2012.
[10] Li Y, Jiao XA, Wei JZ, et al. Analysis on the serotypes and drug-susceptibility ofSalmonellaisolates from pig carcass[J]. Chin J Zoonoses, 2008,24(1):67-70.(in Chinese)
李郁, 焦新安, 魏建忠, 等. 屠宰生猪沙门菌分离株的血清型和药物感受性分析[J].中国人兽共患病学报,2008,24(1):67-70.
[11] Lv SL, Wei CY, Yao XT, et al. Study on the contaminative status and serotype distribution and drug resistant spectrum of Salmonella in food in Guangxi,2010[J]. Journal of Applied Preventive Medicine, 2012,03:137-141,170.(in Chinese)
吕素玲, 韦程媛, 姚雪婷, 等. 2010年广西食品中沙门氏菌污染状况和血清型分布及耐药谱的研究[J]. 应用预防医学,2012,03:137-141,170.
[12] Zhou J, Liu SL, Hou XG, et al. Monitoring and analysis on resistance ofSalmonellafrom animal food in Sichuan Province[J]. China Animal Husbandry & Veterinary Medicine, 2011,03:188-191.(in Chinese)
周佳, 刘书亮, 侯小刚,等. 四川省动物性食品源沙门氏菌的耐药性监测与分析[J]. 中国畜牧兽医,2011,03:188-191.
Resistance and serotype ofSalmonellaisolated from pig slaughtering process in Shandong Province
WANG Juan1, LIU Xian-xian1,2, ZHANG Qian3, ZHAO Jian-mei1, QU Zhi-na1,
HUANG Xiu-mei1,WANG Yu-dong1, ZOU Ming2, WANG Jun-wei1*
(1.LaboratoryofSafetyforAnimalProducts,ChinaAnimalHealthandEpidemiologyCenter,Qingdao266032,China;2.QingdaoAgriculturalUniversity,Qingdao266109,China;3.HuangdaoEntry-ExitInspectionandQuarantineBureau,Qingdao266555,China)
We investigated serotype and resistance ofSalmonelladuring pig slaughtering in Shandong Province, China, providing basic data for the risk assessment ofSalmonellaand for guiding the clinical medication. We used rapid classification kit to identifySalmonellaserotype, adopted broth microdilution method to detect the resistance of 13 kinds drugs belong to 8 categories. Result showed that the identified 9 kinds of serotype were mainlyS.derbyandS.typhimurium. The resistance to 13 kinds drugs of 298Salmonellawere different. The higher percentage of tetracycline drugs as Doxycycline(DOX) and Tetracycline(TE) were 97.99% and 80.20%, respectively, which was most sensitive toColistineE. The resistant rate was only 2.01%, following by Amoxicillin/Clavulanic acid and Ofloxacin which were 2.35% and 4.03%, and the multiple resistant rate was 81.88%. TE-DOX was the regnant drug-resistant spectrum. In conclusion, the predominant serotype ofSalmonellain links of pig slaughtering in Shandong Province isS.derby, and resistance is different to the different drugs. The drug resistance of different slaughter links exist significant differences, multiple drug resistance is serious, and drug-resistant spectrum are varied.
pig; slaughtering;Salmonella; serotype; resistance
10.3969/j.issn.1002-2694.2017.06.009
王君玮,Email:yffs2000@sina.com
1.中国动物卫生与流行病学中心动物产品安全监测室,青岛 266032;
2.青岛农业大学,青岛 266109;
R378
A
1002-2694(2017)06-0517-05-0517-05
2016-09-28 编辑:李友松
国家农产品质量安全风险评估专项(No. GJFP2016 00703)
3.黄岛出入境检验检疫局,青岛 266555
