新城疫病毒核蛋白单克隆抗体的制备及双抗体夹心ELISA的初步建立
2017-06-28王明睿钟建平王国松陈毅歆
王明睿,钟建平,李 睿,王国松,陈毅歆,
新城疫病毒核蛋白单克隆抗体的制备及双抗体夹心ELISA的初步建立
王明睿1,钟建平1,李 睿2,王国松1,陈毅歆1, 2
目的 制备新城疫病毒(NDV)核蛋白(NP)的单克隆抗体(单抗),并用于建立一种可定量检测NDV病毒含量的双抗体夹心酶联免疫吸附试验检测方法(NDV NP ELISA)。方法 基于NDV病毒株F48E9获得NP基因,经原核表达方式制备出重组抗原rNP;免疫小鼠制备NDV NP特异性单抗;单抗经HRP标记和配对筛选,建立NDV NP ELISA,分析其特异性、灵敏度、精密度、准确度和检测线性,并分析本方法定量检测的NP含量与PFU病毒滴度的定量相关性。结果 建立基于单抗3C10和4E7的NDV NP ELISA,其定量检测NDV rNP的最佳线性范围为0.015~0.250 μg/ml(R2=0.9974),回收率在88.4%~106.01%,变异系数小于3.4%;该方法具有良好特异性;该方法定量检测NDV抗原含量与PFU病毒感染滴度有较好的相关性(R2=0.9209)。结论 建立NDV NP ELISA,可准确定量检测NDV病毒中的NP抗原含量,为NDV病毒含量的测定提供一种可靠简便的分析方法。
新城疫病毒;核蛋白;单克隆抗体;定量检测;酶联免疫吸附测定
新城疫(Newcastle disease,ND)是由副黏病毒科(Paramyxoviridae)禽副黏病毒属(Avulavirus)中的NDV引起的一种高度接触性的急性禽类传染病[1]。人类感染NDV可引起发热等流感样症状,但很快就会痊愈,1955年文献首次报道NDV能够在肿瘤细胞中复制并杀伤肿瘤细胞,而不杀伤人正常细胞[2]。自此之后,NDV不断被当作溶瘤制剂用于恶性肿瘤的治疗研究,部分NDV天然毒株如73-T、MTH68、PV107等在临床试验中已显示出一定的肿瘤治疗效果[3-5],随着反向遗传技术的发展,通过基因改造在NDV基因组中导入外源性的肿瘤杀伤因子从而增强其溶瘤效果,使NDV在肿瘤治疗方面拥有更好的前景。
病毒滴定是开展NDV溶瘤研究所必需的实验操作。NDV常用的滴定方法主要为测定鸡胚半数致死量(LD50)、鸡胚半数感染量(EID50)、细胞培养物半数感染量(TCID50)和测定噬斑形成单位(PFU)等。LD50或EID50的测定需要用到鸡胚,操作十分复杂,鸡胚发育强弱差异和接种时的操作可能会影响实验结果;TCID50和PFU的测定是在细胞水平上进行的,具有较高的准确度,但是耗时较长,操作也较为复杂,因此有必要发展新的操作简便的NDV滴定方法。NDV基因组约15 kb,编码6种结构蛋白,其中NP是NDV病毒粒子中含量最丰富的病毒蛋白,保守性很高,常用于NDV的诊断。鉴于此,本研究目的是筛选NDV的NP蛋白特异性单克隆抗体,并建立基于酶联免疫吸附试验(ELISA)的双抗体夹心NDV抗原检测方法,为NDV的病毒滴定提供一种新的手段。
1 材料与方法
1.1 病毒、细胞与实验动物 NDV病毒株F48E9和La Sota为中国农业大学王晓佳教授馈赠,传染性法氏囊病毒(IBDV)、传染性喉气管炎病毒(ILTV)、鸡毒支原体(MG)、鸡痘病毒(FPV)购自青岛易邦生物工程有限公司;小鼠骨髓瘤细胞株Sp2/0-Ag14(Sp2/0)和Vero细胞为本实验室保存;BALB/c小鼠(6-8周龄)购自上海斯莱克实验动物有限公司,实验遵循《实验动物保护条例》。
1.2 主要试剂与耗材 PEG1350、次黄嘌呤、胸腺嘧啶、氨基碟呤、DMSO、HRP、弗氏佐剂均购自Sigma公司。RPMI1640基础培养基、MEM培养基为Invitrogen公司产品。胎牛血清为Hyclone公司产品。硝酸纤维素膜为MDI公司产品。抗体亚型鉴定试剂购自Bio-Rad公司。病毒裂解液购自碧云天公司。各种常规化学试剂为国产分析纯。
1.3 方法
1.3.1 NDV F48E9株NP重组蛋白的表达及纯化鉴定 根据已发表的NDV NP基因序列设计并合成引物,上游引物:5-CGGATCCATGTCTTCCGTATTTGATGAGTACGAGCAGCTC-3,下游引物:5-GCAAGCTTATACCCCCAGTCGGTGTCATTATCTTGAG-3。利用RT-PCR的方法从病毒培养液中调取并扩增F48E9株NP基因,定向连接到pTO-T7载体上,进行测序鉴定及比对。将阳性重组质粒pTO-NP转化大肠杆菌ER2566感受态细胞,IPTG诱导表达,重组蛋白rNP的表达经SDS-PAGE电泳与Western blot鉴定,镍离子柱亲和层析纯化等。
1.3.2 单抗的制备 取纯化的rNP,与弗氏完全佐剂乳化,多点皮下注射BALB/c小鼠,注射剂量100 μg/只,间隔14天取相同剂量rNP加等量弗氏不完全佐剂乳化进行加强免疫。融合前3天,以50 μg rNP经脾脏注射进行加强免疫。按常规杂交瘤技术,在无菌条件下,收集小鼠脾脏细胞与Sp2/0进行细胞融合。阳性杂交瘤细胞经4次克隆化后进行扩大培养和保存。
1.3.3 单抗的效价测定和亚类鉴定 采用体内诱生法在BALB/c小鼠腹腔中制备单抗腹水。采用间接ELISA方法测定抗体效价。按AbD Serotec公司抗体亚类鉴定试剂盒说明书鉴定抗体亚类。
1.3.4 单抗的纯化及标记 用MabSelect Sure LX层析介质纯化腹水中的单抗,SDS-PAGE电泳鉴定纯度。采用过碘酸钠法标记HRP。
1.3.5 双抗体夹心NDV NP ELISA的建立
1.3.5.1 包被单抗及酶标单抗最佳工作浓度的确定 将rNP蛋白稀释至1 μg/mL,2%的NBS为阴性对照,PBS为空白对照,采用方阵滴定法确定最佳的单抗包被浓度和酶标单抗稀释度。采用常规夹心ELISA方法,以pH7.4的磷酸盐缓冲液稀释纯化的3C10包被酶标板,100 μL/孔,4℃过夜;采用0.05%Tween-20的PBS(PBST)洗板3次,每次3 min;含2%明胶的磷酸盐缓冲液封闭酶标板,37℃孵育2 h,洗板;加入待检样品,100 μL/孔,37℃孵育30 min,洗板;4E7-HRP为酶标抗体,37℃孵育30 min,洗板;通过TMB使底物显色,100 μL/孔,37℃反应15 min;最后以2 M的浓硫酸50 μL/孔终止反应,用OD450/630读微孔光密度值。
1.3.5.2 直线性和定量限度实验 用PBS将NP抗原稀释为1 μg/mL,连续二倍稀释后用本方法测定。以抗原浓度和对应的OD值做线性回归分析,以阴性对照的2.1倍为Cutoff值,分析最佳线性范围,确定定量限度。
1.3.5.3 准确性及精密性检测 将NP抗原分别稀释为250、180、100 ng/mL,3人次进行独立试验,每一稀释度作6份重复测定。比较测定值和真实值,计算均值、标准偏差,验证该方法的准确性及精密性。
1.3.5.4 特异性试验 用建立的NDV NP ELISA方法对已知的传染性法氏囊病毒(IBDV)、传染性喉气管炎病毒(ILTV)、鸡毒支原体(MG)、鸡痘病毒(FPV)等禽类病毒进行交叉反应性试验,确定该ELISA方法的特异性。
1.3.5.5 与病毒滴度相关性分析 将不同批次的NDV病毒培养液裂解后用本方法检测各样品的NDV抗原活性,同时用空斑法检测各个样品的病毒滴度。通过比较两种方法的检测结果,分析本方法检测与病毒滴度的相关性。
2 结 果
2.1 NDV病毒NP抗原的表达及小鼠免疫 采用RT-PCR的方法从NDV F48E9株病毒培养液中获取NP的基因,经测序鉴定正确后,构建了pTO-T7/ NP重组表达质粒。在E.coli菌株ER2566中进行大量表达后,利用亲和层析的方法纯化制备出高纯度的重组蛋白rNP。用经过NDV免疫的小鼠血清作为Western blot 的一抗检测rNP,结果显示原核重组表达的NP蛋白活性良好,与抗NDV的血清有良好的反应(图1)。用纯化得到的rNP免疫BALB/c小鼠,制备单克隆抗体。
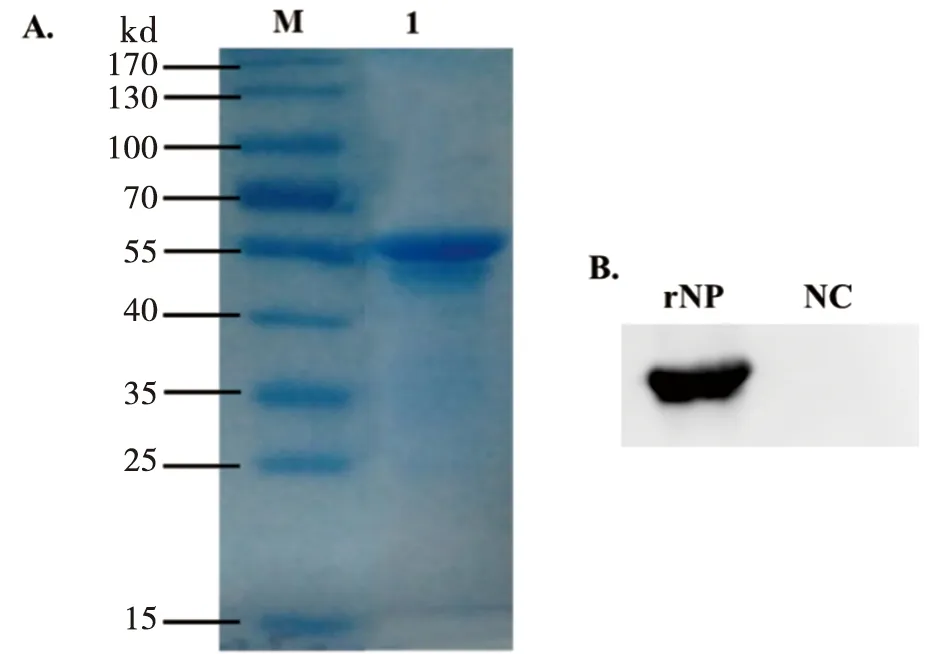
M: Protein marker; 1: SDS-PAGE of the purified recombinant NP图1 重组蛋白rNP的SDS-PAGE(A)及Western blot(B)Fig.1 SDS-PAGE(A)and Western blot(B)analysis of recombinant NP protein
2.2 NDV病毒NP单抗的制备及鉴定 选择血清抗体滴度较高的小鼠,通过细胞融合筛选得到了抗NP的单抗,根据抗体滴度、特异性、配对检测NDV的灵敏度,筛选到两株用于试剂构建的单抗3C10和4E7。用ELISA、Western blot和IFA三种方法鉴定两株单抗性质(图2)。
2.3.1 包被单抗及酶标单抗最佳工作浓度的确定 通过方阵滴定确定单抗3C10最佳包被量为200 ng/孔,酶标单抗4E7-HRP最佳稀释度为1∶4000(图3),此条件下OD阳性值为3.726,阴性值为0.011,且P/N最大。
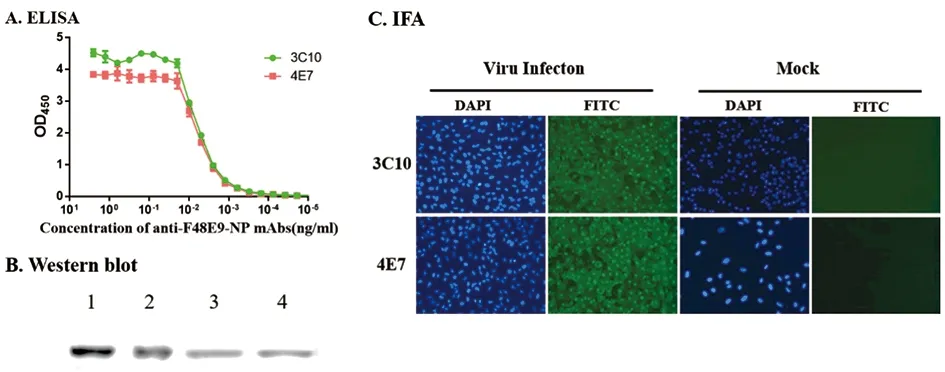
1:Western blot of rNP with mAb 3C10;2:Western blot of rNP with mAb 4E7;3:Western blot of virus with mAb 3C10;4:Western blot of virus with mAb 4E7图2 单抗3C10和4E7的性质鉴定Fig.2 Characterization of mAbs 3C10 and 4E7

图3 最适单抗包被浓度和酶标单抗工作浓度的确定Fig.3 Determination for optimal concentration of coated mAb and peroxidase
2.3.2 NDV NP ELISA的标准曲线 将重组蛋白rNP稀释至1 μg/mL后,进行连续对倍稀释,用建立的NDV NP ELISA检测稀释后的样品。对测定的OD值取常用对数值作为纵坐标,以各稀释样本浓度的常用对数值作为横坐标,得到检测NP抗原标准曲线(图4)。标准曲线方程为y=1.0791x-2.1755,相关系数R2=0.9974,最佳线性范围为0.015~0.250 μg/mL,最低检出限为0.015 μg/mL。
2.4 NDV NP ELISA的性能鉴定
2.4.1 准确性与精密性 用建立的NDV NP ELISA检测线性范围内高、中、低浓度的NP抗原,回收率均在88.4%—106.01%,变异系数均小于3.4%,见表1。
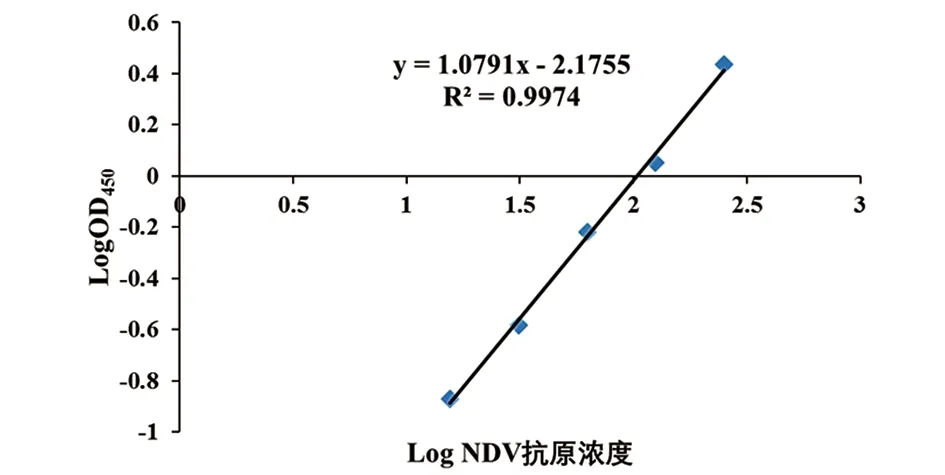
图4 双抗体夹心法检测抗原NP的标准曲线Fig.4 Standard curve of double-antibody sandwich ELISA for NP
表1 NDV NP ELISA的准确性及精密性验证(n=18)
Tab.1 Accuracy and precision of the developed NDV NP ELISA
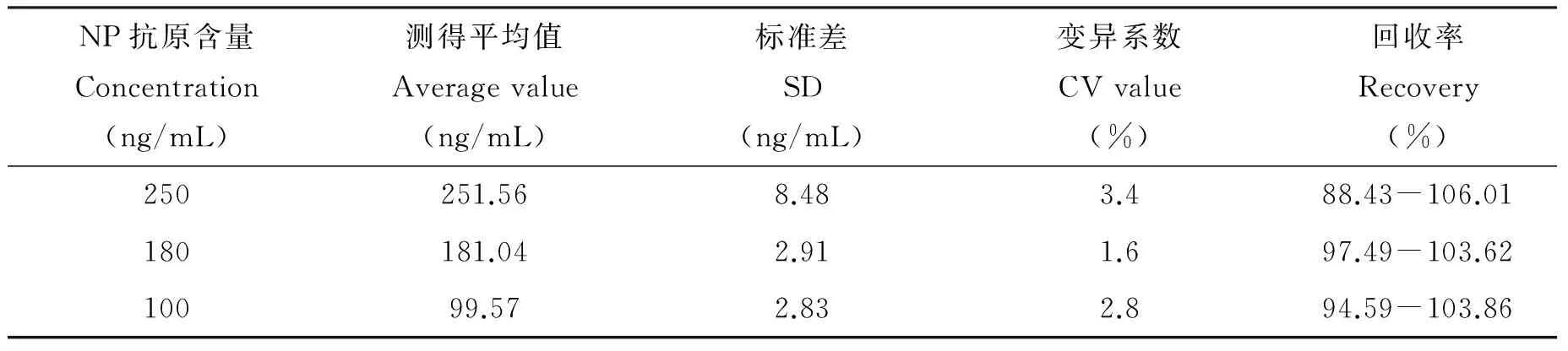
NP抗原含量Concentration(ng/mL)测得平均值Averagevalue(ng/mL)标准差SD(ng/mL)变异系数CVvalue(%)回收率Recovery(%)250251.568.483.488.43-106.01180181.042.911.697.49-103.6210099.572.832.894.59-103.86
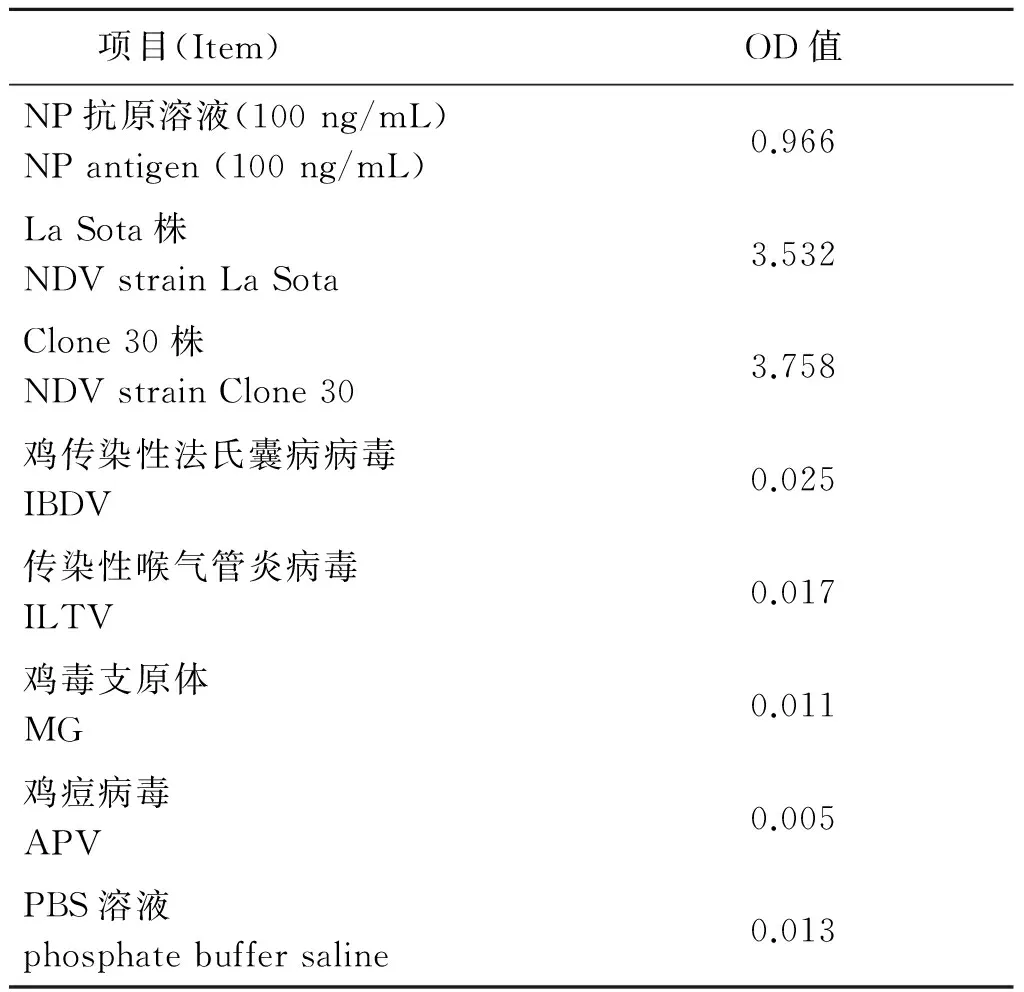
2.4.2 特异性 用建立的NDV NP ELISA测定其他NDV毒株和非NDV样品,结果显示非NDV样品的OD值均小于0.1,与PBS的OD值接近(表2),表明该NDV NP ELISA特异性良好,对其他常见禽类病毒无非特异性检出。
2.4.3 NDV NP ELISA测定NP含量与NDV病毒滴度的相关性分析 取50份NDV病毒样品裂解后用NDV NP ELISA进行检测,将得到的NP抗原含量与对应样品的病毒滴度(PFU)取对数后进行相关性分析。结果(图5)显示NDV的空斑形成滴度PFU与NDV NP ELISA测定的NP抗原含量相关性良好,R2=0.9209,提示NDV NP ELISA测定NDV病毒的NP含量的方法可用于NDV病毒的滴度分析。
表2 NDV NP ELISA的特异性验证结果
Tab.2 Specificity of the developed NDV NP ELISA
项目(Item)OD值NP抗原溶液(100ng/mL)NPantigen(100ng/mL)0.966LaSota株NDVstrainLaSota3.532Clone30株NDVstrainClone303.758鸡传染性法氏囊病病毒IBDV0.025传染性喉气管炎病毒ILTV0.017鸡毒支原体MG0.011鸡痘病毒APV0.005PBS溶液phosphatebuffersaline0.013
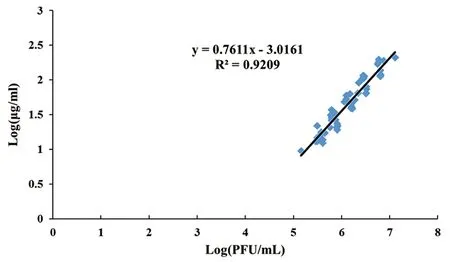
图5 NDV病毒滴度与NDV NP ELISA检测的NP含量的相关性分析Fig.5 Correlation between NDV viral titer and NP concentration
3 讨 论
近30多年来,已被认为是一种安全有效的溶瘤试剂[3, 5-6]。为了更好的开展NDV的溶瘤研究,迫切需要操作简便的病毒定量分析方法。新城疫病毒的基因组是由约15 kb的单股负链RNA组成,共编码核蛋白(NP)、磷蛋白(P)、基质蛋白(M)、融合蛋白(F)、血凝素-神经氨酸酶(HN)糖蛋白和大分子质量聚合酶(L)等六种结构蛋白[7]。其中,NP蛋白、P蛋白、L蛋白和病毒基因组RNA紧密结合,共同形成一个螺旋棒状的核糖核蛋白复合体(RNP),广泛存在于NDV病毒颗粒中,在病毒复制过程中发挥重要作用。因此,建立针对NP含量的测定方法,能够很好的反映出NDV病毒颗粒的含量。
本研究制备的NDV病毒NP蛋白的特异性单抗,并建立了定量的双抗体夹心ELISA方法,显示出良好的灵敏度、回收率和稳定性。该方法检测的NDV的NP抗原含量与传统空斑法检测的NDV病毒滴度有很好的相关性。总之,该方法为NDV病毒的定量分析提供了一种快速、简便的检测方法。
新城疫目前仍是全球一大严重威胁养鸡业的烈性传染病。在临床表现中,感染NDV禽类的临床症状和病理解剖检测容易和其他禽类病毒感染如鸡传染性法氏囊、禽流感、鸡喉气管炎等相混淆,并且不同的NDV毒株的致病差异较大,因此临床症状或病理变化不能作为确诊的依据。当前用于新城疫病毒的检测方法主要为病毒的分离与鉴定、分子生物学诊断(如RT-PCR、核酸探针、实时荧光定量检测)和血清学检测技术(如酶联免疫吸附试验)[8-9]。病毒分离和鉴定方法需要花费较长的时间和精力;RT-PCR等分子生物学方法虽然灵敏,但是需要特殊的仪器设备同时对操作人员有较高的要求。而ELISA方法的敏感性和特异性强,操作较为简便[10],较适合基层兽医部门和禽类养殖场等对新城疫的大面积普查。本研究建立的NDV NP ELISA方法具有良好的特异性,能很好的区分NDV和非NDV禽类传染病病毒。因此,对本方法再经过进一步的完善优化后,有望发展成为有用的NDV的诊断试剂。
[1] Czegledi A, Ujvari D, Somogyi E, et al. Third genome size category of avian paramyxovirus serotype 1 (Newcastle disease virus) and evolutionary implications[J]. Virus Res, 2006, 120(1-2): 36-48. DOI: 10.1016/j.virusres.2005.11.009
[2] Flanagan AD, Love R, Tesar W. Propagation of Newcastle disease virus inEhrlichascitescellsinvitroandinvivo[J]. Proc Soc Exp Biol Med, 1955, 90(1): 82-86. DOI:10.3181/00379727-90-21945
[3] Csatary LK, Moss RW, Beuth J, et al. Beneficial treatment of patients with advanced cancer using a Newcastle disease virus vaccine (MTH-68/H)[J]. Anticancer Res, 1999, 19(1B): 635-638.
[4] Pecora AL, Rizvi N, Cohen GI, et al. Phase I trial of intravenous administration of PV701, an oncolytic virus, in patients with advanced solid cancers[J]. J Clin Oncol, 2002, 20(9): 2251-2266. DOI: 10.1200/JCO.2002.08.042[5] Batliwalla FM, Bateman BA, Serrano D, et al. A 15-year follow-up of AJCC stage III malignant melanoma patients treated postsurgically with Newcastle disease virus (NDV) oncolysate and determination of alterations in the CD8 T cell repertoire[J]. Mol Med, 1998, 4(12): 783-794.
[6] Liu JJ, Liu KY, Wang J. The research progress of the anti-tumor genes of newcastle disease virus[J]. Chin J Zoonoses, 2011, 27(3): 260-262. (in Chinese)
刘进军,刘开扬,王静. 新城疫病毒抗肿瘤基因的研究进展[J]. 中国人兽共患病学报, 2011, 27(3): 260-262.
[7] Steward M, Vipond IB, Millar NS, et al. RNA editing in Newcastle disease virus[J]. J Gen Virol, 1993, 74 ( Pt 12): 2539-2547. DOI: 10.1099/0022-1317-74-12-2539
[8] Wu HR, Diao YX, Li HM, et al. Application of indirect immuno-fluorescent assay for detection and antigen location of duck paramyxovirus in paraffin sections[J]. Chin J Vet Sci, 2011, 31(02): 189-193. (in Chinses)
吴焕荣, 刁有祥, 李宏梅, 等. 间接免疫荧光染色检测鸭源副黏病毒及在鸭体内的抗原定位[J]. 中国兽医学报, 2011, 31(02): 189-193.
[9] Wu HR, Diao YX, Li HM, et al. Establishment and application of RT-PCR diagnostic method for duck paramyxovirus disease[J]. J Northwest A F Univ, 2010, 38(11): 31-35. (in Chinses)
李建侠, 刁有祥, 刘霞, 等. 鸭副粘病毒病RT-PCR诊断方法的建立与应用[J]. 西北农林科技大学学报(自然科学版), 2010, 38(11): 31-35.
[10] Ma SJ, Xiong YQ, Zhang QH, et al. Comparison of three commercial ELISA kits for detection of antibodies against Japaneses encephalitis virus in swine sera[J]. Chin J Zoonoses, 2015, 31(5): 423-426. (in Chinese)
马淑娟,熊益权,张琼花,等. 三种ELISA试剂盒检测猪流行性乙型脑炎病毒血清IgG抗体比较[J]. 中国人兽共患病学报, 2015, 31(5): 423-426.
Development of monoclonal antibodies against nucleoprotein of Newcastle disease virus and establishment of a quantitative double-antibody sandwich ELISA for NDV antigen
WANG Ming-rui1, ZHONG Jian-ping1, LI Rui2, WANG Guo-song1, CHEN Yi-xin1,2
(1.StateKeyLaboratoryofMolecularVaccinologyandMolecularDiagnostics,SchoolofLifeScience,XiamenUniversity,Xiamen361102,China;2.StateKeyLaboratoryofMolecularVaccinologyandMolecularDiagnostics,SchoolofPublicHealth,Diseases,XiamenUniversity,Xiamen361102,China)
We developed the monoclonal antibodies against nucleoprotein (NP) of Newcastle disease virus (NDV), and established a double antibody sandwich ELISA method for quantitative determination of NP antigen of NDV (NDV NP ELISA). The recombination NP protein derived from strain F48E9 of NDV were prepared and used to immunize BLAB/c mice. The mouse splenic cells from immunized mice were fused with SP2/0 cells to generate monoclonal antibodies (mAb). The NDV NP specific mAbs were paired to establish a double antibody sandwich ELISA method. The performance of the NDV NP ELISA was evaluated, including specificity, sensitivity, precision, accuracy and linearity. The correlation between the ELISA and PFU virus titer was analyzed by regression analysis method. Two monoclonal antibodies 3C10 and 4E7 were selected to establish double antibody sandwich ELISA for NP antigen of NDV. The linearity and performance of the NDV NP ELISA was characterized. The detection linearity fell in the range of 0.015-0.250 μg/mL (R2=0.997 4). The detection limit of the assay was 0.015 μg/mL. The recovery was between 88.4% and 106.01%; the variation coefficient was below 3.4%. In testing of 50 NDV virus samples, this assay performed well and correlated comparably with PFU virus titer (R2=0.920 9). The NDV NP ELISA for quantitative detection of NDV is a reliable quantifiable assay for detection of NDV NP protein; it provides a new approach for rapid and quantitative detection of Newcastle disease virus.
Newcastle disease virus; NP protein; monoclonal antibody; quantitative assay; enzyme-linked immunosorbent assay (ELISA)
Chen Yi-xin, Email: yxchen2008@xmu.edu.cn
10.3969/j.issn.1002-2694.2017.06.002
国家自然科学基金(31670934):基于广谱中和单抗的通用型流感疫苗设计及其结构基础研究
陈毅歆,Email:yxchen2008@xmu.edu.cn
1.厦门大学 国家传染病诊断试剂与疫苗工程技术研究中心 生命科学学院,厦门 361102; 2.厦门大学 分子疫苗学与分子诊断学国家重点实验室 公共卫生学院,厦门 361102
R372
A
1002-2694(2017)06-0481-05
2017-04-17 编辑:李友松
Supported by the National Natural Science Foundation of China (Grant No. 31670934): The design of universal influenza vaccine based on broadly neutralizing monoclonal antibody and its structural study.
