白念珠菌CDR1/CDR2和MDR1基因高表达对氧化应激的影响
2017-06-28赵亚婧李水秀宋延君朱坤举
蒋 玲,赵亚婧,李水秀,宋延君,郭 慧,朱坤举,张 宏
白念珠菌CDR1/CDR2和MDR1基因高表达对氧化应激的影响
蒋 玲,赵亚婧,李水秀,宋延君,郭 慧,朱坤举,张 宏
目的 探索白念珠菌CDR1/CDR2和MDR1基因高表达对氧化应激的影响。方法 以白念珠菌CDR1/CDR2和MDR1基因高表达株及其亲本株为研究对象,测定过氧化氢(H2O2)对菌株生长的影响。以H2O2建立氧化应激模型,比较各菌株细胞内活性氧(Reactive oxygen species,ROS)、线粒体膜电位(Mitochondrial membrane potential,ΔΨm)、氧化应激相关基因(CAP1和GRP2)和ROS清除相关基因(SOD2和SOD5)转录水平的差异。结果 各菌株均在5 mmol/L H2O2作用时出现100%生长抑制;H2O2能升高细胞内ROS和降低ΔΨm(P<0.05),其中高表达株中两者的变化幅度较亲本株低(P<0.05);同时高表达株中CAP1和GRP2基因在转录水平的表达上调以及SOD2和SOD5基因的下调也较亲本株少(P<0.05)。结论CDR1/CDR2和MDR1基因高表达能够降低白念珠菌的氧化应激反应,增强其对氧化应激的适应性。
白念珠菌;CDR1/CDR2基因;MDR1基因; 高表达; 氧化应激
近年来白念珠菌病的发病率不断上升,虽然有多种抗真菌药物应用于临床,但耐药现象愈来愈多,耐药程度也越来越高[1]。白念珠菌耐药性的产生与多种因素有关,当前研究发现最主要的机制是ATP结合蛋白转运盒多药外排转运子的编码基因CDR1和CDR2的过度表达,易化载体超家族基因MDR1的过度表达[2]。此外有研究表明白念珠菌的耐药产生于对抗真菌药物的高适应性,同时也是白念珠菌对环境适应的一种体现[3]。某些抗真菌药物,如唑类药物,已被证实可通过诱导氧化应激反应而杀伤真菌,其耐药性的产生也有可能是白念珠菌对氧化应激反应的适应,不同耐药程度的菌株对氧化应激可能作出不同的反应[4-5]。因此,本文选取同一亲本来源的亲本株和CDR1/CDR2和MDR1基因高表达株,在过氧化氢(H2O2)模拟的氧化应激环境下,测定这两组菌株抵抗H2O2氧化刺激的差异,氧化损伤的主要指标,以及氧化应激相关基因和活性氧(ROS)清除相关基因转录水平表达情况,探讨CDR1/CDR2和MDR1基因高表达对白念珠菌氧化应激反应的影响。
1 材料与方法
1.1 材料
1.1.1 菌株 受试菌株(见表1)为来自于艾滋病合并口咽念珠菌病患者的白念珠菌(瑞士洛桑大学微生物研究所Sanglard教授惠赠)。质控菌株为美国临床和实验室标准协会(CLSI) 推荐的克柔念珠菌 ATCC6258和近平滑念珠菌 ATCC22019。
1.1.2 试剂、培养基、主要仪器 H2O2(北京普博欣生物科技有限公司,纯度30%), 四甲基偶氮唑盐(MTT,美国Sigma公司),2′, 7′-二氯荧光素二乙酯(DCFH-DA,美国sigma公司),PBS缓冲液(北京普博欣生物科技有限公司),二甲基亚砜(DMSO, 美国Sigma公司),真菌细胞线粒体膜电位荧光测定试剂盒(上海杰美基因(GenMed)医药科技有限公司),真菌RNA提取试剂盒(E.Z.N.A.Fungal RNA Kit)(美国Omega公司),反转录试剂盒(日本TakaRa公司)。YEPD 液体培养基(含1% 酵母抽提粉,2% 蛋白胨,2% 葡萄糖,美国BD公司),YEPD 固体培养基(含1% 酵母抽提粉,2% 蛋白胨,2% 葡萄糖,2% 琼脂,美国BD公司),RPMI-1640液体培养基(美国Gibco公司, pH 7.0)。酶标仪(680型,美国BIORAD 公司),Gallios 流式细胞仪(美国Beckman Coulter公司),TECAN 全波长多功能酶标仪(奥地利 Tecan 公司),Mini-sub CELL GT电泳仪(美国 BIORAD 公司),凝胶成像系仪(美国 BIORAD 公司),Q-PCR 仪(美国 BIORAD 公司)。
表1 受试菌株
Tab.1 Strains used in this study

菌株Strain亲本株Parentstrain过度表达基因OverexpressiongenesFLC的MIC(μg/mL)MICofFLC(μg/mL)参考文献ReferenceDSY2940.256DSY296DSY294CDR1andCDR2646DSY2900.57DSY292DSY290MDR11287
注:MIC:最低抑菌浓度
Note: MIC, minimum inhibitory concentration
1.2 方法
1.2.1 菌株培养 从4 ℃保存的YEPD固体培养基上挑取白念珠菌单克隆于YEPD液体培养基中,在30 ℃、200 r/min振荡培养,活化16 h后用于实验。1.2.2 试剂配置 H2O2用无菌蒸馏水配置成5 mol/L 的储备液; DCFH-DA用DSMO溶解,配置成2 mg/mL的储备液。两种试剂储备液分别过滤分装后, -20 ℃保存备用。MTT用PBS缓冲液配制成5 mg/mL的储备液, 4 ℃避光保存。
1.2.3 H2O2对白念珠菌生长抑制的测定 先用RPMI-1640液体培养基调节菌液浓度为2倍工作浓度(1~5)×103CFU/mL,将H2O2药物储备液稀释至2倍工作浓度(0.312 5、0.625、1.25、2.5、5、10、20、40、80、160 mmol/L),取其100 μL依次加入96孔板的第2 ~ 11列,第1列为生长对照, 不加药液, 而以100 μL RPMI-1640液体培养基代替;第12列为空白对照, 加入200 μL RPMI-1640液体培养基;除第12列外,其余各孔再分别加入100 μL菌悬液。30 ℃恒温培养24 h,然后加5 mg/mL的MTT作用3~4 h,将各孔上清吸出100 μL,再加DMSO培养20 min,用酶标仪测定OD570值, 结果表示为,与生长对照孔比较,生长活性100%完全抑制,培养基清亮时,所对应的最低药物浓度即为H2O2对白念珠菌生长抑制所需最低浓度。
1.2.4 DCFH-DA 染色检测细胞内ROS 白念珠菌培养同上,调节细胞浓度至2.5×106CFU/mL,加入5 mmol/L H2O2作用,30 ℃培养6 h。药物处理后,将细胞用PBS洗涤3次,并重悬至1×107CFU/mL,加入DCFH-DA 使其终浓度为20 μg/mL,30 ℃孵育20 min。将染色好细胞用PBS洗涤3次后,用Gallios流式细胞仪检测平均荧光强度, 该值即代表ROS水平,激发波长为485 nm,发射波长520 nm。
1.2.5 线粒体膜电位(ΔΨm)检测 将活化好的白念珠菌菌悬液调整浓度为2.5×106CFU/mL,用5 mmol/L H2O2处理6 h。药物处理后,应用GENMED真菌细胞线粒体膜电位荧光测定试剂盒进行检测,调节菌浓度为1×107CFU/mL,GENMED清理液洗涤3次后,加入500 μL GENMED染色工作液(JC-1染色剂:10 μg/mL),30 ℃避光培养20 min,将细胞用GENMED清理液洗涤2次,取200 μL转移至黑色96孔板。应用全波长多功能酶标仪进行荧光双重测定,激发波长490 nm,获得红色荧光单位(散发波长590 nm)和绿色荧光单位(散发波长530 nm)。ΔΨm由红色与绿色荧光的比值来确定。
1.2.6 RNA的提取和cDNA合成 活化后白念珠菌调节浓度为2.5×106CFU/mL,5 mmol/L H2O2作用6 h。药物处理后,调节细胞浓度为1.5×107CFU/mL,取1 mL,按照真菌RNA提取试剂盒的说明书提取总RNA,放入-80 ℃冰箱中保存备用。按照Prime Script RT reagent Kit with gDNA Eraser说明书先去除基因组DNA,再进行反转录,合成的cDNA产物放入-80 ℃冰箱保存备用。
1.2.7 引物合成和qRT-PCR 引物由上海英潍捷基贸易有限公司合成。18sRNA、CAP1、GRP2、SOD2和SOD5的引物序列根据参考文献合成[8-9],见表2。qRT-PCR采用SYBR○RPremix Ex TaqTMII (Tli RNaseH Plus)的标准步骤进行。反应条件:95 ℃预变性10 s;95 ℃ 变性10 s,55 ℃退火20 s,72 ℃延伸15 s,重复40个循环。55 ~ 95 ℃每 1 s 读取一次熔解曲线。以18sRNA作为内参标准,结果应用Light Cycler system software version 3.5(Roche Diagnostics) 软件系统进行分析。以不加药组各个基因的表达量作为对照,计算基因H2O2处理后各个基因mRNA转录水平的相对表达量,各个基因的相对表达量用倍数变化来表示(2-(ΔΔCt)法)。
表2 基因CAP1、GRP2、SOD2和SOD5所需引物序列
Tab. 2 Primer lists ofCAP1,GRP2,SOD2 andSOD5
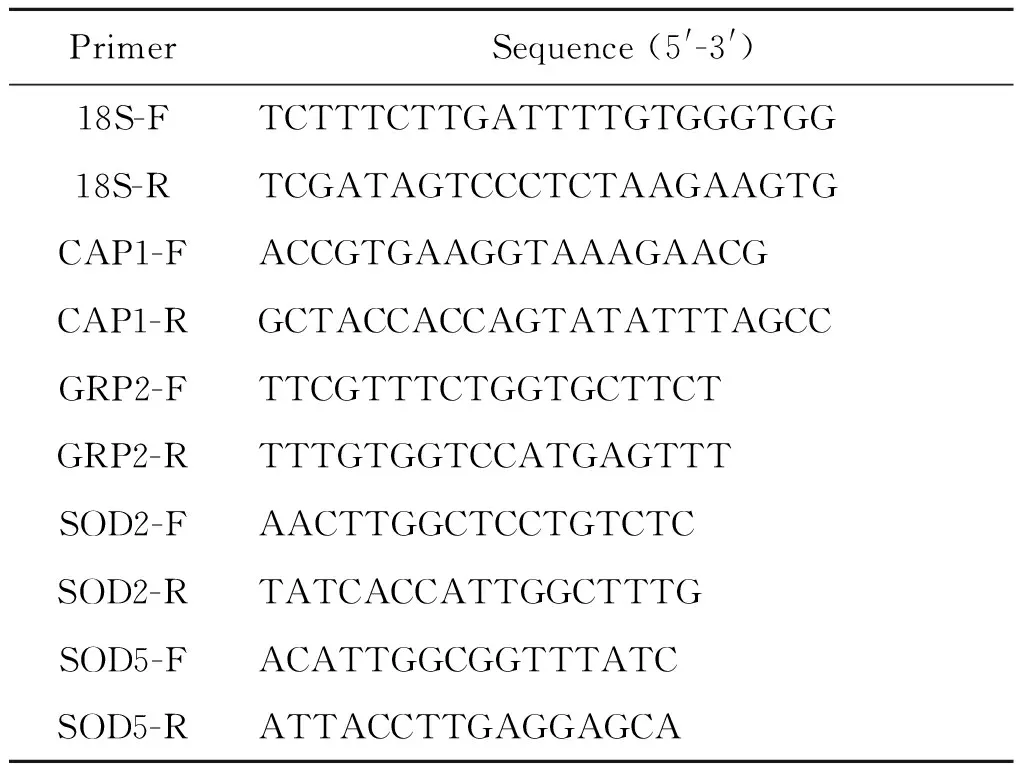
PrimerSequence(5'-3')18S-FTCTTTCTTGATTTTGTGGGTGG18S-RTCGATAGTCCCTCTAAGAAGTGCAP1-FACCGTGAAGGTAAAGAACGCAP1-RGCTACCACCAGTATATTTAGCCGRP2-FTTCGTTTCTGGTGCTTCTGRP2-RTTTGTGGTCCATGAGTTTSOD2-FAACTTGGCTCCTGTCTCSOD2-RTATCACCATTGGCTTTGSOD5-FACATTGGCGGTTTATCSOD5-RATTACCTTGAGGAGCA
2 结 果
2.1 H2O2对白念珠菌生长抑制的影响 结果显示H2O2对这2组白念珠菌生长活性完全抑制对应的最低浓度值均为5 mmol/L,没有显示出CDR1/CDR2和MDR1基因高表达对菌株抵抗H2O2所模拟的氧化应激的能力差异。
2.2 ROS生成的差异 如图1所示,不加药物作用下,亲本株与CDR1/CDR2和MDR1基因高表达株的ROS无明显差异(P>0.05);而在H2O2作用后,各菌株细胞内的ROS水平明显高于空白对照组(P<0.05);且与对应亲本株相比,CDR1/CDR2和MDR1基因高表达株中ROS生成较少(P<0.05),分别只有亲本株的0.34倍和0.49倍。
2.3 ΔΨm降低的差异 如图2所示,不加药物作用下,亲本株与CDR1/CDR2和MDR1基因高表达株的ΔΨm无明显差异(P>0.05),在H2O2作用下,白念珠菌的ΔΨm比空白对照组明显降低(P<0.05);且CDR1/CDR2和MDR1基因高表达株中ΔΨm比亲本株高 (P<0.05),表明其ΔΨm下降程度较亲本株少。
2.4 氧化应激相关基因和ROS清除相关基因转录水平表达差异 如图3所示,H2O2作用下,氧化应激相关基因CAP1和GRP2转录水平的相对表达量在各菌株中均有上调(P<0.05),其中,CDR1/CDR2和MDR1基因高表达株的上调较亲本株少(P<0.05),表明其氧化应激反应低于亲本株; ROS清除相关基因SOD2和SOD5转录水平的相对表达量在各菌株中均有下调(P<0.05),其中,CDR1/CDR2和MDR1基因高表达株的下调较亲本株少(P<0.05),表明其细胞内ROS清除作用高于亲本株。
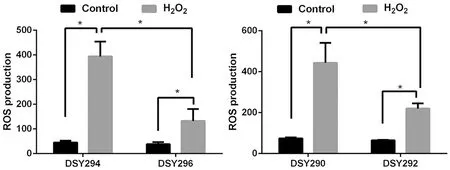
数据以3次独立实验数据的形式表示 * P<0.05The data display the ±s from three independent experiments * P<0.05图1 流式细胞术DCFH-DA染色检测H2O2对亲本株、CDR1/CDR2和MDR1基因高表达株ROS的影响Fig.1 Effect of H2O2 on ROS of parent strains and CDR1/CDR2 or MDR1 genes overexpressed strains were assessed by flow cytometry using DCFH-DA
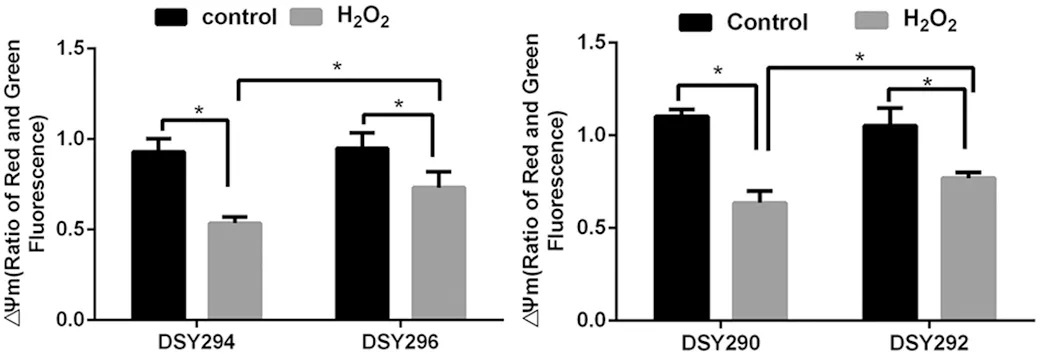
数据以3次独立实验数据的形式表示 *P<0.05The data display the ±s from three independent experiments * P<0.05图2 JC-1染色检测H2O2对亲本株、CDR1/CDR2和MDR1基因高表达株膜电位的影响Fig.2 Effect of H2O2 on ΔΨm of parent strains and CDR1/CDR2 or MDR1 genes overexpressed strains were assessed by JC-1 staining

数据以3次独立实验数据的形式表示The data display the ±s from three independent experiments图3 qRT-PCR 测定不加药或5 mmol/L H2O2处理后白念珠菌基因CAP1(A)、GRP2(B)、SOD2(C)和SOD5(D) 的表达水平Fig.3 qRT-PCR analysis of the expression levels of CAP1(A), GRP2(B), SOD2(C) and SOD5(D) in C. albicans which treated or untreated with 5 mmol/L H2O2
3 讨 论
白念珠菌的耐药性是目前临床上系统性白念珠菌感染治疗失败的主要原因之一。当机体感染白念珠菌时,细胞免疫占主导地位[10],主要是通过吞噬细胞的呼吸爆发产生活性氧物质而杀伤白念珠菌,而白念珠菌对氧化损伤的耐受可以导致免疫逃逸,进一步促进感染的形成[11],其临床治疗也会越困难。因此,本文旨在探讨不同耐药程度的白念珠菌在耐受氧化应激能力上存在的差异,从而为抗真菌治疗提供一个新的途径。
本研究选定白念珠菌药物外排泵基因CDR1/CDR2和MDR1高表达且对唑类药物耐药的菌株和对应的亲本株为研究对象,发现所有菌株对H2O2的耐受性无差异。这可能是因为实验使用的菌浓度和培养基都较少,H2O2为很强的杀菌剂,在这样的情况下它能够在极低的浓度下杀死白念珠菌。同时在5 mmol/L H2O2模拟的氧化应激环境下,我们发现CDR1/CDR2和MDR1基因高表达能够减少ROS的生成。某些抗真菌药物可以通过使真菌处于大量ROS的内外环境而杀伤真菌[4-5]。而真菌过度表达药物外排基因,增加药物外排的过程也就是消除氧化源的过程,是对抗真菌药物引起的氧化刺激最有效的手段。因此,药物外排泵基因CDR1/CDR2和MDR1高表达能够减少氧化刺激下白念珠菌细胞内ROS水平。其次,实验还发现CDR1/CDR2和MDR1基因高表达能够减少白念珠菌ΔΨm的下降。正常白念珠菌细胞中存在着完备的氧化和抗氧化系统,处于氧化还原平衡状态。当辐射、细胞毒性药物等破坏了氧化还原的平衡态时,ROS的生成超过了抗氧化防御的能力,细胞就会进入氧化应激状态。当细胞产生轻度的氧化应激时,在药物作用下细胞会表现出一定的耐药性。但大量的则会导致强烈的氧化损伤反应,如线粒体功能障碍,从而降低了ΔΨm[12]。所以,CDR1/CDR2和MDR1基因高表达在减少细胞内ROS生成后,同时也能减少ΔΨm的下降。
有文献报道,CAP1基因既与白念珠菌的耐药性相关,又与氧化应激相关[13-14],GRP2基因编码丙酮醛还原酶,能单独或通过CAP1基因引起氧化应激反应。SOD2和SOD2基因编码超氧化物歧化酶,清除细胞内ROS,是抗氧化应激反应的第一道防线[15]。CDR1/CDR2和MDR1基因高表达通过减少CAP1和GRP2基因表达的上调,降低了白念珠菌引起氧化应激的能力;同时,CDR1/CDR2和MDR1基因高表达通过减少SOD2和SOD5基因表达的下调,增加了菌株细胞内ROS的清除,减少了其积聚,从而减少氧化应激反应。qRT-PCR的结果与细胞内ROS和ΔΨm测定结果是一致的。
由此可知,CDR1/CDR2和MDR1基因高表达能够降低白念珠菌细胞内的氧化应激反应,增加其对氧化应激环境的适应性。白念珠菌的耐药也是对细胞内外环境的适应,寻找新的抗氧化应激作用的药物与当前耐药的抗真菌药物联合使用,有可能为解决白念珠菌的耐药问题提供新思路。
[1] Liao WQ, Gu JL. Current situation and strategy for the treatment of deep fungal infections [J]. Chin J Infect Chemother, 2007, 7(2): 101-103. (in Chinese)
廖万清, 顾菊林. 深部真菌感染治疗的现状与对策 [J]. 中国感染与化疗杂志, 2007, 7(2): 101-103.
[2] Sanglard D, Kuchler K, Ischer F, et al. Mechanisms of resistance to azole antifungal agents inCandidaalbicansisolates from AIDS patients involve specific multidrug transporters [J]. Antimicrob Agents Chemother, 1995, 39(11): 2378-2386. DOI: 10. 1128/AAC. 39. 11. 2378
[3] Huang H, Wang Y, Li Y, et al. Stress response and drug resistance ofCandidaalbicans[J]. Acad J Sec Mil Medic Univ, 2010, 31 (11): 1239-1243. (in Chinese)
黄海, 王彦, 李莹, 等. 白念珠菌的应激反应与耐药性 [J]. 第二军医大学学报, 2010, 31 (11): 1239-1243.
[4] Kobayashi D, Kondo K, Uehara N, et al. Endogenous reactive oxygen species is an important mediator of miconazole antifungal effect [J]. Antimicrob Agents Chemother, 2002, 46(10): 3113-3117. DOI: 10. 1128/AAC. 46. 10. 3113-3117. 2002
[5] Liu TT, Lee RE, Barker KS, et al. Genome-wide expression
profiling of the response to azole, polyene, echinocandin, and pyrimidine antifungal agents inCandidaalbicans[J]. Antimicrob Agents Chemother, 2005, 49(6): 2226-2236. DOI: 10. 1128/AAC. 49. 6. 2226-2236. 2005
[6] Coste AT, Karababa M, Ischer F, et al.TAC1, transcriptional activator ofCDRgenes, is a new transcription factor involved in the regulation ofCandidaalbicansABC transportersCDR1 andCDR2[J]. Eukaryot Cell, 2004, 3(6): 1639-1652. DOI: 10.1128/EC. 3. 6. 1639-1652. 2004
[7] Dunkel N, Blass J, Rogers PD, et al. Mutations in the multi-drug resistance regulatorMRR1, followed by loss of heterozygosity, are the main cause ofMDR1 overexpression in fluconazole-resistantCandidaalbicansstrains [J]. Mol Microbiol, 2008, 69(4): 827-840. DOI: 10. 1111/j. 1365-2958. 2008. 06309. x
[8] Zhao L, Jiang J, Zhu Z, et al. Lysine enhances the effect of amphotericin B againstCandidaalbicansinvitro[J]. Acta Biochim Biophys Sin, 2016, 48(2): 182-193. DOI: 10. 1093/abbs/gmv125
[9] Miao H, Zhao L, Li C, et al. Inhibitory effect of Shikonin onCandidaalbicansgrowth [J]. Biol Pharm Bull, 2012, 35(11):1956-1963. DOI: 10. 1248/bpb. b12-00338
[10] Shi JP, Li SH, Zhu KJ, et al. Tetrandrine on the dynamic changes of cytokines and antifungal effect in mice withCandidaalbicans[J]. Chin J Zoonoses, 2016, 32(8): 689-695. DOI: 10. 3969/j. issn. 1002-2694. 2016. 08. 002 (in Chinese)
石建萍, 李水秀, 朱坤举, 等. 汉防己甲素对系统性白念珠菌感染小鼠的治疗作用 [J]. 中国人兽共患病学报, 2016, 32(8): 689-695.
[11] Brakebusch M, Wintergerst U, Petropoulou T, et al. Bromelain is an accelerator of phagocytosis, respiratory burst and Killing ofCandidaalbicansby human granulocytes and monocytes [J]. Eur J Med Res, 2001, 6(5): 193-200.
[12] Dantas Ada S, Day A, Ikeh M, et al. Oxidative stress responses in the human fungal pathogen,Candidaalbicans[J]. Biomolecules, 2015, 5(1):142-165. DOI: 10. 3390/biom5010142
[13] Tan PL, Wang ZJ, Zhao JF. Resistance ofCandidaalbicansisolates against fluconazole and the resistance correlation withCAP1 gene [J]. Chin J Zoonoses, 2015, 31(4): 325-329. DOI: 10.3969/j.issn.1002-2694.2015.04.007 (in Chinese)
谈潘莉, 汪浙炯, 赵金方. 白假丝酵母菌临床菌株对氟康唑耐药性及其与CAP1基因相关性研究 [J]. 中国人兽共患病学报, 2015, 33(4): 325-329.
[14] Alarco AM, Raymond M. The b-Zip transcription factor Cap1p is involved in multiple resistance and oxidative stress response inCandidaalbicans[J]. J Bacteriol, 1999, 181(3):700-708.
[15] Luk E, Yang M, Jensen LT, et al. Manganese activation of superoxide dismutase 2 in the mitochondria ofSaccharomycescerevisiae[J]. J Biol Chem, 2005, 280(24): 22715-22720.DOI: 10. 1074/jbc. M504257200
Effect ofCDR1/CDR2 orMDR1 genes overexpression on oxidative stress inCandidaalbicans
JIANG Ling, ZHAO Ya-jing, LI Shui-xiu, SONG Yan-jun, GUO Hui, ZHU Kun-ju, ZHANG Hong
(TheFirstAffiliatedHospital/InstituteofMycology,JinanUniversity,Guangzhou510632,China)
To investigate the effect ofCDR1/CDR2 orMDR1 genes overexpression on oxidative stress inCandidaalbicans, we evaluated the effect of H2O2on cell viability inC.albicansoverexpressing genesCDR1 /CDR2 orMDR1 and their parent strains. After establishing an oxidative stress model with H2O2, we detected reactive oxygen species (ROS),mitochondrial membrane potential (ΔΨm) and the expression of oxidative stress response-related genes (CAP1 andGRP2) and ROS clearance related-genes (SOD2 andSOD5). The results showed thatC.albicansgrowth were inhibited by 100% after the treatment of 5 mmol/L H2O2. H2O2caused more ROS accumulation and ΔΨm reduction in parent strains than inCDR1/CDR2 orMDR1 genes overexpressed strains (P<0.05). Compared to parent strains, the up-regulated expression ofCAP1 andGRP2 were relatively less inCDR1/CDR2 orMDR1 genes overexpressed strains, moreover, the down-regulated expression ofSOD2 andSOD5 were also relatively less inCDR1/CDR2 orMDR1 genes overexpressed strains (P<0.05). In conclusion, the overexpression ofCDR1/CDR2 andMDR1 genes could reduce the oxidative stress response and enhance the adaptability ofC.albicansto oxidative stress.
Candidaalbicans;CDR1/CDR2 gene;MDR1 gene; overexpression; oxidative stress
s: Zhang Hong, Email: tzhangh@jnu.edu.cn;Zhu Kun-ju, Email: zhukunju1111@163.com
10.3969/j.issn.1002-2694.2017.06.003
国家自然科学基金(No. 81171542/81471995)
张 宏,Email:tzhangh@jnu.edu.cn; 朱坤举,Email: zhukunju1111@163.com
暨南大学附属第一医院/暨南大学真菌病研究所,广州 510632
R378
A
1002-2694(2017)06-0486-05
2016-11-10 编辑:张智芳
Supported by the National Natural Science Foundation of China (No. 81171542 / 81471995)
