华支睾吸虫成虫抗原和排泄分泌产物对T细胞的作用研究
2017-06-28张蓓蓓程晓丹汤仁仙郑葵阳
张 波,张蓓蓓,程晓丹,华 慧,于 倩,颜 超,汤仁仙,郑葵阳
华支睾吸虫成虫抗原和排泄分泌产物对T细胞的作用研究
张 波,张蓓蓓,程晓丹,华 慧,于 倩,颜 超,汤仁仙,郑葵阳
目的 观察华支睾吸虫成虫抗原(Crude antigen,CA)、排泄/分泌产物(excretory-secretory products,ESPs)对T细胞的作用。方法 体外分离小鼠骨髓细胞诱导分化为未成熟骨髓树突状细胞(immature DC,iDC);磁珠分选仪分选小鼠脾脏细胞的初始CD4+T细胞;流式细胞术检测DC、CD4+T细胞的纯度;抗原刺激DC细胞,实验分为PBS阴性对照组,LPS阳性对照组,CA和ESPs刺激组;负载抗原后的DC细胞与分选的CD4+T细胞共培养72 h;Real time-PCR检测T-bet、GATA3 mRNA的相对表达量;ELISA检测细胞培养上清中IFN-γ、IL-4细胞因子的表达量。结果 与PBS组相比,ESPs刺激组T-bet、GATA3 mRNA表达水平升高(P<0.05),而CA刺激组T-bet、GATA3 mRNA表达水平差异不显著;与PBS组相比,ESPs刺激组细胞因子IFN-γ、IL-4的含量均升高(P<0.05),CA刺激组仅IFN-γ的分泌增高(P<0.05),IL-4无明显变化。结论 CA可能诱导宿主产生Th1型免疫应答,ESPs可能诱导宿主产生Th1型、Th2型免疫应答。
华支睾吸虫;DC细胞;CD4+细胞;成虫抗原;排泄/分泌产物
Funded by the National Natural Science Foundation of China (Grant Nos. 81171590, 81572019),the Chinese Academy of Agricultural Sciences (Grant No. SKLVEB2013KFKT005), a Project Funded by the Priority Academic Program Development of Jiangsu Higher Education Institutions (PAPD). Corresponding author: Zheng Kui-yang,Email: zky02@163.com
华支睾吸虫病是一种因人或犬猫等哺乳动物食入含有华支睾吸虫囊蚴的淡水鱼而感染的食源性寄生虫病,中国,韩国,越南等是本病严重的国家[1-5]。
特异性抗原刺激后,在不同的转录因子及细胞因子的作用下CD4+T细胞增殖分化形成不同的细胞亚群,包括Th1,Th2等细胞亚群[6]。Th1、Th2两细胞亚群分别在细胞免疫及体液免疫应答中发挥重要的作用,其中Th1细胞免疫应答在抗细胞内病原体如利仕曼原虫、结核杆菌感染中发挥至关重要的作用,而Th2类免疫应答在抗细胞外病原体产生体液免疫应答方面发挥重要作用,如Th2细胞能够缓解肠道蠕虫如巴西日圆线虫的感染[7-8]。病原体-抗原提呈细胞(APCs)的相互作用是引发机体Th1/Th2免疫应答的始动因素,树突状细胞(DC)作为功能最强大的抗原递呈细胞,其识别的抗原递呈给CD4+T细胞后,能够诱导其活化,增殖,分化,并决定其所分泌细胞因子的类型及剂量[9]。在宿主本身内环境因素或外来不同抗原的刺激下,寄生虫感染中DC影响机体对寄生虫感染形成不同的免疫应答状态[10]。关于华支睾吸虫特异性抗原体外被DC特异性识别及将信号递呈给初始CD4+T细胞,是如何调控Th1、Th2细胞的免疫应答反应,目前仍未阐明。本研究在细胞水平阐明华支睾吸虫源性抗原对Th1、Th2细胞的极化作用,为深入研究华支睾吸虫的致病机制奠定基础。
1 材料与方法
1.1 动物及材料 健康雌性6~8周龄BALB/c小鼠,购买自上海斯莱克实验动物有限公司,饲养于徐州医科大学实验动物中心SPF级屏障系统。CD4+T细胞磁珠抗体(德国MiltenyiBiotec公司);流式抗体CD11c(FITC)、CD4(PerCP-Cy5-5)(美国eBioscience公司);RPMI1640培养基(美国Hyclone公司);IL-4、GM-CSF细胞因子(美国PEPROTECH公司);IFN-γ、IL-4 ELISA检测试剂盒(美国eBioscience公司);总RNA提取及反转录试剂盒,(北京天根生化科技有限公司);SYBR GreenⅠ荧光定量试剂盒(罗氏诊断产品(上海)有限公司)。
1.2 方法
1.2.1 抗原制备:CA的制备参照文献[11]。ESPs制备参照文献[12]。
1.2.2 骨髓来源树突状细胞(BMDCs)分离培养和纯度检测:取BALB/c小鼠股骨及胫骨,浸泡于75%乙醇10 min,剪刀去除肌肉组织后,使用1 mL注射器将骨髓腔中细胞冲净,裂解红细胞,常规1 500 r/min洗涤5 min,重复两遍。细胞计数后,用含有IL-4和GM-CSF(终浓度10 ng/mL)的完全培养基重悬细胞,并铺于六孔细胞培养板中,放入37 ℃,5% CO2培养箱中培养。2 d后全量换液,4 d后半量换液,第6 d收集细胞,取约1×105个细胞加入1 μL CD11c抗体室温孵育15 min,洗涤后,流式细胞仪检测其纯度。
1.2.3 CD4+T细胞的分离及纯度检测:取BALB/c小鼠脾脏,包裹于200目滤膜中研磨棒研碎,裂解红细胞,常规洗涤之后,细胞计数,每1×107个细胞加入10 μL CD4+T细胞磁珠抗体,4 ℃孵育15 min。常规洗涤,全自动磁珠分选仪分选细胞,取出CD4+阳性细胞管,洗涤之后加入1 μL CD4流式抗体,室温孵育15 min,洗涤后,流式细胞仪检测其纯度。
1.2.4 抗原刺激DC细胞:收集诱导6 d后的细胞,PBS洗涤3次,用1640完全培养基重悬细胞,调节细胞终浓度为1×106/mL,按1 mL/孔分别加入24孔板中,并加相应致敏原,刺激24 h。实验分组如下:LPS(LPS 1 μg/mL);PBS组;CA组(CA 80 μg/mL);ESPs组(ESPs 50 μg/mL)。
1.2.5 DC细胞与CD4+T细胞共培养:将2.5×105个负载抗原的DC细胞与1.25×106个CD4+T细胞铺于24孔细胞培养板中,共培养72 h。离心分别收集细胞和上清备用。
1.2.6 Realtime-PCR检测T-bet、GATA3的相对表达量:常规提取细胞总RNA并反转录成cDNA,按20 μL Real-time PCR反应体系:cDNA 1 μL,2×Con(SYBRGreenI Master) 10 μL,上游引物(10 μM) 1 μL,下游引物(10 μM) 1 μL,PCR级用水7 μL,混匀。反应程序为pre-incubation 95 ℃ 5 min,扩增循环 95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,共40个循环。以β-actin基因为内参,校正每个样本目的基因的Ct值,计算△Ct值,以2-△△Ct值计算基因相对表达水平。
1.2.7 ELISA检测细胞培养上清中IFN-γ、IL-4的表达量:检测方法按照试剂盒中的说明进行,每组设3个复孔。
2 结 果
2.1 BMDCs、CD4+T细胞纯度检测 诱导培养的小鼠BMDCs培养6 d之后,倒置显微镜观察细胞形态,低倍镜下见及大量大小不一的集落,细胞成簇生长;高倍镜下细胞圆形,并有长短不一的突起伸出细胞表面(见图1)。流式细胞术检测细胞纯度,结果显示CD11c+细胞所占比例在90%以上(见图2 A)。流式细胞术检测磁珠分选后的CD4+T细胞的纯度,其纯度在90%以上(见图2 B)。以上结果表明培养的BMDCs、分选的CD4+T细胞可用于实验中。
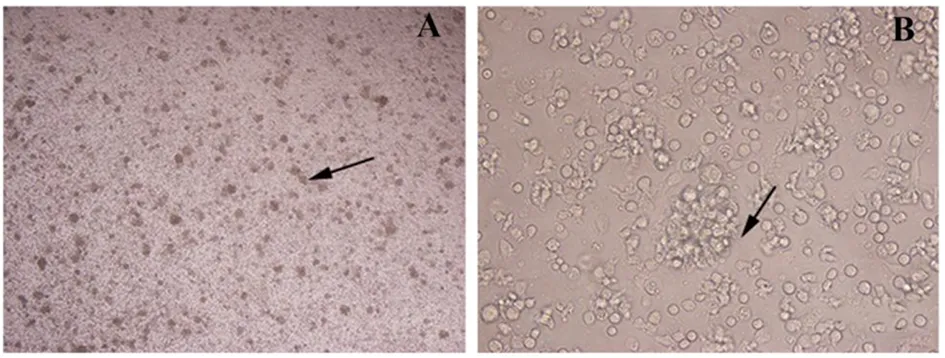
图1 小鼠BMDCs诱导培养6 d显微镜下形态(A:放大40倍,B:放大400倍, →: 集落)Fig.1 Observation of BMDCs by microscope on day 6 (A:×40,B:×400, → : colony)

A、流式细胞术检测BMDCs纯度;B:流式细胞术检测CD4+ T细胞纯度A:Purify of BMDCs;B:Purify of CD4+T cells图2 BMDCs、CD4+ T细胞纯度检测Fig.2 Purification of BMDCs and CD4+T cells
2.2 CD4+T细胞T-bet、GATA3 mRNA的表达水平 我们通过Real time PCR检测了T-bet、GATA3基因表达水平,结果表明与对照组相比CA、ESPs刺激组T-bet、GATA3基因表达水平均是增高的,但是只有ESPs刺激组与对照组相比差异具有统计学差异(P<0.05),(图3)。

注:*:vs PBS 组P<0.05Note:*:vs PBS group, P<0.05图3 Real-time PCR检测T-bet、GATA-3 mRNA的相对表达水平Fig.3 Relative expression of T-bet and GATA-3 mRNA
2.3 细胞培养上清IL-4、IFN-γ的表达水平 为了检测Th1型及Th2型细胞因子的表达水平,采用ELISA法检测IFN-γ及IL-4细胞因子的表达情况,实验结果表明:与PBS组相比,CA刺激组IFN-γ表达显著升高(P<0.05),IL-4的表达无明显变化;ESPs刺激组IFN-γ、IL-4的表达与PBS组相比均显著升高(P<0.05)(图4)。
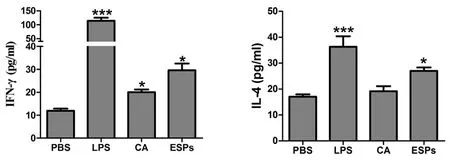
注:*:vs PBS 组P<0.05;***:vs PBS组P<0.001Note:*:vs PBS group, P<0.05; ***:vs PBS group, P<0.001图4 ELISA检测细胞培养上清中IFN-γ、IL-4表达量Fig.4 The levels of IFN-γ and IL-4 cytokines
3 讨 论
目前研究结果显示,蠕虫感染过程中CD4+T细胞亚群的分化对机体抵抗病原体入侵起着重要的作用。如旋毛虫体内的热休克蛋白70(Heat shock protein 70)可以致敏DC细胞从而促进CD4+T细胞分泌大量的Th1型细胞因子IFN-γ、Th2型细胞因子IL-4[13],而肝片吸虫、血吸虫感染小鼠随着感染时间的延长,表现出Th2型优势免疫应答,这可能是由于Th2细胞分泌IL-4、IL-10细胞因子抑制了IFN-γ的分泌,进而抑制Th1细胞的功能[14-15]。研究表明随着华支睾吸虫感染BABL/c小鼠时间的延长,在感染2~4 w后体外培养的脾脏细胞Th2型细胞因子IL-10、IL-5分泌增加,而Th1型细胞因子IFN-γ、IL-2分泌减少[16]。我们通过磁珠分选的技术手段将CD4+T细胞分离纯化后分别与CA、ESPs致敏的骨髓DC细胞共培养,结果显示,T-bet、GATA3基因表达水平均是增高的。T-bet、GATA-3分别是初始T细胞分化成Th1、Th2细胞的重要转录因子,T-bet不仅控制Th1细胞特征性细胞因子IFN-γ的产生,同时还能抑制Th2型细胞因子IL-4的分泌,而IFN-γ又可以促进T-bet的表达。因此二者形成正反馈关系[17-18],而Th2细胞分泌IL-4需要GATA-3基因的表达,且GATA-3与T-bet之间亦有着相互抑制的关系。ELISA结果显示,CA刺激组IFN-γ的分泌显著升高,IL-4的分泌未见升高,ESPs刺激组IFN-γ、IL-4分泌均升高。
寄生虫感染不同阶段的抗原引起的免疫反应也是不一样的,如血吸虫可溶性成虫抗原(SWA)在体外刺激脾脏细胞后促进Th1型免疫应答,虫卵抗原(SEA)体外则促进Th2型优势免疫应答。华支睾吸虫CA刺激增强DCs的免疫学活性后,DCs与脾脏总淋巴细胞共培养产生Th1型而不是Th2型免疫应答。我们的结果表明CA可能在Th1型免疫反应中发挥重要的作用,这与之前的实验结果一致。ESPs可能在Th1型、Th2型免疫反应均发挥重要的作用。在华支睾吸虫感染小鼠的研究中显示,在感染早期表现出Th1型保护性免疫,而随着感染时间的延长,逐渐向Th2型保护性免疫漂移,所以CA抗原中的一些成分可能在感染早期发挥作用。而ESPs在华支睾吸虫感染的整个阶段持续发挥作用。
[1] Brindley PJ, da Costa JM,Sripa B. Why does infection with some helminths cause cancer[J].Trends Cancer, 2015, 1(3): 174-182.
[2] Qian MB, Chen YD, Liang S, et al. The global epidemiology of clonorchiasis and its relation with cholangiocarcinoma[J]. Infect Dis Poverty, 2012, 1(1): 4. DOI: 10.1186/2049-9957-1-4.
[3] Cheng YJ, Yao LJ. Pathogenesis ofClonorchissinensisand liver/gallbladder cancer[J]. Chin J Zoonoses, 2010, 26 (3):275-278. (in Chinese)
程艳洁,姚丽君.华支睾吸虫与肝/胆癌发病机制[J]. 中国人兽共患病学报, 2010, 26 (3):275-278.
[4] Qian MB, Utzinger J, Keiser J, et al. Clonorchiasis[J]. Lancet, 2016, 387(10020): 800-810. DOI: 10.1016/S0140-6736(15)60313-0.
[5] Yang GJ, Liu L, Zhu HR, et al. China’s sustained drive to eliminate neglected tropical diseases[J]. Lancet Infect Dis, 2014, 14(9):881-92. DOI: 10.1016/S1473-3099(14)70727-3.
[6] O’Shea JJ,Paul WE. Mechanisms underlying lineage commitment and plasticity of helper CD4+T cells[J]. Science, 2010, 327(5969): 1098-1102. DOI: 10.1126/science.1178334
[7] Hirahara K,Nakayama T. CD4+T-cell subsets in inflammatory diseases: beyond the Th1/Th2 paradigm[J]. Int Immunol, 2016, 28(4): 163-171. DOI: 10.1093/intimm/dxw006
[8] Pulendran B,Artis D. New paradigms in type 2 immunity[J]. Science, 2012, 337(6093): 431-435. DOI: 10.1126/science.1221064
[9] Kapsenberg ML. Dendritic-cell control of pathogen-driven T-cell polarization[J]. Nat Rev Immunol, 2003, 3(12): 984-993.
[10] Liu XX, Zhu M, Xu Q, et al. Parasitic infection to dendritic cell subsets[J].Chin J Zoonoses, 2012, 28(10): 1020-1024. (in Chinese)
刘晓霞, 朱明, 徐琦, 等. 寄生虫感染对树突状细胞亚群的影响[J].中国人兽共患病学报, 2012, 28(10): 1020-1024.
[11] Dai QF, Fu LL, Liu YS, et al. Dendritic cells pulsed by anantigen ofClonorchissinensisto induce immuneresponse[J]. J Pathog Biol, 2009, 4(8): 582-585. (in Chinese)
戴其锋, 付琳琳, 刘宜升, 等. 华支睾吸虫成虫抗原致敏树突状细胞诱导免疫应答的研究[J]. 中国病原生物学杂志, 2009, 4(8): 582-585.
[12] Guo QQ, Fu LL, Tang RX, et al. Th1/Th2 cytokine profile in spleen mononuclear cells of mice infected withClonorchissinensisstimulated by excretory-secretory antigen[J].Chin Trop Med, 2009, 9(7): 1187-1189.(in Chinese)
郭倩倩, 付琳琳, 汤仁仙, 等. ESA刺激华支睾吸虫感染小鼠脾细胞分泌Th1/Th2的动态观察[J]. 中国热带医学, 2009, 9(7): 1187-1189.
[13] Fang L, Sun L, Yang J, et al. Heat shock protein 70 fromTrichinellaspiralisinduces protective immunity in BALB/c mice by activating dendritic cells[J]. Vaccine, 2014, 32(35): 4412-4419. DOI: 10.1016/j.vaccine.2014.06.055
[14] Pearce EJ, C MK, Sun J, et al. Th2 response polarization during infection with the helminth parasiteSchistosomamansoni[J]. Immunol Rev, 2004, 201: 117-126.
[15] Mendes EA, Mendes TA, dos Santos SL, et al. Expression of IL-4, IL-10 and IFN-gamma in the liver tissue of cattle that are naturally infected withFasciolahepatica[J]. Vet Parasitol, 2013, 195(1/2): 177-182.
[16] Choi YK, Yoon BI, Won YS, et al. Cytokine responses in mice infected withClonorchissinensis[J]. Parasitol Res, 2003, 91(2): 87-93.
[17] Chakir H, Wang H, Lefebvre DE, et al.T-bet/GATA-3 ratio as a measure of the Th1/Th2 cytokine profile in mixed cell populations: predominant role ofGATA-3[J]. J Immunol Methods, 2003, 278(1/2): 157-169.
[18] Babu S, Kumaraswami V, Nutman TB. Transcriptional control of impaired Th1 responses in patent lymphatic filariasis by T-box expressed in T cells and suppressor of cytokine signaling genes[J]. Infect Immun, 2005, 73(6): 3394-3401.
Effects of crude antigen and excretory-secretory products ofClonorchissinensison T cells
ZHANG Bo, ZHANG Bei-bei, CHENG Xiao-dan, HUA Hui, YU Qian, YAN Chao, TANG Reng-xian, ZHENG Kui-yang
(JiangsuKeyLaboratoryofImmunityandMetabolism,DepartmentofPathogenicBiologyandImmunology,XuzhouMedicalCollege,Xuzhou221004,China)
We investigated the roles of the crude antigen(CA) ofClonorchissinensisand excretory-secretory products (ESPs) in the polarization of Th1 and Th2 cells. Bone marrow-derived cells were generated from BALB/c mice and isolated into immature DCs; immature DCs were then treated with either CA (CA stimulated group), ESPs (ESPs stimulated group), LPS (positive control group) or PBS (negative control group) for 24 hours. Then the CD4+T cells were isolated from mouse spleen by using anti-mouse-CD4 Microbeads, and further cocultured with stimulated DCs for another 72 hours. The purities of DCs and CD4+T cells were evaluated by flow cytometry and the expressing levels of T-bet mRNA and GATA-3 mRNA were detected by real-time PCR. ELISA was used to detect the levels of IFN-γ and IL-4 cytokines in the supernatant. mRNA levels of T-bet and GATA-3 in the ESPs group were higher than those in PBS-stimulated group (P<0.05). The concentrations of IFN-γ and IL-4 cytokines in the culture were increased in the ESPs group, compared with PBS stimulated group(P<0.05). IFN-γ but not IL-4 was increased in CA group (P<0.05). The results implied that CA might play a role in Th1 type immune response, and ESPs likely play roles in both Th1 and Th2 immune responses.
Clonorchissinensis; DCs; CD4+T cells; crude antigen; excretory-secretory products
10.3969/j.issn.1002-2694.2017.06.004
国家自然科学基金(No.81171590,81572019);家畜疫病病原生物学国家重点实验室开放课题(No.SKLVEB2013KFKT005);江苏高校优势学科建设工程资助项目(PAPD)联合资助
郑葵阳,zky02@163.com
江苏省免疫与代谢重点实验室,徐州医科大学病原生物学与免疫学教研室/感染与免疫实验室,徐州 221004
R383
A
1002-2694(2017)06-0491-04
2017-01-12 编辑:李友松
