睾酮对膝关节骨关节炎去势雄兔的软骨修复作用
2017-06-19熊华章刘毅王胜民吴术红桑鹏
熊华章,刘毅,王胜民,吴术红,桑鹏
(遵义医学院附属医院,贵州遵义563003)
睾酮对膝关节骨关节炎去势雄兔的软骨修复作用
熊华章,刘毅,王胜民,吴术红,桑鹏
(遵义医学院附属医院,贵州遵义563003)
目的 探讨睾酮对膝关节骨关节炎(KOA)睾丸切除(去势)雄兔的软骨修复作用。方法 将18只雄兔采用改良Hulth法建立右侧KOA模型并去势,8周时随机处死6只,确认模型建立成功。将剩余12只兔随机分为观察组和对照组,每组6只。观察组每隔2周肌注十一酸睾酮6 mg/kg,对照组同时肌注等量生理盐水,共8周(4次)。分组处理第8、12、16周,采用电化学发光免疫分析法检测血清睾酮;分组处理第16周末处死,取出右股骨髁,肉眼观察标本大体情况,采用免疫组化法检测软骨组织胰岛素样生长因子1(IGF-1)表达,并进行关节软骨Mankin′s评分。结果 两组第8周血清睾酮水平比较差异无统计学意义(P>0.05),观察组第12、16周血清睾酮水平均明显高于对照组(P均<0.05)。对照组右膝关节明显肿大,关节软骨面变薄、粗糙,软骨表面色泽变暗,溃疡较深,边缘骨赘形成明显。观察组右膝关节肿大程度轻于对照组,软骨表面有光泽,可见小溃疡和不规则裂隙。观察组软骨组织IGF-1阳性表达率高于对照组,Mankin′s评分低于对照组(P均<0.05)。结论 睾酮可促进KOA去势雄兔的软骨修复;其机制可能与促进IGF-1表达有关。
骨关节炎;膝关节;睾酮;去势法;胰岛素样生长因子1;软骨修复;兔
膝关节骨关节炎(KOA)是一种以关节软骨退变、软骨下骨硬化、骨赘形成及滑膜炎为特征的疾病,目前尚无有效的治疗药物,膝关节置换手术效果较好,但价格昂贵,且存在翻修等问题。研究证实,雌激素有预防关节退变和促进关节软骨修复的作用,而关于雄激素对KOA是否具有软骨修复作用鲜有报道[1,2]。为此,我们于2015年3~12月进行了如下研究。
1 材料与方法
1.1 材料 实验动物:雄性家兔18只,20周龄,体质量2.0~2.5 kg,购自遵义医学院动物实验基地。主要试剂及仪器:十一酸睾酮检测试剂(EIA2352,德国DRG公司),十一酸睾酮(生产批号:140812,浙江仙琚制药股份有限公司);胰岛素样生长因子1(IGF-1)单克隆抗体(BA0782,武汉博士德生物工程有限公司);SABC免疫组化染色试剂盒(SA3053-兔IgG,北京中杉金桥生物技术有限公司);IMMULITE自动生化仪(美国DPC公司),Image-proplus6.0图像分析系统软件(美国Media Cybernetics公司),E200型显微镜(日本尼康公司),SM2000R病理组织切片机(德国Leica公司)。
1.2 建模与分组处理 18只雄性家兔均建立右侧KOA模型并进行睾丸切除(去势)。建模方法:采用改良Hulth法。将3%戊巴比妥钠以30 mg/kg沿兔耳缘静脉注射麻醉,对右膝关节进行消毒处理,正中切开皮肤约3.5 cm;暴露膝关节腔,切断右膝关节前交叉韧带(ACL),并切除内侧半月板,确认前拉赫曼试验阳性后缝合皮肤。去势方法:在阴囊中部作一约2 cm长的纵行切口,分离双侧睾丸包膜,将睾丸挤出后结扎睾丸动脉及输精管,切除睾丸,缝合皮肤。术后肌注青霉素20万U/kg,连用3天;相同条件下自由摄食,每日驱赶,分笼饲养,饮水不限。8周后随机选择6只家兔,采用空气栓塞法处死,采用Mankin′s评分评价OA 病理分期,确认中期KOA模型成功建立[3,4]。将剩余12只雄性家兔随机分为观察组和对照组,每组6只。观察组每隔2周肌注十一酸睾酮6 mg/kg,对照组同时肌注等量生理盐水,共8周(4次)。
1.3 相关指标观察 ①血清睾酮水平:分别于分组处理第8、12、16周8:00,抽取两组耳缘静脉血3 mL,4 000 r/min离心5 min,分离血清,由遵义医学院附属医院生化室采用电化学发光免疫分析法检测血清睾酮。②标本大体情况:分组处理第16周,采用空气栓塞法处死,取出右股骨髁,肉眼观察标本大体情况。③软骨组织IGF-1表达:取右股骨髁标本,4%多聚甲醛固定24 h,15% EDTA脱钙4周,脱水,石蜡包埋,5 μm厚度切片。常规免疫组化染色,以细胞核或细胞质出现棕黄色颗粒定义为阳性细胞,随机选择同组任意一只动物的左股骨髁标本作为对照。100倍显微镜下随机选取10个视野,记录阳性细胞数和细胞总数,计算阳性细胞百分比,即软骨组织IGF-1阳性表达率。④关节软骨Mankin′s评分:取右股骨髁标本,常规进行HE染色和Safranin-O染色,由2位观察者分别于100倍显微镜下,参照Mankin′s评分标准[4]进行评分(Mankin′s评分越高说明病理分期越高,骨关节炎病情越严重)。

2 结果
2.1 血清睾酮水平 两组第8周血清睾酮水平比较差异无统计学意义(P>0.05),观察组第12、16周血清睾酮水平均明显高于对照组(P均<0.05)。见表1。
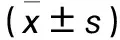
表1 两组血清睾酮水平比较
注:与对照组比较,*P<0.05。
2.2 标本大体情况 对照组右膝关节明显肿大,关节软骨面变薄、粗糙,软骨表面色泽变暗,溃疡较深,边缘骨赘形成明显。观察组右膝关节肿大程度轻于对照组,软骨表面有光泽,可见小溃疡和不规则裂隙。
2.3 软骨组织IGF-1表达 两组均有阳性颗粒表达,观察组软骨组织内阳性细胞密集,软骨层均见其表达,对照组软骨全层表达较少。观察组软骨组织IGF-1阳性表达率为(62.31±4.26)%, 对照组为(3.58±0.66)%,两组比较P<0.05。
2.4 关节软骨Mankin′s评分 观察组关节软骨Mankin′s评分为(4.00±0.58)分,对照组为(9.67±0.99)分,两组比较P<0.05。
3 讨论
KOA的病理学基础是软骨基质合成和降解失衡,从而导致关节软骨的破坏[5]。正常关节软骨90%以上由软骨基质组成,蛋白聚糖和Ⅱ型胶原是其主要成分,蛋白聚糖丢失[6]、降解可诱发炎症反应,导致软骨弹性降低或丧失、含水量降低,最终引起关节软骨破坏和功能丧失[6,7]。人类膝关节软骨细胞、关节滑膜组织及骨细胞中均存在雄激素受体[9],且男性和女性的软骨细胞均能表达二氢睾酮和睾酮受体,说明软骨细胞可能受雄激素的调控[10]。睾酮能够结合骨骼中的雄激素受体而影响骨骼的内环境,同时关节软骨细胞具有合成雄激素的能力,进一步说明雄激素可能与KOA的发病有关[11]。本研究观察组第12、16周血清睾酮水平明显高于对照组,且血清睾酮水平维持在正常生理剂量;与对照组比较,观察组右膝关节肿大程度轻,软骨表面具有光泽,溃疡和裂缝较小。说明睾酮可促进KOA去势雄兔的软骨修复。
软骨生长因子(如IGF-1、转化生长因子等)能够促进软骨细胞的增殖、分化及诱导间充质干细胞向软骨组织分化,维持软骨结构稳定。当软骨受到破坏时,基质蛋白溶解,激活的蛋白酶活化IGF-1,从而促进软骨细胞增殖,维持环境稳定。IGF-1还可通过细胞表面受体而发挥作用,在成人软骨组织中IGF-1能促进软骨细胞分裂增殖,并增强软骨保护作用[12]。研究认为,睾酮能上调成熟软骨细胞层IGF-1表达,促进软骨生发层生长,其调节机制可能与IGF-1有关[1,13]。本研究观察组软骨组织IGF-1阳性表达率高于对照组;表明睾酮能够上调软骨组织中IGF-1的表达,并可能通过促进软骨细胞的增殖而对关节软骨发挥修复作用。国外研究发现,生理剂量的睾酮对男性晚期OA患者软骨形成具有积极作用,在关节滑液中给予睾酮替代治疗可刺激患者关节软骨组织的再生潜能[14]。睾酮与关节软骨中雄激素受体结合,产生生物学效应,二氢睾酮能够减少网状组织的破坏、减少胶原和糖胺聚糖丢失,但不能阻止弹性蛋白的丢失[15]。睾酮可作用于IGF-1,IGF-1通过其细胞表面受体发挥作用,促进蛋白多糖及Ⅱ型胶原的合成,利于软骨修复,维持环境稳定[16~19]。体外研究表明,在无IL-1存在的情况下,睾酮亦能刺激关节软骨基质的合成,阻止软骨基质的丢失。本研究观察组关节软骨Mankin′s评分低于对照组,表明十一酸睾酮不但可以促进软骨细胞的增殖,还可促进软骨基质的合成并抑制其降解。
综上所述,睾酮可促进KOA去势雄兔的软骨修复;其机制可能与促进IGF-1表达有关。
[1] 熊华章,刘毅,吴术红,等.睾酮对雄兔膝骨关节炎预防作用的实验研究[J].重庆医科大学学报,2012,37(8):677-681.
[2] Raz P, Nasatzky E, Boyan BD, et al. Sexual dimorphism of growth plate prehypertrophic and hypertrophic chondrocytes in response to testosterone requires metabolism to dihydrotestosterone (DHT) by steroid 5-alpha reductase type[J]. Cell Biochem, 2005,951(1):108-119.
[3] 曾俊华,马笃军,彭力平,等.实验兔膝骨关节炎模型的建立及鉴定[J].中国临床研究,2016,29(5):679-682.
[4] Hussein MR, Fathi NA, El-Din AM, et al. Alterations of the CD4(+), CD8(+). Tcellsubsets interleukins-1beta, IL-10, IL-17, tumornecrosis factor-alpha and solubleinte rcellular adhesion molecule-1 in rheumatoid arthritis and osteoarthritis: preliminary observations[J]. Pathol Oncol Res, 2008,14(3):321-328.
[5] Lee AS, Ellman MB, Yan D, et al. A current review of molecular mechanisms regarding osteoarthritis and pain[J]. Gene, 2013,527(2):440-447.
[6] Dahlberg L, Billinghurst RC, Manner P, et al. Selective enhancement of collagenase-mediated cleavage of resident typeII collagen in cultured osteoarthritic cartilage and arres twith asynthetic inhibitor that spares collagenase1 (matrixmetalloproteinase1)[J]. Arthritis Rheum, 2000,43(3):673-682.
[7] Abbaszade I, Liu RQ, Yang F, et al. Cloning and characterization of ADAMTS11, anaggrecanase from the ADAMTS family[J]. Biol Chem, 1999,274(3):23443-23450.
[8] Tortorella MD, Burn TC, Pratta MA, et al. Purification and cloning of aggrecanase-1: amember of the ADAMTS family ofproteins[J]. Science, 1999,284(5420):1664-1666.
[9] Capellino S, Riepl B, Rauch L, et al. Quantitative determination of steroid hormone receptor positive cells in the synovium of patients with rheumatoid arthritis and osteoarthritis: is there a link to inflammation[J]. Ann Rheum Dis, 2007,66(1):53-58.
[10] Claassen H, Steffen R, Hassenpflug J, et al. 17beta-estradiol reduces expression of MMP-1, -3, and -13 in human primary articular chondrocytes from female patients cultured in a three dimensional alginate system[J]. Cell Tissue Res, 2010,342(2):283-293.
[11] Sasano H, Uzuki M. Aromataes in human bone tissue[J]. Bone Miner Res, 1997,12(9):1416-1423.
[12] Gooch KJ, Blun kT, Courter DL, et al. IGF-2 and mechanical environment interact tomodulateengineered cartilage development[J]. Biochem Biophys Res Commun, 2001,286(5):9091.
[13] Maor G, Segev Y, Phillip M. Testosterone stimulates insulin-like growth factor-1 and insulin-like growth factor-1-receptor gene expression in the mandibular condyle-a model of endochondral ossification[J]. Endocrinology, 1999,140(4)1901-1910.
[14] Koelling S, Miosge N. Sex differences of chondrogenic progenitor cells in late stages of osteoarthritis[J].Arthritis Rheum, 2010,62(4):1077-1087.
[15] Ganesan K, Tiwari M, Balachandran C, et al. Puvanakrishnan R.Estrogen and testosterone attenuate extracellular matrix loss in collagen-induced arthritis in rats[J]. Calcif Tissue Int, 2008,83(5):354-364.
[16] Englert C, Blunk T, Fierlbeck J, et al. Steroid hormones strongly support bovine articular cartilage integration in the absence of interleukin-1beta[J]. Arthritis Rheum, 2006,54(12):3890-3897.
[17] Bijlsma JW, Berenbaum F, Lafeber FP. Osteoarthritis: an update withrelevance for clinical practice[J]. Lancet, 2011,377(9783):2115-2126.
[18] Ham KD, Carlson CS. Effects of estrogen replacement therapy on bone turnover in subchondral bone and epiphyseal metaphyseal cancellous bone of ovariectomized cynomolgus monkeys[J]. J Bone Miner Res, 2004,19(5):823-829.
[19] Takeuchi S, Mukai N, Tateishi T, et al. Production of sex steroid hormones from DHEA in articular chondrocyte of rats[J]. Amer J Physiol, 2007,293(1):E410-415.
贵州省科技厅社发攻关基金资助项目(黔科合SY[2010]3091);贵州省卫生厅资助项目(D-285);硕士启动基金资助项目(院字[2013]20)。
刘毅(E-mail: 13308529536@163.com)
10.3969/j.issn.1002-266X.2017.16.010
R684
A
1002-266X(2017)16-0035-03
2016-04-05)
