钛合金假体表面涂层微孔孔径和孔隙率对骨整合的影响
2017-06-19周鹏赵辉吴宇黎吴海山陈宜丁喆如
周鹏,赵辉,吴宇黎,吴海山,陈宜,丁喆如
(上海长征医院,上海200003)
钛合金假体表面涂层微孔孔径和孔隙率对骨整合的影响
周鹏,赵辉,吴宇黎,吴海山,陈宜,丁喆如
(上海长征医院,上海200003)
目的 探讨钛合金假体表面涂层微孔孔径和孔隙率对骨整合的影响。方法 采用3D打印技术打印3种不同微孔孔径和孔隙率的钛合金假体,第一种假体表面微孔孔径(260.5±34.5)μm、孔隙率68.1%,第二种孔径(553.2±16.7)μm、孔隙率79.2%,第三种孔径(749.8±15.0)μm、孔隙率89.0%,分别标记为a、b、c型假体。选择新西兰大白兔27只,随机分为A、B、C组各9只,分别将a、b、c型假体植入兔股骨髓腔。术后4、8、12周,每组随机处死3只,通过Micro CT扫描观察各组成骨情况并测量骨体积分数(BV/TV)、组织矿物密度(TMD),通过拔出试验检测各组最大拔出力。结果 术后4周,各组内植物均在位,微孔内及周围呈低信号,无明显沉积骨质;拔出标本仅远端有少量未成熟骨质,表面多覆盖纤维结缔组织及陈旧血凝块,处理标本时可轻易洗去;三组BV/TV、TMD及最大拔出力比较差异均无统计学意义(P均>0.05)。术后8周,各组微孔内及周围均见部分中密度影,为未成熟骨质,A组相对较多;三组拔出标本远端均有明显骨质覆盖,A组假体体部表面可见沉积骨质;三组间BV/TV、TMD比较差异均无统计学意义(P均>0.05),但A组最大拔出力明显高于B、C组(P均<0.05)。术后12周,各组微孔内及周围均见高密度影,为沉积骨质,且伸入微孔内部,形成锁结,A组多于B、C组,无明显骨溶解;A组整个假体表面均匀覆盖较多骨质,B、C组远端和近端可见明显沉积骨质,但少于A组;A组BV/TV、TMD明显高于B、C组(P均<0.05);最大拔出力A组>B组>C组,组间两两比较P均<0.05。结论 钛合金假体表面涂层微孔孔径226~295 μm、孔隙率68.1%有利于促进骨整合,并具有较好的生物力学性能。
全髋关节置换;人工假体;关节假体深层;微孔;骨整合;3D打印技术;兔
全髋关节置换是治疗各种终末期髋关节疾病的可靠手段,长期随访效果满意,但部分患者仍然会出现无菌性松动,需要进行二期翻修。生物型全髋关节置换患者的远期预后与假体的骨整合程度密切相关,对假体的表面进行物理修饰(即制作粗糙面)可促进骨整合。但传统工艺制作的微孔大小不均,对骨整合最有利的微孔孔径和孔隙率还存在争议。3D打印技术区别于传统的制造业,其首先用计算机辅助设计模型,再以“增材制造”的方式完美复原所设计的产品,可精确制作不同微孔孔径和孔隙率的假体表面涂层。2016年8~12月,我们利用3D打印技术精确构建钛合金假体表面微孔涂层,并观察涂层微孔孔径和孔隙率对骨整合的影响,旨在探索最有利于骨整合的微孔参数。
1 材料与方法
1.1 材料 选择健康雄性新西兰大白兔27只,7~8月龄,体质量2.5~3.0 kg,购自浙江省农业科学院。饲养环境:温度20~25 ℃,相对湿度40%~70%,自由摄食、饮水。骨科手术器械,上海医疗器械有限公司;WDW-10A型电子万能试验机,常州三丰仪器科技有限公司;X-5000型显微CT(Micro CT),美国NSI公司;M2型3D金属打印机,德国Concept Laser公司;EVO18型扫描电镜,德国ZEISS公司。
1.2 3D打印假体设计制作 参考预实验结果,采用ProE软件设计长4.85 cm、直径3.5 mm的圆柱体,远端1.35 cm表面为光滑区域,近端3.5 cm表面为不同孔径、孔隙率的微孔涂层,光滑区域预留直径1.5 mm的圆孔。文件转化为STL格式,导入3D打印机,使用Ti-6Al-4V粉末进行打印,最终精确构建出三种具有均匀大小微孔涂层的钛合金假体。经扫描电镜软件测量其表征,第一种假体表面微孔孔径(260.5±34.5)μm、孔隙率68.1%,第二种孔径(553.2±16.7)μm、孔隙率79.2%,第三种孔径(749.8±15.0)μm、孔隙率89.0%,分别标记为a、b、c型假体。
1.3 兔股骨假体植入骨整合模型建立 所有大白兔在动物房环境中适应性饲养6天,随机分为A、B、C组,每组9只。A、B、C组分别于股骨植入a、b、c型假体。具体步骤:三组均采用1%戊巴比妥钠3 mL/kg耳缘静脉注射麻醉,仰卧固定于无菌手术台上,常规铺巾;取膝关节前正中纵行切口,沿髌骨和髌腱内侧缘切开,髌骨翻向外侧,显露膝关节;屈曲膝关节,直视下确定股骨髁间凹前交叉韧带(ACL)附着点处,于ACL止点上约3 mm处用直径3.5 mm钻头开口,扩髓,生理盐水冲洗,探查无明显骨折;取3D打印钛合金假体沿股骨纵轴敲入,尾端埋入关节面内;活动膝关节见活动度良好,生理盐水彻底冲洗,缝合关节囊,全层缝合皮肤。术后保温至麻醉苏醒后,放回笼中分开饲养,肌注青霉素160万U/d,连续3天。分别于术后第4、8、12周随机取出3只,处死后完整取出双侧股骨行相关指标观察。
1.4 骨整合指标检测
1.4.1 成骨情况及骨体积分数(BV/TV)、组织矿物质密度(TMD) 采用X-5000型Micro CT扫描各组标本,观察各组成骨情况。扫描参数:电压80 kV,电流300 μA,聚焦点24 μm,延迟30 ms,放大27.93倍。设金属部件最远端1 cm的区域为感兴趣区(ROI),测量BV/TV(阈值二值化后骨体积占总体积的比例)、TMD(当前ROI内阈值二值化后被认定为骨骼部分的骨密度)。
1.4.2 最大拔出力 采用WDW-10A微机控制电子万能试验机对各组标本进行拔出试验。所有标本小心清除股骨髁部骨质,显露假体远端光滑部分,贯通预留孔,整个过程避免假体在轴向和侧方受力;将自凝牙托粉与牙托水混合,进入面团期后灌入定制铝合金管内,将股骨插入,保持股骨纵轴与地面水平线垂直,并防止牙托粉黏附在假体表面;牙托粉坚硬期过后,预留孔内穿入直径1 mm钢丝绳,并将钢丝绳和定制铝合金管与电子万能试验机两端夹具相连接,以0.1 mm/s速度进行加载,行拔出试验,观察拔出标本的骨整合情况;采用自带软件描记应力-时间曲线,其峰值即为最大拔出力。

2 结果
2.1 各组成骨情况及BV/TV、TMD比较 术后4周,各组内植物均在位,微孔内及周围呈低信号,无明显沉积骨质;术后8周,各组微孔内及周围均见部分中密度影,为未成熟骨质,A组相对较多;术后12周,各组微孔内及周围均见高密度影,为沉积骨质,且伸入微孔内部,形成锁结,A组多于B、C组,无明显骨溶解。各组不同时间BV/TV、TMC比较见表1。
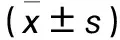
表1 各组不同时间BV/TV、TMC比较
注:与同组术后4周比较,*P<0.05;与同组术后8周比较,#P<0.05;与B、C组同时间比较,△P<0.05。
2.2 各组拔出标本骨整合情况及最大拔出力比较 术后4周,三组拔出标本仅远端有少量未成熟骨质,表面多覆盖纤维结缔组织及陈旧血凝块,处理标本时可轻易洗去;术后8周,三组拔出标本远端均有明显骨质覆盖,A组假体体部表面陆续出现沉积骨质;术后12周,A组整个假体表面均匀覆盖较多骨质,B、C组远端和近端可见明显沉积骨质,均较前增多,但少于A组。各组不同时间最大拔出力比较见表2。
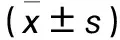
表2 各组不同时间最大拔出力比较
注:与同组术后4周比较,*P<0.05;与同组术后8周比较,#P<0.05;与C组同时间比较,△P<0.05;与B组同时间比较,▲P<0.05。
3 讨论
人工全髋关节置换治疗终末期髋关节疾病临床疗效满意可靠,可即刻消除关节疼痛、恢复关节的正常活动功能,被称为二十世纪医学史上最成功的手术之一[1]。对于相对年龄较小、骨量较好患者,多倾向于采用生物型的固定方式,其远期预后跟假体与骨界面的骨整合情况密切相关[2]。因此,通过对假体材料表面处理和修饰,提高假体内植物与周围骨整合性能已经成为骨科内植物材料领域的研究热点[3~5]。
假体表面化学修饰主要是指在表面沉积钙磷酸盐涂层,但存在成分不稳定、涂层易剥脱、潜在感染风险等缺陷。因此,目前研究多集中于物理修饰,即采用各种方法使假体表面粗糙化,构建出纳米级或微米级的微孔。虽然纳米级的微孔也能促进成骨基因表达以及骨质在假体表面的沉积,但不同于临床上要求的“骨长入”,这种现象被称为“骨长上”[6],不能与假体形成有效的机械锁结,故目前的研究主要聚焦于构建微米级的微孔。多孔钛金属假体的传统制作方法主要有松装烧结法、阳极氧化法、有机泡沫浸渍法、浆料发泡法、固态发泡法、自蔓延高温烧结法、等离子喷涂法等,各有优势,但共同的缺陷是制作的微孔分布不均匀、孔径大小不一。目前,对于何种孔径参数最有利于骨整合还存在争议。Doi等[7]研究发现,在牙科植入材料表面分别覆盖孔隙率44%、48%的钛网修复犬齿,表面覆盖孔隙率48%的植入材料,植入第2、4周均观察到更多的新骨形成。Vasconcellos等[8]采用粉末烧结法将三组不同孔径(180、300、180 μm)和孔隙率(30%、30%、40%)的内植物植入家兔胫骨,术后8周时180 μm孔径、40%孔隙率假体新骨沉积明显优于180 μm孔径、30%孔隙率假体,说明在这个范围内增加孔径和孔隙率有利于成骨。Torstrick等[9]制造了三组表面微孔孔径分别为(284±35)、(341±49)、(416±54)μm的椎间融合器,与光滑椎间融合器相比,这三种微孔椎间融合器均能促进细胞的成骨分化,推测直径200~508 μm的微孔可能是理想的孔径参数。受制造工艺精度的限制,产生最大骨整合效能的具体孔径和孔隙率目前尚无统一标准。
3D打印技术主要通过激光选择性熔化技术(SLM)或电子束熔化技术(EBM)来实现。由于EBM所使用的粉末颗粒相对较大,制作精度低,故本研究选用了SLM技术。尽管金属粉末在熔化过程中会黏附周围粉末,有一定误差,但前期研究表明将误差控制在3%左右仍为目前最精确的制造方法。骨长入对孔径的最低要求为100 μm,孔径为100~600 μm最有利于骨长入[10]。刘邦定等[11]设计了孔径为1、2、3 mm的大孔径部件,植入18只犬的股骨外侧髁,发现随着孔径的逐渐增大,成骨反而越来越少。因此,随着孔径的增大,成骨效应会有一个极点,并不是孔径越大越好。本研究按梯度设计了三种钛金属假体,假体表面所有微孔设计为正八面体结构,孔径大小为正八面体内切球的直径,旨在寻求相对最佳孔径参数。
髋关节处建立骨整合模型的影响因素较多,对涂层要求亦较多。因此,本研究选择于膝关节处建立钛合金假体植入的骨整合模型,以减少其他因素对骨整合模型的影响,并利于操作。本研究结果显示,随着时间延长,各组骨整合越好,以假体表面微孔孔径(260.5±34.5)μm、孔隙率68.1%效果最佳。微孔涂层促进骨整合的机制可能为:①多孔涂层增加了假体表面接触面积,有利于细胞黏附、增殖及分化;②构建的多孔分布均匀,绝对连通,有利于氧气及营养成分的流动更新;③多孔结构摩擦力大,有利于获得较好的初始稳定性,骨质沉积入微孔能形成足够强大的三维机械锁结,形成理想的骨整合状态。本研究还发现,拔出标本的骨质沉积多在远端,其次为近端髁部,均为接触骨质的一侧,这可能与假体远端在股骨峡部与骨质接触紧密,近端在髁部相对稳定,且血运丰富有关。有研究发现,微动超过220 μm、间隙超过50 μm时,界面会形成纤维连接,不利于骨整合[12]。提示临床行全髋关节置换时获得初始稳定性尤为重要。本研究还发现,骨形态学测量和最大拔出力并不完全对应,骨形态学测量无统计学差异时最大拔出力却出现统计学差异,说明孔径和孔隙率的逐渐增大,对生物力学的影响大于对局部成骨反应的影响。通过构建微孔增加假体摩擦力、降低弹性模量的同时,也降低了抗压能力、抗剪切力,虽然微孔内沉积了骨质,但不能形成足够多、足够强大的机械锁结,依然无法获得较好的稳定性。本研究C组部分拔出标本近端末梢部分微孔已经塌陷,可能是在动物造模时将假体打入髓腔所致,故当孔隙率接近90%时,此种类型的微孔已不能满足内植物的力学性能要求。应力刺激亦是影响骨整合的重要因素之一[13]。Branemark等[14]建议,在实现骨质愈合前无载荷,但这仅是基于经验所提出的。樊瑜波等[15]将钛钉植入山羊胫骨,并给予不同大小的轴向载荷,结果发现给予10 N载荷骨整合情况优于无载荷和给予20、30 N载荷,并认为合理范围内的轴向载荷可能有利于骨整合,与Branemark等[14]观点相悖。因为没有专门为动物设计的髋关节假体,且施加力学载荷需长期制动,本研究未将力学载荷因素纳入考量范围,后期可另行设计实验探讨不同力学载荷对3D打印钛合金假体表面微孔涂层整合的影响。
综上所述,全髋关节置换假体表面涂层微孔孔径226~295 μm、孔隙率68.1%有利于促进骨整合,并具有较好的生物力学性能。本研究钛金属假体设计和手术方式均最大限度模拟临床,且未进行沉积羟基磷灰石或负载其他生物活性因子的化学改性,排除了混杂因素,单纯评价微孔涂层对骨整合的影响具有一定参考意义。今后可在单个假体上行随机微孔设计,进一步从仿生学角度观察微孔对骨整合的影响,以便更好地指导假体设计。
[1] Mellon SJ, Liddle AD, Pandit H. Hip replacement: landmark surgery in modern medical history[J]. Maturitas, 2013,75(3):221-226.[2] 贺业腾,闫新峰.人工全髋关节置换髋臼杯和股骨柄假体的选择及固定方式[J].山东医药,2011,51(19):108-109.
[3] Drnovsek N, Novak S, Dragin U, et al. Bioactive glass enhances bone ingrowth into the porous titanium coating on orthopaedic implants[J]. Int Orthop, 2012,36(8):1739-1745.
[4] de Vasconcellos LM, Oliveira FN, Leite Dde O, et al. Novel production method of porous surface Ti samples for biomedical application[J]. J Mater Sci Mater Med, 2012,23(2):357-364.
[5] Tang Z, Xie Y, Yang F, et al. Porous tantalum coatings prepared by vacuum plasma spraying enhance bmscs osteogenic differentiation and bone regeneration in vitro and in vivo[J]. PLoS One, 2013,8(6):e66263.
[6] 王娜,吕武龙,李景辉,等.不同管径TiO2纳米管对小型猪体内种植体的基因表达及骨整合的影响[J].北京口腔医学,2012,20(2):101-105.
[7] Doi K, Oue H, Morita K, et al. Development of implant/interconnected porous hydroxyapatite complex as new concept graft material[J]. PLoS One, 2012,7(11):e49051.
[8] Vasconcellos LM, Leite DO, Oliveira FN, et al. Evaluation of bone ingrowth into porous titanium implant: histomorphometric analysis in rabbits[J]. Braz Oral Res, 2010,24(4):399-405.
[9] Torstrick FB, Evans NT, Stevens HY, et al. Do surface porosity and pore size influence mechanical properties and cellular response to PEEK[J]. Clin Orthop Relat Res, 2016,474(11):2373-2383.
[10] Hulbert SF, Young FA, Mathews RS, et al. Potential of ceramic materials as permanently implantable skeletal prostheses[J]. J Biomed Mater Res, 1970,4(3):433-456.
[11] 刘邦定,郭征,郝玉琳,等.多孔钛合金不同孔径大小对新骨长入的影响[J].现代生物医学进展,2012,12(9):1601-1604.
[12] Konttinen YT, Zhao D, Beklen A, et al. The microenvironment around total hip replacement prostheses[J]. Clin Orthop Relat Res, 2005(430):28-38.
[13] Puleo DA, Nanci A. Understanding and controlling the bone-implant interface[J]. Biomaterials, 1999,20(23-24):2311-2321.
[14] Branemark PI, Hansson BO, Adell R, et al. Osseointegrated implants in the treatment of the edentulous jaw. Experience from a 10-year period[J]. Scand J Plast Reconstr Surg Suppl, 1977(16):1-132.[15] 樊瑜波,修凯华,董骧,等.力学载荷对骨整合影响的动物实验研究[J].中国科学:生命科学,2008,39(3):253-260.
Effect of porous coating of titanium alloy prosthesis with different pore size and porosity on osseointegration
ZHOUPeng,ZHAOHui,WUYuli,WUHaishan,CHENYi,DINGZheru
(ShanghaiChangzhengHospital,Shanghai200003,China)
Objective To study the effect of porous coating of titanium alloy prosthesis with different pore size and porosity on osseointegration. Methods Three kinds of titanium alloy prosthesis with different porous surface were manufactured by 3D printing technology. The micropore diameter and the porosity was (260.5±34.5) μm and 68.1% in type a, (553.2±16.7) μm and 79.2% in type b, and (749.8±15.0) μm and 89.0% in type c. Twenty-seven New Zealand white rabbits were randomly divided into three groups, which were group A, group B and group C, and three kinds of prostheses were implanted into the femoral medullary cavity of rabbits. Three rabbits of each group were randomly sacrificed at the end of the fourth, eighth, twelfth weeks after operation. Micro-CT were taken to observe the condition of bone formation of each group, while bone volume fraction (BV/TV) and tissue mineral density (TMD) were measured by Micro-CT, the peak pull-out load of each group was measured by pull-out testing. Results At the fourth week after operation, all of the prostheses were in good position, the area within and around pores showed low signal, and no obvious bone formation was found. Distal parts of prostheses were only covered by little immature osteoid, but most of it was fibrous connective tissue and oboslete blood clot which could be washed away easily. The BV/TV, TMD and peak of pull-out load showed no statistical difference between any two groups (allP>0.05). At the eighth week after operation, the area within and around pores showed medium signal, which was immaturate osteoid, and especially in the group A, which was more than the other two groups. Distal pull-out specimens were all covered by bone in the three groups, and the middle of prostheses of group A also showed bone deposition. The BV/TV and TMD showed no statistical difference between any two groups, but the peak pull-out load of group A was higher than that of group B and group C (allP<0.05). At the twelfth week after operation, the area within and around pores all appeared high density shadow, which was bone deposition, and formed locking junction in three dimension, group A was more than group B and group C, no obvious osteolysis was found. All the parts of prostheses of group A were evenly covered by a lot of bone, the distal and proximal prostheses of group B and group C appeared significant bone formation, but less than that of group A. The BV/TV and TMD of group A was significant higher than that of group B and group C (P<0.05), the peak pull-out load showed statistical difference between every two groups (allP<0.05), and the sequence from high to low was: group A, group B, and group C. Conclusion The porous coating of titanium alloy prosthesis with pore size of 226-295 μm and porosity of 68.1% is the best for enhancing osseointegration, which shows good biomechanical property. Key words: total hip arthroplasty; artificial prosthesis; joint prosthesis coating; micropore; osseointegration; 3D printing technology; rabbits
上海市教育委员会科研创新项目(15ZZ039)。
周鹏(1983-),男,博士研究生,研究方向为关节外科疾病的诊断与治疗。E-mail: zhoupeng6141@163.com
吴海山(1963-),男,主任医师、教授,研究方向为人工关节置换、关节镜外科及运动医学。E-mail: drisland@vip.sina.com
10.3969/j.issn.1002-266X.2017.16.004
R687.3
A
1002-266X(2017)16-0012-04
2017-02-05)
