miR-449a对食管鳞癌细胞Eca-109增殖、迁移、侵袭的影响及机制
2017-06-19王强强王梦洁张玉虹李皓高飞刘阳晨
王强强,王梦洁,张玉虹,李皓,高飞,刘阳晨
(1蚌埠医学院研究生部,安徽蚌埠 233000;2泰兴市人民医院)
miR-449a对食管鳞癌细胞Eca-109增殖、迁移、侵袭的影响及机制
王强强1,2,王梦洁1,2,张玉虹1,2,李皓2,高飞2,刘阳晨2
(1蚌埠医学院研究生部,安徽蚌埠 233000;2泰兴市人民医院)
目的 探讨miR-449a对食管鳞癌细胞Eca-109增殖、迁移、侵袭的影响及其可能的机制。方法 将食管鳞癌细胞Eca-109分为miR-449a组和NC组,分别转染miR-449a-mimics和NC-mimics;采用实时荧光定量PCR法检测两组miR-449a相对表达量,miR-449a组 miR-449a相对表达量明显高于NC组,证实上调miR-449a表达的Eca-109细胞模型建立成功。采用CCK-8法、平板克隆形成试验检测两组细胞增殖能力(分别以培养12、24、48 h吸光度值和克隆数表示),细胞划痕试验检测细胞迁移能力(以细胞之间的距离表示),Transwell小室试验检测细胞侵袭能力(以侵袭到下室的细胞数量表示),流式细胞仪检测细胞周期比例。采用实时荧光定量PCR法和Western blotting法分别检测两组miR-449a直接靶基因E2F3 mRNA及蛋白相对表达量。结果 miR-449a组细胞培养12、24、48 h时的吸光度值及克隆数、细胞之间的距离、侵袭到下室的细胞数量均低于NC组(P<0.05或<0.01)。miR-449a组G1期细胞比例高于NC组,S期细胞比例低于NC组(P均<0.05);两组G2/M期细胞比例比较差异无统计学意义(P>0.05)。miR-449a组E2F3 mRNA及蛋白相对表达量均低于NC组(P均<0.01)。结论 miR-449a可抑制食管鳞癌细胞Eca-109的增殖、迁移和侵袭;抑制靶基因E2F3表达可能是其作用机制。
食管鳞癌;微小RNA-449a;E2F3基因;细胞增殖;细胞迁移;细胞侵袭
食管癌是中国发病率排名第四的恶性肿瘤[1],其中食管鳞癌占80%以上。食管鳞癌恶性程度较高,患者就诊时多属晚期,五年生存率仅20%左右。微小RNA(miRNAs)是一类非编码小RNA,长21~23个核苷酸序列,通过与靶基因的3′-非编码区(UTR)结合而抑制靶基因的表达。研究表明,miRNAs与多种疾病相关,在肿瘤发生、发展中发挥重要作用[2]。miR-449a是一种新发现的miRNA,在肝癌、胃癌等多种恶性肿瘤的发生中发挥抑癌基因作用[3,4],但是其在食管鳞癌中的生物学作用尚不明确。2015年12月~2016年8月,本研究观察了miR-449a对食管鳞癌细胞Eca-109(下称Eca-109细胞)增殖、迁移及侵袭的影响,并探讨其可能的机制。
1 材料与方法
1.1 材料 细胞:Eca-109细胞购自中国医学科学院。主要试剂:RPMI1640培养液购自美国Gibco公司,miR-449a-mimics及NC-mimics购自苏州吉玛基因股份有限公司,TRIzol、LipofectamineTM2000购自美国Invitrogen公司,实时荧光定量PCR试剂盒购自日本TaKaRa公司,Transwell(8 μm孔径)购自美国Corning公司,Materigel购自美国BD公司,兔抗E2F3多克隆抗体购自美国Abcam公司,细胞周期试剂盒、BCA蛋白定量检测试剂盒、RIPA裂解液、ECL-plus试剂盒、兔抗鼠人GAPDH单克隆抗体、辣根过氧化物酶标记的lgG(羊抗兔)二抗、小牛血清均购自上海碧云天生物技术有限公司。
1.2 上调miR-449a表达的Eca-109细胞模型建立 将Eca-109细胞置于含10%胎牛血清及双抗(青霉素100 U/mL、链霉素100 mg/mL)的RPMI1640培养液中,37 ℃、5%CO2细胞培养箱进行培养。转染前1天重悬细胞,按5×105个/孔的密度接种至6孔板中。待细胞贴壁后将其分为miR-449a组和NC组,分别转染miR-449a-mimics和NC-mimics,严格按照LipofectamineTM2000说明书操作。转染6 h后更换含10%胎牛血清的完全培养基继续培养,200倍荧光显微镜下拍照。转染的模拟物带有荧光标记,转染成功的细胞呈绿色荧光,计算细胞转染效率为90%左右。转染48 h收集两组细胞,采用实时荧光定量PCR法检测miR-449a表达:以TRIzol提取总RNA,紫外分光光度计测定RNA纯度、浓度合格,光密度(OD)260/280为1.9~2.0,用于后续实验。采用反转录试剂盒反转录得到cDNA,以此为模板进行PCR扩增。miR-449a引物序列:上游引物:5′-GCTGGCAGTGTATTGTTA-3′,下游引物:5′-GTGCAGGGTCCGAGGT-3′。内参基因U6引物序列:上游引物:5′-CTCGCTTCGGCAGCACATATACT-3′,下游引物:5′-ACGCTTCACGAATTTGCGTGTC-3′。PCR扩增条件:95 ℃、30 s,95 ℃、5 s,60 ℃、30 s,72 ℃、30 s,共39个循环。采用2-ΔΔCt法计算miR-449a相对表达量。结果显示,miR-449a组与NC组miR-449a相对表达量分别为9 278.00±412.62、96.33±6.43,两组比较P<0.01。证实上调miR-449a表达的Eca-109细胞模型建立成功。
1.3 miR-449a对Eca-109细胞增殖、迁移、侵袭能力影响的观察
1.3.1 细胞增殖能力 ①CCK-8法:取两组转染后对数生长期细胞,制成细胞悬液,按4×103个/孔接种于96孔板中,每组设置3个复孔。分别于细胞贴壁后12、24、48 h加入CCK-8试剂(每100 μL培养液加入10 μL CCK-8试剂),避光孵育3 h。采用酶标仪检测450 nm处OD值。OD值越高说明细胞增殖能力越强。②平板克隆形成试验:取两组转染后对数生长期细胞,消化后按200个/孔接种于6孔板中。继续培养9天左右,待6孔板中出现肉眼可见的克隆时停止培养。加入0.1%结晶紫染液进行染色,200倍显微镜下观察,以细胞染成紫色且数量大于50个作为1个克隆,计数两组克隆数。实验重复3次。
1.3.2 细胞迁移能力 采用细胞划痕试验。取两组转染后对数生长期细胞,以3×105个/孔接种于6孔板中。待细胞融合达到80%左右时,使用高压消毒后的100 μL枪头在6孔板上垂直划一直线。PBS冲洗2遍,加入无血清培养基,放入培养箱中继续培养24 h。200倍显微镜下拍照,采用Image J软件打开图片,随机测量划线即刻与培养24 h后的细胞距离,以两次细胞距离的差值计算细胞迁移距离。实验重复3次。
1.3.3 细胞侵袭能力 采用Transwell小室试验。取60 μL Materigel稀释液(1∶3)包被小室。取两组转染后对数生长期细胞,消化后以无血清培养基重悬,将200 μL细胞悬液加于Transwell上室中,下室中加入含有血清的完全培养基500 μL。培养24 h后除去培养液,使用棉签拭去上室中未侵袭的细胞,PBS洗涤2次;10%甲醛固定15 min,PBS洗涤2次;0.1%结晶紫染色15 min,PBS洗涤两次。400倍显微镜下拍照,计数侵袭到下室的细胞数量。实验重复3次。
1.3.4 细胞周期比例 采用流式细胞术。取两组转染后对数生长期细胞,消化后按5×105个/孔接种于6孔板中。PBS洗涤2次,胰酶消化,离心后弃上清,4 ℃ PBS洗涤2次,加入70%预冷乙醇固定,冰箱过夜。按细胞周期检测试剂盒说明书配制碘化丙啶溶液,染液重悬后暗室放置30 min,将染色后的细胞上流式细胞仪检测周期比例。实验重复3次。
1.4 miR-449a靶基因预测、验证及靶基因mRNA、蛋白表达检测
1.4.1 miR-449a靶基因预测及验证 通过生物信息软件工具(Targetscan、miR-Base)预测miR-449a靶基因。结果显示,E2F3基因3′端有潜在的miR-449a结合位点。推测E2F3可能是miR-449a的直接靶基因。参照Ren等[5]的方法,采用荧光素酶报告基因实验进行验证。结果显示:miR-449a组和NC组E2F3 3′-UTR野生型相对表达量分别为0.37±0.13、0.97±0.86,两组比较P<0.05;E2F3 3′-UTR突变型相对表达量分别为0.91±0.15、0.97±0.87,两组比较P>0.05。证实E2F3是miR-449a的直接靶基因。
1.4.2 E2F3 mRNA及蛋白表达检测 ①E2F3 mRNA表达:采用实时荧光定量PCR法。E2F3引物序列:上游引物:5′-AATATGGCGTAGTATCTCCG-3′,下游引物:5′-CTTCCCAAACATACACCCAC-3′。以GAPDH为内参基因,实验步骤参照1.2的方法,计算E2F3 mRNA相对表达量。②E2F3蛋白表达:采用Western blotting法。收集两组对数生长期细胞,RIPA裂解液(加入PMSF)提取总蛋白质,BCA法测定蛋白浓度。取20 μg蛋白样品进行SDS-PAGE电泳,将分离后的蛋白条带转移至PVDF膜上,Western封闭液于室温条件下封闭4 h。加入一抗(E2F3 1∶2 000、GAPDH 1∶1 000),4 ℃孵育过夜。次日加入二抗室温反应2 h,经BeyoECL化学发光检测试剂显色,化学发光仪显色拍照,采用Image软件分析灰度值。以目的蛋白与内参(GAPDH)蛋白灰度值的比值作为E2F3蛋白相对表达量。

2 结果
2.1 两组细胞增殖能力比较 miR-449a组细胞贴壁后12、24、48 h的OD值分别为0.86±0.53、1.56±0.29、2.17±0.69,NC组分别为0.75±0.22、1.27±0.25、1.58±0.47;两组同时间点比较P均<0.01。miR-449a组、NC组克隆数分别为(76.00±10.07)、(175.66±18.23)个,两组比较P<0.01。
2.2 两组细胞迁移能力比较 miR-449a组细胞迁移距离为(12.68±0.77)μm,NC组为(27.68±6.01)μm,两组比较P<0.05。
2.3 两组细胞侵袭能力比较 miR-449a组侵袭到下室的细胞数量为(76.67±9.61)个,NC组为(267.00±33.42)个;两组比较P<0.05。
2.4 两组细胞周期比例比较 miR-449a组G1期细胞比例高于NC组,S期细胞比例低于NC组(P均<0.05);两组G2/M期细胞比例比较差异无统计学意义(P>0.05)。见表1。
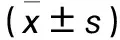
表1 两组不同时期的细胞比例比较
注:与NC组比较,*P<0.05。
2.5 两组E2F3 mRNA及蛋白相对表达量比较 miR-449a组E2F3 mRNA及蛋白相对表达量均低于NC组(P均<0.01)。见表2。
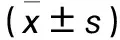
表2 两组E2F3 mRNA及蛋白相对表达量比较
注:与NC组比较,*P<0.01。
3 讨论
研究表明,miRNAs能够参与调节肿瘤的多种生物学功能,包括增殖、凋亡、侵袭、迁移等[6,7]。miRNAs与食管癌发生、发展的关系是近年研究的热点。Byrnes等[8]研究发现,miR-199a与食管癌的发生有关。亦有报道称,miR-124能够下调信号传导与转录激活因子3(STAT3)表达,从而抑制食管癌细胞的增殖和侵袭[9]。本课题组前期研究结果显示,miR-124在食管癌组织中低表达,可通过激活miR-124/CDK4信号通路而抑制食管癌细胞TE-1的增殖和迁移[10]。以上研究均表明,某些miRNAs异常表达可促进食管癌的发生、发展。miR-449a作为一种新发现的miRNA,已被证实在多种恶性肿瘤中低表达[3]。在脑胶质瘤中,miR-449a通过诱导细胞分化和阻滞细胞停留在G0/G1期而抑制肿瘤细胞增殖[11]。miR-449a在肺癌组织中低表达,上调miR-449a可以减少肺癌细胞增殖,从而影响肿瘤进程[5]。在胃癌中,过表达miR-449a后可通过调节Bcl-2基因和细胞周期蛋白D1而抑制癌细胞增殖[12]。
本研究结果显示,miR-449a组细胞贴壁后12、24、48 h的OD值及克隆数、细胞迁移距离、侵袭到下室的细胞数量均低于NC组,说明miR-449a表达上调可降低Eca-109细胞的增殖、迁移及侵袭能力。本研究miR-449a组G1期细胞比例高于NC组,S期细胞比例低于NC组,说明miR-449a表达上调可将Eca-109细胞阻滞于G1期,减少细胞进入S期。以上均表明,miR-449a在食管癌的发展中发挥一定的抑癌基因作用。
在肺癌组织中,E2F3被证实是miR-449a的一个靶基因[5]。E2F3转录调节因子定位于染色体6p22,是E2F家族8个成员中的一个,在细胞周期G1/S期转换过程中担任着重要角色[13]。E2F3作为一种致癌基因,具有促进细胞增殖、减少细胞凋亡的作用[14]。最近研究报道,E2F3与肾透明细胞癌患者的某些临床病理特征有关,并在肾癌和非小细胞肺癌组织中表达升高[15,16]。E2F3在肺癌细胞增殖和转移过程中也具有重要作用[17],一些miRNA(如miR-199a、miR-141、miR-144等)可调节E2F3表达而发挥作用[14,18]。因此,E2F3是促进肿瘤细胞增殖和迁移的重要致癌基因。寻找靶向抑制E2F3基因的小分子药物,对肿瘤的治疗具有重要价值。本研究通过生物信息学网站预测,E2F3是miR-449a的靶基因,并通过荧光素酶报告基因实验进行验证;miR-449a组E2F3 mRNA及蛋白相对表达量均低于NC组,说明上调miR-449a可以抑制E2F3表达。
综上所述,miR-449a可抑制Eca-109细胞的增殖、迁移、侵袭,抑制靶基因E2F3表达可能是其作用机制。因此,miR-449a可作为食管鳞癌治疗的一个新靶点。本研究的不足为只在细胞水平进行了分析,缺乏实体实验证据;未深入分析E2F3对食管鳞癌细胞的生物学影响。以上均为本课题组未来的研究重点。
[1] Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016,66(2):115-132.
[2] Cheng CJ, Bahal R, Babar IA, et al. MicroRNA silencing for cancer therapy targeted to the tumour microenvironment[J]. Nature, 2014,518(7537): 107-110.
[3] Chen SP, Liu BX, Xu J, et al. MiR-449a suppresses the epithelial-mesenchymal transition and metastasis of hepatocellular carcinoma by multiple targets[J]. BMC Cancer, 2015(15):706.
[4] Li X, Li H, Zhang R, et al. MicroRNA-449a inhibits proliferation and induces apoptosis by directly repressing E2F3 in gastric cancer[J]. Cell Physiol Biochem, 2015,35(5):2033-2042.
[5] Ren XS, Yin MH, Zhang X, et al. Tumor-suppressive microRNA-449a induces growth arrest and senescence by targeting E2F3 in human lung cancer cells[J]. Cancer Lett, 2014,344(2):195-203.
[6] Di Leva G, Garofalo M, Croce CM. MicroRNAs in cancer[J]. Annu Rev Pathol, 2014(9):287-314.
[7] 祖彩华,张国梁,刘涛.miR-506对结肠癌细胞增殖的影响及其作用机制[J].山东医药,2016,56(40):5-8.
[8] Byrnes KA, Phatak P, Mansour D, et al. Overexpression of miR-199a-5p decreases esophageal cancer cell proliferation through repression of mitogen-activated protein kinase kinase kinase-11 (MAP3K11) [J]. Oncotarget, 2016,7(8):8756-8770.
[9] Cheng Y, Li Y, Nian Y, et al. STAT3 is involved in miR-124-mediated suppressive effects on esophageal cancer cells[J]. BMC Cancer, 2015(15):306.
[10] Zhang YH, Wang QQ, Li H, et al. miR-124 radiosensitizes human esophageal cancer cell TE-1 by targeting CDK4[J]. Genet Mol Res, 2016,15(2):15027893.
[11] Zhao Z, Ma X, Sung D, et al. microRNA-449a functions as a tumor suppressor in neuroblastoma through inducing cell differentiation and cell cycle arrest[J]. RNA Biol, 2015,12(5):538-554.
[12] Hu J, Fang Y, Cao Y, et al. miR-449a Regulates proliferation and chemosensitivity to cisplatin by targeting cyclin D1 and BCL2 in SGC7901 cells[J]. Dig Dis Sci, 2014,59(2):336-345.
[13] Miles WO, Tschop K, Herr A, et al. Pumilio facilitates miRNA regulation of the E2F3 oncogene[J]. Genes Dev, 2012,26(4):356-368.
[14] Dong D, Gong Y, Zhang D, et al. miR-874 suppresses the proliferation and metastasis of osteosarcoma by targeting E2F3[J]. Tumour Biol, 2016,37(5):6447-6455.
[15] Gao Y, Li H, Ma X, et al. E2F3 upregulation promotes tumor malignancy through the transcriptional activation of HIF-2a in clear cell renal cell carcinoma[J]. Oncotarget, 2016,43(12):501-503.
[16] Sun C, Li S, Zhang F, et al. Long non-coding RNA NEAT1 promotes non-small cell lung cancer progression through regulation of miR-377-3p-E2F3 pathway[J]. Oncotarget, 2016,7(32):51784-51814.
[17] Trikha P, Sharma N, Pena C, et al. E2f3 in tumor macrophages promotes lung metastasis[J]. Oncogene, 2016,35(28):3636-3646.
[18] Lee JM, Heo MJ, Lee CG, et al. Increase of miR-199a-5p by protoporphyrin Ⅸ, a photocatalyzer, directly inhibits E2F3, sensitizing mesenchymal tumor cells to anti-cancer agents[J]. Oncotarget, 2015,6(6):3918-3931.
Effects of miR-449a on proliferation, migration and invasion of esophageal squamous-cell carcinoma cell line Eca-109
WANGQangqiang1,WANGMengjie,ZHANGYuhong,LIHao,GAOFei,LIUYangchen
(1BengbuMedicalCollege,Bengbu233000,China)
Objective To investigate the effects of miR-449a on cell proliferation, migration and invasion of esophageal squamous-cell carcinoma cell line Eca-109 and its mechanism. Methods Eca-109 cells were divided into the miR-449a group and the negative control (NC) group, in which miR-449a mimics and NC-mimics were transfected into Eca-109 cells, respectively. Real-time fluorescent quantitative PCR was performed to detect the relative expression of miR-449a in Eca-109 cells. When the expression of miR-449a in Eca-109 cells of the miR-449a group was higher than that of the NC group, indicating Eca-109 cell models with up-regulated miR-449a expression were successfully established. The cell proliferation abilities of the two groups were analyzed by CCK-8 and colony formation assay, which were shown in OD values and cell survival numbers at 12, 24 and 48 h. The cell migration and invasion was measured by Scratch test and Transwell invasion testing system, respectively. Additionally, flow cytometry was performed to detect cell cycle. Real-time fluorescent quantitative PCR and Western blotting were performed to detect the expression of E2F3 mRNA and protein in the two groups. Results At 12, 24 and 48 h, the OD value, the number of survival cells, distance between cells and the number of cells invading into the lower chamber of the miR-449a group were lower than those in the NC group (P<0.05 orP<0.01). The percentage of cells in G1phase of the miR-449a group was higher than that in the NC group, and the percentage of cells in S phase was lower than that of the NC group (allP<0.05). However, there was no significant difference in the percentage of cells in G2/M phase between the two groups (P>0.05). The relative expression of E2F3 mRNA and protein in the miR-449a group was lower than that in the NC group (allP<0.01). Conclusion miR-449a can inhibit the proliferation, migration and invasion of esophageal squamous-cell carcinoma cell line Eca-109 by inhibiting the expression of target gene E2F3.
esophageal squamous-cell carcinoma; microRNA-449a; E2F3 gene; cell proliferation; cell migration; cell invasion
江苏省“333工程”科研项目(BRA2015225)。
王强强(1989-),男,住院医师,研究方向为消化系统肿瘤临床与基础。E-mail: wangqiangqiang89@163.com
刘阳晨(1969-),男,主任医师、硕士生导师,研究方向为肿瘤综合治疗。E-mail: liuyctx@163.com
10.3969/j.issn.1002-266X.2017.16.007
R735.1
A
1002-266X(2017)16-0024-04
2016-11-29)
