链球菌毒力因子溶血素S的研究进展
2017-04-19陈德芳
王 虹,彭 爽,陈德芳
链球菌毒力因子溶血素S的研究进展
王 虹,彭 爽,陈德芳
链球菌溶血素S (Streptolysin S, SLS)是链球菌产生的重要毒力因子之一。化脓链球菌、海豚链球菌、咽峡炎链球菌等多种人和动物致病性链球菌均含有该毒力因子,化脓链球菌是人类主要的病原菌,其致病机制备受关注。SLS是一个由sagA-sagI9个连续基因编码修饰的多肽性细胞溶素,具有帮助致病菌渗透上皮屏障、造成组织损伤、抵抗宿主免疫细胞吞噬、与其他毒力因子相互作用的功能;SLS可作为细胞群体感应的信号分子,参与调节其他毒力因子的表达。本文对SLS的结构和在致病过程中的生物学功能作一综述。
化脓性链球菌;链球菌溶血素S;结构;致病作用
化脓性链球菌(Streptococcuspyogenes)根据其表面C抗原在Lancefield分群中被划为A族,因此又称为A族链球菌(A group Streptococcus),是一种重要的人类病原菌,可造成急性坏死性筋膜炎、风湿热、急性肾小球肾炎等疾病。据世界卫生组织(World Health Organization)统计,该病原菌每年可造成1 800万继发性感染和70万侵袭性疾病,大约50万人死亡[1]。S.pyogenes具有溶解红细胞的能力,当生长在血平板上时,菌落周围可形成一个2~4 mm宽、界限分明、完全透明的溶血环,该现象称为乙型溶血或β-溶血。1932年Todd[2]证明了S.pyogenes可以产生2种不同的溶血素,一种命名为链球菌溶血素O (streptolysin O),其对氧敏感,另一种命名为链球菌溶血素S(streptolysin S,SLS),在血清中具有较高的溶解性。SLS是一种高毒性的细胞溶素,研究表明SLS通过诱导氯离子快速通过红细胞破坏红细胞阴离子交换蛋白band-3,从而破坏溶解红细胞[3]。除了溶解红细胞形成完全透明的溶血环以外,SLS还可以损害多种细胞,如淋巴细胞、肿瘤细胞、角质细胞和白细胞。作为重要毒力因子,在S.pyogenes致病过程中发挥着重要作用,本文总结了SLS的结构和在致病中的作用,以期为含有SLS的链球菌的研究提供参考。
1 SLS的结构
1.1 SLS的基因结构 1998年Betschel等[4]运用转座子Tn916插入到两株临床分离的S.pyogenes中,发现转座子插入后S.pyogenes溶血现象消失,进一步研究证明该插入位点位于一个未知开放阅读框的启动子区域,并指定为sagA,首次确定了SLS产生的相关位点。2000年Nizet等[5]运用转座子诱变技术、染色体步移研究、参考S.pyogenes全基因组序列,发现了与SLS产生相关的9个连续基因:sagA、sagB、sagC、sagD、sagE、sagF、sagG、sagH、sagI。对这9个基因进行定点靶向集成诱变,发现S.pyogenes都没有溶血现象,即不能产生SLS;对sagA启动子上游和sagI末端序列的下游进行突变却不影响溶血现象,从而确定了SLS产生的相关基因界限。将完整的sag操纵子转入到非溶血的乳酸菌(Lactococcuslactis)中进行异源表达,发现乳酸菌产生了β-溶血现象,进一步证明了sag操纵子(sagA-I)对于SLS产生的必要性[5]。
1.2 SLS的蛋白结构 对S.pyogenes的sag操纵子进行计算机模拟分析,表明SLS和第一类细菌素一样由一个操纵子编码,其中含有一个结构基因,该结构基因是一个包含氨基端前导区域和羧基末端核心肽的前体肽,操纵子还包括催化前体肽成熟、运载成熟毒素输出蛋白的基因的编码机制。Nizet等[5]对S.pyogenes的sag基因簇的各个基因进行研究,预测出了各个基因的蛋白和功能。
sagA编码了一个53个氨基酸的肽,具有细菌素前体肽的特点:包括一个潜在的Gly-Gly分裂位点,将sagA分为一个23个氨基酸前导肽和一个30个氨基酸的核心肽。含有丰富的Ser(13.2%),Thr(15.1%),Cys(13.2%)和Gly(15.1%)残基,这些残基是sagA翻译后修饰的位点[5-6]。
大肠杆菌(E.coli)分泌的细菌素17,由Mcb操纵子(McbA-G)编码产生,其各基因所编码的蛋白和细菌素B17产生过程与sag操纵子(sagA-I)编码的蛋白在SLS产生过程有相似之处,两种毒素均由McbA或sagA编码原毒素,随后在操纵子其他基因编码的蛋白下修饰、运输到体外发挥毒性(图1)。其中McbBCD是细菌素B17中McbBCD编码组合成的复合酶,其中包含一个脱氢酶(McbC),一个环化脱水酶(McbB)和“对接”蛋白质(McbD),这些酶有助于将McbA上的 4个Ser残留和4个Cys残基分别转化为恶唑和噻唑杂环化合物,这些修饰对于成熟细菌素B17的活性是必不可少的[7]。SagB、sagC、sagD所编码的蛋白能共同形成一个复合酶,其中SagB编码蛋白与脱氢酶McbC的一致性为22%、sagC与环化脱水酶McbB的一致性为13%、sagD与“对接”蛋白McbD的一致性为18%。Lee等[8]证明了重组的SagBCD能成功替代McbBCD对体外的McbA进行加工,证实了SagBCD与McbBCD复合酶相似,能够催化杂环化合物的形成。在sagA前导蛋白的分开位点的N端有一个sagC高亲和的底物绑定结合位点,通过SagBCD复合物底物sagA得到高效的修饰[9]。这一修饰包含了2个步骤的转换,即将Ser34,Ser39,Ser46 和 Ser48转换为恶唑,Cys32转换为噻唑,Cys24和Cys27对SLS的溶血具有重要性。SagC是一个锌硫醇氧化脱氢酶,清除来自肽骨架的水,将Cys, Ser 和Thr残基催化为二氢噻唑,恶唑啉和甲基恶唑啉环。随后,SagB作为一个脱氢酶,以一种黄素单核苷酸依赖的脱氢催化方式,将上一步的产物分别催化为芳香噻唑,恶唑和甲基恶唑杂环化合物。SagD可能在SagBCD复合物的形成和酶活性的调节中发挥作用[8]。这些杂环化合物合并制约了前导肽的主链构象的灵活性,使得成熟的SLS具有更加稳定的结构,这对于其生物活性是必不可少的,因为非结构化的肽,将消耗更多的能量来有效的绑定到靶分子上[10]。因此,原毒素SagA转化成SLS的过程中离不开复合物SagBCD的修饰作用。SagE是一个25.4 kDa的蛋白,与跨膜蛋白相关,在促进SLS原毒素的成熟中具有重要作用[5, 11-12]。药物奈非那韦阻止SLS的合成主要是通过抑制CaaX蛋白水解酶和细菌素加工过程酶(CaaX proteases and bacteriocin-processing enzymes,CPBP)家族成员SagE,与该家族中的其他成员一样,早期认为SagE也是一种免疫相关蛋白,如植物乳杆菌(Lactobacillusplantarum)中细菌素的相关编码基因PlnP编码的蛋白,该蛋白具有免疫性。但是通过奈非那韦抑制SLS的产生之后,S.pyogenes的生长并未受到影响,说明SLS没有拥有任何抗菌活性,表明了sagE 并未参与自身的免疫作用[12]。Sag F是一个26.2 kDa的膜相关蛋白,预测其在SLS的成熟中具有重要作用,但具体机制不明[13]。Sag G 是一个34.2 kDa的蛋白, SagH 是一个42.2 kDa蛋白 和 SagI 是一个41.7 kDa的蛋白,预测都是膜蛋白,共同形成ABC类转运蛋白参与SLS的产出[13-14]。
这9个基因所编码的蛋白在S.pyogenes的SLS的形成、成熟、产出过程中发挥着各自关键的作用。SLS的产生可以阐述为sagA编码的SLS前多肽在sagBCD编码的复合物sagBCD环化修饰和sagE和sagF的进一步催化,最终形成成熟的2.7 kDa的杂环肽类毒素,最后在sagGHI所编码的ABC类转运蛋白的作用下,输出到体外发挥毒性。
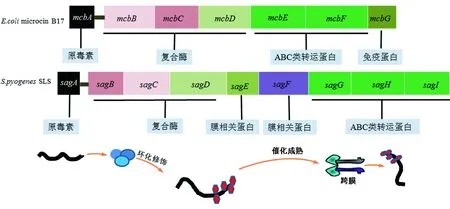
图1 S.pyogenes的SLS sag操纵子、E.coli的微菌素B17 Mcb操纵子以及SLS的产生过程[15]Fig.1 Genetic organization of the streptolysin S-associated gene cluster (sagA-I) from S. pyogenes and the E. coli microcin B17 gene cluster (mcbA-G),and the process of SLS developing[15]
2 SLS的作用
2.1 帮助菌体穿过上皮屏障S.pyogenes感染时首先定植在宿主表皮层,再越过上皮屏障内化到下层组织。S.pyogenes具有两种入侵途径:细胞内途径,指菌体进入胞内,直接损伤细胞,继而达到入侵下层组织的目的;细胞旁路途径,菌体渗透进入下层组织时的路径为细胞间连接处,几乎不损伤细胞[16-17]。Tomoko等[17]运用S.pyogenes菌株SSI-1在人结肠腺癌细胞系Caco-2上进行研究,构建了SLS的编码基因sagA缺失株,发现△sagA菌株所能转移进入单层Caco-2的能力显著低于野生株,而sagA重新导入到△sagA菌株后,入侵能力可以恢复达到野生株的水平,因此SLS在促进S.pyogenes渗透到下层组织过程中发挥着重要作用。但是,试验期间并未检测到胞内细胞因子TNF-α、IFN-γ、IL-6、IL-8的释放和细胞的损伤,因此推测在入侵过程中,SLS可能参与调控宿主细胞间链接蛋白解连接,而不是直接由SLS的毒素作用和炎性作用导致的。后续研究显示,在S.pyogenes移位穿过上皮细胞时,SLS介导宿主钙黏蛋白、钙蛋白酶到细胞膜上,随后与半胱氨酸蛋白酶协同来降低宿主上皮细胞间的紧密连接,使细菌通过旁路途径入侵到深层组织[18-19]。但是关于SLS是如何诱导这一过程中钙蛋白酶激活的信号通路的机制有待进一步研究,这有助于了解在入侵的早期阶段途径,宿主细胞与S.pyogenes之间的关系。
2.2 引起组织的损伤S.pyogenes最初黏附于角质化的上皮细胞上,SLS诱导渗透效应,导致磷酸化的蛋白激酶Akt丢失,随后激活丝裂原活化蛋白激酶p38途径,p38的激活使得NF-κB在核中启动炎性细胞因子的产生。这一过程可能通过细胞因子受体蛋白和死亡受体蛋白,导致炎性细胞因子自分泌信号的循环,最终使得角质化细胞的细胞程序性死亡[20]。SLS能够增强角质化细胞上的促炎信号和导致细胞程序性死亡,同时下调蛋白激酶调控的细胞保护作用造成组织损伤。SLS缺失的S.pyogenes在小鼠软组织感染模型中减弱了组织的损伤程度,表明SLS在皮肤和软组织感染中是重要的毒力因子,有助于组织损伤[13]。磷酸烯醇式丙酮酸磷酸转移酶系统[21-22]的破坏和碳代谢阻遏蛋白ccpA[23]缺失在感染的早期阶段可以促进SLS的表达及活性,显著增强对小鼠皮下溃疡的严重性。通过用化学抑制剂抑制SLS的目标蛋白band3后,可以急剧减轻S.pyogenes对体内皮肤的损伤[3]。研究发现即使只有sagA的Ser39突变,都可导致S.pyogenes在小鼠皮肤感染模型失去毒性,该位点的突变阻止了SLS中重要恶唑杂环的形成[9]。SLS还可以与溶血素O、抗吞噬表面蛋白M[13, 24-26]和致热性外毒素B(Streptococcal exotoxin B,Spe B)[27-28]等S.pyogenes的其他毒力因子相互作用加快组织的坏死。
2.3 对抗宿主的免疫清除 当S.pyogenes穿透皮肤或粘膜到达体内组织后,吞噬细胞率先从毛细血管中移行并聚集到病原菌所在部位,多数情况下,病原菌被吞噬细胞内吞并消化清除。但在深层组织中发现S.pyogenes的存在,说明其存在逃避吞噬细胞清除的机制。通过△sagA的S.pyogenes不能存活在人全血和中性粒细胞中,第一次发现SLS具有对抗吞噬细胞的作用[13]。在S.pyogenes感染斑马鱼的模型中SLS缺失后菌株的毒力显著小于野生株,并且突变株感染位点比野生株有更多的中性粒细胞聚集浸润,结果表明SLS是影响宿主中性粒细胞产生的趋化性信号[29]。吞噬细胞主要负责截取和吞噬入侵的S.pyogenes,SLS破坏中性粒细胞在感染位点的聚集可能是细菌特殊的毒力机制来避免先天免疫系统[30]。巨噬细胞是另一个防御S.pyogenes感染的关键,△sagA菌株与野生型菌株相比所引起的巨噬细胞的凋亡显著减少,因此在SLS调控下,通过激活炎症细胞程序性死亡途径,S.pyogenes能够杀死巨噬细胞,可以减小宿主免疫应答[20, 31-33]。但是研究发现海豚链球菌(Streptococcusiniae)的SLS在对抗宿主免疫细胞吞噬中几乎无作用,因为当SLS缺失和野生的S.iniae与鲤鱼的白细胞共同孵化时,两株菌的生长之间并无统计学差异。因此并不是所有β-溶血性链球菌的SLS都拥有相同的功能,其具体机制值得进一步研究。
2.4 与其他毒力因子之间协调致病 Chih-Hsin Hung等[34]使用小鼠皮下气囊感染模型,用野生型S.pyogenesNZ131、△sagB、△speB、△sagB/speB和重组基因补足株进行感染,链球菌致热性外毒素SpeB具有破坏宿主防御系统,帮助细菌逃避免疫清除的功能。在气囊模型的渗出液调查中发现△sagB/speB菌株中炎症性细胞因子的表达受到了显著的抑制,△sagB、△speB、△sagB/speB株比起正常野生株更易受到免疫细胞的杀伤,其中△sagB/speB最显著,所引起的巨噬细胞凋亡最少。因此在S.pyogenes中SLS和SpeB有助于病原菌逃避来自宿主免疫细胞的杀灭。在皮肤损伤和死亡率试验中发现,SLS和SpeB之间有协同作用,造成局部组织损伤和小鼠的死亡,其中SpeB的主要作用是局部组织伤害,而SLS在小鼠死亡方面更具有显著的作用,二者之间在S.pyogenes感染致病过程中具有协同作用。
2.5 作为群体感应信号分子调控毒力因子表达 群体感应(quorum sensing)是指微生物群体在其生长过程中,由于群体密度的增加,导致其生理和生化特性的变化, 显示出少量菌体或单个菌体所不具备的特征[35]。细菌能自发产生、释放一些特定的信号分子,当细胞密度增加时,信号分子浓度达到阈值,使得相关基因表达。一些细菌素有群体感应调节的作用,自身的结构肽可作为信号分子来诱导自身在密度依赖的诱导循环中表达。
研究发现sagA与pel(一个未转录的mRNA)一起可以调节毒力因子如M蛋白、链接酶、SpeB的表达[36-39]。研究发现,随着S.pyogenes浓度的增加,sagA的表达量也增加,这是作为一个信号分子的显著标志[40]。在革兰氏阳性细菌中,信号分子通常是一种寡肽,由ABC类转运蛋白分泌细胞外。sagA可以以密度依赖的方式和当培养环境中存在SLS两种情况下表达量上调。在S.pyogenes中,自体诱导物Ⅱ类分子luxS同源物的缺失,改变了细菌的多个生长表型,同时发现luxS突变株由于sagA转录的增加使得SLS的活性增强[41]。sagA的表达随着细胞密度增加而增加,是一个群体感应分子,与pelmRNA一起以一种菌株特异性方式调控了其他毒力因子。
3 展 望
目前对SLS已进行了广泛研究,但关于其精确的化学结构还尚未知晓,此外其相关基因sagF的具体功能还有待进一步研究。SLS的研究主要集中在人类病原菌S.pyogenes上,而对其他含有该毒素的链球菌的研究较少,如S.iniae,咽峡炎链球菌等,因此对S.pyogenesSLS的总结可为其他含有该毒素的链球菌的致病过程提供参考。
在自然感染过程中,SLS不具有免疫原性,可能是因为其分子量较小且氨基酸经过高度修饰,从而减少了蛋白水解位点,而蛋白水解位点对于抗原的消失和出现起到了关键作用;也可能是因为SLS具有强大的毒性来对抗参与先天和获得性免疫的细胞[42-43]。然而,有研究表明S.iniaeSLS相关基因sagE,sagF,sagG和sagI研发的DNA疫苗,可以对S.iniae的感染起到有效的保护作用[44]。其中sagE的DNA疫苗对杂交条纹鲈进行免疫,结果发现免疫一个月后接种S.iniae,20 d之后该疫苗的相对免疫保护率可以达到95%,两个月后的相对免疫保护率达到88%,且在血清中产生了特异性抗体IgM来对抗细菌感染[45]。这些结果为通过毒力因子SLS来防控S.pyogenes疾病带来启示。
[1] Carapetis JR, Steer AC, Mulholland EK, et al. The global burden of group Astreptococcaldiseases[J]. Lancet Infectious Dis, 2005, 5(11): 685-694. DOI: 10.1016/s1473-3099(05) 70267-x
[2] Todd E. Antigenic streptococcal hemolysin [J]. J Exper Med, 1932, 55(2): 267-280. DOI: 10.1084/jem.5 5.2.267
[3] Higashi DL, Biais N, Donahue DL, et al. Activation of band 3 mediates group AStreptococcusstreptolysin S-based beta-haemolysis [J]. Nat Microbiol, 2016, 1: 15004. DOI: 10.1038/ nmic-robiol. 2015.4
[4] Betschel SD, Borgia SM, Barg NL, et al. Reduced virulence of group AstreptococcalTn916 mutants that do not produce streptolysin S [J]. Infect Immun, 1998, 66(4): 1671-1679.
[5] Nizet V, Beall B, Bast DJ, et al. Genetic locus for streptolysin S production by group Astreptococcus[J]. Infect Immun, 2000, 68(7): 4245-4254. DOI: 10.1128/iai.68.7.4 245-4254. 2000
[6] Tagg JR, Dajani AS, Wannamaker LW. Bacteriocins of gram-positive bacteria[J]. Bacteriologic Rev, 1976, 40(3): 722. DOI: 10.1007/978-3-642-76974-0-5
[7] Milne JC, Roy RS, Eliot AC, et al. Cofactor requirements and reconstitution of microcin B17 synthetase: a multienzyme complex that catalyzes the formation of oxazoles and thiazoles in the antibiotic microcin B17 [J]. Biochemistry, 1999, 38(15): 4768-4781. DOI:10.1021/ bi982975q
[8] Lee SW, Mitchell DA, Markley AL, et al. Discovery of a widely distributed toxin biosynthetic gene cluster [J]. Proc Natl Acad Sci, 2008, 105(15): 5879-5884. DOI: 10.1073/ pnas.080 1338105
[9] Mitchell DA, Lee SW, Pence MA, et al. Structural and functional dissection of the heterocyclic peptide cytotoxin streptolysin S [J]. J Biologic Chem, 2009, 284(19): 13004-13012. DOI: 10.1074/jbc.M900802200
[10] Haft DH, Basu MK, Mitchell DA. Expansion of ribosomally produced natural products: a nitrile hydratase-and Nif11-related precursor family [J]. BMC Biol, 2010, 8(1): 70. DOI: 10.1186/1741-7007-8-70
[11] PSORT I. PSORT: a program for detecting sorting signals in proteins and predicting their subcellular localization [J]. J Mol Biol, 1997, 266: 594-600. DOI: 10.1016/S 0968-0004 (98)01336-X
[12] Maxson T, Deane CD, Molloy EM, et al. HIV protease inhibitors block streptolysin S production[J]. ACS Chemic Biol, 2015, 10(5): 1217-1226. DOI: 10.1021/cb500843r
[13] Datta V, Myskowski SM, Kwinn LA, et al. Mutational analysis of the group Astreptococcaloperon encoding streptolysin S and its virulence role in invasive infection[J]. Mol Microbiol, 2005, 56(3): 681-695. DOI: 10.1111/j.1365-2958.2005.04583.x
[14] Sahl HG, Bierbaum G. Lantibiotics: biosynthesis and biological activities of uniquely modified peptides from gram-positive bacteria [J]. Ann Rev Microbiol, 1998, 52(1): 41-79. DOI: 10.1146/annurev.micro.52.1.41
[15] Molloy EM, Cotter PD, Hill C, et al. Streptolysin S-like virulence factors: the continuing sagA [J]. Nat Rev Microbiol, 2011, 9(9): 670-681. DOI: 10.1038/nrmicro2624
[16] Terao Y, Kawabata S, Kunitomo E, et al. Fba, a novel fibronectin-binding protein fromStreptococcuspyogenes, promotes bacterial entry into epithelial cells, and the fba gene is positively transcribed under the Mga regulator [J]. Mol Microbiol, 2001, 42(1): 75-86. DOI: 10.1046/j.1365-2958.2001.02579.x
[17] Terao Y, Kawabata S, Kunitomo E, et al. Novel laminin-binding protein ofStreptococcuspyogenes, Lbp, is involved in adhesion to epithelial cells [J]. Infect Immun, 2002, 70(2): 993-997. DOI: 10.1128/IAI. 70.2.99 3-997.2002
[18] Sumitomo T, Nakata M, Higashino M, et al. Streptolysin S contributes to group Astreptococcaltranslocation across an epithelial barrier [J]. J Biologic Chem, 2011, 286(4): 2750-2761. DOI: 10.1074/jbc.m110.171504
[19] Sumitomo T. Group AStreptococcustranslocates across an epithelial barrier via degradation of intercellular junctions [J]. J Oral Biosci, 2015, 57(3): 135-138. DOI: 10.1016/j. job. 201 5.03.002
[20] Flaherty RA, Puricelli JM, Higashi DL, et al. Streptolysin S promotes programmed cell death and enhances inflammatory signaling in epithelial keratinocytes during group AStreptococcusinfection [J]. Infect Immun, 2015, 83(10): 4118-4133. DOI: 10.1128 /iai. 006 11-15
[21] Gera K, Le T, Jamin R, et al. The phosphoenolpyruvate phosphotransferase system in group AStreptococcusacts to reduce streptolysin S activity and lesion severity during soft tissue infection [J]. Infect Immun, 2014, 82(3): 1192-1204. DOI: 10.1128/iai.01271-13
[22] Gera K, Le T, Jamin R, et al. The PEP Phosphotransferase System (PTS) in the Group AStreptococcusacts to reduce SLS activity and lesion severity during soft tissue infection [J]. Infect Immun, 2013, 82(3): 241-243. DOI: 10.1128/iai.01271-13
[23] Kinkel TL, McIver KS. CcpA-mediated repression of streptolysin S expression and virulence in the group Astreptococcus[J]. Infect Immun, 2008, 76(8): 3451-3463. DOI: 10.1128/i ai. 00343-08
[24] Humar D, Datta V, Bast D J,et al. Streptolysin S and necrotising infections produced by group Gstreptococcus[J].Lancet, 2002, 359(9301): 124-129. DOI: 10.1016/s0140-6736 (02) 07371-3
[25] Ofek I, Zafriri D, Goldhar J, et al . Inability of toxin inhibitors to neutralize enhanced toxicity caused by bacteria adherent to tissue culture cells [J]. Infect Immun,1990, 58(11):3737-3742.
[26] Smeesters PR, McMillan DJ, Sriprakash KS. The streptococcal M protein: a highly versatile molecule[J]. Trends Microbiol, 2010, 18(6): 275-282. DOI: 10.1016/j.tim.2010.02.007
[27] Ginsburg I. Could synergistic interactions among reactive oxygen species, proteinases, membrane-perforating enzymes, hydrolases, microbial hemolysins and cytokines be the main cause of tissue damage in infectious and inflammatory conditions [J]. Med Hypotheses, 1998, 51(4): 337-346. DOI: 10.1016/s0306-9877(98) 90059-7
[28] Kwinn LA, Nizet V. How group AStreptococcuscircumvents host phagocyte defenses [J]. 2007. DOI: 10.2217/17460913.2.1.75
[29] Lin A, Loughman JA, Zinselmeyer BH, et al. Streptolysin S inhibits neutrophil recruitment during the early stages ofStreptococcuspyogenesinfection [J]. Infect Immun, 2009, 77(11): 5190-5201. DOI: 10.1128/i ai.00420-09
[30] Miyoshi-Akiyama T, Takamatsu D, Koyanagi M, et al. Cytocidal effect ofStreptococcuspyogeneson mouse neutrophilsinvivoand the critical role of streptolysin S[J]. J Infectious Dis, 2005, 192(1): 107-116. DOI: 10.1086/430617
[31] Goldmann O, Sastalla I, Wos-Oxley M, et al.Streptococcuspyogenesinduces oncosis in macrophages through the activation of an inflammatory programmed cell death pathway [J]. Cellular Microbiol, 2009, 11(1): 138-155.DOI: 10.1111/j.1462-5822.2008.01245.x
[32] Sumby P, Zhang S, Whitney AR, et al. A chemokine-degrading extracellular protease made by group AStreptococcusalterspathogenesis by enhancing evasion of the innate immune response [J]. Infect Immun, 2008, 76(3): 978-985. DOI: 10.1128/iai.01354-07
[33] Zinkernagel AS, Timmer AM, Pence MA, et al. The IL-8 protease SpyCEP/ScpC of group AStreptococcuspromotes resistance to neutrophil killing [J]. Cell Host Microbe, 2008, 4(2): 170-178. DOI: 10.3410/f.1121776.578849
[34] Hung CH, Tsao N, Zeng YF, et al. Synergistic effects of streptolysin S and streptococcal pyrogenic exotoxin B on the mouse model of group Astreptococcalinfection [J]. Medical Microbiol Immunol, 2012, 201(3): 357-369. DOI: 10.1007/s00430-012-0241-6
[35] Wu QP, Wu K, Ye YW, et al. Quorum sensing and its roles in pathogenesis among animal-associated pathogens areview [J]. Acta Microbiol Sin, 2009 (7) : 853-858. DOI:10.3321 /j.issn:0001-6209.2009.07.003 (in Chinese)
吴清平,吴葵,叶应旺,等. 群体感应及其在动物病原菌致病中的作用[J]. 微生物学报, 2009(7): 853-858.DOI :10.3321/j.issn:0001-6209.2009.07.003
[36] Li Z, Sledjeski DD, Kreikemeyer B, et al. Identification of pel, aStreptococcuspyogeneslocus that affects both surface and secreted proteins[J]. J Bacteriol, 1999, 181(19): 6019-6027. DOI: 10.1046/j.13 65-295 8.1998.01057.x
[37] Shelburne SA, Olsen RJ, Suber B, et al. A combination of independent transcriptional regulators shapes bacterial virulence gene expression during infection [J]. PLoS Pathog, 2010, 6(3): e1000817. DOI: 10.1371/journal.ppat.1000817
[38] Mangold M, Siller M, Roppenser B, et al. Synthesis of group Astreptococcalvirulence factors is controlled by a regulatory RNA molecule[J]. Mol Microbiol, 2004, 53(5): 1515-1527. DOI: 10.1111/j.136 5-29 5 8.2004.04222.x
[39] Biswas I, Germon P, McDade K, et al. Generation and surface localization of intact M protein inStreptococcuspyogenesare dependent on sagA [J]. Infect Immun, 2001, 69(11): 7029-70 38. DOI: 10.1128/iai.69.11.7029-7038.2001
[40] Salim KY, Azavedo JCD, Bast DJ, et al. Role for sagA and siaA in quorum sensing and iron regulation inStreptococcuspyogenes[J]. Infect Immun, 2007, 75(10):5011-7. DOI:10.1128/IAI.01824-06
[41] Lyon WR, Madden JC, Levin JC, et al. Mutation of luxS affects growth and virulence factor expression inStreptococcuspyogenes[J]. Mol Microbiol, 2001, 42(1): 145-157. DOI: 10.10 46/j.1365-2958.2001.02616.x
[42] Nizet V. Streptococcal β-hemolysins: genetics and role in disease pathogenesis [J]. Trends microbiol, 2002, 10(12): 575-580.DOI: 10.1016/s0966-842x (02)02473-3
[43] Ofek I, Bergner-Rabinowitz S, Ginsburg I. Oxygen-stable hemolysins of group AstreptococciVIII. Leukotoxic and antiphagocytic effects of streptolysins S and O [J]. Infect Immun, 1972, 6(4): 459-464. DOI: 10.1093/infdis/122.6.517
[44] Sun Y, Hu YH, Liu CS, et al. Construction and comparative study of monovalent and multivalent DNA vaccines againstStreptococcusiniae[J]. Fish Shellfish Immunol, 2012, 33(6): 1303-1310. DOI: 10.1016/j.fsi.2012.10.004
[45] Sun Y, Sun L, Xing M Q, et al. SagE induces highly effective protective immunity againstStreptococcusiniaemainly through an immunogenic domain in the extracellular region[J]. Acta Vet Scand, 2013, 55(1): 1-9. DOI: 10.1186/1751-0147-55-78
Research progress on the virulence factors ofStreptococcushemolysin S
WANG Hong, PENG Shuang, CHEN De-fang
(DepartmentofAquaculture,CollegeofAnimalScienceandTechnology,SichuanAgriculturalUniversity,Wenjiang611130,China)
Streptolysin S (SLS), one of the important virulence factors ofStreptococcus, exist in several kinds of human and animal pathogenic bacterial, includingStreptococcuspyogenes,StrepstococcusiniaeandStreptococcusanginosus. SLS is a peptide toxin encoded by nine consecutive genes (sagA-sagI). The functions of SLS include contributing pathogenic bacterium to pass through epithelial barrier, causing tissue damage, resisting to phagocytic clearance of host immune cells and interacting with other virulence factors. In addition, SLS as a signaling molecule of cell quorum sensing is involved in regulating the expression with other virulence factors. This paper summarized the structures and the biological functions of SLS inStreptococcusinfection.
Streptococcuspyogenes; streptolysin S; structure; pathogenic function Supported by the Science fund of Sichuan provincial Department of Education (No. 13ZB0279) Corresponding author: Chen De-fang, Email: chendf_sicau@126.com
10.3969/j.issn.1002-2694.2017.03.018
陈德芳,Email: chendf_sicau@126.com
四川农业大学动物科技学院水产系,温江 611130
R378.1
A
1002-2694(2017)03-0287-06
2016-10-09 编缉:梁小洁
四川省教育厅项目(No. 13ZB0279)资助
