2014—2016年广东省肇庆市人感染H7N9禽流感病毒基因组特征分析
2017-04-19谭翰清程洁萍谭海芳朱颖梅梁晓晴
谭翰清,程洁萍,谭海芳,朱颖梅,林 凤,梁晓晴,陈 捷,麦 炜
2014—2016年广东省肇庆市人感染H7N9禽流感病毒基因组特征分析
谭翰清1,程洁萍1,谭海芳1,朱颖梅1,林 凤1,梁晓晴2,陈 捷2,麦 炜1
目的 了解广东省肇庆市2014-2016年人感染H7N9禽流感病毒基因进化特征。方法 对肇庆市17例H7N9患者咽拭核酸直接进行8节段基因序列扩增与测定,用BioEdit5.0、MEGA6.0进行同源性和重要氨基酸位点分析,采用Neighbor-Joining法构建进化树,参比序列从GenBank下载。结果 7份H7N9病例标本获得8节段全基因序列,HA与A/chicken/Dongguan/695/2014(H7N9)相似度最高,NA与A/chicken/Dongguan/1075/2014(H7N9)相似度最高;内部基因与2013—2014年广东东莞、深圳禽源H7N9及H9N2相似度较高。HA和NA基因与广东省东莞、广州、深圳等地市的H7N9序列同处于珠三角进化分支,与安徽、浙江、江苏等长三角分支的序列相似性低。HA蛋白受体结合位点发生G186V、Q226L 变异,裂解位点序列均为PEIPKGR↓GLF,含有2个碱性氨基酸;M2蛋白上发现耐药位点S31N,PB2蛋白上发现 E627K突变,NA蛋白上未发现耐神经氨酸酶的位点变异。结论 肇庆市人感染H7N9病毒株可能来源于2013—2014年广东省珠三角地区禽源H7N9和H9N2,G186V、Q226L和E627K位点变异增强了对人的易感性。
人感染H7N9禽流感病毒;血凝素基因;神经氨酸酶基因;序列分析
甲型流感病毒属于正黏病毒科,可感染人和禽鸟类、猪、马等多种动物;其基因组为单负链分节段的RNA,不同宿主来源的病毒的基因组易重组产生新的亚型[1];根据血凝素(Hemagglutinin,HA)和神经氨基酸酶(Neuraminidase,NA)抗原分为不同的亚型,目前已发现18种HA、11种NA[2-4]。当流感病毒基因变异突破了物种的适应性,并对人具有明显选择优势时,可对人类产生严重性疾病或导致人类流感大流行[5]。自1997年首次发现可感染人的H5N1禽流感以来,还发现H7N7、H9N2等亚型[6-7]。2013年2月上海报告了全球首个H7N9禽流感新亚型感染病例,紧接着在苏、浙、徽等地相继报告类似病例,并迅速在我国大部分省份蔓延,其导致严重的临床症状和高病死率,引起了全球公共卫生的关注[8]。截至2016 年12月31日,我国内地累计报告H7N9 确诊病例889例(死亡321例),广东省累计报告211例(死亡82例),肇庆市(2014年1月报告首例)累计报告17例(死亡5例)。本研究对2014-2016年从广东省肇庆市人感染H7N9禽流感病例标本中提取到的毒株进行序列分析,掌握其基因进化和关键氨基酸位点变异特征,为科学防控人感染H7N9禽流感疫情提供病原学依据。
1 材料与方法
1.1 标本来源 基于肇庆市国家级流感监测网络系统,收集2014-2016年流感样病例和不明原因肺炎病例咽拭标本,应用实时荧光RT-PCR试剂(上海之江生物科技有限公司)进行H7N9检测,共发现17例人感染H7N9病例,样本经国家疾病预防控制中心和广东省流感参比实验室复核确认,置-75 ℃保存备用。
1.2 主要试剂与仪器 MagMAXTM-96 Viral RNA Isolation Kit(Life Technologies,货号:AM1836);PathAmpTMFluA Reagents(Life Technologies ,货号:4401512);ExoSAP-IT试剂盒(USB,货号:78201);Takara PCR Kit(Takara,货号:DR011);8个节段基因扩增所用的22对引物参考文献[9]合成。
1.3 基因扩增与序列测定 1)取400 μL咽拭标本,应用MagMAXTM-96 Viral RNA Isolation Kit进行病毒RNA提取,最后用20 μL去离子水洗脱;2)应用PathAmpTMFluA Reagents进行甲型流感8个节段序列扩增,使用ExoSAP-IT对产物进行快速纯化与回收;3)分别应用22对引物进行H7N9病毒8个节段PCR扩增;4)PCR产物电泳、纯化后在ABI3700测序仪上进行双向序列测定。具体操作参照试剂盒说明书和参考文献[9-10]。
1.4 同源性与进化树分析 利用DNAStar5.0的SeqMan程序进行序列拼接,采用BioEdit5.0、NCBI的BLAST进行核苷酸同源性比对,应用MEGA6.0构建HA、NA基因进化发生树(Neighbor Joining法,bootstrap = 1 000)和关键氨基酸位点分析[11]。参比序列从GenBank下载,HA和NA序列主要包括了上海、浙江、安徽、江苏、广东等地的病人、环境和禽源H7N9序列44条,其中2016年2条、2015年5条、2014年12条、2013年25条序列;此外,还包括了2005-2011年江西、浙江等地的4条H7N3序列,2005-2012年韩国、江西等地的6条H7N7序列,2008-2011年韩国、西班牙的H7N9序列3条,2005-2006年广东、江西等地的5条H11N9序列。
2 结 果
2.1 疫情概括 2014-2016年肇庆市共发现17例H7N9病例,重症11例(死亡5例)、轻症6例(无死亡);发病年龄4-78岁,男女比11∶6;分布在怀集县、四会市、鼎湖区;首例于2014年1月30日报告,末例于2016年12月28日报告,其中2014年10例、2015年4例、2016年3例,集中分布在每年12月至次年2月发病;病例2和3为家庭聚集病例,病例16有病死禽类接触史;对病例样本核酸直接进行扩增和测序,7例样本获得8个节段全序列,分别编号为ZQ01~07(表1)。
2.2 同源性分析结果 7份毒株的HA核苷酸同源性98.3%~100.0%,与A/chicken/Dongguan/695/2014(H7N9)相似度较高(98.3%~99.8%);7份毒株的NA核苷酸同源性99.0%~99.9%,与A/chicken/Dongguan/1075/2014(H7N9)相似度较高(99.1%~99.9%)。7份毒株的PB2、PB1、PA、NP、MP、NS核苷酸同源性分别为94.1%~100.0%、95.5%~99.8%、95.7%~100.0%、94.1%~100.0%、96.4%~99.9%、95.4%~100.0%,PB2、NP、M与2013-2014年广东东莞的禽源H7N9相应基因相似度较高(95.1%~100.0%),PB1、PA、NS与2013-2014年广东东莞、深圳禽源H9N2相应基因相似度较高(96.2%~99.8%)(表2)。
表1 2014-2016年肇庆市人感染H7N9病例信息概况
Tab.1 Information profile for cases of human infection with avian influenza A (H7N9) virus in Zhaoqing, China, 2014-2016

病例性别年龄地区发病日期诊断日期病例分类愈后发病前10d内是否与疑似或确诊病例接触过是否接触过病、死禽类呼吸道样本实时荧光PCR检测的Ct值直接测序结果1男28怀集县2014/1/192014/1/30重症治愈否否33/2男5怀集县2014/1/282014/2/1轻症治愈否否21ZQ013女4怀集县2014/1/262014/2/4轻症治愈是否22ZQ024女5怀集县2014/1/312014/2/5轻症治愈否否32/5男42怀集县2014/1/262014/2/5重症治愈否否34/6男62怀集县2014/2/12014/2/7重症治愈否否33/7男49怀集县2014/1/272014/2/7重症治愈否否33/8男11怀集县2014/2/42014/2/9轻症治愈否否21ZQ039男8怀集县2014/2/62014/2/12轻症治愈否否23ZQ0410女45四会市2014/2/132014/2/21重症死亡否否34/11男54四会市2014/12/252015/1/7重症死亡否否20ZQ0512男5四会市2015/1/192015/1/23轻症治愈否否22ZQ0613男59四会市2015/2/52015/2/23重症死亡否否35/14男78四会市2015/2/182015/2/26重症治愈否否34/15女76四会市2016/2/92016/2/16重症治愈否否23ZQ0716女45怀集县2016/12/172016/12/23重症死亡否是33/17女50鼎湖区2016/12/212016/12/28重症死亡否否32/
注:“/”表示未成功获得序列信息
表2 2014-2016年肇庆市人感染H7N9各基因片段相似度分析结果
Tab.2 Nucleotide identity and similarity analysis of avian influenza A(H7N9) virus in Zhaoqing, China, 2014-2016
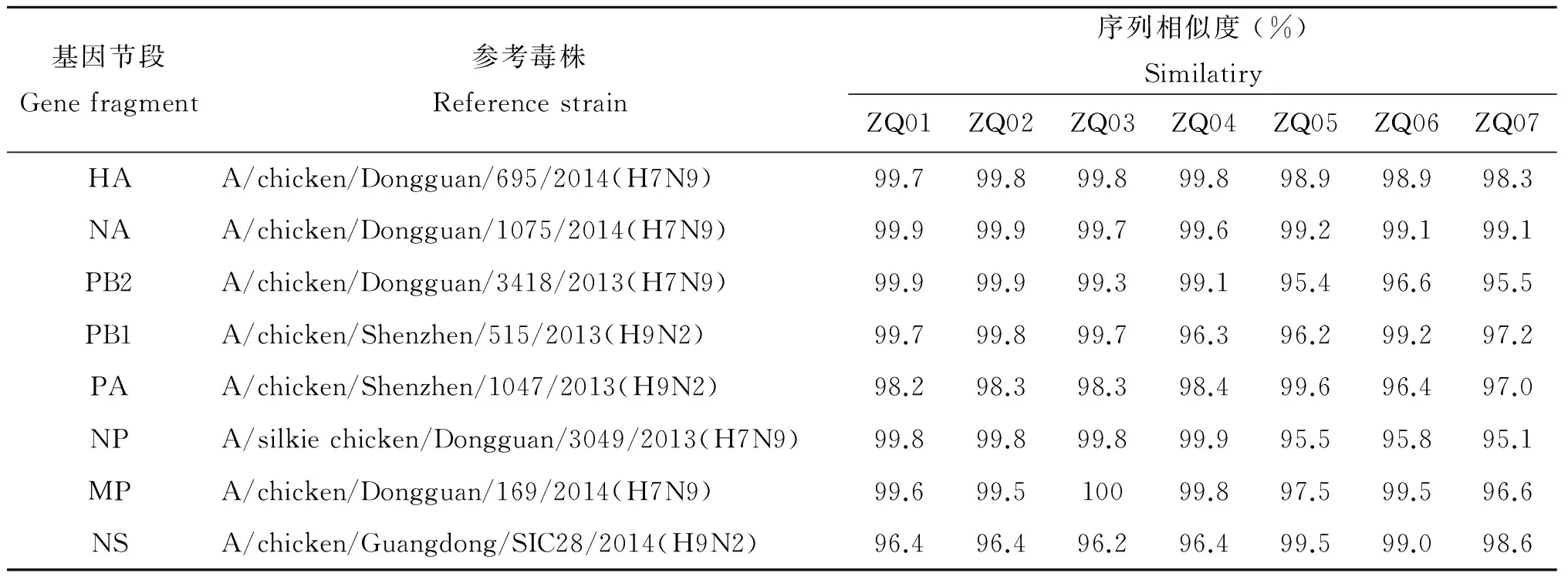
基因节段Genefragment参考毒株Referencestrain序列相似度(%)SimilatiryZQ01ZQ02ZQ03ZQ04ZQ05ZQ06ZQ07HAA/chicken/Dongguan/695/2014(H7N9)99.799.899.899.898.998.998.3NAA/chicken/Dongguan/1075/2014(H7N9)99.999.999.799.699.299.199.1PB2A/chicken/Dongguan/3418/2013(H7N9)99.999.999.399.195.496.695.5PB1A/chicken/Shenzhen/515/2013(H9N2)99.799.899.796.396.299.297.2PAA/chicken/Shenzhen/1047/2013(H9N2)98.298.398.398.499.696.497.0NPA/silkiechicken/Dongguan/3049/2013(H7N9)99.899.899.899.995.595.895.1MPA/chicken/Dongguan/169/2014(H7N9)99.699.510099.897.599.596.6NSA/chicken/Guangdong/SIC28/2014(H9N2)96.496.496.296.499.599.098.6
2.3 HA与NA基因进化特征分析 目前分析我国发现的H7N9病毒的HA和NA基因序列,在进化树上明显的分为两大分支,一支是以广东珠三角地区为代表的珠三角分支,一支是以上海、浙江为代表的长三角分支[11-12]。本文中研究的这7例从肇庆人感染H7N9病例分离的病毒HA和NA基因进化树分析结果显示,ZQ01-07病毒的HA和NA基因在进化树上与广东省其他地市,如东莞、广州、深圳等地的禽、市场环境及人中分离的H7N9病毒序列相似性高,位于同一分支——珠三角分支;而与在进化树上位于长三角分支的序列,如安徽、浙江、江苏等地分离的H7N9病毒基因序列相似性低。其中ZQ01-07序列在进化树中又集中在一簇,与广东东莞鸡中分离的H7N9病毒相似性最高(图1,2)。
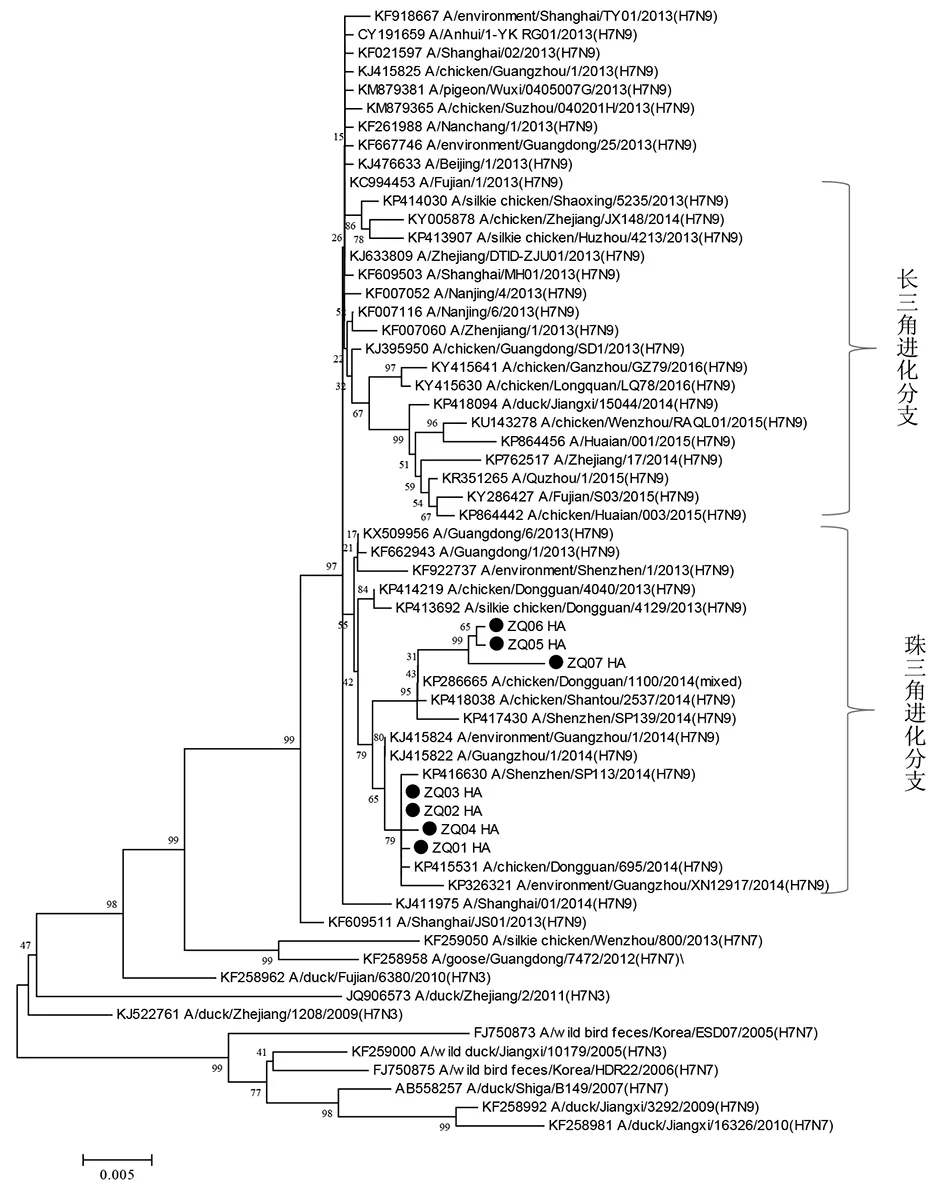
图1 2014-2016年肇庆市人感染H7N9病毒株HA基因进化树Fig.1 Phylogenetic tree of the HA gene of human infection with avian influenza A (H7N9) virus in Zhaoqing, China, 2014-2016
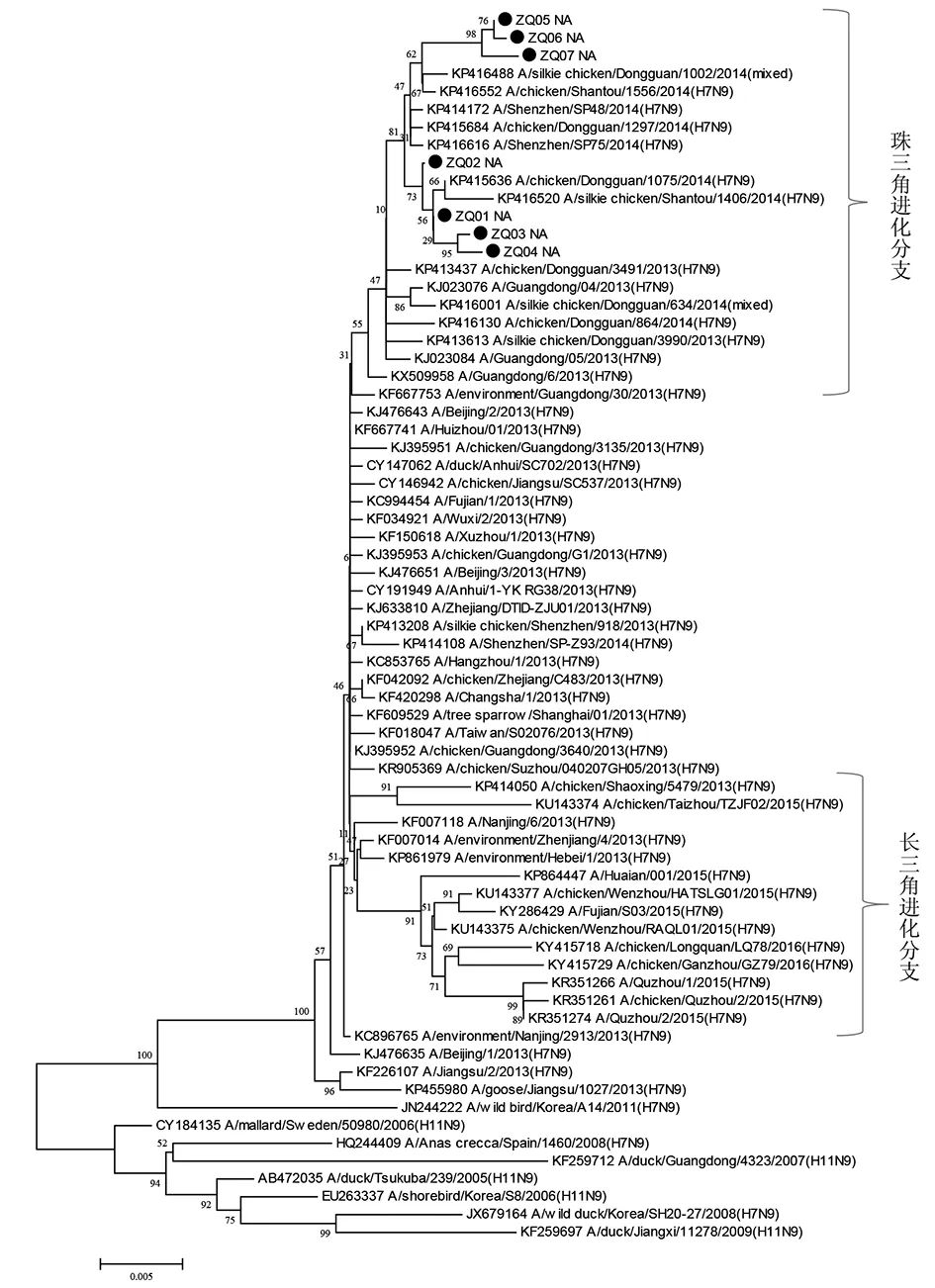
图2 2014-2016年肇庆市人感染H7N9病毒株NA基因进化树Fig.2 Phylogenetic tree of the NA gene of human infection with avian influenza A (H7N9) virus in Zhaoqing, China, 2014-2016
2.4 重要氨基酸位点分子特征 以H3N2(A/Aichi/2/1968)氨基酸序列为基准对H7N9的HA基因编码的氨基酸位点进行分析[13],并以A/Guangdong/6/2013(H7N9)HA氨基酸序列为参照,ZQ01-07HA蛋白受体结合位点发生G186V、Q226L变异;HA蛋白裂解位点序列均为PEIPKGR↓GLF,含有2个碱性氨基酸(表3)。HA蛋白上第30、46、249、421、493位氨基酸上的糖基化位点分别为NGT、NAT、NDT、NWT、NNT,未发生糖基化位点缺失。NA蛋白柄部发生了69-73位的“QISNT”氨基酸删除;NA蛋白上分别在42、52、63、66、87、147、202上有7个潜在糖基化位点,分别表现为NCS、NTS、NET、NIT、NLT、NGT、NAS;未发现NA蛋白对达菲耐药的H274Y、R292K、N294S、E119V/G位点变异,未发现对扎那米韦耐药的E119A/D/G、Q136K/ L、I222R/K、D151A /E /G /V位点突变,也未发现对帕拉米韦耐药的R292K突变。M蛋白出现了对烷胺类耐药的S31N的突变;PB2蛋白均发生了E627K突变,提示对哺乳动物细胞亲和力增强。
表3 HA蛋白裂解位点和受体结合关键氨基酸位点
Tab.3 Amino acid sequence at the cleavage site and receptor-binding region of the HA protein
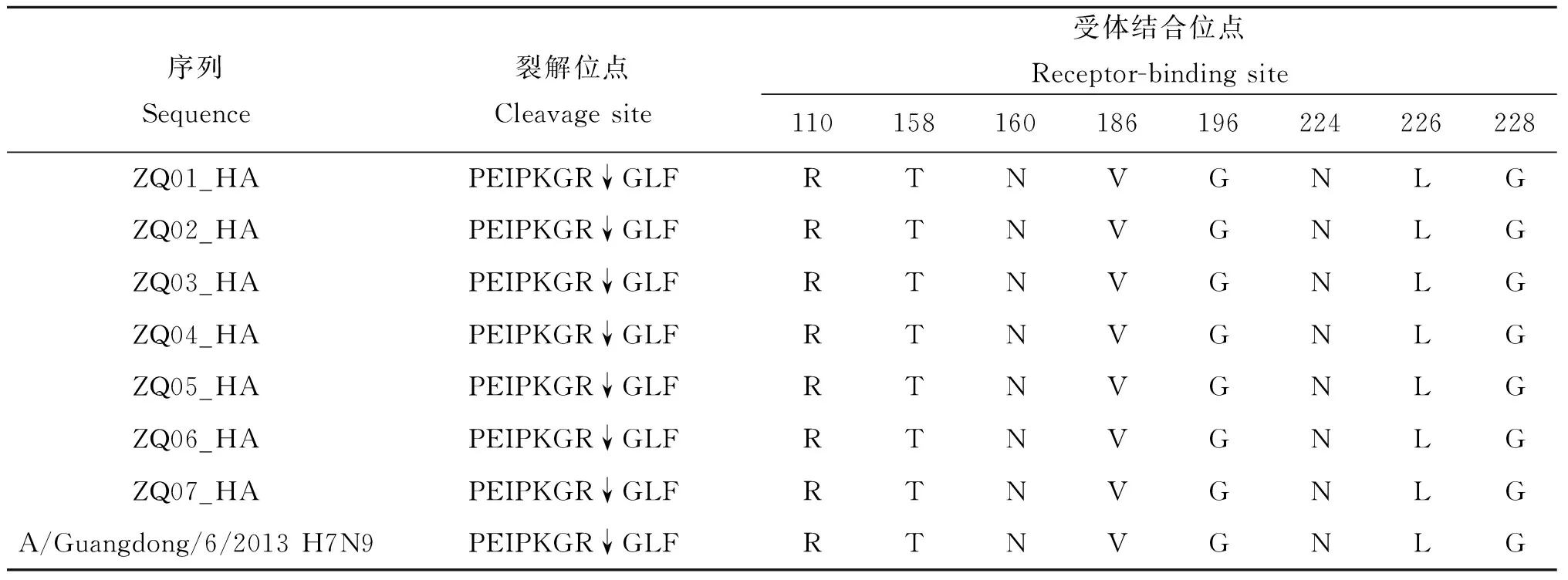
序列Sequence裂解位点Cleavagesite受体结合位点Receptor-bindingsite110158160186196224226228ZQ01_HAPEIPKGR↓GLFRTNVGNLGZQ02_HAPEIPKGR↓GLFRTNVGNLGZQ03_HAPEIPKGR↓GLFRTNVGNLGZQ04_HAPEIPKGR↓GLFRTNVGNLGZQ05_HAPEIPKGR↓GLFRTNVGNLGZQ06_HAPEIPKGR↓GLFRTNVGNLGZQ07_HAPEIPKGR↓GLFRTNVGNLGA/Guangdong/6/2013H7N9PEIPKGR↓GLFRTNVGNLG
3 讨 论
获取流感病毒基因组序列的传统方法常用Sanger法[14],近年来,高通量测序技术迅速发展和应用,可对核酸浓度较低的H7N9样本检测,并在短时间内快速获得大量有效数据[15]。本研究应用PathAmpTMFluA Reagents Kit对咽拭样本核酸直接扩增和Sanger法测序,核酸浓度较高的7份样本成功获得8个节段基因全序列。研究表明新型H7N9禽流感病毒为三源重组病毒,HA和NA最初来自于2011年浙江鸭中流行的H7N3和韩国野鸟中流行的H7N9,内部基因来自于两个不同源的H9N2[8,16]。在H7N9传播与进化过程中,H9N2为内部基因的重排提供了基本的骨架[17],并与邻近区域或本地的禽源H7N9病毒发生持续性重排,进化呈现区域差异[4]。本研究中的外部基因进化树结果显示,ZQ01-07病毒的HA和NA基因均在珠三角分支上进化,与广东东莞鸡中分离的H7N9病毒相似性最高,与长三角分支上安徽、浙江、江苏等地分离的H7N9病毒基因序列相似性低。推测肇庆的该7例病例被同样的传染源传染,可能是通过禽类贸易被广东东莞的鸡感染,也可能是和广东东莞鸡被同样的传染源传染。
肇庆市是广东省禽类养殖和消费大户,首例H7N9病例于2014年1月在怀集县发现时,当地活禽市场环境标本H7阳性率高达65. 0%,是人感染H7N9的高危场所。在之后2周的强化和应急监测中,该县区域共发现9例H7N9病例。其中病例3为病例2的密接者,两者共同生活并接触家中饲养的鸡,而其家庭环境及鸡样本检测出H7病毒,流行病学调查判断为家庭聚集疫情[18]。HA蛋白关键位点的变异与流感致病性、传播能力密切相关[19-21]。研究表明,当HA受体结合位点发生Q226L和G186V突变时,H7N9病毒对SAα-2,6Gal 的结合力增强,导致人感染概率大大增加[8,22];当HA蛋白裂解位点处有4个以上连续的碱性氨基酸时,病毒株具有高致病性[23];当HA蛋白出现158D/224K/226L、110Y/160A/226L/228S、196R/226L/228S三种突变组合中的一种,就能使H5N1禽流感病毒在上呼吸道有效增殖并通过飞沫在雪貂间传播[24]。ZQ01-07的HA受体结合位点均发生Q226L和G186V突变,HA蛋白裂解位点处氨基酸序列与广东、浙江、安徽等[9,25-26]地序列一样,均为PEIPKGR↓GLF,含有2个碱性氨基酸,对禽类是低致病性的,也未发现能使禽流感病毒在上呼吸道有效增殖并通过飞沫传播突变组合,提示该病毒尚未获得飞沫传播的充分条件,人传人可能性较小。ZQ01-02分别为病例2和3的毒株序列,HA序列分析结果进一步证明了病例2和3为共同暴露的家庭聚集疫情,而非人传人导致的。
2016年12月以来江、浙、粤等地人感染H7N9病例数迅猛增加,报告的病例数和疫情波及范围高于前几年同期水平,疫情形势严峻[27]。2017年1月,广东省疾控中心对2例人感染H7N9病例分离到的病毒株中发现血凝素链接肽位置发生了基因插入性突变,提示该病毒突变为对禽高致病性的病毒,检测结果已经国家流感中心复核确认[28]。值得注意的是,当中1例为本研究病例16的妹妹,43岁,曾照顾病例16,属于密切接触者,在其医学观察期间的2016年12月30日出现发热症状,即到广州市第八人民医院就诊,经广东省疾控中心确诊并发现其血凝素链接肽位置发生了基因插入性突变。而病例16曾接触病死禽类,遗憾的是病例16及其家禽环境样本的H7核酸浓度较弱,其血凝素链接肽位置是否发生了基因插入性突变,有待进一步研究。
[1] Jin Q. Molecular virology of medicine[M].Beijing: Science Press, 2001: 635-637. (in Chinese)
金奇. 医学分子病毒学[M]. 北京: 科学出版社, 2001: 635-637.
[2] Tong S, Zhu X, Li Y, et al, New World Bats harbor diverse influenza A viruses[J]. PLoS Pathog, 2015, 9(10): 1078-1084.
[3] Tong S, Li Y, Rivailler P, et al, A distinct lineage of influenza A virus from bats[J]. Proc Nat Acad Sci, 2012, 109(11): 4269-4274.
[4] Qi X, Tang FY. Biological characteristics and evolutionary trend for H7N9 avian influenza virus[J]. Jiangsu J Preventive Med, 2014, 25(2): 47-50. (in Chinese)
祁贤, 汤奋扬. H7N9禽流感病毒的生物学特征及进化趋势[J]. 江苏预防医学, 2014, 25(2): 47-50.
[5] Kawaoka Y, Krauss S, Webster RG. Avian-to-human transmission of the PB1 gene of influenza A viruses in the 1957 and 1968 pandemics[J]. J Virol, 1989, 63(11): 4603-4608.
[6] Vries ED, Guo H, Dai M, et al. Rapid emergence of highly pathogenic avian influenza subtypes from a subtype H5N1 hemagglutinin variant[J]. Emerg Infect Dis, 2015, 21(5): 842-846.
[7] Yu YF, Guo XL, Wang Y, et al. Analysis of molecular basis about pathogenicity of avian influenza A H7N9 virus to human[J]. J Sun Yat-sen Univ: Med Sci, 2013, 34(5): 657-665. (in Chinese)
于玉凤, 郭晓兰, 王颖, 等. H7N9禽流感病毒对人类致病的分子基础分析[J]. 中山大学学报(医学科学版), 2013, 34(5): 657-665.
[8] Gao R, Cao B, Hu Y, et al. Human infection with a novel avian-origin influenza A (H7N9) virus[J]. N Engl J Med, 2013, 368(20): 1888.
[9] Xie JF, Zhao L, Zhang YH, et al. Establishment of assay for amplifying and sequencing the complete genome of avian influenza virus A (H7N9)[J]. Chin J Zoonoses, 2015, 31(9): 795-799. (in Chinese)
谢剑锋, 赵琳, 张炎华, 等. 人感染H7N9禽流感病毒全基因组扩增与测序方法的建立[J]. 中国人兽共患病学报, 2015, 31(9): 795-799.
[10] Chen Y, Mao HY, Li Z, et al. Genomic sequences of human infection of avian-origin influenza A (H7N9) virus in Zhejiang province[J]. Chin J Epidemiol, 2013, 34(6): 604-608. (in Chinese)
陈寅, 茅海燕, 李榛, 等. 浙江省人感染H7N9禽流感病毒的基因组序列分析[J]. 中华流行病学杂志, 2013, 34(6): 604-608.
[11] Wu J, Lu J, Faria NR, et al. Effect of live poultry market interventions on influenza A(H7N9) virus, Guangdong, China[J]. Emerg Infect Dis, 2016, 22(12): 2104-2112.
[12] Wu J, Lau EH, Xing Q, et al. Seasonality of avian influenza A(H7N9) activity and risk of human A(H7N9) infections from live poultry markets[J]. J Infect, 2015, 12(6): 690-693.
[13] Ha Y, Stevens DJ, Skehel JJ, et al. X-ray structure of the hemagglutinin of a potential H3 avian progenitor of the 1968 Hong Kong pandemic influenza virus[J]. Virology, 2003, 309(2): 209-218.
[14] Hoffmann E, Stech J, Guan Y, et al. Universal primer set for the full-length amplification of all influenza A viruses[J]. Arch Virol, 2001, 146(12): 2275-2289.
[15] Pei GQ, Fan H, An XP, et al. Detection of avian influenza A(H7N9) virus by high through put sequencing and genomic sequence analysis[J]. Acta Universitatis Medicinalis Anhui, 2014, 49(8): 1033-1038. (in Chinese)
裴广倩, 范航, 安小平, 等. 利用高通量测序快速检测H7N9禽流感病毒及基因组序列分析[J]. 安徽医科大学学报, 2014, 49(8): 1033-1038.
[16] Lam TY, Wang J, Shen Y, et al, The genesis and source of the H7N9 influenza viruses causing human infections in China[J]. Nature, 2013, 502(7470): 241-244.
[17] Zou LR, Mao XX, Wu J, et al. Investigation on the environmental pollution status of avian influenza virus in live poultry market in Guangdong province during 2012-2015[J]. Acta Laser Biology Sinica, 2016, 25(3): 277-282. (in Chinese)
邹丽容, 毛小晓, 武婕, 等. 2012-2015年广东省活禽市场外环境禽流感病毒污染状况研究[J]. 激光生物学报, 2016, 25(3): 276-282.
[18] Zhu BL, Mai W, Deng H, et al. Epidemiology of human infection with avian influenza A (H7N9) virus in Huaiji, Guangdong[J]. Dis Surveill, 2014, 29(9): 696-699. (in Chinese)
朱碧柳, 麦炜, 邓鸿, 等. 广东省肇庆市怀集县人感染H7N9禽流感流行特征分析[J]. 疾病监测, 2014, 29(9): 696-699.
[19] Kaverin NV, Rudneva IA, Ilyushina NA, et al. Structure of antigenic sites on the haemagglutinin molecule of H5 avian influenza virus and phenotypic variation of escape mutants[J]. J General Virol, 2002, 83(Pt 10): 169-179.
[20] Sun S, Wang Q, Zhao F, et al. Glycosylation site alteration in the evolution of influenza A (H1N1) viruses[J]. PLoS One, 2010, 6(6): e22844.
[21] Guo XL, Si LL, Guan DW, et al. Whole genome sequencing and analysis of molecular characteristics of the two avian influenza A H7N9 viruses[J]. J Sun Yat-Sen Univ: Med Sci, 2015, 36(2): 167-175. (in Chinese)
郭晓兰, 司露露, 管大伟, 等. 两株人H7N9禽流感病毒的全基因组测序及分子特征分析[J]. 中山大学学报医学科学版, 2015, 36(2): 167-175.
[22] Dortmans JCFM, Dekkers J, Wickramasinghe INA, et al. Adaptation of novel H7N9 influenza A virus to human receptors[J]. Scientific Reports, 2013, 3(10): 3058-3058.
[23] Jr SA, Matsuoka Y, Lau YF, et al. The multibasic cleavage site of the hemagglutinin of highly pathogenic A/Vietnam/1203/2004 (H5N1) avian influenza virus acts as a virulence factor in a host-specific manner in mammals[J]. J Virol, 2012, 86(5): 2706-2714.
[24] Russell CA, Fonville JM, Brown AE, et al. The potential for respiratory droplet-transmissible A/H5N1 influenza virus to evolve in a mammalian host[J]. Science, 2012, 336(6088): 1541-1547.
[25] Wang XG, Lei YL, Ye BF, et al. Sequencing of genome of avian influenza A (H7N9) virus isolated from human infection cases in Lishui, Zhejiang, 2014[J]. Dis Surveill, 2016, 31(2): 106-110. (in Chinese)
王晓光, 雷永良, 叶碧峰, 等. 2014年浙江省丽水市人感染H7N9禽流感病毒分离株基因特征分析[J]. 疾病监测, 2016, 31(2): 106-110.
[26] He J, Hu WF, Li FR, et al. Characterization of avian influenza virus A (H7N9) genome in Anhui Province, China[J]. Chin J Zoonoses, 2014, 30(9): 913-918. (in Chinese)
何军, 胡万富, 李芙蓉, 等. 安徽省人感染H7N9禽流感病毒基因组特征分析[J].中国人兽共患病学报, 2014, 30(9): 913-918.
[27] Chinese Center for Disease Control and Prevention. Chinese center for disease control and prevention held a national video conference for epidemic of human infection with avian influenza A (H7N9)[J]. Dis Surveill, 2017, 32(1): 56-65. (in Chinese)
中国疾病预防控制中心召开全国人感染H7N9禽流感疫情视频会商会[J]. 疾病监测, 2017, 32(1): 56-65.
[28] Chinese Center for Disease Control and Prevention. H7N9 mutated virus strains were found in human cases from China[EB/OL]. (2017-02-19)[2017-03-01]. http: //www, chinacdc, cn/yw_9324/201702/t20170219_138185, html. (in Chinese)
中国疾病预防控制中心. 我国从人感染病例中发现H7N9病毒变异株 [EB/OL].(2017-02-19)[2017-03-01]. http: //www,chinacdc,cn/yw_9324/201702/t20170219_138185, html.
收稿日期:2017-01-25 编辑:林丹
Genomic characterization of avian influenza A(H7N9) virus in Zhaoqing, China, 2014-2016
TAN Han-qing1, CHENG Jie-ping1, TAN Hai-fang1, ZHU Ying-mei1, LIN Feng1, LIANG Xiao-qing2, CHEN Jie2, MAI Wei1
(1.ZhaoqingPrefectureCenterforDiseaseControlandPrevention,Zhaoqing526060,China;2.TheFirstPeople’sHospitalofZhaoqing,Zhaoqing526000,China)
We analyzed genetic evolution characteristics of avian influenza A (H7N9) virus isolated in Zhaoqing, China, 2014-2016. Nucleic acid were extracted and sequenced from 17 samples of H7N9 positive cases in Zhaoqing. Genetic characteristics of homology and important amino acid sites were analyzed by using BioEdit5.0 and MEGA6.0. The evolutionary trees were constructed by Neighbor-Joining and the referenced sequences were downloaded from GenBank. Eight nucleic acid fragments from 7 strains of H7N9 viruses were successfully generated. The highest homology was found in HA gene with A/chicken/Dongguan/695/2014(H7N9), and NA gene with A/chicken/Dongguan/1075/2014(H7N9). The internal genes were high homology with avian H7N9 and H9N2 virus from Dongguan and Shenzhen in Guangdong, China. The HA and NA genes were directly evolved in the Pearl River Delta evolution branch with the H7N9 sequences from the cities of Dongguan, Guangzhou and Shenzhen, while the sequences from the provinces of Anhui, Zhejiang, and Jiangsu were in the Yangtze River Delta evolution branch. There were 2 alkaline amino acids in cleavage site of HA, 2 mutations (G186V and Q226L) in the crucial sites related with the receptor of HA protein, 1 mutation (E627K) in PB2 protein, and 1 drug resistance mutation (S31N) in M2 protein. And no evidence of neuraminidase resistance in NA protein was found. In conclusion, the H7N9 virus for human infection in Zhaoqing may originate from avian H7N9 and H9N2 viruses, which circulated in the Pearl River Delta region of Guangdong from 2013 to 2014. The mutations of G186V, Q226L and E627K might be related with high susceptibility to human beings.
human infection with avian influenza A(H7N9) virus; hemagglutinin gene; neuraminidase gene; sequence analysis Funded by the Medical Science and Technology Research Foundation of Guangdong Province (No. A2015573) and the Zhaoqing Science and Technology Innovation Project (No. 2015E1810)
2017-03-20 编辑:林丹
10.3969/j.issn.1002-2694.2017.03.003
1.广东省肇庆市疾病预防控制中心,肇庆 526060; 2.广东省肇庆市第一人民医院,肇庆 526000
Email:tanhaqing2000@163.com
R373.1
A
1002-2694(2017)03-0202-06
广东省医学科学技术研究基金(No.A2015573)和肇庆市科技创新项目(No.2015E1810)联合资助
