杭州地区单核细胞增生李斯特菌食品分离株分子型别研究
2017-04-19潘劲草汪皓秋斯国静楼秀芹
俞 骅,潘劲草,汪皓秋,斯国静,刘 涛,楼秀芹,张 蔚,严 杰
杭州地区单核细胞增生李斯特菌食品分离株分子型别研究
俞 骅1, 2,潘劲草2,汪皓秋2,斯国静2,刘 涛2,楼秀芹2,张 蔚2,严 杰1
目的 研究杭州地区单核细胞增生李斯特菌(Listeriamonocytogenes)食品分离株的分子分型情况,了解当地流行株的型别特征。方法 用脉冲场凝胶电泳(PFGE)和多位点序列分型(MLST)的方法对单核细胞增生李斯特菌进行分子分型。PFGE结果进行聚类分析,并绘制MLST数据的最小生成树。结果 6个血清型组成的133株杭州食品分离株共获得19个MLST型别,并发现1个新的ST型ST767。ST9和ST121是数量最多的型别。用AscI和ApaI酶切分别获得33和45个PFGE带型。结论 杭州地区单核细胞增生李斯特菌食品分离株分子型别分布广泛,大部分菌株是可引起人李斯特菌病的Lineage I和Lineage II菌株。食品中单核细胞增生李斯特菌的污染比较严重,应加强监测与管理以防食源性疾病的发生。
单核细胞增生李斯特菌;多位点序列分型;脉冲场凝胶电泳
单核细胞增生李斯特菌(Listeriamonocytogenes)是一种革兰氏染色阳性短杆菌,是最常见的食源性致病菌,该病原引起人类和动物的疾病统称为李斯特菌病,其主要病症有脑膜炎,菌血症以及孕妇流产等[1]。李斯特菌病发病的高危人群是儿童,老年人以及免疫力低下或缺陷的人群,致死率可以达到20%~30%[2]。
近年来欧美发达国家连续发生了多起单核细胞增生李斯特菌感染暴发事件[2-3],而我国食品中单核细胞增生李斯特菌分离率一直处于较高的水平,但主要是散发的孕妇流产病例[4],目前国内还没有李斯特菌病暴发的报道。由于李斯特菌病不是法定报告传染病,临床病例关注度不高;并且李斯特菌病潜伏期长,且与一般的食源性疾病引起的症状不同,很容易被忽视,病原菌较难开展进一步的追踪溯源。
血清分型和噬菌体分型技术是最常见的细菌表型分型的方法,但单核细胞增生李斯特菌的表型分型方法较为不敏感,操作复杂,因此常用分子分型的方法对菌株溯源。脉冲场凝胶电泳(Pulsed-field gel electrophoresis, PFGE)是做为细菌分子分型的金标准,用于菌株在暴发事件中的聚类关系界定。多位点序列分型(Multi-locus sequence typing, MLST)通过对管家基因建立等位基因图谱的方式来分型,用于种群分析和分子流行病学的研究。本文采用PFGE和MLST方法对近年来杭州地区单核细胞增生李斯特菌食品分离株的型别特征进行分析,建立本地单核细胞增生李斯特菌食品分离株的分子型别数据库,有助于病原菌的追踪溯源。
1 材料和方法
1.1 菌株及来源 收集2003-2016年杭州地区133株分离自食品的单核细胞增生李斯特菌株。分离时间及食品类别见表1。实验采用的单核细胞增生李斯特菌株标准菌株CMCC 54007购自中国药品生物制品检定所。脉冲场凝胶电泳所用Marker标准菌株为沙门氏菌H9812由中国疾病预防控制中心提供。限制性内切酶AscI和ApaI购自New England Biolabs 公司;Ex-Taq酶,限制性内切酶XbaI和蛋白配K购自上海生工生物工程有限公司;溶菌酶购自Merck公司;核酸提取试剂盒Qiagen DNA mini Kit购自QIAGEN公司。
表1 133株单核细胞增生李斯特菌株信息
Tab.1 Information of 133 isolates ofListeriamonocytogenesinvestigated in this study

食品种类Food年份Year生禽肉Rawpoultry生畜肉Rawmeat熟肉制品Cookedmeatproducts即食凉拌菜Instantcolddishes生食水产品Freshaquaticproducts预加工肉制品Processedmeatproducts其他Others菌株数No.ofstrains20031562005112221182007104111620084112820092932111192010222620115117201255201321320141231221212015332421420164211210Total4732091188133
1.2 PFGE分型 PFGE实验依照PulseNet International的操作手册进行[5]。PFGE电泳图谱用BioNumerics v6.6软件进行分析。采用UPGMA方法和Dice系数来绘制聚类图,条带位置的差异容许度(Tolerance)设置1.5%,优化值(Optimization)设置1.5%,分别绘制菌株采用AscI和ApaI酶切的带型关系图谱。
1.3 MLST分型 菌株核酸提取,PCR引物和扩增反应条件参见文献[6]。PCR扩增产物送至上海生工生物工程有限公司进行测序。测序结果用BioNumerics v6.6 软件进行拼接分析,获得各菌株的ST型别。为构建单核细胞增生李斯特菌种群结构,将Institute Pasteur MLST Databases网站的数据库的数据导入BioNumerics,绘制MLST最小生成树图(Minimum Spanning Tree, MSTree)。
2 结 果
2.1 PFGE分型结果 133株单核细胞增生李斯特菌用AscI酶切产生约10-12条带,片段长度25 kb-1 000 kb,共获得33个PFGE带型;131株单核细胞增生李斯特菌(2株酶切降解)用ApaI酶切产生约13-15条带,片段长度25 kb-480 kb,共获得45个PFGE带型。PFGE结果散在分布,未见与分离时间或分离食品类别相关的聚类关系。AscI和ApaI酶切的不同PFGE带型的聚类关系见图1、2。
2.2 MLST分型结果 133株单核细胞增生李斯特菌共分成19个ST型(参见图3),ST9(1/2a)和ST121(1/2c)是分离数最多的型别。根据等位基因的关系,引起人类和动物李斯特菌病的菌株谱系(Lineage)主要为Lineage I和Lineage II型,也是杭州地区食品分离株的主要型别。实验发现1个新型别ST767,该型别与本地分离数最多的ST9型仅在等位基因abcZ有差异,属于同一个克隆系(Clonal Complex)。本地分离株在MLST数据库最小生成树的型别分布见图3,本地分离株的最小生成树见图4。
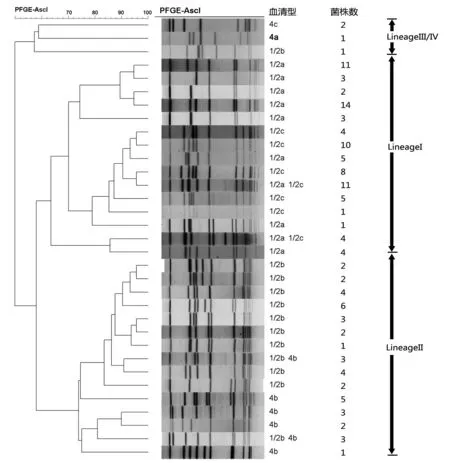
图1 133株单核细胞增生李斯特菌AscI酶切图谱聚类分析Fig.1 PFGE cluster analysis on 133 Listeria monocytogenes by AscI

图2 131株单核细胞增生李斯特菌ApaI酶切图谱聚类分析Fig.2 PFGE cluster analysis on 133 Listeria monocytogenes by ApaI
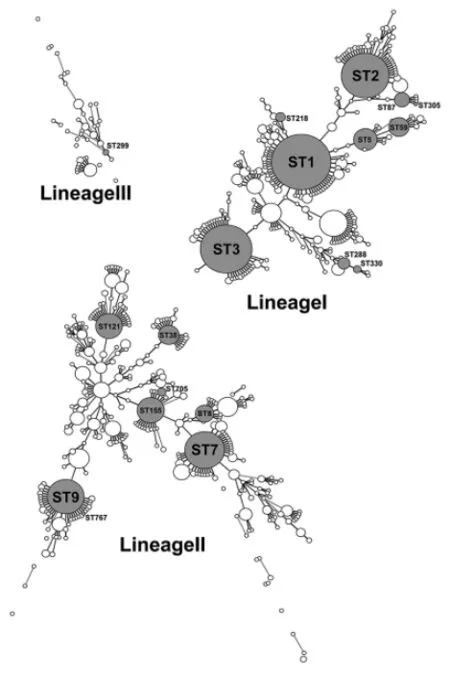
实心圆点表示杭州本地食品分离株的型别
Solid dots are localListeriamonocytogenesisolates MLST types.
图3 单核细胞增生李斯特菌MLST数据库的最小生成树图
Fig.3 Minimum spanning tree forListeriamonocytogenesMLST database isolates
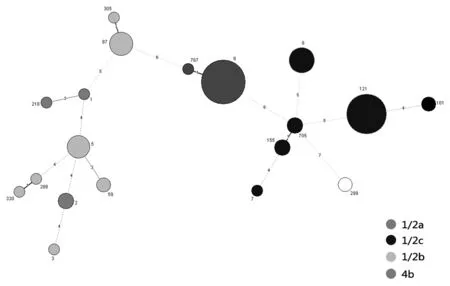
圆点大小表示菌株数,圆点周围数字表示MLST型别,线条中数字代表等位基因的差异数
The dots sizes indicate strain number, the numbers outside dots indicate MLST type, and the number in the lines means the number of different genes.
图4 133株本地分离株的最小生成树
Fig.4 Minimum spanning tree for 133Listeriamonocytogeneslocal isolates
3 讨 论
近年来,西方发达国家发生了多起由单核细胞增生李斯特菌引起的食源性疾病暴发事件[7-9]。De Noordhout CM[10]通过对全球李斯特菌病meta数据分析评估,认为李斯特菌病能引起较高的致死和致残率。随着国内经济不断发展,交通逐渐便利,人民的生活水平日益提高,日常的饮食习惯和结构与西方发达国家越来越接近,我们应更加关注单核细胞增生李斯特菌食源性感染的风险。
单核细胞增生李斯特菌引起人和动物李斯特菌病暴发的血清型主要是1/2a,1/2b和4b[11]。免疫缺陷或免疫低下者是李斯特菌病易感人群,但目前其致病机制尚不完全清楚。研究发现单核细胞增生李斯特菌食品分离株的常见毒力基因检出率超过98%[12-13],因此菌株毒力基因的携带与否和菌株致病性没有直接关联。
PFGE结果显示ApaI酶切能获得更多的带型数,但存在部分血清型单核细胞增生李斯特菌均无法获得带型的情况,这在Brosch R[14]和Nevesa E[15]等人的研究中也报道过。AscI酶切条带数少,但是条带分布均匀,更容易识别。本实验的单核细胞增生李斯特菌菌株的PFGE聚类关系可以分成3个组,分别为Lineage I,Lineage II和Lineage III/IV。ApaI酶切带型中Lineage II的菌株可以分为5个聚类(以80%为界限),而AscI酶切的带型则差异明显小于ApaI酶切,只有3个聚类。对于Lineage I型的菌株,ApaI和AscI酶切的带型分类差异不明显,可能与菌株数量与地区分布等因素有关。在不同年份均可分离得到主要PFGE带型的菌株,说明该型别菌株是本地流行株。PFGE型别显示不同带型的菌株与食品样品种类和食品采集时间关系不明显,同一采样地点采集的不同种类样品出现聚类的现象提示样品污染来源很可能与后期包装,运输,储存和销售等环节有关。
通过构建Pasteur公共数据库的MLST 最小生成树,对照Wang Y等[16]对中国单核细胞增生李斯特菌食品分离株的研究,结果显示杭州分离株与国内其他地区分离株的ST型别基本一致。比较刘萍萍等[17]的研究,结果显示上海动物源性单核细胞增生李斯特菌分离株MLST型别在杭州食品分离株中均可分离得到,提示这些型别的单核细胞增生李斯特菌可能为国内的主要流行株。本实验也发现1个属于Lineage II的新型别ST767与ST9只在abcZ基因(ST767:12;ST9:6)有差异。但在该基因序列上这2个等位基因位点相差了10个碱基,有可能是遗传上发生1次重组事件产生的新型别。而abcZ:12这个等位基因只出现在除ST312的Lineage I的型別中(ST8, ST88, ST156, ST296,ST310, ST594, ST612, ST619, ST730, ST767),而同属Lineage II的型別ST312的菌株也是分离自中国,提示这种重组事件可能是在中国发生的。杭州地区食品分离株的ST型別除ST299为Lineage III型外,其他均为Lineage I/II型菌。而2株ST299菌株均为分离自三文鱼中,从食品的来源看可能为国外输入性菌株。
杭州本地流行株主要分布在图3最小生成树拓扑结构中的节点位置,这些型别的菌株在国际上也是主要流行株[18],如ST1,ST3,ST121等引起的食源性疾病暴发[19-21]。而国内李斯特菌病的散发病例也主要由这些型別引起[22]。但同时也存在ST9流行株衍生出的ST767本地变异株。
通过比对本地食品分离株的PFGE带型和引起欧美国家食物中毒暴发的血清型为1/2b,4b菌株的带型,结果显示带型并不一致。但我们仍应高度重视食品中单核细胞增生李斯特菌的污染状况,加强销售终端在运输和储存环节上的管理。同时加强李斯特菌病的重视程度,寻找临床分离株和食品分离株的溯源关系,才能使单核细胞增生李斯特菌分子分型数据库更有应用意义。
(致谢:我们对于单核细胞增生李斯特菌MLST数据库的维护者Institut Pasteur (Paris, France) 提供的MLST数据以及对新数据的提交和审核表示感谢。)
[1] McLauchlin J, Mitchell RT, Smerdon WJ, et al.Listeriamonocytogenesand listeriosis: a review of hazard characterisation for use in microbiological risk assessment of foods[J]. Int J Food Microbiol, 2004, 92(1): 15-33.
[2] Dalton CB, Austin CC, Sobel J, et al. An outbreak of gastroenteritis and fever due toListeriamonocytogenesin milk[J]. N Engl J Med, 1997, 336(2): 100-105.
[3] Allerberger F, Wagner M. Listeriosis: a resurgent foodborne infection[J]. Clin Microbiol Infect, 2010, 16(1): 16-23.
[4] Feng YF, Ran L, Zhang LS. Listeriosis cases reported in medical literatures in China, 2000-2009[J]. Dis Surveillance, 2011, 26(8): 654-659. (in Chinese)
冯延芳, 冉陆, 张立实. 2000-2009年中国李斯特菌病文献报告病例分析[J]. 疾病监测, 2011, 26(8): 654-659.
[5] Halpin JL, Garrett NM, Cooper KL, et al. Re-evaluation, optimization, and multilaboratory validation of the PulseNet-standardized pulsed-field gel electrophoresis protocol forListeriamonocytogenes[J]. Foodborne Pathog Dis, 2010, 7(3): 293-298.
[6] Stessl B,Rückerl I,Wagner M. Multilocus Sequence Typing (MLST) ofListeriamonocytogenes[J]. Methods Mol Biol,2014, 1157: 73-83.
[7] Swaminathan B, Gerner-Smidt P. The epidemiology of human listeriosis[J]. Mocrobes Infect, 2007, 9(10): 1236-1243.
[8] Heiman KE, Garalde VB, Gronostaj M, et al. Multistate outbreak of listeriosis caused by imported cheese and evidence of cross contamination of other cheese, USA, 2012[J]. Epidemiol Infect, 2016, 144(13): 2698-2708.
[9] Che Y, Burall LS, Luo Y, et al.Listeriamonocytogenesin stone fruits linked to a multistate outbreak: enumeration of cells and whole-genome sequencing[J]. Appl Environ Microbiol, 2016, 82(24): 7030-7040.
[10] De Noordhout CM, Devleesschauwer B, Angulo FJ, et al. The global burden of listeriosis: a systematic review and meta-analysis[J]. Lancet Infect Dis, 2014, 14(11): 1073-1082.
[11] Borucki MK, Call DR.Listeriamonocytogenesserotype identification by PCR[J]. J Clin Microbiol, 2003, 41(12): 5537-5540.
[12] He C, Wang Y, Wang TS, et al. Distribution of virulence-related genes of selectedListeriamonocytogenesstrains isolated from food samples in China[J]. Dis Surveillance, 2013, 28(5): 384-388. (in Chinese)
贺春, 王艳, 王天姝,等. 中国部分食品来源单增李斯特菌中致病相关基因的分布研究[J]. 疾病监测, 2013, 28(5): 384-388.
[13] Camejo A, Carvalho F, Reis O, et al. The arsenal of virulence factors deployed byListeriamonocytogenesto promote its cell infection cycle[J]. Virulence, 2011, 2(5): 379-394.
[14] Brosch R, Chen J, Luchansky JB, et al. Pulsed-field fingerprinting ofListeriae: identification of genomic divisions forListeriamonocytogenesand their correlation with serovars[J]. Appl Environ Microbiol, 1994, 60(7): 2584-2592.
[15] Nevesa E, Lourenc A, Silva AC, et al. Pulsed-field gel electrophoresis (PFGE) analysis ofListeriamonocytogenesisolates from different sources and geographical origins and representative of the twelve serovars[J]. Syst Appl Microbiol, 2008, 31(5): 387-392.
[16] Wang Y, Zhao A, Zhu R, et al. Genetic diversity and molecular typing ofListeriamonocytogenesin China[J]. BMC Microbiol, 2012, 12: 119-127.
[17] Liu PP,Wang SP,Zhao HQ,et al.Multilocus sequence typing ofListeriamonocytogenesform animal foods in Shanghai[J]. Chin J Anim Infect Dis, 2013, 21(4): 18-22. (in Chinese)
刘萍萍,王少辉,赵华秋,等. 上海市动物源性食品中单增李斯特菌的MLST分析[J].中国动物传染病学报, 2013, 21(4): 18-22.
[18] Chenal-Francisque V, Lopez J, Cantinelli T, et al. Worldwide distribution of major clones ofListeriamonocytogenes[J]. Emerg Infect Dis, 2011, 17(6): 1110-1112.
[19] Nyarko EB, Donnelly CW.Listeriamonocytogenes: strain heterogeneity, methods, and challenges of subtyping[J]. J Food Sci, 2015, 80(12): 2868-2878.
[20] Dreyer M,Aguilar-Bultet L,Rupp S, et al.Listeriamonocytogenessequence type 1 is predominant in ruminant rhombencephalitis[J]. Sci Rep, 2016, 6: 36419.
[21] Schmitz-Esser S,Müller A,Stessl B, et al. Genomes of sequence type 121Listeriamonocytogenesstrains harbor highly conserved plasmids and prophages[J]. Front Microbiol, 2015, 6: 380.
[22] Lv J, Qin Z, Xu Y, et al.Listeriainfection in Chinese pregnant women and neonates from Shandong[J]. Int J Clin Exp Med, 2014, 7(9): 2730-2734.
欢迎在本刊惠登广告
联系电话:0591-87552018 传真:0591-87563582
Molecular characteristics ofListeriamonocytogenesfoodborne
isolates in Hangzhou, China
YU Hua1,2, PAN Jing-cao2, WANG Hao-qiu2, SI Guo-jing2, LIU Tao2, LOU Xiu-qin2, ZHANG Wei2, YAN Jie1
(1.DepartmentofMedicalMicrobiologyandParasitology,SchoolofMedicine,ZhejiangUniversity,Hangzhou310058,China; 2.HangzhouCenterforDiseaseControlandPrevention,Hangzhou310026,China)
We determined molecular characteristics ofListeriamonocytogenesfoodborne isolates in Hangzhou and investigated the characterization of local strains. Multi-locus sequence typing(MLST) and pulsed-field gel electrophoresis(PFGE) were applied to identify molecular types ofListeriamonocytogenesisolates. Results showed that a total of 133 strains of 6 serotypes were divided into 19 MLST types including a new type ST767. ST9 and ST121 were the major ST types. There were 33 and 45 PFGE patterns characterized byAscI andApaI. The molecular types ofListeriamonocytogenesstrains were widely distributed in Hangzhou. It is indicated that the major clusters were Lineage I and Lineage II which will cause listeriosis. The contamination ofListeriamonocytogenesin food is serious in Hangzhou and the surveillance and management should be strengthened to prevent the food borne diseases.
Listeriamonocytogenes; multi-locus sequence typing; pulsed field gel electrophoresis Supported by the Zhejiang Provincial Medical and Health Science and Technology Program (No. 2015123381) Corresponding author: Yan Jie, Email: med_bp@zju.edu.cn
10.3969/j.issn.1002-2694.2017.03.014
严杰,Email: med_bp@zju.edu.cn
1.浙江大学医学院病原生物学系,杭州 310058; 2.杭州市疾病预防控制中心,杭州 310026
R378
A
1002-2694(2017)03-0264-07
2016-12-31 编辑:林丹
浙江省医药卫生科技计划项目(No. 2015123381)
