核磁共振氢谱检测糖尿病不同发病阶段额叶和枕叶的代谢变化
2017-03-29王丹郑涌泉赵良才郑宏高红昌张华杰
王丹,郑涌泉,赵良才,郑宏,高红昌,张华杰
(1.温州医科大学 药学院,浙江 温州 325035;2.浙江大学医学院附属妇产科医院 药剂科,浙江杭州 310006)
核磁共振氢谱检测糖尿病不同发病阶段额叶和枕叶的代谢变化
王丹1,郑涌泉2,赵良才1,郑宏1,高红昌1,张华杰1
(1.温州医科大学 药学院,浙江 温州 325035;2.浙江大学医学院附属妇产科医院 药剂科,浙江杭州 310006)
目的:运用基于核磁共振氢谱(1H NMR)的代谢组学方法分析1型糖尿病大鼠不同发病阶段额叶和枕叶2个脑区的代谢变化。方法:取正常大鼠(n=22)和链脲佐菌素(STZ)诱导的糖尿病大鼠发病1周(n=8)、5周(n=7)、9周(n=7)的额叶和枕叶组织进行1H NMR检测,并结合多元模式识别和代谢物定量分析阐述代谢特征。结果:糖尿病发病各个时期,额叶和枕叶的代谢模式均发生显著改变。与正常大鼠相比,代谢物乳酸(Lac)、牛磺酸(Tau)、肌醇(m-Ins)含量随着糖尿病的发展明显升高;而N-乙酰天冬氨酸(NAA)、天冬氨酸(Asp)、琥珀酸(Suc)等的含量显著降低。结论:额叶和枕叶的代谢变化相似,且均发生于糖尿病早期,主要涉及能量代谢紊乱、谷氨酸-谷氨酰胺-γ-氨基丁酸(Glu-Gln-GABA)循环抑制、渗透压调节增强。
糖尿病;能量代谢;额叶;枕叶;核磁共振氢谱;大鼠
糖尿病引起的中枢神经系统损伤日益受到关注[1]。糖尿病会导致脑萎缩和白质损伤,临床上,脑萎缩和白质损伤通常被认为是糖尿病患者认知功能障碍的病理学基础[2]。而糖尿病患者脑内额叶和枕叶萎缩与注意力下降和记忆力损伤密切相关[3]。然而,导致糖尿病脑损伤的发病机制目前仍不明确。
基于核磁共振的代谢组学技术在生命科学领域拥有重要地位和强大优势[4-8]。本研究利用基于核磁共振氢谱(1H NMR)的代谢组学方法分析1型糖尿病大鼠不同发病阶段额叶和枕叶2个脑区的代谢变化,找出具有时间依赖性和脑区特异性的特征代谢物和代谢途径,为阐明糖尿病患者注意力和记忆力发生障碍的潜在发病机制提供线索。
1 材料和方法
1.1 仪器、试剂与动物 Bruker AVANCE I I I 600核磁共振谱仪(德国Bruker公司);血糖试纸及血糖仪(德国贝朗医疗国际贸易有限公司);冷冻干燥机(ALPHA-4,德国Christ公司)。链脲佐菌素(streptozocin,STZ)购自美国Sigma-Aldrich公司;重水(D2O,99.9%)购于英国剑桥同位素实验室;柠檬酸、柠檬酸钠、甲醇、氯仿购于上海国药集团化学试剂有限公司。Sprague-Dawley(SD)大鼠44只,购于上海斯莱克实验动物有限责任公司动物合格证号:SCXK(沪)2012-0002,饲养在温州医科大学实验动物中心SPF级动物房,并通过实验动物伦理学委员会批准。
1.2 方法
1.2.1 1型糖尿病模型的建立:大鼠适应性饲养1周后,随机分为2组,即糖尿病组和对照组,各22只。大鼠禁食12 h后,糖尿病组腹腔注射STZ柠檬酸钠混悬溶液(70 mg/kg,现配现用),72 h后测其血糖水平,空腹血糖值大于16.7 mmol/L的大鼠为造模成功的糖尿病大鼠。对照组注射同等剂量的柠檬酸钠混悬溶液(0.1 mol/L,pH=4.5)。
1.2.2 脑组织(额叶和枕叶)样本的收集和处理:大鼠在STZ诱导1周(n=8)、5周(n=7)、9周(n=7)后断头处死,快速分离出额叶和枕叶,并将收集的脑组织样本迅速浸入液氮中急冻,置于-80 ℃保存。冰冻的脑组织样本称重后,置于匀浆管中,加入冰甲醇4 mL/g,蒸馏水0.85 mL/g,使用手持式组织匀浆机匀浆,涡漩15 s;再加入2 mL/g氯仿,涡漩;最后分别加入2 mL/g冰氯仿和冰蒸馏水,涡漩后于冰上静置15 min。于1 000×g 4 ℃条件下离心15 min,取上层水溶性代谢物。冻干24 h,得到代谢物粉末。最后将粉末重新溶解于500 μL D2O中,离心(12 000×g,10 min,4 ℃),上清液转入NMR样品管中进行测试。
1.2.3 脑组织提取物的1H NMR检测及数据处理:于600 MHz NMR波谱仪上进行NMR采集实验,探头温度控制为25 ℃,累加采样256次,采样点数64 K,谱宽为12 000 Hz,弛豫延迟10 s。将采得的时域信号进行傅立叶变换后,使用Topspin 2.1软件对所有的1H NMR谱图进行相位校正、基线调整,并以乳酸的甲基峰的化学位移(1.33 ppm)定标[9]。所有谱图用MATLAB软件(R2012a,美国MathWorks公司)进行对齐处理[10]。将1H NMR谱从δ0.1~10.0 ppm按0.01 ppm为单位进行自动分段积分,为了消除预饱和压水峰时引起的谱线扭曲,将δ5.16~4.70 ppm的水峰区域设为0积分段。对每一段积分值都相对于该谱的所有积分值进行归一化,然后将数据导入SIMCA-P+12.0软件(瑞典Umetrics公司)进行偏最小二乘判别分析(partial least-squares discriminant analysis,PLS-DA)。所得得分图是以第一和第二主成分作为x,y坐标轴构建的二维空间,该空间中每一个点代表一个样本,图中椭圆区域代表95%的置信区间。由PLS-DA得到的轨迹图中,一个点代表各组某一个时间点的代谢轮廓。相应的彩色相关系数载荷图(correlation coefficient color-coded loadings plot)上,横坐标代表化学位移,纵坐标代表相关系数|r|值(0~1.0),表示各代谢物对组间分离的贡献,|r|越大,即图中峰颜色越偏向于暖色调,对组间分离的贡献越大。
1.3 统计学处理方法 应用SPSS13.0统计软件进行统计学处理,结果以±s表示,2组间比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 糖尿病发病不同时期的额叶和枕叶1H NMR谱及代谢模式分析 脑组织提取物的1H NMR波谱可以同时测量多种内源性代谢物,图1和图2分别为额叶和枕叶提取物的典型1D1H NMR谱,基于实验室前期已发表的研究成果[6,11]及2D1H-1H COSY和TOCSY谱图验证,归属代谢物有乳酸(Lac,δ1.33,δ4.11)、丙氨酸(Ala,δ1.47)、N-乙酰天冬氨酸(NAA,δ2.01,δ4.39),γ-氨基丁酸(GABA,δ1.90,δ2.29)、谷氨酸(Glu,δ2.35,δ3.75)、琥珀酸(Suc,δ2.40)、谷氨酰胺(Gln,δ2.45,δ3.75)、天冬氨酸(Asp,δ2.82)、肌酸(Cre,δ3.03,δ3.93)、胆碱(Cho,δ3.20)、牛磺酸(Tau,δ3.42)、甘氨酸(Gly,δ3.55)和肌醇(m-Ins,δ3.52,δ4.06)。从代谢轨迹图中可以看出额叶和枕叶2个脑区,糖尿病组和对照组在第一主成分方向上明显区分,且糖尿病发展这一因素对代谢模式的影响远大于大鼠自身生长发育这一因素对代谢模式的影响,见图3A和4A。且2个脑区在糖尿病发病不同时期的代谢模式均明显区分,见图3B和4B。在额叶区,引起糖尿病组和对照组之间的差异的主要代谢物有:Lac、NAA、Gln、m-Ins;同样的,这些也是引起枕叶区代谢差异的主要特征性代谢物,见图3C和4C。
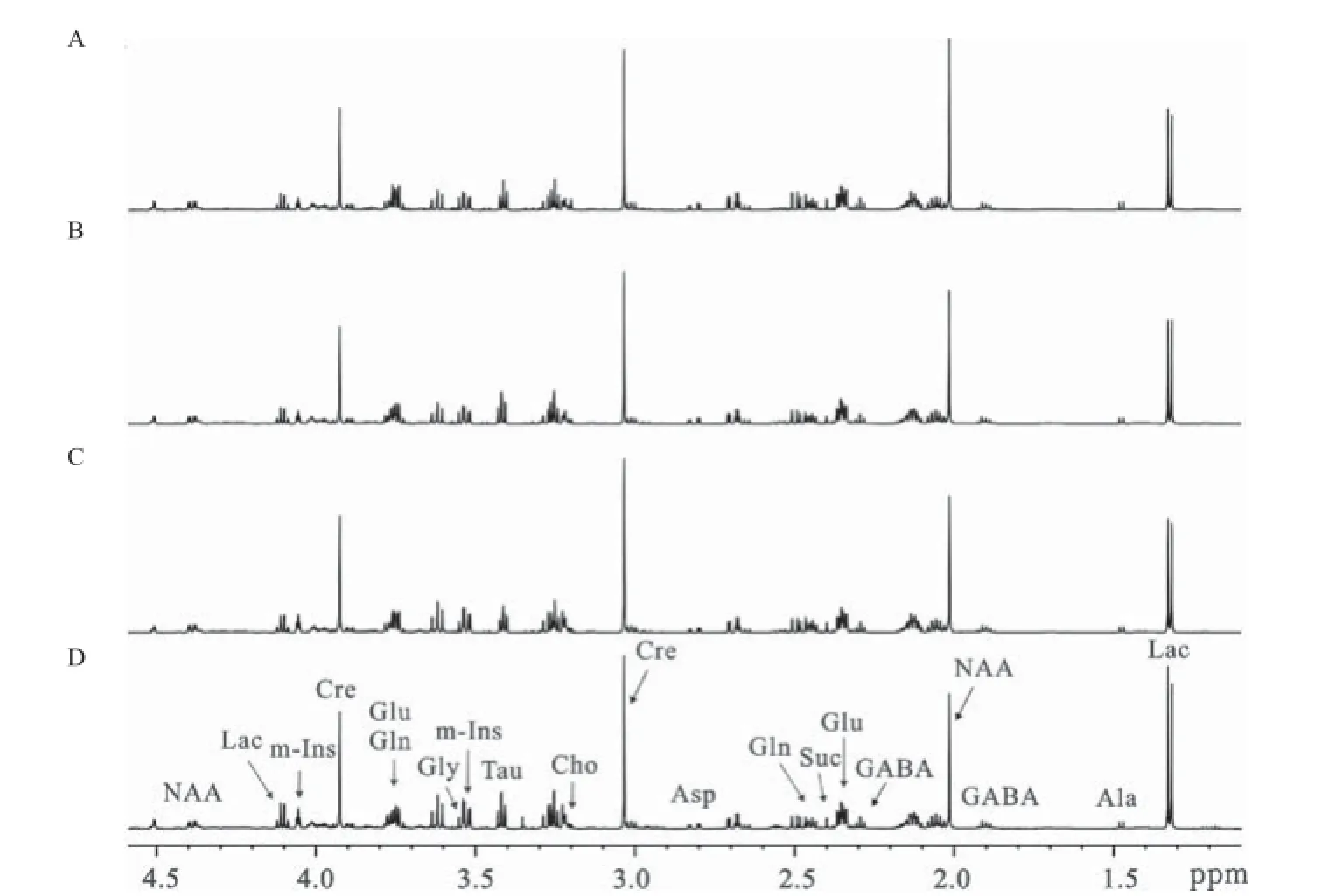
图1 对照组1周(A)和糖尿病组1周(B)、5周(C)、9周(D)时大鼠额叶组织典型的1H NMR谱
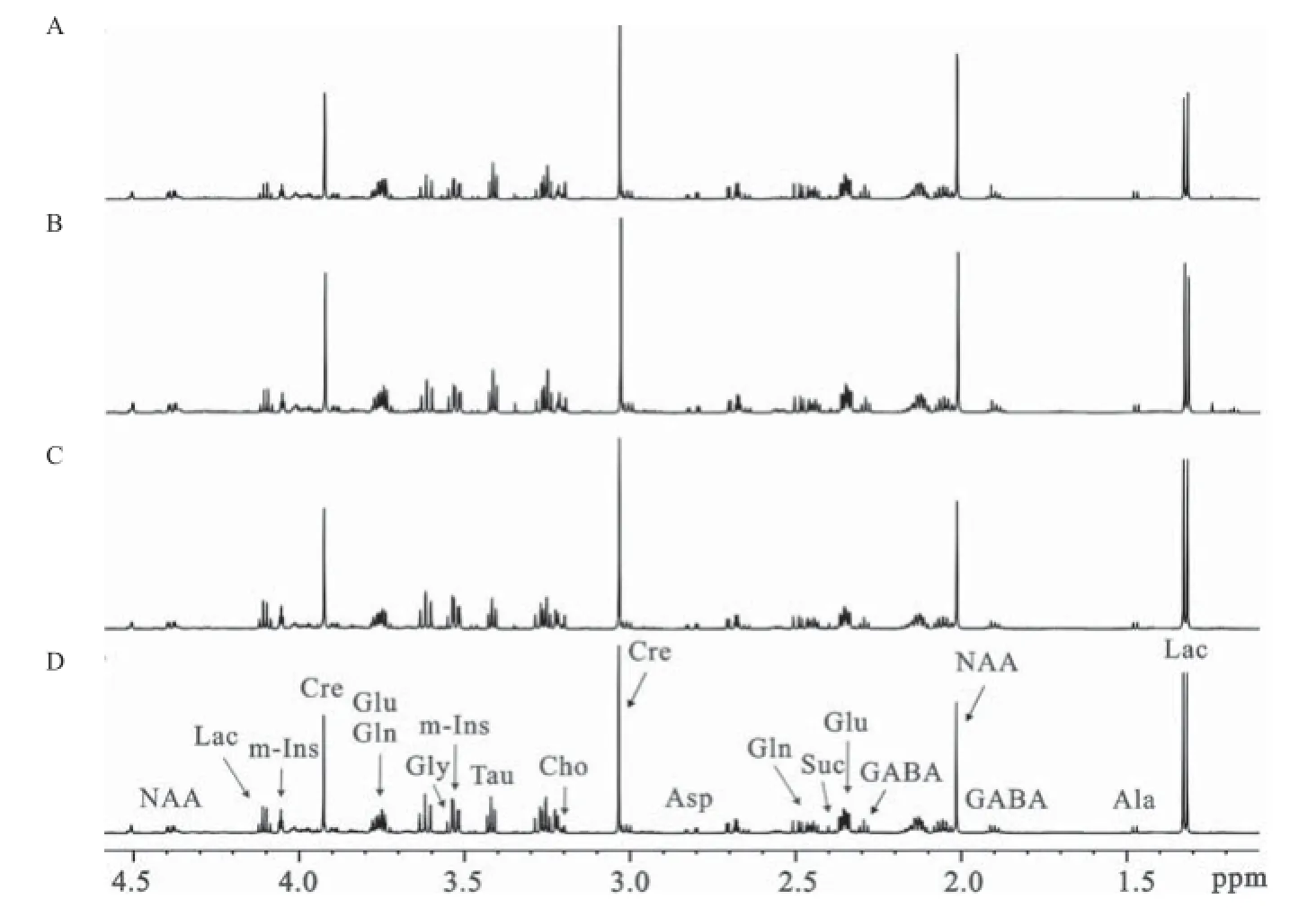
图2 对照组1周(A)和糖尿病组1周(B)、5周(C)、9周(D)时大鼠枕叶组织典型的1H NMR谱
2.2 代谢物定量分析结果 进一步对代谢物进行定量分析后发现,在糖尿病组1周时的大鼠额叶中,NAA、GABA、Gln、Cho含量明显下降,m-Ins含量显著升高,而枕叶中还存在Lac升高的现象。当糖尿病发展至5周时,在之前的基础上,代谢变化逐渐加剧,额叶中的Lac开始显著升高,枕叶中的Tau显著升高。至第9周时,代谢变化持续加剧,Asp开始在2个脑区显著降低,此外,额叶中的Tau开始出现升高的趋势,枕叶中的Gly开始出现降低的趋势,见表1。
2.3 Glu-Gln-GABA循环 糖尿病1周时,额叶和枕叶区均已开始出现Glu、Gln、GABA含量减少的趋势。与对照组大鼠相比,糖尿病组大鼠额叶和枕叶区,三者总含量(Glu+Gln+GABA)在1、5、9周时均持续降低,见图5。
3 讨论

图3 额叶模式识别分析结果
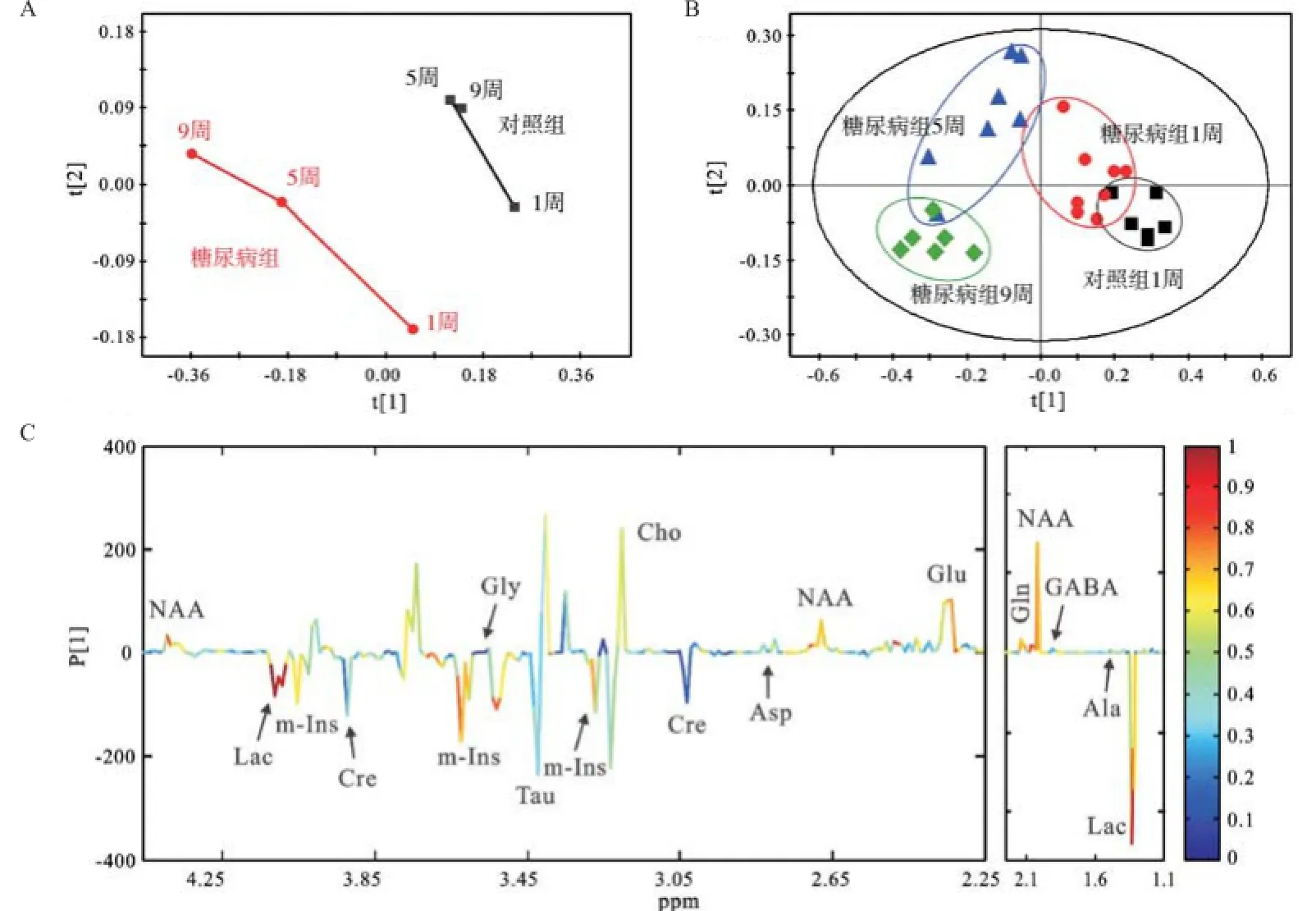
图4 枕叶模式识别分析结果
3.1 能量代谢紊乱 脑部能量需求至少占人体总能量需求的20%[12],脑能量代谢紊乱与脑病的发生发展密切相关[13]。本研究发现,在糖尿病的发病进程中,额叶和枕叶中Lac含量均持续升高,而Lac在脑内是由能量底物葡萄糖通过无氧酵解方式代谢产生的,在糖尿病大鼠脑内的这种异常升高,说明无氧酵解途径增强。同时,当糖尿病发展到第9周时,2个脑区中三羧酸循环(tricarboxylic acid cycle,TCA循环)中间产物Asp和Suc均出现降低的趋势,说明TCA循环活性减弱,可能是高糖刺激脑内神经细胞致使其线粒体受损,从而影响到正常的氧化呼吸供能。综上所述,糖尿病诱导的无氧酵解过强导致无效供能增加,而发病后期TCA循环的减弱,进一步加剧了能量代谢紊乱。
3.2 神经元-胶质代谢区间改变 哺乳动物脑内存在2个主要代谢区间,分别是神经元代谢区间和胶质细胞代谢区间[6],Glu-Gln-GABA循环在维持这2个代谢区间的神经递质平衡以及大脑运作中起着至关重要的作用[10]。Glu被星形胶质细胞摄取后,在胶质内转化为Gln,因为谷氨酰胺合成酶仅存在于胶质细胞中,随后合成的Gln被转运回神经元,作为氨基酸类神经递质Glu和GABA的主要前体物质,继续参与神经冲动传递或其他代谢途径。本研究在2个脑区中同时发现Glu、Gln、GABA的含量有持续减少的趋势,三者总含量随着糖尿病的发生发展显著降低,说明在糖尿病发病进程中,神经元和胶质细胞之间的这一重要循环受到阻碍,递质动态平衡被打破。这一结果与本课题组早前在2型糖尿病模型db/db小鼠海马内得到的Glu-Gln循环减弱的结果[7]一致。可见无论是1型还是2型糖尿病,高血糖造成的脑中神经元和胶质细胞间的递质传递障碍普遍存在。此外,本研究还发现,从糖尿病1周开始,额叶和枕叶区就已开始出现Glu-Gln-GABA循环障碍的现象,且随着糖尿病的发生发展持续减弱。有研究[3]表明糖代谢紊乱的早期就已触发脑损伤,这种代谢水平观测到的早期代谢异常,很可能是导致糖尿病患者逐渐发展演变为脑损伤的重要原因。
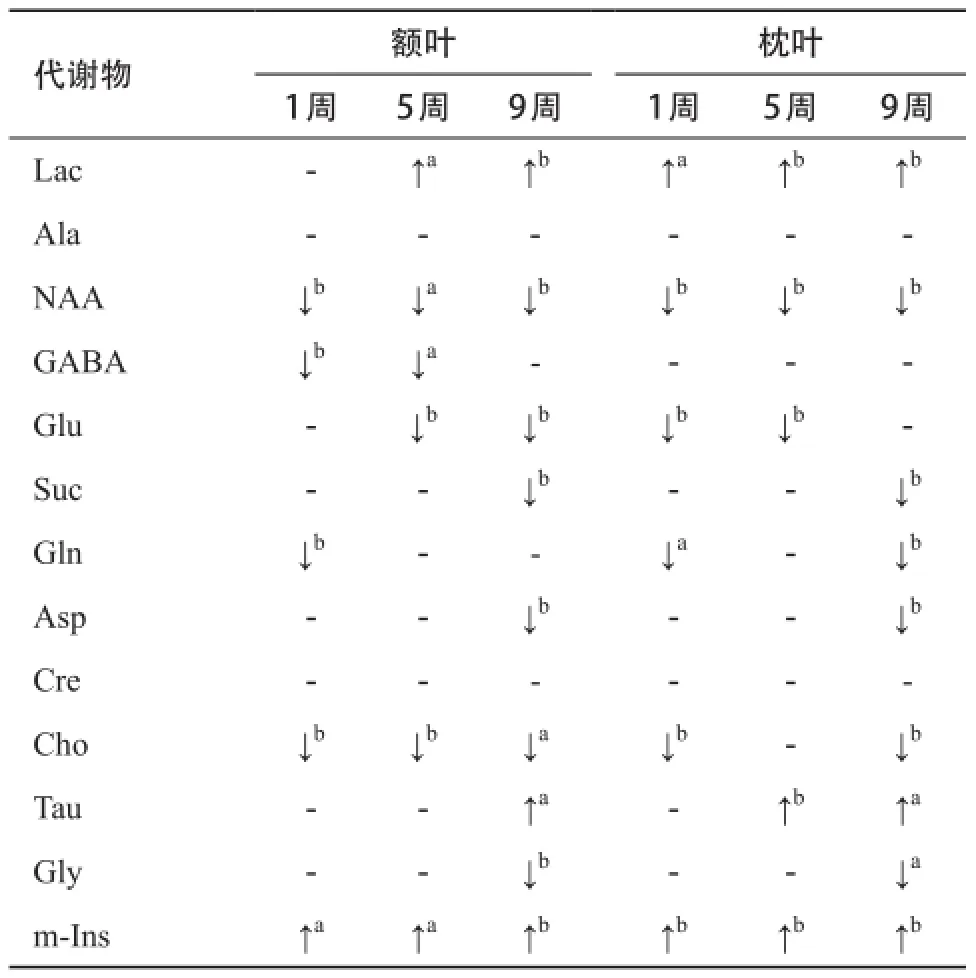
表1 糖尿病组大鼠脑中代谢物含量变化表
3.3 氨基酸类神经递质代谢紊乱 m-Ins、Tau是反映胶质细胞增生或胶质细胞活性以及胶质渗透压调节的特征性代谢物,主要参与调节渗透压平衡和细胞内环境的稳定[14-15]。糖尿病1周大鼠额叶和枕叶中m-Ins的增加以及糖尿病发病后期Tau的升高表明2个脑区中胶质细胞渗透压调节的需求增强。Cre的含量在2个脑区中一直维持稳定,这也与相关文献[16-18]报道的脑内Cre含量在绝大多数疾病发生时一般恒定不变是相符的。此外,与对照组大鼠相比,额叶和枕叶中NAA从1周时开始显著降低,与1型糖尿病患者额叶活体定域MRS结果[19-20]一致。而NAA作为神经元活性的特征性代谢物,其含量的降低说明神经元受损。结合上述分析,神经元受损可能是导致神经元和胶质细胞之间的Glu-Gln-GABA循环障碍的重要诱因。
3.4 脑区相似性 本实验分别考察了大脑内参与调节注意力和记忆力的2个脑区—额叶和枕叶,在糖尿病发生发展进程中的一系列重要的神经化学物质的扰动。值得一提的是,在糖尿病发病进程中,2个脑区中发生变化的特征性代谢物基本一致,且随着发病周期的增加具有规律性的持续降低或升高,比如Lac、NAA、m-Ins、Suc、Asp、Tau、Gly等。说明高血糖对额叶和枕叶造成的代谢紊乱是相似的,只是个别代谢物的扰动发生的时期略有差异,比如Lac的升高在额叶中至第5周才出现统计学差异,而在枕叶中第1周就显著升高;额叶中的Tau在糖尿病造模9周后才出现明显升高,而枕叶中发病第5周就具有统计学差异。这说明虽然额叶和枕叶在大脑内分布的具体位置不同,但是可能由于它们均参与调控注意力和记忆力,功能上相互协调,所以一旦受到外界刺激,会引起相似的代谢调控反应,这也进一步说明了高血糖可能会对注意力和记忆力造成损害,而且,这种损害在糖尿病发病早期(1周)时,就已经可以观测到代谢水平的扰动。

图5 糖尿病大鼠额叶和枕叶中Glu、Gln和GABA总含量柱状图
综上所述,本研究应用基于1H NMR的代谢组学方法分析了1型糖尿病大鼠不同发病阶段额叶和枕叶2个脑区的代谢水平的变化,结果发现,高血糖对额叶和枕叶在糖尿病各个时期的代谢轮廓均造成了较大程度的影响。从代谢物水平观测到2个脑区中发生的特征性代谢物变化具有相似性,且多数代谢紊乱在糖尿病发病早期就已开始出现,随着糖尿病的发生发展逐渐加剧,其中包括能量代谢出现紊乱、Glu-Gln-GABA循环受到抑制、渗透压调节的增强等。
[1] CHEN J, CUI X, ZACHAREK A, et al. White matter damage and the effect of matrix metalloproteinases in type 2 diabetic mice after stroke[J]. Stroke, 2011, 42(2): 445-452.
[2] 黄微, 曹子玉. STZ诱导大鼠1型糖尿病进行性脑萎缩的磁共振成像及组织化学研究[J]. 波谱学杂志, 2015, 32(3): 439-449.
[3] WEINSTEIN G, MAILLARD P, HIMALI J J, et al. Glucose indices are associated with cognitive and structural brain measures in young adults[J]. Neurology, 2015, 84(23): 2329-2337.
[4] GAO H C, ZHU H, SONG C Y, et al. Metabolic changes detected by ex vivo high resolution1H NMR spectroscopy in the striatum of 6-OHDA-induced Parkinson’s rat[J]. Mol Neurobiol, 2013, 47(1): 123-130.
[5] LIU K, YE X J, HU W Y, et al. Neurochemical changes in the rat occipital cortex and hippocampus after repetitive and profound hypoglycemia during the neonatal period: an ex vivo1H magnetic resonance spectroscopy study[J]. Mol Neurobiol, 2013, 48(3): 729-736.
[6] WANG N, ZHAO L C, ZHENG Y Q, et al. Alteration of interaction between astrocytes and neurons in different stages of diabetes: a nuclear magnetic resonance study using [1-13C] Glucose and [2-13C] Acetate[J]. Mol Neurobiol, 2015, 51(3): 843-852.
[7] ZHENG Y Q, YANG Y J, DONG B J, et al. Metabonomic prof les delineate potential role of glutamate-glutamine cycle in db/db mice with diabetes-associated cognitive decline [J]. Mol Brain, 2016, 9: 40.
[8] PSIHOGIOS N G, GAZI I F, ELISAF M S, et al. Gender-related and age-related urinalysis of healthy subjects by NMR-based metabonomics[J]. NMR Biomed, 2008, 21(3): 195-207.
[9] 魏婷婷, 郑涌泉, 王慧, 等. 2型糖尿病小鼠小脑代谢物的1H NMR研究[J]. 温州医科大学学报, 2015, 45(2): 119-122.
[10] ZHENG H, ZHAO L C, XIA H H, et al. NMR-based metabolomics reveal a recovery from metabolic changes in the striatum of 6-OHDA-induced rats treated with basic f -broblast growth factor[J]. Mol Neurobiol, 2016, 53(10): 6690-6697.
[11] GAO H C, XIANG Y, SUN N L, et al. Metabolic changes in rat prefrontal cortex and hippocampus induced by chronic morphine treatment studied ex vivo by high resolution1H NMR spectroscopy[J]. Neurochem Int, 2007, 50(2): 386-394.
[12] MAGISTRETTI P J, ALLAMAN I. A cellular perspective on brain energy metabolism and functional imaging[J]. Neuron, 2015, 86(4): 883-901.
[13] 方永奇, 莫镇涛. 脑能量代谢调节机制研究新进展[J]. 广州中医药大学学报, 2011, 28(3): 328-331.
[14] BRAND A, RICHTER-LANDSBERG C, LEIBFRITZ D. Multinuclear NMR studies on the energy metabolism of glial and neuronal cells[J]. Dev Neurosci, 1993, 15(3-5): 289-298.
[15] SARTORIUS A, LUGENBIEL P, MAHLSTEDT M M, et al. Proton magnetic resonance spectroscopic creatine correlates with creatine transporter protein density in rat brain[J]. J Neurosci Methods, 2008, 172(2): 215-219.
[16] 李春霞, 王亚强, 潘文举, 等. 长期慢性强迫游泳应激抑郁模型大鼠前额叶脑代谢物的1H NMR研究[J]. 武汉大学学报(理学版), 2008, 54(4): 451-456.
[17] SAHIN I, ALKAN A, KESKIN L, et al. Evaluation of in vivo cerebral metabolism on proton magnetic resonance spectroscopy in patients with impaired glucose tolerance and type 2 diabetes mellitus[J]. J Diabetes Complications, 2008, 22(4): 254-260.
[18] STRZELECKI D, GRZELAK P, PODGORSKI P, et al. Comparison of metabolite concentrations in the left dorsolateral prefrontal cortex, the left frontal white matter, and the left hippocampus in patients in stable schizophrenia treated with antipsychotics with or without antidepressants.1HNMR spectroscopy study[J]. Int J Mol Sci, 2015, 16(10): 24387-24402.
[19] MANGIA S, KUMAR A F, MOHEET A A, et al. Neurochemical prof le of patients with type 1 diabetes measured by1H-MRS at 4 T[J]. J Cereb Blood Flow Metab, 2013, 33(5): 754-759.
[20] ZHANG M, SU X, ZHANG Z, et al. Brain metabolite changes in patients with type 2 diabetes and cerebral infarction using proton magnetic resonance spectroscopy[J]. Int J Neurosci, 2014, 124(1): 37-41.
(本文编辑:丁敏娇)
Study on frontal lobe and occipital lobe metabolism in different stages of diabetes using1H NMR spectros-
copy
WANG Dan1, ZHENG Yongquan2, ZHAO Liangcai1, ZHENG Hong1, GAO Hongchang1, ZHANG Huajie1.
1.School of Pharmaceutical Sciences, Wenzhou Medical University, Wenzhou, 325035; 2.Department of Pharmacy, Women’s Hospital, School of Medicine, Zhejiang University, Hangzhou, 310006
Objective:To investigate the metabolic changes of frontal lobe and occipital lobe in different stages of diabetes.Methods:The frontal lobe and occipital lobe were dissected from the 1-week, 5-week and 9-week diabetic rats and the age-matched controls.1H NMR-based metabonomics combined with multivariate pattern recognition analysis and quantitative analysis were used to study the metabolic characteristics.Results:The metabolic patterns of frontal lobe and occipital lobe were signif cantly changed in different stages of diabetes. Compared to the controls, lactate, taurine and myo-inositol were distinctly increased both in frontal lobe and occipital lobe with the development of diabetes, while the levels of N-acetyl-aspartate, aspartate and succinate were markedly decreased.Conclusion:The metabolic changes in frontal lobe and occipital lobe are similar, and occurr in the early stage of diabetes. The metabolic changes mainly focus around the disordered energy metabolism, inhibit Glu-Gln-GABA cycle and increas osmoregulation.
diabetes mellitus; energy metabolism; frontal lobe; occipital lobe;1H NMR; rats
R34
A
10.3969/j.issn.2095-9400.2017.02.003
2016-05-17
浙江省药学重中之重一级学科开放基金(YKFJ2-003);浙江省自然科学基金资助项目(LY14H090014,LY15H180010);高等学校博士学科点专项科研基金新教师类资助课题(20133321 120006)。
王丹(1991-),女,浙江嘉兴人,硕士生。
张华杰,教授,硕士生导师,Email:zhanghuajie116@ sina.com。
