太湖流域典型河流含氮物消减速率研究
2017-01-19郭加汛彭俊翔张海涛胡维平赵耕毛赖锡军邓建才中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室江苏南京0008南京农业大学资源与环境科学学院江苏南京0095
郭加汛,彭俊翔,张海涛,胡维平,赵耕毛,赖锡军,邓建才*(.中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室,江苏 南京 0008;.南京农业大学资源与环境科学学院,江苏 南京 0095)
太湖流域典型河流含氮物消减速率研究
郭加汛1,2,彭俊翔1,张海涛1,胡维平1,赵耕毛2,赖锡军1,邓建才1*(1.中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室,江苏 南京 210008;2.南京农业大学资源与环境科学学院,江苏 南京 210095)
采用自主研发的原位培养装置,开展了太湖流域典型河流水体含氮物消减速率及其影响因素研究.结果表明,总氮和氨氮消减速率呈现显著的空间差异性(P<0.05),消减速率分别为(280.6±180.0)~(1458.8±725.7)mg/(m3·d)、(35.2±3.7)~(343.6±88.4)mg/(m3·d),但硝态氮消减速率(44.3±7.6)~(521.2±19.2)mg/(m3·d))无显著的空间差异性(P>0.05).微生物作用下氮素消减速率为95.0~733.1mg/(m3·d),分别占含氮物总消减速率和总负荷的12.9%~50.3%和2.0%~13.4%,非微生物作用下氮素消减速率为180.0~996.7mg/(m3·d),占含氮物总消减速率和总负荷的49.8%~87.0%和7.4%~25.7%,说明污染物进入水体,短期内微生物作用对含氮物消减速率的贡献较低.氮素消减速率与TN、NO3-、SS均呈线性相关关系(P<0.05),说明TN、NO3-、SS在一定程度上是氮素消减作用的影响因素.
河流水体;含氮物;消减速率
水体自净能力是指系统内的污染物在物理、化学和生物的协同作用下恢复或接近到污染前水平的潜力,受污染物自身理化性质、水生态系统的水文条件(流速、水深)以及水环境要素(温度、氧化还原电位、酸碱度)影响[1].氮是生物体必需的营养元素,水体中含氮化合物能促进水生生物生长,但过量的含氮物排放到河流、湖泊水体中,超出水生态系统的自净能力,会导致水体富营养化.围绕水体自净过程及其影响因素,国内外学者开展了一系列研究,主要集中在河流、湖泊沉积物的硝化反硝化作用[2]、厌氧氨氧化速率的季节变化[4]以及水柱的硝化作用[5]等方面,这些研究表明微生物参与的硝化反硝化及厌氧氨氧化作用可去除水环境介质中部分含氮物.在一定的NH3浓度范围内,氨氧化速率随着NH3浓度升高而显著增加,而亚硝酸盐的氧化过程具有明显的阶段性[6].水体中的悬浮物也会对水体自净作用产生影响,悬浮物既可加速其表面吸附的含氮物硝化过程[7],也能促进反硝化作用[8].以往研究多是通过室内模拟的方法研究水体的自净作用,试验条件可控性强,结果能很好的反映微生物在水体自净过程中的作用,但对于非微生物自净作用以及通过原位手段进行水体自净能力研究,目前鲜有报道.
消减速率是指单位时间内污染物在水体物理、化学、生物作用下的减少量,其大小可反映水体自净能力.本研究采用自主研发的原位试验培养装置,通过对太湖流域五条河流水体进行培养,计算不同试验处理条件下含氮物的消减速率,分析生物因素和非生物因素对水体自净作用的贡献率,探讨不同河流含氮物消减速率差异的原因,并估算其自净能力,为太湖流域河流水环境容量评估以及污染物排放许可提供重要参数与理论依据.
1 材料与方法
1.1 研究对象与原位试验培养装置

表1 采样位点与周边环境Table 1 Information of sampling sites and environmental characteristics

图1 实验装置示意Fig.1 Diagram of experimental device
太湖流域河流环境复杂多样,出入太湖的河流多达125条[9].本研究选择太滆运河、丹金溧漕河、南溪—西氿、京杭运河—嘉兴段、太浦河5条代表不同环境背景、功能和地域的典型河流,表1为采样点周边环境.采样点河流中的含氮物质主要来自周边工业废水、生活污水、农田化肥以及船舶污水排放等,水体总氮浓度为2.4~6.4mg/L,铵态氮浓度为0.1~3.0mg/L,硝态氮浓度为0.7~3.1mg/L.
自主研发的原位试验培养装置(图1,专利授权号:ZL201520816420.7)主体为直径80cm、高2.5cm的圆形钢环,通过3根宽2cm钢板与中轴连接,钢环上等距离焊接有12个直径为3.5cm圆环,圆环用以悬挂培养瓶和其他试验探头,培养瓶通过瓶塞上的乳胶管与大气相通.培养装置特点是原位测定水体污染物消减.
1.2 实验处理与样品采集
1.2.1 实验处理 实验设置对照与杀菌处理,分别反映有和无微生物作用的水体,每个处理设置3个重复.用采水器从靠河流两岸和中间取距水面50cm处水样,置于塑料桶中混匀.对照处理直接加满混匀后水样,灭菌处理则先加入约一半水样后加入抑制剂(2mL 0.5% HgCl2)摇匀后加满(避免溢出),加橡皮塞密封(培养瓶顶部无空气),放在采样点附近的水体中进行原位培养.
1.2.2 样品采集 当原位培养达到预设定的时间后,从河流中缓慢取出装置,避免扰动沉降至培养瓶底部的悬浮物.培养瓶内水样从瓶底侧面的取样口采集,瓶底沉降的悬浮物样从底部加盖瓶口转移至采样瓶,用20mL蒸馏水清洗培养瓶,并将清洗液转入含悬浮物的采样瓶.采集结束后,在对照处理采样瓶中加入1mL 0.5% HgCl2溶液,采集的样品均放入便携式冰箱,并尽快送到实验室冷冻至分析.
1.3 指标测定方法
采用多参数水质分析仪(YSⅠ)现场测定温度、溶解氧(DO)、pH值;采用River Surveyor M9(SonTek,Xylem子公司)原位测定断面流速、流量、河宽.水样总氮(TN)采用紫外分光光度法测定[10],采用连续注射分析仪(Skalar San++,荷兰)测定NH4+、NO3-、NO2-浓度.仪器检测限:NH4+为0.1mg/L、NO3-为0.01mg/L、NO2-为0.01mg/L.
1.4 数据处理与统计
采用Excel 2013处理数据,采用Person相关性分析和单因素方差分析(SPSS 19.0)对数据进行相关性和差异性分析,采用GraphPadPrism5作图.
2 结果与分析
2.1 含氮物消减速率
图2为不同采样点水体含氮物的消减速率,TN、NO3--N以及NH4+-N消减速率的变化范围 分 别 为 (280.6±180.0)~(1458.8±725.7)mg/(m3·d)、(44.3±7.6)~(521.2±19.2)mg/(m3·d)和(35.2 ±3.7)~(343.6±88.4)mg/(m3·d),其最大值分别出现在DJ3、TG2和TG1.从表2可知,TG、DJ、JX的TN平均消减速率显著大于NX和TP(P<0.05),分别为NX和TP的1.9和2.0、2.1和2.3、1.9和2.0倍,TG、DJ、JX间没有显著性差异(P>0.05);TG的NH4+-N平均消减速率显著大于NX和TP(P<0.05),分别为NX和TP的2.0和3.7倍,且DJ和JX显著大于TP(P<0.05),TG和DJ、DJ和NX均无显著性差异(P>0.05);各河流NO3--N平均消减速率无显著性差异(P>0.05).

图2 样点含氮物消减速率Fig.2 Reduction rates of TN, NO3--N and NH4+-N in sampling sites
同一河流不同部位TN消减速率也存在差异性,TG1和TG3显著大于TG2(P<0.05),DJ2和DJ3显著大于DJ1(P<0.05),NX2显著大于NX1和NX3(P<0.05),JX1和JX2显著大于JX3(P<0.05);TG1、TG2、TG3以及NX1、NX2、NX3的NH4+-N消减速率无显著性差异(P>0.05),DJ3显著大于DJ1(P<0.05),JX3显著大于JX1和JX2(P<0.05),TP3显著大于TP1和TP2(P<0.05);TG2的NO3--N消减速率显著大于TG1和TG3且TG1显著大于TG3(P<0.05),NX2显著大于NX1和NX3(P<0.05),TP2显著大于TP3和TP1同时TP3显著大于TP1(P<0.05),DJ1、DJ2、DJ3以及JX1、JX2、JX3的NO3--N消减速率无显著差异性(P>0.05).

表2 含氮物平均消减速率[mg/(m3·d)]Table 2 Mean reduction rates of TN, NO3--N and NH4+-N in sampling sites (TG, DJ, NX, JX and TP)[mg/(m3·d)]
2.2 微生物和非微生物作用下的N素消减速率
从图3可以看出,太湖流域5条河流采样点水体微生物作用下的N素消减速率为95.0~733.1mg/(m3·d),占总消减速率的12.9%~50.3%,占N负荷的2.0%~13.4%,最高值出现在DJ3.表3为5条河流采样点水体在微生物作用下含氮物的平均消减速率,最大值出现在DJ(392.9mg/(m3·d)),最小值出现在NX(150.2mg/(m3·d)).TG1、TG2,NX1、NX2、NX3,JX1、JX2、JX3水体的含氮物消减速率无显著性差异(P>0.05),DJ3显著大于DJ1和DJ2(P<0.05),TP3显著大于TP1(P<0.05),但5条河流采样点水体微生物作用下的N素消减速率无显著性差异(P>0.05).

图3 微生物和非微生物作用下N素消减速率Fig.3 Reduction rates of N under the microbial actions and non-microbial actions
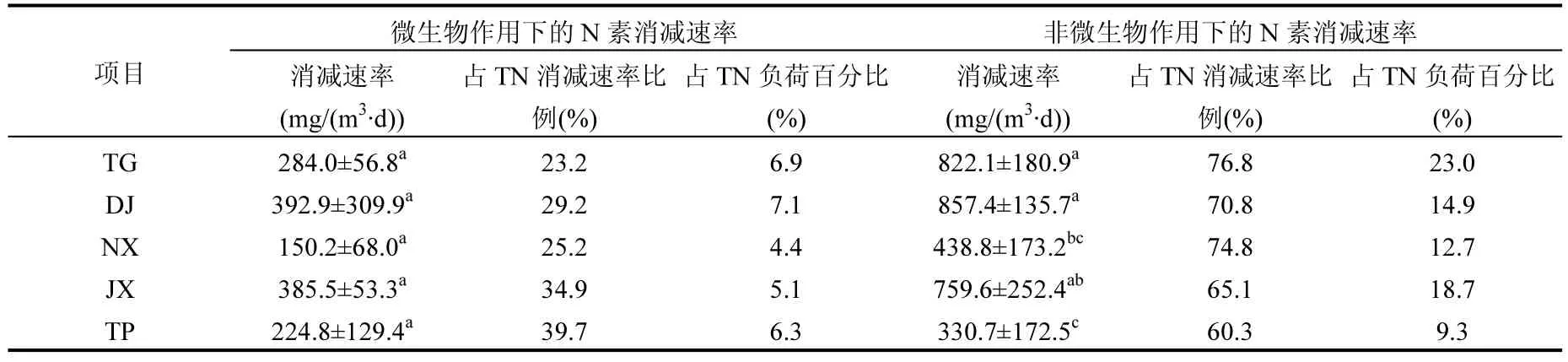
表3 微生物及非微生物作用下的N素消减速率及所占比例Table 3 Mean reduction rates of N and the proportion of N reduction rates and N load under the microbial and non-microbial actions in sampling sites (TG, DJ, NX, JX and TP)
图3表明非微生物作用下各采样点N素消减速率为180.0~996.7mg/(m3·d),最大值在DJ2.5条河流采样点水体非微生物作用下的消减速率见表3,其中TG、DJ的消减速率显著大于NX和 TP(P<0.05),JX显著大于TP(P<0.05).非微生物作用下的N素消减速率占总消减速率的49.8%~87.0%,占N负荷的7.4%~25.7%.NX2水体含氮物的消减速率显著大于NX1和NX3的(P<0.05),JX1和JX2的显著大于JX3的(P<0.05),TP3的显著大于TP2且TP2显著大于TP1(P<0.05),其他河流采样点间无显著性差异(P>0.05).
微生物作用对N素消减的贡献率较低,而非微生物作用的贡献率较高,说明污染物进入水体后,短期内主要是非微生物作用在含氮物总消减过程中发挥作用.
2.3 环境因子对N素消减速率的影响
从表4可以看出,5条河流采样点水体TN浓度与其消减速率呈显著正相关(r2=0.5471,P<0.05).NH4+-N消减速率则随着浓度的增大显著增大(P<0.05),在浓度为0.5mg/L时消减速率最大,之后随着浓度的增大消减速率显著减小(P<0.05)(图4).微生物参与的N素消减速率与采样点河流水体中TN(r2=0.6305,P<0.05)、NO3--N(r2=0.4299,P<0.05)和SS(悬浮物) (r2=0.4018, P<0.05)浓度均呈显著正相关关系.非微生物作用下的N素消减速率与水体中SS(r2=0.3039, P<0.05)和TN(r2=0.4662,P<0.05)浓度呈显著正相关关系.
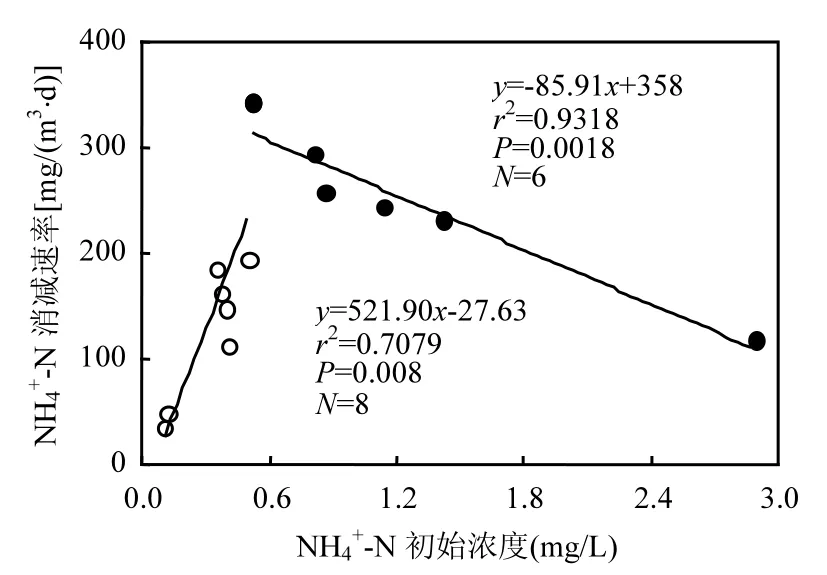
图4 NH4+-N消减速率与其初始浓度关系Fig.4 Relationship between NH4+-N reduction rates and concentrations

表4 消减速率与不同指标浓度的相关性分析Table 4 Correlations between reduction rates and concentrations of factors
3 讨论
3.1 含氮物消减速率的空间差异性分析
含氮物通过转化和降解过程实现消减,是水体自净能力的重要体现.通过对5条河流采样点水体TN消减速率分析得出,TG、DJ、JX的TN消减速率显著高于NX和TP(P<0.05),TN消减速率 范 围 为 (280.6±180.0)~(1458.8±725.7)mg/(m3·d),呈现显著的空间差异性.TG、DJ、JX河流多处于城镇功能区,生活污水大量排放导致TN负荷严重((4.9±0.9) mg/L),而NX和TP的TN负荷较轻((3.4±0.9)mg/L),即TN浓度呈现出空间异质性.N素降解与其初始浓度有关,氨氮初始浓度越高其降解速率越快[11],沉积物中N2产生量与水体TN浓度相关[12].在本研究中,TN消减速率与其初始浓度呈显著正相关(r2=0.5471, P<0.05),TN浓度的空间异质性导致其消减速率的空间差异性.水体中TN、NH4+-N及非微生物作用下N素消减速率与河流的流量(1.6~464.0m3/s)、河宽(29.6~203.3m)均呈显著负相关(P<0.05),大流量和宽河流水体可加速污染物的降解和稀释,使污染物浓度降低[13-14].蒲迅赤等[15]研究表明河流紊动强度越大,有机物降解速率越大.可见,河流不同水环境以及水文条件也可导致TN消减速率空间差异性.
5条河流采样点流量和河宽间也存在差异,NH4+-N消减速率与河流流量和河宽均成显著负相关(P<0.05),河流水文条件差异可能导致NH4+-N消减速率空间异质性.此外,从图4可以看出,NH4+-N消减速率随其初始浓度增大先增加后减小,在NH4+-N为0.5mg/L时其消减速率达到最大,NH4+-N初始浓度的空间差异也可能是导致NH4+-N消减速率空间质异性的原因.一些生态系统中的硝化作用会受到氨氮浓度的影响[16],过高的NH4+-N浓度会促进氨氧化作用[17],但是本研究中高浓度NH4+-N并未促进其消减速率增加,而是出现了降低.这可能是因为当NH4+- N浓度较低时(<0.5mg/L),以NH4+-N为底物的硝化作用和悬浮物沉降能转化和转移大部分NH4+-N,其消减作用非常明显,但随着浓度增大(>0.5mg/L),水体中悬浮颗粒物吸附NH4+-N后沉降至培养装置底部,一方面水体中悬浮颗粒物浓度明显降低,对NH4+-N吸附作用减弱,另一方面悬浮颗粒物表面的硝化细菌也随其沉降至培养装置底部,显著降低了硝化细菌与水体中NH4+-N的接触面积,导致水体中NH4+-N消减速率减小.这表明水体中NH4+-N消减并不是简单微生物参与下的氨氧化和亚硝酸盐氧化过程,而是微生物和非微生物共同作用的结果.
NO3--N消减速率无显著空间差异性(P>0.05).厌氧条件下,以NO3-为最终电子受体的反硝化作用可以转化一部分的NO3--N,但是河流属于富氧水体(DO检测平均值为8.9mg/L),虽然水体中悬浮物对反硝化的进行有一定作用[8],但是较为微弱,所以微生物作用对NO3--N的消减也比较微弱.同时,在分析过程中因不能区分硝化作用产生的NO3-而增加的NO3--N浓度,加上河流所处环境和水文条件的影响,可能导致了其消减速率无空间差异性.
3.2 环境因子对N素消减速率的影响分析
3.2.1 微生物对N素消减速率的影响 本研究中水体处于好氧环境,微生物将NH4+氧化为NO2-再氧化为NO3-,是NH4+消减的主要途径;悬浮物表面厌氧微位点上的微生物将NO3-还原为N2O和N2,是NO3-消减的主要过程.微生物作用下5条河流采样点水体中氮素的去除速率为95.0~733.1mg/(m3·d),占N负荷的2.0%~13.4%,平均为6.3%.反硝化作用一般发生在沉积物水界面,但在富氧水体中,悬浮物表面也可以发生反硝化作用.Liu等研究结果表明在悬浮物内部可能存在厌氧微位点,这为反硝化提供了必要的好氧—厌氧微界面环境[18].水体中悬浮物为反硝化细菌提供了附着点,使反硝化细菌与悬浮物结合在一起,本研究通过野外原位实验也间接证明了富氧水体中反硝化的存在.
3.2.2 非微生物作用对N素消减速率的影响水体中悬浮物以黏土矿物或其他矿物微粒为集结核,腐殖酸及重金属水合氧化物组成的粘附架桥聚集在一起结合在矿物微粒表面,在运动过程中可吸附含氮物和其他重金属到其表面[19],使含氮物从水相进入固相,并随着悬浮物在水体中沉降,进入下部水体和沉积物中,使水体中污染物浓度降低.研究结果表明,非微生物作用下的N素消减速率为180.0~996.7mg/(m3·d),占总消减速率的49.8%~87.0%,占N负荷的7.4%~25.7%.郭长城等研究表明,河流泥沙对污染河流的N素有一定的吸附效果,而且污染物负荷越大、泥沙含量越高吸附效果越好[20],这与研究中非微生物作用下N素的消减速率与TN浓度和SS均成显著正相关关系(P<0.05)的结果吻合.
3.2.3 TN、SS、NO3--N对N素消减速率的影响 TN、SS、NO3--N通过影响水体中微生物作用和非微生物作用来影响河流水体中N素的消减.在本研究中,微生物参与的N素消减速率与水体中NO3--N浓度呈显著正相关关系(P<0.05). NO3-作为反硝化过程中的最终电子受体,其浓度一定程度上影响反硝化作用,水体中NO3-浓度高时,有利于反硝化微生物的作用,这与Zhao等研究结果一致[12].微生物参与的N素消减速率与SS呈显著正相关关系,与余晖等研究结果类似但也有一定区别,因为本研究中微生物作用包括硝化、反硝化等多种过程.水体中悬浮物含量的高低对参与硝化作用的细菌产生显著影响[21],同时悬浮物表面的微厌氧位点可提供反硝化作用所需的环境[18],悬浮物含量越高,可提供的附着点和微厌氧位点越多,有助于微生物参与N素消减的进行.水体中SS含量越高比表面积越大,对含氮污染物的吸附能力相对越强[20];污染物浓度越高,对吸附也有一定的作用;研究结果表明,非微生物作用下的N素消减速率与TN和SS呈显著正相关关系(P<0.05).
4 结论
4.1 河流水体对含氮物具有一定的消减作用,且河流水文条件、总氮和氨氮初始浓度是导致含氮物消减速率空间差异的主控因子.
4.2 微生物作用和非微生物作用对含氮物消减都有一定的贡献,但短期内非微生物作用是河道水体含氮物消减的主要方式.
[1] 谭 夔,陈求稳,毛劲乔,等.大清河河口水体自净能力实验 [J].生态学报, 2007,7(11):4736-4742.
[2] 傅国伟.河流水质数学模型及其模拟计算 [M]. 北京:中国环境科学出版社, 1987.
[3] Bellinger B J, Jicha T M, Lehto L R P, et al. Sediment nitrification and denitrification in a Lake Superior estuary [J]. Journal of Great Lakes Research, 2014,40(2):392-403.
[4] Zhao Y, Xia Y, Kana T M, et al. Seasonal variation and controlling factors of anaerobic ammonium oxidation in freshwater river sediments in the Taihu Lake region of China [J]. Chemosphere, 2013,93(9):2124-2131.
[5] Pauer J J, Auer M T. Nitrification in the water column and sediment of a hypereutrophic lake and adjoining river system [J]. Water Research, 2000,34(4):1247-1254.
[6] 陈国元,赵 超.不同浓度NH3-N对富营养化湖泊水体硝化作用的影响 [J]. 水生态学杂志, 2011,32(6):52-56.
[7] Xia X H, Yang Z F, Huang G H, et al. Nitrification in natural waters with high suspended-solid content--a study for the Yellow River [J]. Chemosphere, 2004,57(8):1017—1029.
[8] 姚晓龙,徐会显,唐陈杰,等.鄱阳湖水体悬浮物反硝化潜力模拟研究 [J]. 中国环境科学, 2015,35(3):846-855.
[9] 张利民,孙卫红,程 炜,等.太湖入湖河流水环境综合治理 [J].环境监测管理与技术, 2009,21(5):1-5.
[10] 金相灿,屠清瑛.湖泊富营养化调查规范 [M]. 第2版.北京:中国环境科学出版社, 1990.
[11] 张世坤,张建军,田依林,等.黄河花园口典型污染物自净降解规律研究 [J]. 人民黄河, 2006,28(4):46-47.
[12] Zhao Y, Xia Y, Ti C P, et al. Nitrogen removal capacity of the river network in a high nitrogen loading region [J]. Environmental Science & Technology, 2015,49(3):1427-1435.
[13] 杨丽蓉,陈利顶,孙然好.河道生态系统特征及其自净化能力研究现状与发展 [J]. 生态学报, 2009,29(9):5066-5075.
[14] 李锦秀,廖文根.水流条件巨大变化对有机污染物降解速率影响研究 [J]. 环境科学研究, 2002,15(3):45-48.
[15] 蒲迅赤,李克锋,李 嘉,等.紊动对水体中有机物降解影响的实验 [J]. 中国环境科学, 1999,19(9):485-489.
[16] Belser L W. Population ecology of nitrifying bacteria [J]. Annual Review of Microbiology, 1979,33(33):309-333.
[17] Chen G, Cao X, Song C, et al. Adverse effects of ammonia on nitrification process: the case of chinese shallow freshwater lakes[J]. Water Air & Soil Pollution, 2010,210(1):297-306.
[18] Liu T, Xia X H, Liu S, et al. Acceleration of denitrification in turbid rivers due to denitrification occurring on suspended sediment in oxic waters [J]. Environmental Science & Technology,2013,47(9):4053-4061.
[19] Gurtz M E, Hart B T. Water quality management: the role of particulate matter in the transport and fate of pollutants [J]. Journal of the North American Benthological Society, 1987.
[20] 郭长城,喻国华,王国祥.河流泥沙对污染河水中污染物的吸附特性研究 [J]. 生态环境, 2006,15(6):1151-1155.
[21] 余 晖,张学青,张 曦,等.黄河水体颗粒物对硝化过程的影响研究 [J]. 环境科学学报, 2004,24(4):601-606.
Study on reduction rates of nitrogen pollution in typical rivers of Taihu Basin.
GUO Jia-xun1,2, PENG Jun-xiang1,ZHANG Hai-tao1, HU Wei-ping1, ZHAO Geng-mao2, LAI Xi-jun1, DENG Jian-cai1*(1.State Key Laboratory of Lake Science and Environment, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, China;2.College of Resources and Environmental Sciences, Nanjing Agricultural University, Nanjing 210095,China). China Environmental Science, 2016,36(10):3026~3032
The reduction rates of nitrogen pollution in typical rivers of Taihu Basin were studied using a self - developed in-situ device. The reduction rates of total nitrogen and ammonia nitrogen were (280.6±180.0)~(1458.8± 725.7)mg/(m3·d)and (35.2±3.7)~(343.6±88.4)mg/(m3·d), respectively, which indicated significant spatial difference (P<0.05). The reduction rate of nitrate nitrogen had no significant difference (P>0.05) among the rivers, and the rate was(44.3±7.6)~(521.2±19.2) mg/(m3·d). The N reduction rates under the microbial and non-microbial actions were 95.0~733.1mg/(m3·d) and 180.0~996.7mg/(m3·d), accounting for 12.9%~50.2% and 49.8%~87.0% of the total N reduction rate and 2.0%~13.4% and 7.4%~25.7% of the total N load to the rivers, respectively, indicating that the contribution of microbial actions to the reduction of nitrogen pollutants was low in short-term after nitrogen into the rivers. The N reduction rates were positively correlated with the TN, NO3-and SS concentrations (P<0.05), which suggested TN, NO3-and SS might be the influencing factors for N reducing.
river water;nitrogen pollutant;reduction rate
X522
A
1000-6923(2016)10-3026-07
郭加汛(1991-),男,安徽怀远人,南京农业大学资源与环境科学学院硕士研究生,主要从事河流水环境研究.
2016-02-05
水体污染控制与治理科技重大专项(2014ZX07101-011);国家自然科学基金(41271213);中国科学院重点部署项目(KZZDEW-10)
* 责任作者, 副研究员, jcdeng@niglas.ac.cn
