SNAD生物膜厌氧氨氧化活性的氨氮抑制动力学研究
2017-01-19郑照明赵白航北京工业大学建筑工程学院北京100124
郑照明,李 军,马 静,杜 佳,赵白航 (北京工业大学建筑工程学院,北京 100124)
SNAD生物膜厌氧氨氧化活性的氨氮抑制动力学研究
郑照明,李 军*,马 静,杜 佳,赵白航 (北京工业大学建筑工程学院,北京 100124)
通过批试实验研究了氨氮浓度对SNAD生物膜厌氧氨氧化性能的影响. SNAD生物膜反应器以生活污水为进水.进水NH4+-N和COD浓度平均值分别为70mg/L和180mg/L,出水NH4+-N, NO2--N, NO3--N和COD浓度平均值分别为2mg/L, 2mg/L, 7mg/L和50mg/L. SNAD生物膜具有良好的厌氧氨氧化活性.初始NH4+-N和NO2--N浓度都为70mg/L时,厌氧氨氧化批试NH4+-N、NO2--N和TⅠN去除速率分别为0.121kg N/(kg VSS·d), 0.180kg N/(kg VSS·d)和0.267kg N/(kg VSS·d). 采用Haldane模型可以很好的拟合氨氮浓度对厌氧氨氧化活性的影响.在高FA和低FA工况下氨氮浓度对厌氧氨氧化活性的抑制动力学常数相差不大. M1(FA浓度为0.7~20.4mg/L)和M2(FA浓度为6.3~190.5mg/L)的最大NO2--N理论去除速率rmax分别为0.209kg N/(kg VSS·d)和0.221kg N/(kg VSS·d),氨氮半饱和常数Ks分别为9.5mg/L和6.1mg/L,氨氮自身抑制常数KI分别为422mg/L和597mg/L.氨氮(而不是游离氨)对SNAD生物膜的厌氧氨氧化活性起主要抑制作用.
SNAD生物膜;厌氧氨氧化;氨氮;抑制作用;动力学特性
含氮污水的大量排放会造成水体富营养化.传统生物脱氮采用硝化反硝化技术,存在着曝气能耗高,污泥产量大,需要额外投加碳源等缺点[1]. SNAD工艺是一种经济环保的脱氮工艺,在适宜的工况下,亚硝化菌、厌氧氨氧化菌和反硝化菌在一个反应器中实现总氮和有机物的去除[2-3].
关于SNAD工艺的研究多集中于高氨氮污水的处理,鲜有关于处理城市生活污水的SNAD工艺的报道[4-5].厌氧氨氧化菌在SNAD反应器的自养脱氮中起着核心作用.底物浓度和外界环境对厌氧氨氧化菌具有重要影响[6].对于厌氧氨氧化过程,许多研究提出了不同的NO2--N抑制浓度.Strous等[7]的研究表明NO2--N浓度达98mg/L时即可完全抑制厌氧氨氧化活性.其他研究人员提出了更高的NO2--N抑制浓度. Dapena-Mora[8]和Lotti等[9]的研究表明当NO2--N浓度分别为350mg/L和400mg/L时,厌氧氨氧化活性被抑制50%. Fernández等[10]的研究表明游离亚硝酸(FNA)会对厌氧氨氧化菌产生抑制作用.近年来, Puyol[11]和Lotti等[9]的研究表明NO2--N(而不是FNA)对厌氧氨氧化活性起主要抑制作用. Strous等[7]的研究表明NH4+-N浓度为980mg/L时不会抑制厌氧氨氧化活性. Dapena-Mora等[8]的批试研究表明NH4+-N浓度为770mg/L时,厌氧氨氧化活性被抑制50%. Jung[12]和Fernández等[10]的研究表明FA对厌氧氨氧化活性起抑制作用.Fernández等[10]的批试研究表明FA浓度分别为38mg/L和100mg/L时,厌氧氨氧化菌的活性分别被抑制50%和80%.但是Jung[12]和Fernández[10]的研究没有区分开对厌氧氨氧化活性起主要作用的是氨氮还是游离氨.一些研究表明生物膜存在传质阻力,有助于缓解底物浓度对厌氧氨氧化菌的抑制[13-14].本研究通过批试实验分析了氨氮浓度对SNAD生物膜厌氧氨氧化活性的抑制动力学特性,比较了氨氮和游离氨对厌氧氨氧化活性的抑制作用,以期为SNAD生物膜反应器的稳定运行提供指导作用.
1 材料和方法
1.1 实验装置-SNAD生物膜反应器
图1为SNAD生物膜反应器.反应器为圆柱形结构,有效容积为89.5L(高径比为2.07).反应器采用SBR运行方式,周期运行完毕之后马上进行下一个周期,反应器内填充鲍尔环作为生物膜载体(K3载体, AnoxKaldnes,北京),鲍尔环的直径为25mm,分成多个小格,每个小格的直径为4mm,鲍尔环堆积体积为34L,反应器有效盛水容积为77.7L,排水比为81%.图2为鲍尔环生物膜照片.在底部设置曝气盘,采用温度控制箱在线监测并控制反应器内水温,反应器侧壁(距底部以上20cm处)安装水力搅拌器,排水口设置在底部以上20cm处,排水口直径为20mm.在反应器稳定运行阶段,曝气量控制为500L/h,温度为30℃.

图1 SBR反应器示意Fig.1 The schematic diagram of SBR reactor

图2 SNAD生物膜反应器中鲍尔环照片Fig.2 The photo of Kaldnes ring in SNAD biofilm reactor
1.2 SNAD生物膜反应器运行工况
周期运行工况为:进水(5min),间歇曝气循环(曝气20min/混合20min),后曝气(20min),沉淀(10min),排水(10min),静置(1min).间歇曝气循环次数为6次.曝气和混合阶段反应器内的平均溶解氧浓度分别为5.6mg/L和0mg/L.反应器进水为北京工业大学家属区生活污水,试验阶段主要水质指标如下: CODCr200~300mg/L; NH4+-N 60~80mg/L; NO2--N <1mg/L; NO3--N <1mg/L;TOC 50~60mg/L; TN 100~140mg/L; pH为7.5~8.0;碱度300~400mg/L.
1.3 批试实验装置及其运行条件
通过批试实验测定厌氧氨氧化活性.批试实验采用1000mL烧杯,烧杯内放置50个鲍尔环,进行3次平行重复实验.鲍尔环取自稳定运行的SNAD生物膜反应器,实验前将鲍尔环置于30℃自来水中洗去表面的残留基质.批试实验采用人工配水,配水氮素组分为NH4Cl, NaNO2.其他微量元素组分浓度参照Tang等[15]的文献.批试过程中采用HCl和NaOH实时调节pH.为了研究氨氮浓度对厌氧氨氧化活性的影响,批试过程中pH控制为7.0(M1),固定NO2--N浓度为70mg/L,NH4+-N浓度设定为70 mg/L, 100 mg/L, 300 mg/L, 500 mg/L, 700 mg/L, 900 mg/L, 1100 mg/L,1300 mg/L, 1500 mg/L, 1700 mg/L, 1900 mg/L和2100 mg/L.为了研究高FA条件下氨氮浓度对厌氧氨氧化活性的影响,批试过程中pH控制为8.0(M2).
厌氧氨氧化活性测定步骤参照文献[16-17]:①配置泥水混合液; ②启动恒温磁力搅拌器,转速为500r/min,用保鲜膜密封烧杯口,通氮气10min(氮气纯度99.999%); ③停止通氮气,将烧杯连同磁力搅拌器放入30℃的恒温培养箱中.每隔一定时间取样测定主要组分浓度.污泥的厌氧氨氧化活性计算根据公式1.

式中:浓度单位为mg/L;计时终点单位为min; 挥发性物质质量单位为g.计时终点的确定:若在取样的时间内,批试装置内的NH4+-N或NO2--N浓度低于10mg/L,则以NH4+-N或NO2--N浓度刚低于10mg/L的取样时刻为计时终点;若在取样的时间内,批试装置内的NH4+-N或NO2--N浓度始终高于10mg/L,则以取样结束的时刻为计时终点.污泥活性单位为: kg N/(kg VSS·d).
1.4 底物抑制模型
采用Haldane模型拟合底物浓度对厌氧氨氧化活性的影响根据公式2.

式中:r为底物去除速率, kg N/(kg VSS·d); S为底物浓度, mg/L; rmax为最大底物去除速率, kg N/(kg VSS·d); Ks为半速率常数, mg/L; KI为抑制常数, mg/L.
1.5 分析方法
NH4+-N:纳氏试剂光度法; NO2--N:N-(1-萘基)-乙二胺分光光度法; NO3--N:麝香草酚分光光度法; 取NH4+-N, NO2--N和NO3--N浓度之和为TⅠN浓度; DO、pH、温度: WTW/Multi 3420测定仪;CODCr:按中国国家环保局和美国环境总署发布的标准方法测定,考虑NO2--N对COD测定的影响,取[18].
鲍尔环污泥浓度的确定:用牙签刮落鲍尔环表面附着较为松散的生物膜,将残留有生物膜的鲍尔环放于烧杯中,盛适量水,采用超声设备(VCX105PB)进行处理,待鲍尔环表面的生物膜完全脱落,将超声后的泥水混合液和前面的松散污泥混合用滤纸过滤,将截留污泥的滤纸经烘箱和马弗炉处理,烘干时间及温度同常规污泥浓度测量条件相同,得到鲍尔环污泥的干物质量和挥发性物质质量.
FA的计算公式3参照文献[19].
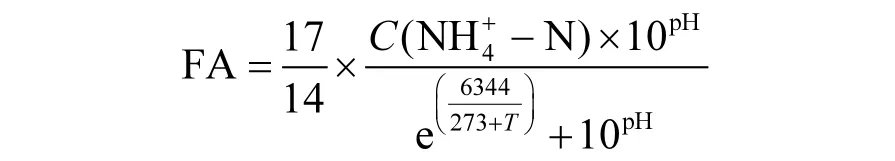
式中:T为温度(℃); C为浓度(mg/L).
2 结果与讨论
2.1 SNAD生物膜反应器的脱氮性能
图3表明了稳定运行阶段SNAD生物膜反应器的脱氮性能和COD去除特性.反应器进水NH4+-N和COD浓度平均值分别为70mg/L和180mg/L,出水NH4+-N, NO2--N, NO3--N和COD浓度平均值分别为2mg/L, 2mg/L, 7mg/L和50mg/L.反应器的NH4+-N和COD平均进水负荷分别为0.27kg N/(m3·d)和0.67kg COD/(m3·d), COD平均去除率为71%, TⅠN去除率为80%~90%, TⅠN平均去除负荷为0.22kg TⅠN/(m3·d).

图3 SNAD生物膜反应器的脱氮性能和COD去除性能Fig.3 The nitrogen and COD removal performance of the SNAD biofilm reactor
2.2 适宜氨氮浓度SNAD生物膜的厌氧氨氧化活性
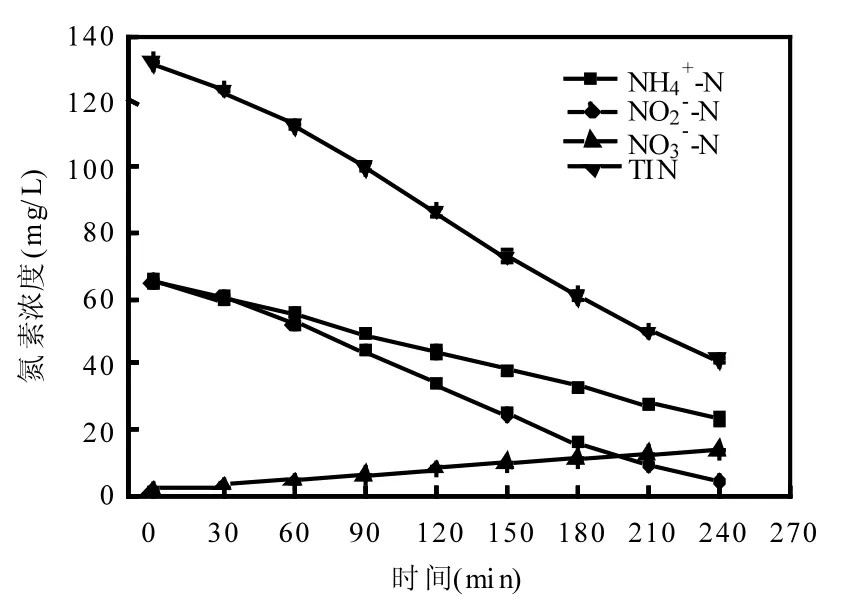
图4 适宜NH4+-N浓度SNAD生物膜的厌氧氨氧化活性Fig.4 Anammox activity of SNAD biofilm with appropriate NH4+-N concentration
图4为厌氧氨氧化批试过程中的氮素浓度变化情况.在适宜的氨氮浓度条件下, SNAD生物膜表现出良好的厌氧氨氧化活性.初始NH4+-N和NO2--N浓度都为70mg/L,随着反应的进行, NH4+-N和NO2--N浓度逐渐降低, NO3--N浓度逐渐上升. △NO2--N/△NH4+-N(摩尔比)=1.45, △NO3--N/△NH4+-N(摩尔比)=0.29,和Strous等[7]的研究结果相近.厌氧氨氧化批试NH4+-N、NO2--N和TⅠN去除速率分别为0.121kg N/(kg VSS·d), 0.180kg N/(kg VSS·d)和0.267kg N/(kg VSS·d).
Strous等[20]和Kieling等[21]采用人工配水运行厌氧氨氧化反应器,污泥的厌氧氨氧化活性分别为0.18kg N/(kg VSS·d)和0.19kg N/(kg VSS·d). Tang等[22]控制温度为35℃,在高浓度基质条件下利用UASB反应器培养厌氧氨氧化颗粒污泥,污泥的厌氧氨氧化活性为1.7kg N/(kg VSS·d).本研究污泥的厌氧氨氧化活性与Strous[20]和Kieling等[21]的研究结果相似,但是低于Tang等[22]的研究结果. Tang等[22]的反应器进水底物浓度较高,厌氧氨氧化菌以颗粒污泥的形式存在,颗粒污泥生物量大,有助于缓解高底物浓度对厌氧氨氧化菌的抑制,表现出较高的活性.但是本研究采用生活污水运行SNAD生物膜反应器,进水NH4+-N浓度平均值仅为70mg/L;而且SNAD生物膜由亚硝化菌,厌氧氨氧化菌和反硝化菌等微生物组成,厌氧氨氧化菌的生物量较小.所以SNAD生物膜的厌氧氨氧化活性低于Tang等[22]的研究结果.
Strous等[23]的研究表明当氧分压超过0.5%的空气饱和度时,厌氧氨氧化菌的厌氧氨氧化活性将会受到抑制.本研究曝气和混合阶段反应器内的平均溶解氧浓度分别为5.6mg/L和0mg/L. SNAD生物膜的厌氧氨氧化活性没有受到抑制.可能的原因为本研究厌氧氨氧化菌位于SNAD生物膜的内部,生物膜对溶解氧的传质具有阻碍作用[24-25],有助于缓解溶解氧对厌氧氨氧化菌的抑制作用;同时,异养菌和AOB倾向于生长在生物膜的外表面,厌氧氨氧化菌倾向于生长在生物膜的内部[26-27];生物膜表面的AOB和异养菌对于溶解氧的消耗有助于维持生物膜内部较低的溶解氧浓度;此外,本研究SNAD生物膜反应器采用间歇曝气运行方式,厌氧氨氧化菌在缺氧混合阶段可以利用曝气阶段产生的亚硝态氮和反应器中的氨氮进行厌氧氨氧化,有助于缓解曝气阶段溶解氧的抑制作用.
2.3 氨氮对厌氧氨氧化NO2--N去除速率的影响

图5 不同NH4+-N 浓度下的厌氧氨氧化批试NO2--N浓度变化Fig.5 Evolution of NO2--N concentrations for Anammox process with different NH4+-N concentrations
图5为氨氮浓度对厌氧氨氧化影响批试过程中NO2--N浓度的变化情况.图6为不同氨氮浓度条件下厌氧氨氧化NO2--N的去除速率.随着氨氮浓度的增加,M1和M2的NO2--N去除速率逐渐减小.M1和M2的NO2--N最大去除速率分别为0.157kg N/(kg VSS·d)和0.190kg N/(kg VSS·d).当M1和M2的NH4+-N浓度分别为700mg/L和900mg/L时, M1和M2的厌氧氨氧化反应NO2--N去除速率分别为最大速率的50.3%和49.0%. Strous等[7]的研究表明NH4+-N浓度为980mg/L时不会抑制厌氧氨氧化活性.但是Dapena-Mora等[8]的批试研究表明NH4+-N浓度为770mg/L时,厌氧氨氧化活性被抑制50%.本研究结果和Dapena-Mora等[8]的研究较为接近.
Haldane模型对NH4+-N浓度的自抑制作用拟合结果如图6所示(R12=0.937,R22=0.949). M1
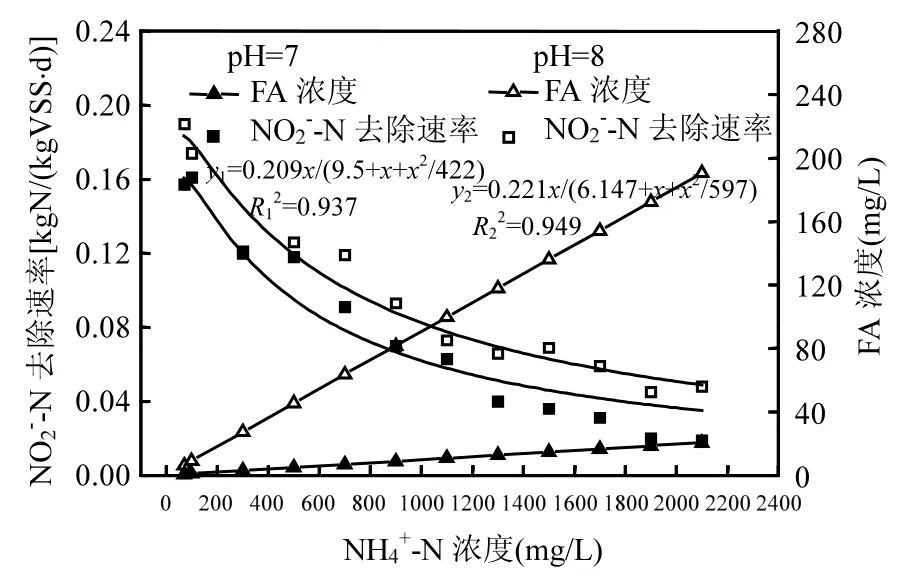
图6 NH4+-N浓度对厌氧氨氧化批试NO2--N去除速率的影响Fig.6 Effect of NH4+-N concentrations on the NO2--N removal rate of Anammox process
和M2的最大NO2--N理论去除速率rmax分别为0.209kg N/(kg VSS·d)和0.221kg N/(kg VSS·d),氨氮半饱和常数Ks分别为9.5mg/L和6.1mg/L,氨氮自身抑制常数KI分别为422mg/L和597mg/L.陈婷婷等[28]采用高浓度基质培养厌氧氨氧化颗粒污泥,进水NH4+-N和NO2--N浓度分别为707.9mg/L和768.1mg/L,动力学研究表明厌氧氨氧化最大亚硝态理论去除速率rmax为0.305kg N/(kg VSS·d),氨氮半饱和常数Ks为36.75mg/L,氨氮自身的抑制常数KI为887.1mg/L.本研究采用生活污水培养厌氧氨氧化菌,进水NH4+-N浓度平均值为70mg/L,厌氧氨氧化菌没有适应高NH4+-N浓度的抑制,所以氨氮半饱和常数和氨氮自身抑制常数都低于陈婷婷等[28]的研究结果. Strous等[29]研究表明对于粒径小于50µm的厌氧氨氧化污泥,厌氧氨氧化菌对氨氮的半饱和常数小于0.1mg/L.本研究的厌氧氨氧化菌位于SNAD生物膜内部,生物膜具有一定的传质阻力,所以氨氮的半饱和常数高于Strous[29]的研究结果.但是,本研究厌氧氨氧化菌的氨氮半饱和常数小于10mg/L,对于低氨氮浓度的废水处理具有重要意义.
Martinelle等[30]的研究表明FA能够穿透细胞膜进入细胞,破坏细胞内pH值,从而对细胞产生影响.前人的研究表明FA对厌氧氨氧化活性起抑制作用[10,12].Fernández等[10]的批试研究表明FA浓度为38mg/L时,厌氧氨氧化菌的活性被抑制50%.到目前为止,鲜有研究将氨氮和游离氨对厌氧氨氧化活性的主要抑制作用加以区分.本研究中, M1的FA浓度为0.7~20.4mg/L, M2的FA浓度为6.3~190.5mg/L. Haldane模型结果表明M2的最大亚硝态理论去除速率和氨氮抑制常数比M1高,氨氮半饱和常数比M1更低.虽然M2的FA浓度较M1高,但是M2的厌氧氨氧化性能比M1更好, FA没有对M2产生强烈的抑制作用,原因可能为厌氧氨氧化反应的最适pH为8[29,31],同时生物膜存在传质阻碍[24-25],有助于缓解FA对厌氧氨氧化菌的抑制.
当M1和M2的FA浓度分别为6.8mg/L(NH4+-N浓度为700mg/L)和81.6mg/L (NH4+-N浓度为900mg/L)时, M1和M2的厌氧氨氧化反应NO2--N去除速率分别为最大速率的50.3%和49.0%.当NH4+-N浓度分别为2100mg/L和300mg/L时,M1和M2对应的FA浓度分别为20.4mg/L和27.2mg/L, M1和M2的厌氧氨氧化NO2--N去除速率分别为0.019kg N/(kg VSS·d)和0.121kg N/(kg VSS·d), M1的厌氧氨氧化NO2--N去除速率仅为M2的15.7%.这些结果表明氨氮对厌氧氨氧化的抑制起主要作用.
3 结论
3.1 SNAD生物膜反应器可以有效地去除生活污水中的氮素和有机物.稳定运行阶段,SNAD生物膜反应器的进水NH4+-N和COD平均值分别为70mg/L和180mg/L,出水NH4+-N, NO2--N,NO3--N和COD浓度平均值分别为2mg/L,2mg/L, 7mg/L和50mg/L.COD平均去除率为71%. TⅠN去除率为80%~90%, TⅠN平均去除负荷为0.22kg TⅠN/(m3·d).
3.2 SNAD生物膜具有良好的厌氧氨氧化活性.初始NH4+-N和NO2--N浓度都为70mg/L时,厌氧氨氧化批试NH4+-N、NO2--N和TⅠN去除速率分别为0.121kg N/(kg VSS·d), 0.180kg N/(kg VSS·d)和0.267kg N/(kg VSS·d).生物膜对溶解氧传质的阻碍作用,生物膜表面AOB和异养菌对于溶解氧的消耗和间歇曝气运行方式是缓解高溶解氧对厌氧氨氧化菌抑制作用的关键因素.
3.3 Haldane模型可以很好的拟合氨氮浓度对厌氧氨氧化活性的影响.在高FA和低FA工况下氨氮浓度对厌氧氨氧化活性的抑制动力学常数相差不大. M1 (FA浓度为0.7~20.4mg/L)和M2(FA浓度为6.3~190.5mg/L)的最大NO2--N理论去除速率rmax分别为0.209kg N/(kg VSS·d)和0.221kg N/(kg VSS·d),氨氮半饱和常数Ks分别为9.5mg/L和6.1mg/L,氨氮自身抑制常数KI分别为422mg/L和597mg/L.氨氮(而不是游离氨)对SNAD生物膜厌氧氨氧化活性起主要抑制作用.
[1] Bagchi S, Biswas R, Nandy T. Autotrophic ammonia removal processes: ecology to technology [J]. Critical Reviews in Environmental Science and Technology, 2012,42(13):1353-1418.
[2] Daverey A, Chen Y C, Dutta K, et al. Start-up of simultaneous partial nitrification, anammox and denitrification (SNAD) process in sequencing batch biofilm reactor using novel biomass carriers[J]. Bioresource Technology, 2015,190:480-486.
[3] 郑照明,李泽兵,刘常敬,等.城市生活污水SNAD工艺的启动研究 [J]. 中国环境科学, 2015,35(4):1072-1081.
[4] Wang C C, Lee P H, Kumar M, et al. Simultaneous partial nitrification, anaerobic ammonium oxidation and denitrification(SNAD) in a full-scale landfill-leachate treatment plant [J]. Journal of Hazardous Materials, 2010,175(1-3):622-628.
[5] Zhang X J, Zhang H Z, Ye C M, et al. Effect of COD/N ratio on nitrogen removal and microbial communities of CANON process in membrane bioreactors [J]. Bioresource Technology, 2015,189: 302-308.
[6] Carvajal-Arroyo J M, Puyol D, Li G, et al. Pre-exposure to nitrite in the absence of ammonium strongly inhibits anammox [J]. Water Research, 2014,48(0):52-60.
[7] Strous M, Heijnen J J, Kuenen J G, et al. The sequencing batch reactor as a powerful tool for the study of slowly growing anaerobic ammonium-oxidizing microorganisms [J]. AppliedMicrobiology and Biotechnology, 1998,50(5):589-596.
[8] Dapena-Mora A, Fernandez Ⅰ, Campos J L, et al. Evaluation of activity and inhibition effects on Anammox process by batch tests based on the nitrogen gas production [J]. Enzyme and Microbial Technology, 2007,40(4):859-865.
[9] Lotti T, van der Star W R L, Kleerebezem R, et al. The effect of nitrite inhibition on the anammox process [J]. Water Research,2012,46(8):2559-2569.
[10] Fernández Ⅰ, Dosta J, Fajardo C, et al. Short- and long-term effects of ammonium and nitrite on the Anammox process [J]. Journal of Environmental Management, 2012,95,Supplement(0): S170-S174.
[11] Puyol D, Carvajal-Arroyo J M, Sierra-Alvarez R, et al. Nitrite(not free nitrous acid) is the main inhibitor of the anammox process at common pH conditions [J]. Biotechnology letters,2014,36(3):547-551.
[12] Jung J Y, Kang S H, Chung Y C, et al. Factors affecting the activity of anammox bacteria during start up in the continuous culture reactor [J]. Water Science and Technology, 2007,55(1/2): 459-468.
[13] Cho S, Takahashi Y, Fujii N, et al. Nitrogen removal performance and microbial community analysis of an anaerobic up-flow granular bed anammox reactor [J]. Chemosphere, 2010,78(9): 1129-1135.
[14] Kimura Y, Ⅰsaka K, Kazama F, et al. Effects of nitrite inhibition on anaerobic ammonium oxidation [J]. Applied Microbiology and Biothehnology, 2010,86(1):359-365.
[15] Tang C J, Zheng P, Hu B L, et al. Ⅰnfluence of substrates on nitrogen removal performance and microbiology of anaerobic ammonium oxidation by operating two UASB reactors fed with different substrate levels [J]. Journal of Hazardous Materials,2010,181(1-3):19-26.
[16] 汪彩华,郑 平,唐崇俭,等.间歇性饥饿对厌氧氨氧化菌混培物保藏特性的影响 [J]. 环境科学学报, 2013(1):36-43.
[17] Tang C J, Zheng P, Mahmood Q, et al. Start-up and inhibition analysis of the Anammox process seeded with anaerobic granular sludge [J]. Journal of Ⅰndustrial Microbiology and Biotechnology,2009,36(8):1093-1100.
[18] Liang Z, Liu H. Control factors of partial nitritation for landfill leachate treatment [J]. Journal of Environmental Sciences-China,2007,19(5):523-529.
[19] Anthonisen A C, Loehr R C, Prakasam T, et al. Ⅰnhibition of nitrification by ammonia and nitrous-acid [J]. Journal Water Pollution Control Fedration, 1976,48(5):835-852.
[20] Strous M, Vangerven E, Zheng P, et al. Ammonium removal from concentrated waste streams with the anaerobic ammonium oxidation (anammox) process in different reactor configurations[J]. Water Research, 1997,31(8):1955-1962.
[21] Kieling D D, Reginatto V, Schmidell W, et al. Sludge wash-out as strategy for Anammox process start-up [J]. Process Biochemistry, 2007,42(12):1579-1585.
[22] Tang C, Zheng P, Chen T, et al. Enhanced nitrogen removal from pharmaceutical wastewater using SBA-ANAMMOX process [J]. Water Research, 2011,45(1):201-210.
[23] Strous M, Vangerven E, Kuenen J G, et al. Effects of aerobic and microaerobic conditions on anaerobic ammonium-oxidizing(Anammox) sludge [J]. Applied and Environmental Microbiology,1997,63(6):2446-2448.
[24] Vazquez-Padin J R, Fernandez Ⅰ, Morales N, et al. Autotrophic nitrogen removal at low temperature [J]. Water Science and Technology, 2011,63(6):1282-1288.
[25] Rathnayake R M L D, Song Y, Tumendelger A, et al. Source identification of nitrous oxide on autotrophic partial nitrification in a granular sludge reactor [J]. Water Research, 2013,47(19): 7078-7086.
[26] Volcke E, Picioreanu C, De Baets B, et al. Effect of granule size on autotrophic nitrogen removal in a granular sludge reactor [J]. Environmental Technology, 2010,31(11):1271-1280.
[27] Winkler M, Yang J J, Kleerebezem R, et al. Nitrate reduction by organotrophic Anammox bacteria in a nitritation/anammox granular sludge and a moving bed biofilm reactor [J]. Bioresource Technology, 2012,114:217-223.
[28] Chen T, Zheng P, Shen L, et al. Kinetic characteristics and microbial community of Anammox-EGSB reactor [J]. Journal of Hazardous Materials, 2011,190(1—3):28-35.
[29] Strous M, Kuenen J G, Jetten M. Key physiology of anaerobic ammonium oxidation [J]. Applied and Environmental Microbiology, 1999,65(7):3248-3250.
[30] Martinelle K, Westlund A, Haggstrom L. Ammonium ion transport - A cause of cell death [J]. Cytotechnology, 1996,22(1-3):251-254.
[31] Egli K, Fanger U, Alvarez P, et al. Enrichment and characterization of an anammox bacterium from a rotating biological contactor treating ammonium-rich leachate [J]. Archives of Microbiology, 2001,175(3):198-207.
The kinetic coefficients of ammonium inhibition on the Anammox activity of SNAD biofilm.
ZHENG Zhao-ming, LI Jun*, MA Jing, DU Jia, ZHAO Bai-hang (The College of Architecture and Civil Engineering, Beijing University of Technology, Beijing 100124, China). China Environmental Science, 2016,36(10):2957~2963
The effect of ammonium concentrations on the anaerobic ammonium oxidation (Anammox) activity of simultaneous partial nitrification, anaerobic ammonium oxidization and denitrification (SNAD) biofilm was investigated in batch tests. The SNAD biofilm reactor performed stable nitrogen removal performance with the influent of domestic wastewater. The average influent NH4+-N and COD concentrations were 70mg/L and 180mg/L, respectively. As a result,the average effluent NH4+-N, NO2--N and NO3--N concentrations were 2mg/L, 2mg/L, 7mg/L and 50mg/L, respectively. The SNAD biofilm performed good Anammox activity. The NH4+-N, NO2--N and total inorganic nitrogen (TIN) removal rates were 0.121kg N/(kg VSS·d), 0.180kg N/(kg VSS·d) and 0.267kg N/(kg VSS·d) with the initial NH4+-N and NO2--N concentrations of both 70mg/L. Moreover, Haldane model was applied to investigate the ammonium inhibition on the Anammox process. There is no obvious difference in kinetic coefficients of ammonium inhibition under high or low FA conditions. As for M1 (FA ranges of 0.7mg/L and 20.4mg/L), the rmax, Ks and KIof ammonium were 0.209kg NO2--N/(kg VSS·d), 9.5mg/L and 422mg/L. As for M2 (FA ranges of 6.3mg/L and 190.5mg/L), the rmax, Ks and KIof ammonium were 0.221kg NO2--N/(kg VSS·d), 6.1mg/L and 597mg/L. Ammonium rather than FA is the main inhibitor for Anammox process.
SNAD biofilm;Anammox;ammonium;inhibition;kinetic characteristics
X703.5
A
1000-6923(2016)10-2957-07
郑照明(1989-),男,浙江嵊州市人,北京工业大学博士研究生,主要从事厌氧氨氧化,亚硝化和SNAD工艺研究.发表论文4篇.
2016-01-30
国家水体污染控制与治理科技重大专项(2014ZX 07201-011); 16人才培养质量建设-双培养计划新兴专业建设(004000542216031);教育部博士点新教师(20131103120017);北京市博士后工作经费资助项目(2015ZZ-10)
* 责任作者, 教授, jglijun@bjut.edu.cn
