山羊IFN-γ免疫血清制备及抗体ELISA检测方法的建立
2017-01-04刘鹤媛岳进华张洪杰陈德坤
刘鹤媛,周 铭,岳进华,张洪杰,陈德坤
(西北农林科技大学动物医学院,陕西杨凌 712100)
山羊IFN-γ免疫血清制备及抗体ELISA检测方法的建立
刘鹤媛,周 铭,岳进华,张洪杰,陈德坤*
(西北农林科技大学动物医学院,陕西杨凌 712100)
为制备山羊干扰素-γ(IFN-γ)免疫血清并建立山羊IFN-γ抗体ELISA检测方法,以原核表达的山羊γIFN重组蛋白(rIFN-γ)为材料,免疫小鼠制备免疫血清;通过对测定不同的抗原包被浓度及包被时间,酶标抗体稀释度,免疫血清的孵育时间等条件的优化建立检测抗体效价的ELISA检测方法,并采用建立的方法测定免疫血清的抗体效价。结果显示,rIFN-γ抗原包被浓度为10 μg/mL,4 ℃包被12 h;酶标抗体稀释度为1∶5 000;免疫血清孵育时间为60 min,可以得到最佳ELISA的检测结果。重复试验显示该方法变异系数(CV)在1.5%~5%之间。采用建立的方法测得免疫小鼠免疫血清效价为107。该ELISA检测方法灵敏高,稳定性好,为山羊IFN-γ抗体检测提供了技术支持。
山羊;rIFN-γ;免疫血清;酶联免疫吸附试验
γ干扰素(IFN-γ)是一种重要的细胞因子,主要参与细胞免疫[1]。病毒、细胞内寄生菌等病原体入侵机体[2],或肿瘤细胞的产生[3],都会刺激机体产生IFN-γ,诱导巨噬细胞、T细胞、B细胞等细胞MHCⅡ类分子的表达,提高抗原递呈能力;IFN-γ也能活化巨噬细胞、NK细胞等,提高其对病原体的杀伤能力[4],可以反映机体的细胞免疫状态。 近年来,随着山羊集约化养殖的扩大,山羊疫病大规模暴发的现象日益突出,疫病防控工作也变得尤为重要。以IFN-γ为评估指标,可以评估机体细胞免疫水平,为疫病防控工作提供参考。目前,已见有关于其他动物IFN-γ的ELISA检测方法[5-6],但尚未见有关山羊IFN-γ的检测方法。本试验拟建立抗IFN-γ抗体ELISA检测方法,为后续制备抗山羊IFN-γ单克隆抗体,建立山羊IFN-γ的ELISA检测方法打下基础,也为临床监测评估山羊免疫状态提供有效的手段。
1 材料与方法
1.1 材料
1.1.1 实验动物 雌性Balb/c小鼠,6周龄~8周龄,购自第四军医大学实验动物中心。
1.1.2 主要试剂与仪器 未除盐的纯化山羊rIFN-γ冻干粉,为西北农林科技大学动物医学院兽医免疫学实验室保存;弗氏完全佐剂、弗氏不完全佐剂为Sigma公司产品;羊抗小鼠IgG酶标抗体为北京博奥森生物公司产品;TMB显色液为天根生化科技(北京)有限公司产品;酶标仪为Bio-Rad公司产品;酶标板为Castor公司产品;其他试剂为进口或国产分析纯。
1.2 方法
1.2.1 抗原制备 将纯化的山羊rIFN-γ冻干粉溶于蒸馏水,配制成1 mg/mL的液体,取弗氏完全佐剂与rIFN-γ等量混匀,用三通管进行乳化,乳化约1 h后,取1滴乳化物置于静止水面,乳化物1 min内不散开,表明乳化达到目的,此免疫原供小鼠首次免疫使用。按照同样的方法制备rIFN-γ与弗氏不完全佐剂乳化的免疫原,供第2次免疫使用。rIFN-γ水剂抗原直接用蒸馏水溶解,制备成1 mg/mL即可。上述3种免疫原制备完成后,4℃保存,供1周内小鼠免疫使用。
1.2.2 小鼠免疫及免疫血清制备 第1次免疫小鼠,按照100 μL/只,腹部皮下多点注射(50 μL/点);首免后14 d,进行第2次免疫,免疫剂量同第1次,免疫部位选择第1次未注射抗原的腹部皮下位点(50 μL/点);2免后第14天,用水剂抗原免疫小鼠,免疫剂量为100 μL/只,腹腔注射。之后每隔1周,用水剂抗原加强免疫小鼠1次,免疫剂量和途径同第3次免疫。末次免疫后10 d左右,摘眼球法采集免疫小鼠血液并分离血清,此为免疫血清(阳性血清)。另采集未免小鼠血液并分离血清,作为阴性血清。血清置-20℃保存备用。
1.2.3 间接ELISA操作方法 用pH9.6 、0.1 mol/L碳酸盐缓冲液稀释包被抗原(山羊rIFN-γ),100 μL/孔,4 ℃包被过夜;次日弃去孔内液体,用pH7.4 含0.5 mL/L的Tween-20的PBS(PBST)洗涤2~3遍(以下简称洗涤),加入50 g/L脱脂奶粉,100 μL/孔,37℃封闭1 h;弃去封闭液,洗涤,加入pH7.4的PBST稀释的小鼠抗血清,并设阴性对照(阴性血清),100 μL/孔,37℃孵育1 h;弃去小鼠血清,洗涤,加入羊抗小鼠IgG酶标二抗,100 μL/孔,37 ℃孵育1 h;弃去酶标二抗,洗涤,加入TMB显色液,100 μL/孔,避光孵育15 min;加入2 mol/L硫酸,100 μL/孔,终止反应,置于酶标仪,读取OD450 nm值。待测孔OD450 nm值(P)比阴性对照孔OD450 nm值(N)大于或等于2.1(即P/N≥2.1)时,待测孔判为阳性孔。
1.2.4 羊抗小鼠IgG酶标抗体最佳稀释比例的确定 用PBST稀释羊抗小鼠IgG酶标抗体,按照1∶1 000、1∶3 000、1∶5 000、1∶7 000、1∶10 000的比例稀释,每一稀释度做3个重复,100 μL/孔,37 ℃包被2 h;弃去孔内液体,用PBST洗涤3次,以50 g/L脱脂奶粉作为封闭液,100 μL/孔,37℃封闭1 h;弃去孔内液体,用PBST洗涤3次,加入TMB显色液,100 μL/孔,避光孵育15 min;加入2 mol/L的硫酸,100 μL/孔,终止反应,置于酶标仪,取OD450 nm值最接近1.0的孔对应的羊抗小鼠IgG酶标抗体稀释比例为最佳稀释比例。
1.2.5 抗原包被浓度及包被时间的确定 用pH 9.6、0.1 mol/L碳酸盐缓冲液10倍连续稀释山羊rIFN-γ为100.00、10.00、1.00、0.100 μg/mL,每一浓度的抗原分别与阳性、阴性血清反应,按照上述间接ELISA操作方法,检测不同浓度包被抗原所对应的OD450 nm值。以P/N值最大的孔所对应的抗原包被浓度为最佳抗原包被浓度。 以最佳抗原包被浓度将抗原包被10、11、12、13、14 h,并按照上述间接ELISA操作方法,检测不同包被时间所对应的OD450 nm值,以OD450 nm值趋于稳定后对应的最短包被时间为最佳包被时间。
1.2.6 血清孵育时间的确定 取小鼠阳性血清,用PBST以1∶1 000稀释,按照上述ELISA操作方法,分别孵育30 、45、60、75、90 min,检测不同孵育时间对应的OD450 nm值,以OD450 nm值稳定后对应的最短孵育时间为最佳孵育时间。
1.2.7 重复试验 取一份小鼠阳性血清分为A、B、C 3等份,分别在3个不同时间段,按照优化条件,进行间接ELISA操作,检测不同时间所得OD450 nm值,根据统计结果计算变异系数(CV)。
1.2.8 抗山羊rIFN-γ免疫血清效价的测定 用PBST稀释阳性血清(抗rIFN-γ抗体)及阴性血清,均按照1∶103、1∶104、1∶105、1∶106、1∶107、1∶108、1∶109、1∶1010的比例稀释,并按照优化条件进行ELISA操作,检测阴、阳性血清按照不同比例稀释时所得OD450 nm值,以P/N≥2.1为阳性结果,测免疫血清抗体效价。
2 结果
2.1 羊抗小鼠IgG酶标抗体稀释度优化结果
将羊抗小鼠IgG酶标抗体按照不同比例稀释后,经ELISA检测,OD450 nm值见表1,酶标抗体的稀释度为1∶5 000时,OD450 nm值最接近1.0,为最佳稀释度。
2.2 山羊 rIFN-γ包被浓度优化结果
山羊rIFN-γ作为包被抗原,稀释为不同浓度后,经ELISA检测,当包被抗原浓度为10 μg/mL时,所得P/N值最大,因此,抗原的最佳包被浓度为10 μg/mL(表2)。
2.3 山羊rIFN-γ包被时间优化结果
当包被时间超过12 h(包括12 h)后,OD450 nm值趋于稳定,因此,山羊rIFN-γ的最佳包被时间为12 h(表3)。
2.4 免疫血清孵育时间
小鼠阳性血清不同孵育时间所对应的OD450 nm值见表4,当孵育时间超过60 min(包括60 min)后,OD450 nm值趋于稳定,因此,小鼠血清的最佳孵育时间为60 min。
2.5 重复性试验
根据公式,变异系数(CV)=(标准差SD/平均值Mean)×100%,计算不同时间同一小鼠阳性血清ELISA检测结果的变异系数(表5),ELISA检测结果的变异系数(CV)在1.5%~5%,说明该间接ELISA检测方法具有较好的重复性和稳定性。
2.6 抗山羊rIFN-γ免疫血清抗体效价检测结果
将阴、阳性血清按照不同比例稀释后,所得OD450 nm及P/N值见表6,根据P/N值可知抗山羊IFN-γ免疫血清抗体效价为107。
表1 羊抗小鼠IgG酶标抗体稀释度检测结果
Table 1 The determinition result of goat anti-mouse IgG-HRP dilutions

项目Item酶标抗体稀释度IgG-HRPdilution1∶10001∶30001∶50001∶70001∶10000OD450nm1.453±0.0741.209±0.0531.034±0.0430.892±0.0320.783±0.017
表 2 山羊rIFN-γ包被浓度优化结果
Table 2 The optimization result of coating concentration of goat rIFN-γ

rIFN-γ浓度/(μg·mL-1)rIFN-γconcentrationOD450nm阳性血清(P)Positiveserum阴性血清(N)NegativeserumP/N100.001.446±0.0220.076±0.01319.0310.001.267±0.0320.063±0.00920.111.001.203±0.0180.074±0.01116.260.100.412±0.0130.056±0.0087.36
表3 山羊rIFN-γ包被时间
Table 3 The coating time of goat rIFN-γ

项目Item包被时间/hCoatingtime1011121314OD450nm0.842±0.0730.937±0.0831.032±0.0381.041±0.0221.037±0.019
表4 免疫血清孵育时间
Table 4 The incubation time of immune serum

项目Item孵育时间/minIncubationtime3045607590OD450nm0.768±0.0920.896±0.0431.043±0.0381.037±0.0231.041±0.016
表5 间接ELISA检测方法的重复性试验结果
Table 5 Repetitive test results of indirect ELISA method
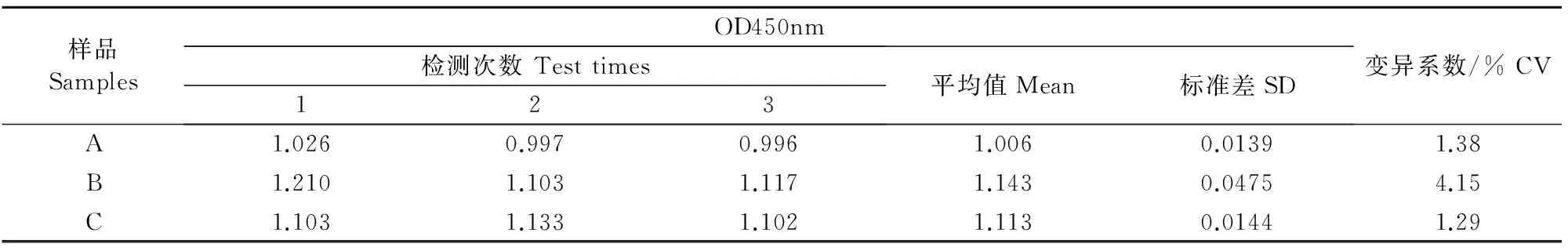
样品SamplesOD450nm检测次数Testtimes123平均值Mean标准差SD变异系数/%CVA1.0260.9970.9961.0060.01391.38B1.2101.1031.1171.1430.04754.15C1.1031.1331.1021.1130.01441.29
表6 抗山羊rIFN-γ抗体效价测定结果
Table 6 Potency test results of antibody against goat rIFN-γ
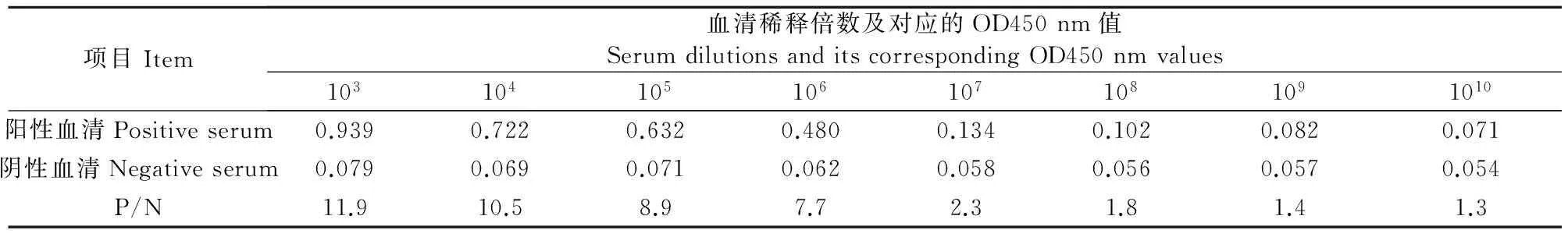
项目Item血清稀释倍数及对应的OD450nm值SerumdilutionsanditscorrespondingOD450nmvalues1031041051061071081091010阳性血清Positiveserum0.9390.7220.6320.4800.1340.1020.0820.071阴性血清Negativeserum0.0790.0690.0710.0620.0580.0560.0570.054P/N11.910.58.97.72.31.81.41.3
3 讨论
IFN-γ由天然免疫系统的NK细胞分泌,在特异性免疫反应中主要由活化的Th1、CTL分泌。NK细胞、活化Th1和CTL数量越多,IFN-γ分泌量就越多,体内IFN-γ水平就越高,机体抗病毒等免疫功能就越强。准确测定IFN-γ含量,对于评估机体细胞免疫功能状态极为重要。通常测定IFN-γ水平,主要应用抗IFN-γ单抗试剂盒[8-9]。目前市面未见山羊IFN-γ检测试剂盒,主要原因是未有山羊IFN-γ单抗研制成功,这极大地限制了山羊免疫学基础研究,以及相关的疫苗免疫效果评估等工作。本研究建立的山羊IFN-γ抗体ELISA检测方法,对于实验室后续研制山羊单抗工作奠定了基础。
无论是制备山羊IFN-γ免疫血清还是山羊IFN-γ单抗,对IFN-γ都具有特别要求。纯化的天然IFN-γ无论是用于免疫原还是包被抗原,都是最理想的抗原,但实际工作中这一思路的可行性较差。实验室研发细胞因子单抗,首选免疫原通常考虑原核表达产物,主要基于其易于纯化并且可大量获得[10],但要求原核表达的细胞因子必须和天然分子之间具有相同的功能性B细胞表位。本实验室前期已成功获得了纯化的具有免疫活性的山羊IFN-γ原核表达产物[7],该产物能够抑制羊口疮病毒(ORFV)感染山羊胎儿成纤维细胞,具有良好的抗病毒生物学活性,表明该产物具有与山羊天然IFN-γ相同免疫活性,二者在活性相关的结构部位可能存在相同的功能性B细胞表位。以此为基础所制备的免疫血清和建立的IFN-γ抗体ELISA检测方法,无疑具有识别山羊IFN-γ活力,为山羊IFN-γ研究和水平测定提供了可行的技术手段。影响ELISA测定结果的因素较多,关键因素包括抗原包被浓度及时间、酶标抗体稀释度、免疫血清孵育时间等,这些因素中的任何一个因素优化条件不到位,都会对测定结果的特异性和灵敏度产生影响。本研究优化结果显示包被抗原浓度为10 μg/mL。无论包被抗原浓度高于还是低于这一浓度,P/N值均会降低,偏离此包被浓度愈远,灵敏度愈低;在确定酶标抗体稀释度时,参考稀释范围为1∶1 000~1∶10 000,本研究设计5个不同的稀释比例,优化的稀释比例为1∶5 000。这一优化结果既避免了酶标抗体的浪费,又保证了所得结果的可靠性;当抗原包被时间为12 h,小鼠血清孵育时间为60 min时,OD450 nm值不再随时间的延长而增加,表明此时各自的反应充分。按照以上优化条件重复ELISA操作,结果发现变异系数保持在1.5%~5%之间,且利用该ELISA方法所测得的小鼠阳性血清的稳定效价为107,表明本研究建立的方法具有良好的稳定性。
[1] 金伯泉. 细胞与分子免疫学[M]. 北京: 科学出版社, 2006: 183-184.
[2] Almanzar G, Schmalzing M, Trippen R, et al. Significant IFNγ responses of CD8+T cells in CMV-seropositive individuals with autoimmune arthritis[J]. J Clin Virol,2016, 77: 77-84.
[3] Briesemeister D, Sommermeyer D, Loddenkemper C, et al. Tumor rejection by local interferon gamma induction in established tumors is associated with blood vessel destruction and necrosis[J]. Int J Cancer,2011, 128(2): 371-378.
[4] Young H A, Bream J H. IFN-gamma: recent advances in understanding regulation of expression, biological functions, and clinical applications[J]. Curr Top Microbiol Immunol,2007, 316: 97-117.
[5] 张改梅,贾 红,侯绍华,等. 检测牛IFN-γ双抗体夹心ELISA的建立及在牛结核病诊断上的初步应用[J]. 畜牧兽医学报,2014(10): 1693-1698.
[6] 李志中. 抗鸡γ-干扰素单克隆抗体的制备及定量抗原ELISA检测方法的建立[D]. 内蒙古呼和浩特:内蒙古农业大学, 2007.
[7] 安 贝. 山羊IFN-γ基因的克隆表达及抗ORFV活性鉴定[D]. 陕西杨凌:西北农林科技大学, 2014.
[8] 杨永辉. 一种γ-干扰素定量检测方法及试剂盒[P]. 中国专利: CN201510037981.1, 2015-4-29.
[9] 陈利苹, 刘思国, 朱海波, 等. 一种抗天然牛γ-干扰素的单克隆抗体,分泌该抗体的杂交瘤细胞株及应用[P]. 中国专利: CN201410668539.4, 2015-4-29.
[10] 朱玉贤. 现代分子生物学[M]. 北京: 高等教育出版社, 2007.
Preparation of Goat IFN-γ Immune Serum and Establishment of an ELISA for Detecting Antibodies
LIU He-yuan,ZHOU Ming,YUE Jin-hua,ZHANG Hong-jie,CHEN De-kun
(CollegeofVeterinaryMedicine,NorthwestA&FUniversity,Yangling,Shaanxi, 712100,China)
In order to prepare immune serum against goat IFN-γ and develop a method of ELISA, Balb/c mice were immunized with recombinant goat IFN-γ (rIFN-γ) expressed prokaryotically to produce immune serum, and then the coating concentration and time of rIFN-γ, the HRP-IgG dilution, and incubation time of the immune serum were all determined to optimize the ELISA method. And the potency of immune serum was also detected. The results suggested that an optimized ELISA result could be acquired when rIFN-γ was coated at 4℃ for 12 h in a concentration of 10 μg/mL, HRP-IgG was diluted at 1∶5 000, and the immune serum was incubated for 60 min. The repeated experiments suggested that the coefficient of variation (CV) varied between 1.5% and 5%. The immune serum potency was proved to be 107. This ELISA method with high sensitivity and stability could provide a strong requirement for goat IFN-γ detection.
goat; rIFN-γ; immune serum; ELISA
2016-04-12
陕西省科技统筹创新工程计划项目(2015KTTSNY04-04)
刘鹤媛(1989-),女,河南周口人,硕士研究生,主要从事兽医病原学与免疫学研究。 *通讯作者
S852.4
A
1007-5038(2016)12-0024-04