超临界及亚临界萃取澳洲薄荷挥发性成分的对比
2016-12-05谢红旗刘雪辉刘东波
张 思 谢红旗,3,4 刘雪辉 王 靖 刘东波,3,4
(1. 国家中医药管理局亚健康干预技术实验室,湖南 长沙 410128;2. 湖南农业大学园艺园林学院,湖南 长沙 410128;3. 湖南省作物种质创新与资源利用重点实验室,湖南 长沙 410128;4. 湖南省植物功能成分利用协同创新中心,湖南 长沙 410128)
超临界及亚临界萃取澳洲薄荷挥发性成分的对比
张 思1,2谢红旗1,2,3,4刘雪辉1,2王 靖1,2刘东波1,2,3,4
(1. 国家中医药管理局亚健康干预技术实验室,湖南 长沙 410128;2. 湖南农业大学园艺园林学院,湖南 长沙 410128;3. 湖南省作物种质创新与资源利用重点实验室,湖南 长沙 410128;4. 湖南省植物功能成分利用协同创新中心,湖南 长沙 410128)
以澳洲薄荷为原料,采用超临界CO2、亚临界丁烷萃取技术萃取澳洲薄荷的挥发性成分,并通过 GC—MS对其成分进行分析。结果表明,超临界CO2萃取的得率为2.5%,亚临界丁烷萃取得率为1.4%;超临界CO2的GC—MS分析出萃取挥发性成分为 21 种,薄荷醇的相对含量为70.33%;亚临界丁烷萃取物的挥发性成分为11 种,薄荷醇的相对含量为60.83%。澳洲薄荷挥发性成分的超临界CO2萃取优于亚临界丁烷萃取。
澳洲薄荷;超临界CO2萃取;亚临界丁烷萃取;GC—MS分析
澳洲薄荷,学名Prostantheraincisa,原产于澳大利亚新南威尔士州,是唇形花科薄荷属的多年生草本植物,喜阳光、肥,口感及香味较温和,叶片和花的基础油含量达到3%~4%。澳洲薄荷挥发性成分以薄荷醇、薄荷酮为主,有利肝利胆(消化系统)、祛痰(呼吸系统)、促进透皮吸收、抗炎镇痛、止痒(抗组胺抗过敏)等作用[1]。仅在《中华人民共和国药典》(2000版一部)收载的含有薄荷醇的常用中成药就有40多种,被广泛地应用于医药卫生、食品、日用化工等领域[2]。
中国对于澳洲薄荷的研究主要集中在对酚类、黄酮类等非挥发性组分的分离鉴定上,而未见分析其挥发性成分的相关报道[3-4]。因此,选择一种高效、低耗、绿色的萃取方法对于充分利用其主要挥发性成分至关重要。
目前萃取挥发性成分的方法主要有传统的压榨法、溶剂萃取法、水蒸气蒸馏法以及新兴的超临界CO2萃取法、亚临界萃取法及超声波辅助萃取法等[5]。其中,水蒸气蒸馏法和超临界CO2萃取法是从薄荷中提取挥发性成分的主要方法[6]。传统的提取方法工艺繁琐、溶剂残留、提取率低[7-8],而超临界、亚临界萃取技术具有工艺简单、萃取效率高、非热加工、易于分离等优点,在食品工业应用上发展十分迅速[9-10]。同时比较分析超临界CO2、亚临界流体萃取技术萃取澳洲薄荷挥发性成分的应用未有报道。
本研究以澳洲薄荷为原料,分别采用超临界CO2萃取、亚临界丁烷萃取技术萃取其挥发性成分,并对获得的挥发性成分进行GC—MS成分对比分析,比较这两种萃取方法萃取澳洲薄荷挥发性成分的效果,以期为澳洲薄荷挥发性成分的高效萃取提供参考依据。
1 材料与方法
1.1 材料与试剂
澳洲薄荷的干燥茎叶:亚洲农业食品开发中心;
无水乙醚:色谱纯,国药集团化学试剂有限公司;
CO2:食品级,纯度 99.5%以上,长沙市特种气体厂。
1.2 主要仪器设备
超临界萃取设备:HA231-50-06型,江苏南通华安超临界萃取有限公司;
亚临界萃取设备:CBE-50+1L型,河南省亚临界生物技术有限公司;
GC—MS 仪器:QP2010型,岛津企业管理(中国)有限公司。
1.3 方法
1.3.1 超临界CO2、亚临界流体萃取澳洲薄荷挥发性成分
根据前期研究结果,确定澳洲薄荷挥发性成分的超临界CO2萃取工艺为:装料1 200 g,萃取温度45 ℃,萃取压力25 MPa,分离温度55 ℃,分离压力5 MPa,萃取时间1.5 h;亚临界萃取工艺为:根据设备规格,装料100 g,萃取溶剂为丁烷,萃取温度65 ℃,萃取压力0.6 MPa,萃取时间1.5 h。按式(1)计算萃取得率。
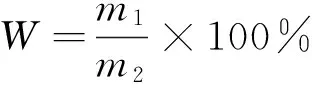
(1)
式中:
W——萃取得率,%;
m1——萃取所得物质的重量,g;
m2——澳洲薄荷装料量,g。
1.3.2 澳洲薄荷挥发性成分的GC—MS分析
(1) 前处理条件:精密称取萃取所得澳洲薄荷挥发油1.000 g于100 mL容量瓶,无水乙醚定容,混匀后准确吸取2.0 mL于10 mL容量瓶中,无水乙醚定容,混匀,过0.45 μm滤膜,利用GC—MS进行检测。
(2) GC—MS分析条件:GC 条件:DB-5MS 毛细管柱,柱温50 ℃,程序升温 3 ℃/min 至 130 ℃,保持5 min;5 ℃/min 至 200 ℃,保持4 min;20 ℃/min 至 300 ℃,保持2 min。进样口温度 280 ℃,载气为氮气,分流比 13∶1,柱流速1.0 mL/min,进样量1 μL。MS 条件:EI 离子源,电子能量70 eV,离子源温度200 ℃,接口温度220 ℃,质核比扫描范围40~500 m/z。
2 结果与讨论
2.1 不同萃取方法萃取得率比较
由表1可知,相同萃取时间下,超临界CO2萃取法的得率是2.5%,亚临界丁烷萃取法的得率是1.4%,前者是后者的约1.8倍。
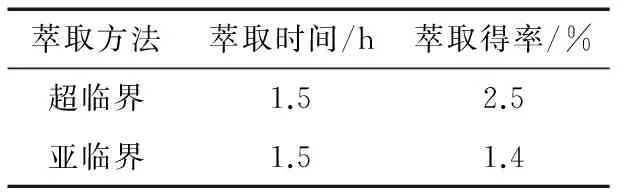
表1 超临界CO2、亚临界萃取得率
2.2 澳洲薄荷挥发性成分的GC—MS分析结果
图1、2为不同萃取方法萃取的澳洲薄荷挥发性成分经GC—MS分析得到总离子流图,采用G1701DA质谱工作站,NIST08质谱库,结合相关文献[11-12],对各组分进行结构确定,并用峰面积归一化法对各组分进行相对定量。澳洲薄荷各组分的相对含量见表2,对各组分进行分类整理的结果见表3。
由图1、2和表2、3可知,超临界CO2萃取澳洲薄荷挥发性成分 21 种,通过NIST08质谱数据库检索、人工谱图解析,最终鉴定出 19 种,占总组分的99.4%;其中萜烯类 5 种,萜烯醇 4 种,萜烯酮 5 种。
亚临界丁烷萃取澳洲薄荷挥发性成分 11 种,鉴定出有 10 种,占总组分的98.86%;其中萜烯类 1 种,萜烯醇 3 种,萜烯酮 5 种。
澳洲薄荷主要功效成分是薄荷醇,其在超临界CO2及亚临界丁烷萃取所得挥发物质中的相对含量分别为70.33%和60.83%,超临界CO2萃取所得含量高于亚临界丁烷萃取。
超临界CO2萃取得到的组分中沸点较高、相对分子质量较大的比较多,分析是由于萃取过程在密闭系统中完成,操作温度较低,因此易氧化成分和热不稳定性组分不会受到破坏。而亚临界流体萃取所用溶剂为丁烷,存在溶剂残留的问题,在后续挥发溶剂的操作中,澳洲薄荷中一些易挥发组分随之流失,造成组分减少,故萃取效率比超临界萃取效率低。
3 结论
在本研究所定萃取工艺条件下,超临界CO2、亚临界丁烷萃取澳洲薄荷的得率分别为2.5%,1.4%;萃取物通过GC—MS分析,超临界CO2萃取 21 种挥发性组分,比亚临界丁烷多 10 种,主要是萜烯类、酯类等。超临界萃取的薄荷醇相对含量为70.33%,亚临界萃取的相对含量为60.83%。结果表明超临界CO2萃取技术比亚临界丁烷流体萃取技术更适用于澳洲薄荷挥发性成分的萃取。
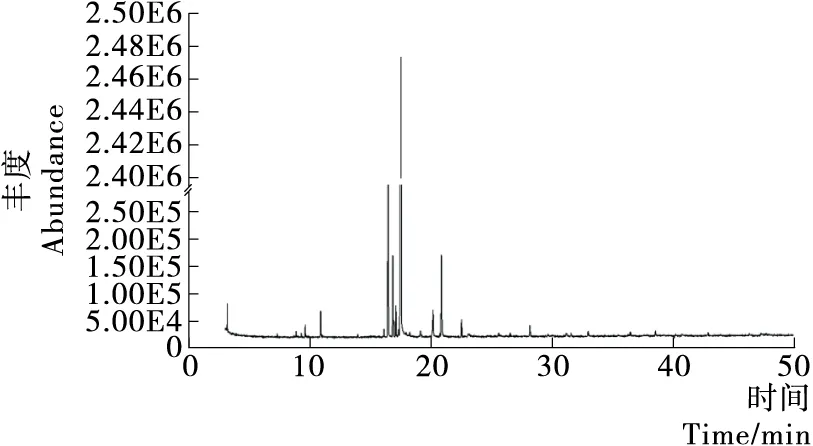
图1 超临界CO2萃取澳洲薄荷挥发性成分总离子流图
Figure 1 TIC (total ion current) of volatile components in Australia mint extracted with supercritical CO2

图2 亚临界萃取澳洲薄荷挥发性成分总离子流图
Figure 2 TIC (total ion current) of volatile components in Australia mint extracted with subcritical
表2 超临界CO2、亚临界萃取澳洲薄荷挥发性成分组成†
Table 2 Volatile components of Australia mint extracted with supercritical CO2and subcritical
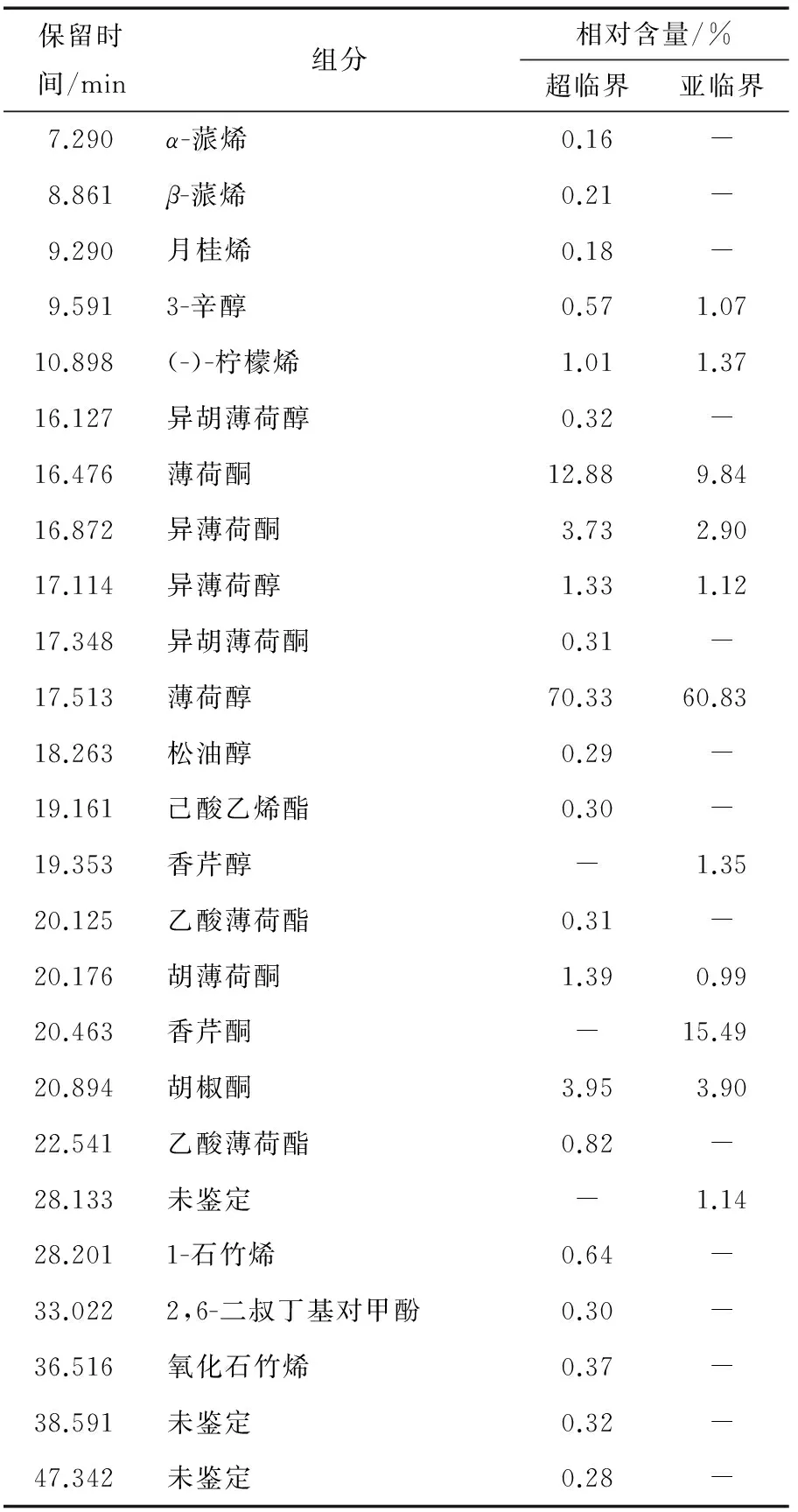
保留时间/min组分相对含量/%超临界亚临界7.290α-蒎烯0.16-8.861β-蒎烯0.21-9.290月桂烯0.18-9.5913-辛醇0.571.0710.898(-)-柠檬烯1.011.3716.127异胡薄荷醇0.32-16.476薄荷酮12.889.8416.872异薄荷酮3.732.9017.114异薄荷醇1.331.1217.348异胡薄荷酮0.31-17.513薄荷醇70.3360.8318.263松油醇0.29-19.161己酸乙烯酯0.30-19.353香芹醇-1.3520.125乙酸薄荷酯0.31-20.176胡薄荷酮1.390.9920.463香芹酮-15.4920.894胡椒酮3.953.9022.541乙酸薄荷酯0.82-28.133未鉴定-1.1428.2011-石竹烯0.64-33.0222,6-二叔丁基对甲酚0.30-36.516氧化石竹烯0.37-38.591未鉴定0.32-47.342未鉴定0.28-
† “-”表示没有此物质。
表3 超临界CO2、亚临界萃取澳洲薄荷挥发性成分分类
Table 3 Classifications of volatile components in Australia mint extracted with supercritical CO2and subcritical
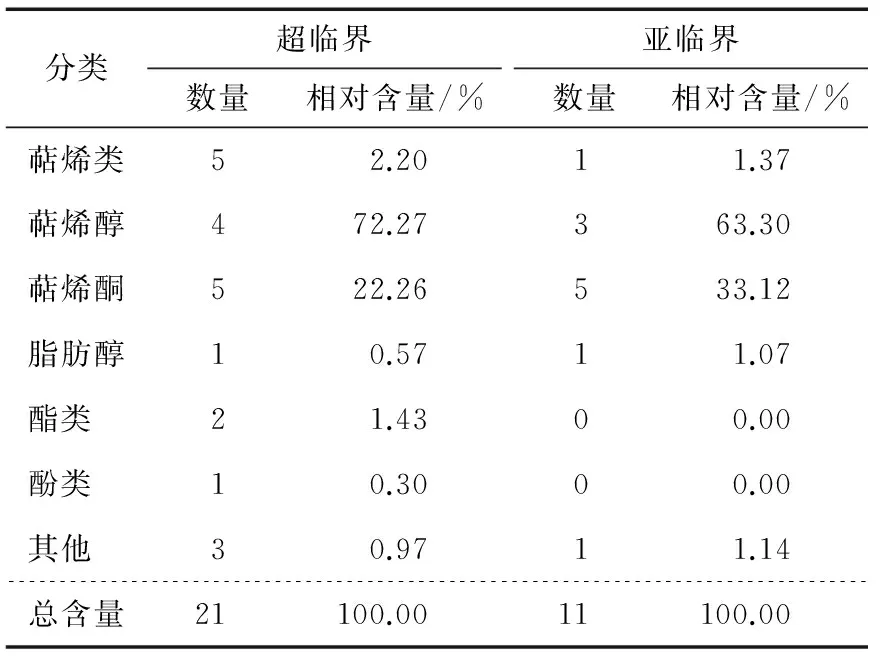
分类超临界数量相对含量/%亚临界数量相对含量/%萜烯类52.2011.37萜烯醇472.27363.30萜烯酮522.26533.12脂肪醇10.5711.07酯类 21.4300.00酚类 10.3000.00其他 30.9711.14总含量21100.0011100.00
[1] 陈智坤, 梁呈元, 任冰如, 等. 薄荷属植物挥发性成分及药理作用研究进展[J]. 天然产物研究与开发, 2013, 25(6): 856-861.
[2] 梁呈元, 佟海英, 赵志强, 等. 水蒸气蒸馏法与超临界CO2萃取法提取薄荷油的化学成分比较[J]. 林产化学与工业, 2007, 27(1): 81-84.
[3] TANG Kitty S C, KONCZAK Izabela, ZHAO Jian. Identification and quantification of phenolics in Australian native mint (Mentha australis R. Br.)[J]. Food Chemistry, 2016, 192: 698-705.
[4] 刘雪辉, 谢红旗, 张思, 等. 高速逆流色谱法分离澳洲薄荷中香叶木苷[J]. 中国农学通报, 2016, 32(27): 109-113.
[5] 张志军, 刘西亮, 李会珍, 等. 植物挥发油提取方法及应用研究进展[J]. 中国粮油学报, 2011, 26(4): 118-120.
[6] 于清跃, 朱新宝. 薄荷种植与薄荷精油提取研究进展[J]. 安徽农业科学, 2012, 40(13): 7 91l-7 913.
[7] 彭维, 刘丽, 刘飞, 等. 紫苏籽油超临界与亚临界萃取方法的比较研究[J]. 食品工业, 2014, 35(8): 22-26.
[8] WANG Juan, YU Rui, ZHANG Jun-yan, et al. Comparison of Volatile components in tea blossom obtained by supercritical CO2, subcritical CO2, and petroleum ether extractions[J]. Modern Food Science and Technology, 2015, 31(2): 240-248.
[9] 任健, 郑喜群, 杨勇, 等. 超临界CO2流体萃取技术提取南瓜籽油的研究[J]. 食品与机械, 2006, 22(6): 34-36.
[10] 常大伟, 孙娇娇, 刘树兴. 利用亚临界萃取技术提取生姜中的姜油[J]. 食品与机械, 2015, 31(1): 159-163.
[11] 靳有才, 庆易薇, 郭珍. 青海野生薄荷挥发油成分GC—MS分析[J]. 中国实验方剂学杂志, 2013, 19(23): 143-145.
[12] 叶兰荣, 姚雷, 徐勇, 等. 四种薄荷植物学性状和精油成分的比较[J]. 上海交通大学学报: 农业科学版, 2006, 24(5): 435-440.
Comparison of volatile components in Australia mint obtained by supercritical and subcritical extraction
ZHANGSi1,2XIEHong-qi1,2,3,4LIUXue-hui1,2WANGJing1,2LIUDong-bo1,2,3,4
(1.StateKeyLaboratoryofSub-healthInterventionTechnology,Changsha,Hunan410128,China;2.CollegeofHorticultureandLandscape,HunanAgriculturalUniversity,Changsha,Hunan410128,China;3.HunanProvincialKeyLaboratoryofCropGermplasmInnovationandUtilization,Changsha,Hunan410128,China;4.HunanCo-InnovationCenterforUtilizationofBotanicalFunctionalIngredients,Changsha,Hunan410128,China)
In this study, the volatile components in Australia mint were extracted, using supercritical CO2and subcritical butane, and then the extractives were analyzed by GC—MS. The results showed that the extraction rate of supercritical CO2was 2.5%, and that of the subcritical butane was 1.4%. Through the analysis of GC—MS, 21 components were identified in the supercritical CO2extraction, and the relative content of menthol was 70.33%. However, 11 components were identified in the subcritical butane extraction, and the relative content of menthol was 60.83%. Our results showed that the supercritical CO2extraction of volatile components in Australian mint was better than the subcritical butane one.
Australia mint; supercritical CO2extraction; subcritical butane extraction; GC—MS
国家国际科技合作专项项目(编号:2013DFA31790)
张思,女,湖南农业大学在读硕士研究生。
刘东波(1970-),男,湖南农业大学教授,博士。
E-mail:chinasaga@163.com.
2016—06—07
10.13652/j.issn.1003-5788.2016.10.032
