余甘子抑制口臭活性物质的分离纯化与结构鉴定
2016-12-05姜元欣刘伯科刘小玲
姜元欣 刘伯科 刘小玲
(1. 广西农业职业技术学院,广西 南宁 530004;2. 广西大学轻工与食品工程学院,广西 南宁 530004)
余甘子抑制口臭活性物质的分离纯化与结构鉴定
姜元欣1,2刘伯科2刘小玲2
(1. 广西农业职业技术学院,广西 南宁 530004;2. 广西大学轻工与食品工程学院,广西 南宁 530004)
以电子鼻检测及评价模型为抑臭活性导向方法,余甘子95%乙醇提取物经过有机溶剂分级萃取、硅胶正相分离、C18反相柱分离后得到了抑制口臭活性含量最高的EⅡM20组分,将该组分进行多次正相分离与HPLC制备分离,得到了3个单体化合物L1(6.8 mg)、L2(4.5 mg)、L3(4.9 mg),采用1H NMR、13C NMR、HR-ESI-MS等多种波谱分析对其进行结构鉴定。波谱分析表明:L1为麦芽糖(maltose),L2为1,2-苯二甲酸-双-2’甲基庚酯[Bis(2-methylheptyl)phthalate],L3为1-(4’-氨苯基)-1,2异二醇[1-(4’-amino-phenyl)-ethane-1,2-diol]。为后续口臭研究及余甘子的开发利用提供了依据。
余甘子;口臭;分离纯化;结构鉴定
余甘子(PhyllanthusemblicaL.)为大戟科(Euphorbiaceae)叶下珠属(Phyllanthus)热带、亚热带落叶小乔木的果实[1],目前主要分布于中国南部的广东、广西、福建、贵州、云南等省区以及热带的印度、马来西亚、泰国、巴基斯坦等国家。中国余甘子资源分布广、品种繁多、产量丰富,但其开发利用率及产品附加值低。余甘子作为藏药使用历史悠久,其富含对人体有利的多种营养与活性成分,包括有酚类、糖类、皂苷、有机酸、黄酮等类型物质,如鞣花酸、柚皮素、云香苷、桂皮酸、槲皮素、没食子酸、β-谷甾醇、二十六烷酸等[2-3]。自2004年起国内外对余甘子植株活性研究报道日益增多。近年来研究表明余甘子具有抗氧化[4-5]、抗肿瘤[6]、抗衰老[7]抗菌与消炎[8]等作用。
口臭是一种口腔疾病,甚至是全身疾病的征兆。全球约25%的人遭受口臭的困扰,口臭对患者造成严重的生理及心里障碍。Lee等[9]探讨了口臭与幽门螺杆菌的关系,研究表明幽门螺杆菌是口臭的致臭菌之一,能够生成硫化氢和甲硫醇等挥发性硫化物。Mehrotra[10]研究了余甘子对幽门螺旋杆菌的抑制作用,结果表明余甘子中的多酚类、黄酮类物质具有很好的抗幽门螺旋杆菌作用。Barwall[11]论述了口腔清新剂的质量评价方法。除此之外,国内外针对口臭形成的本质、口臭的评价方法、抑制口臭的有效成分、改善口臭食品的研究还很缺乏。基于此,本研究以电子鼻技术作为评价手段,以抑臭能力作为活性导向追踪,对余甘子抑臭能力进行评价,并对其提取物的抑臭成分进行分离纯化,以期从余甘子中寻找有抑制口臭的成分,为余甘子开发利用提供理论依据。
1 材料与方法
1.1 原料与试剂
余甘子(PhyllanthusemblicaL.):品种为玻璃甘,产自广东潮州,购于广西南宁市海吉星水果批发市场;
乙醇、氯仿、乙酸乙酯、正丁醇、甲醇、硫酸、十二烷基硫酸钠、三乙醇胺:分析纯;
牛血清蛋白:上海罗氏制药有限公司;
甲醇、乙腈:色谱级, 美国Fisher Scientific公司;
超纯水:过0.45 μm滤膜的娃哈哈纯净水;
硅胶薄层板GF254、柱层析用硅胶(100~200目):青岛海洋化工厂;
Agilent ZORBAX SB-C18柱:5 μm,4.6 mm×250 mm,美国安捷伦公司;
RP-C18:材料为Ultimate spherical XB-C18,40~70 μm,100 Å,浙江月旭科技有限公司。
1.2 仪器设备
二氧化碳细胞培养箱:HH.CP-7型,上海博讯实业有限公司医疗设备厂;
电子天平:TLE204E型,梅特勒—托利多仪器(上海)公司;
紫外分析仪:WD-9403C型,北京市六一仪器厂;
高效液相色谱仪:Waters e2695型,Waters 2998光电二极管阵列检测器(DAD),Empower 2工作站,美国Waters公司;
质谱仪:Agilent 1100 Series型,美国安捷伦公司;
超导核磁共振仪:DRX-500,德国Bruker公司;
质谱仪:API-QSTAR-TOF型,加拿大Applied Biosystem Corporation公司;
便携式电子鼻:PEN3,德国AIRSENSE公司;
分光光度计:722N型,上海佑科仪器仪表有限公司。
1.3 试验设计与方法
1.3.1 余甘子抑制口臭活性评价方法 课题组研究发现,电子鼻传感器中R6(检测甲基类化合物)、R7(检测无机硫化物)、R9(检测有机硫化物)与感官评价值相关性好,在口臭的评估与检测中,R6、R7、R9可作为口腔恶臭的表征传感器,其响应值越大表明口臭气味越严重。样品的电子鼻测定图谱导入电子鼻分析模型中所得的臭味指数值越大,表明其口臭越严重。因此本研究采用电子鼻的臭味指数为抑制口臭活性评价指标。将待测组分配置成浓度为3.25 mg/mL的样品液,在10 mL顶空瓶中分别加入1 mL全唾和0.2 mL样品液,振荡均匀后,置于37 ℃密封恒温孵化12 h后,采用电子鼻分析其臭味程度,评价样品的抑臭活性。
1.3.2 余甘子中抑臭活性物质的提取分离 余甘子抑臭活性物质提取分离纯化路线见图1。
(1) 余甘子活性物质提取及有机溶剂萃取:余甘子果实采摘后,经清洗晾干,去核,于55 ℃恒温干燥2~3 d,粉碎,得余甘子干燥粉末,加入5倍体积的95%乙醇,超声提取1.5 h后,于50 ℃水浴恒温提取22.5 h,提取3次,合并提取液,过滤,于50 ℃真空浓缩干燥得乙醇提取浸膏(P),并将浸膏用3倍体积的水分散,得悬浮液,依次用等体积氯仿、乙酸乙酯、正丁醇充分萃取,萃取次数4次以上,浓缩干燥,得到氯仿萃取组分(C)、乙酸乙酯萃取组分(E)、正丁醇萃取组分(B)、水余液组分(W)。采用1.3.1方法评价各萃取组分抑臭活性。

图1 余甘子抑臭活性物质提取分离流程
(2) E组分的硅胶柱层析分离:将1.3.2(1)溶剂萃取中活性较高的乙酸乙酯萃取组分(E)再用硅胶进行柱层析分离。称取乙酸乙酯(E)萃取组分112 g,用等量硅胶干法拌样后,装入玻璃层析柱,硅胶层析柱内径11 cm,柱高为50 cm。采用氯仿—甲醇体系进行梯度洗脱;依次用9∶1(Ⅰ),8∶2(Ⅱ),7∶3(Ⅲ),6∶4(Ⅳ),1∶0(Ⅴ)进行洗脱。按不同梯度收集样品并真空浓缩至干,分别得到EⅠ、EⅡ、EⅢ、EⅣ、EⅤ组分。将各组分样品配置成同浓度的待测样品液,采用1.3.1方法测定不同洗脱组分的抑制口臭活性。
(3) EⅡ组分的C18反相层析柱分离:将1.3.2(2)乙酸乙酯萃取物硅胶柱层析的氯仿-甲醇体系8∶2(Ⅱ)洗脱组分EⅡ进行C18低压反相柱分离。C18反相层析柱内径5 cm,柱高为40 cm。采用20%甲醇水溶液、40%甲醇水溶液、60%甲醇水溶液、100%甲醇溶液进行梯度洗脱,按不同梯度收集样品并浓缩至干,得到EⅡM20、EⅡM40、EⅡM60、EⅡM100。将各梯度样品配置成同浓度的待测样品液,采用1.3.1方法测定不同洗脱组分的抑制口臭活性。
(4) EⅡM20的HPLC分离:将1.3.2(3)中C18低压反相柱分离洗脱组分EⅡM20用硅胶柱层析分离,干法装柱后依次采用氯仿—甲醇体系50∶1(α),15∶1(β),10∶1(γ),5∶1(δ),3∶1(ε),1∶1(ζ)进行梯度洗脱,并采用薄层色谱法(TLC法)分析收集合并馏分,将所得馏分利用高压制备液相色谱进行分离。样品溶解于甲醇溶液中,色谱条件:色谱柱:Agilent ZORBAX SB-C18柱(5 μm,4.6 mm×250 mm),紫外检测波长:190~800 nm全波长扫描,流动相:超纯水与甲醇(色谱级)或者超纯水与乙腈(色谱级)等度洗脱,流速:1.0 mL/min,温度:25 ℃。
1.3.3 结构鉴定 化合物L1、L2、L3溶解于MOD中,采用BrukerDRX-500、DRX-600型超导核磁共振仪测定,测定氢谱(1H NMR)和碳谱(13C NMR),以四甲基硅烷(TMS)为内标。高分辨电子轰击质谱(HR-ESI-MS)采用API-QSTAR-TOF型质谱仪测定。大气压化学电离源APCI,扫描范围(scan range):50~1 000 amu,扫描方式(scan mode):full scan(SIM)。
2 结果与分析
2.1 余甘子粗提物及溶剂萃取物的活性分析
余甘子粗提物及不同溶剂萃取物的活性分析见表1。由表1可知,水余液的得率最高,表明余甘子粗提物中主要为极性大的物质,中等极性物质较少,极性小的物质最少。与空白对照比对,乙醇粗提物的电子鼻模型臭味指数均显著降低(约为空白的一半),说明余甘子有明显的抑臭作用。电子鼻传感器R7(W1W)、R9(W2W)信号显示,乙酸乙酯萃取部位与其他部位有显著性差异,且信号值最低,说明余甘子乙酸乙酯萃取部位有明显抑制无机硫化物和有机硫化物产生的作用;传感器R6(W1S)信号显示,氯仿与乙酸乙酯萃取部位无显著性差异,但两者相对其他部位有显著差异,说明余甘子中小极性物质有明显抑制甲基类化合物产生的活性。与95%乙醇粗提物相比,各萃取组分臭味指数有一定差异,其中氯仿和正丁醇萃取物与乙醇粗提物相当,而水余液不如乙醇粗提物。比较其传感器信号值显示,乙酸乙酯萃取物的抑制活性最显著,同时对甲基类化合物的抑制也相当显著,说明余甘子萃取分离后所得乙酸乙酯萃取物活性显著高于95%乙醇提取液,萃取分离对余甘子的抑臭活性物质进行了富集纯化。
2.2 E组分的硅胶柱分离及活性分析
乙酸乙酯萃取组分经硅胶柱分离得到5个组分EⅠ、EⅡ、EⅢ、EⅣ、EⅤ,其得率与抑制口臭活性比较见表2。

表1 余甘子粗提物与不同溶剂萃取物抑臭活性比较†
† 同列数据后的不同字母表示存在显著差异(P<0.05)。

表2 不同组分抑制口臭活性的比较†
† 同列数据后的不同字母表示存在显著差异(P<0.05)。
由表2经统计学分析,观察传感器R7(W1W)与R9(W2W)数据,各硅胶分离组分均显著低于对照组,其中组分EⅡ降低程度最大,且与其他4个分离组分有显著性差异,表明5个组分都具备抑制全唾中硫化物生成的活性,且组分EⅡ的活性最强。对于传感器R6(W1S),5个组分与空白对照组有显著性差异,但5个组分相互间差异性不明显,说明5个组分都有抑制甲基类化合物生成的活性。
5个组分对全唾臭味指数的影响见图2。由图2可知,组分EⅡ、EⅢ、EⅣ有降低臭味指数的活性,组分EⅡ活性最强,与其余组分有显著性差异;组分EⅠ、EⅤ促进了臭味指数升高,其中组分EV尤为明显,呈现显著性差异。因此EⅡ组分中活性成分抑制口臭能力最强,可以作为活性跟踪的组分,需对其做进一步分离纯化。

不同字母表示存在显著差异(P<0.05)
2.3 组分EⅡC18反相柱粗分离及活性分析
组分EⅡ(64.68 g)经C18反相层析柱分离所得组分得率与抑制口臭活性比较见表3和图3。由表3可知,4个反相层析分离组分中EⅡM20的得率最高,达到80.13%。各洗脱组分与空白对照组相比皆有显著性差异,但组分间无差异,说明各组分都有抑制口臭的活性,且活性能力相当。观察三个传感器信号值,与EⅡ相比,除EⅡM20有所升高或基本持平外,其余洗脱组分EⅡM40、EⅡM60、EⅡM100有一定程度的降低,但与EⅡM20无显著差异。说明C18反相层析柱的不同乙醇浓度洗脱物,其抑制口臭没有显著差异,鉴于其他组分洗脱物的含量少,而20%甲醇水溶液洗脱的得率为80.13%,因此对20%甲醇水溶液洗脱部位EⅡM20做进一步的制备分离。

不同字母表示存在显著差异(P<0.05)

组分得率/%传感器R7(W1W)R6(W1S)R9(W2W)空白对照/12.867±0.742b11.022±0.444b8.620±0.432bEⅡM1000.932.865±0.161a2.701±0.121a2.601±0.164aEⅡM600.903.006±0.215a3.175±0.231a2.606±0.190aEⅡM409.202.935±0.391a2.802±0.261a2.861±0.284aEⅡM2080.134.052±0.852a3.734±0.672a3.633±1.042aEⅡ/3.835±0.022a3.471±0.101a3.745±0.042a
† 同列数据后的不同字母表示存在显著差异(P<0.05)。
2.4 EⅡM20组分的HPLC分离及纯度检测
EⅡM20组分经硅胶反复正相分离及液相制备分离后得到3个化合物:L1(6.8 mg)、L2(4.5 mg)、L3(4.9 mg),通过HPLC 190~800 nm全波长扫描进行纯度检测,L1、L3的最大吸收波长在202 nm左右,L2的最大吸收波长在280 nm左右(图略),所得化合物纯度均在98%以上。
2.5 化合物L1、L2、L3结构鉴定
化合物L1为无色粒状晶体,熔点 110 ℃,易溶于水,微溶于甲醇。13C NMR(125 MHz,CD3OD)谱中给出碳信号δ:98.1(C-1),73.8(C-2),74.8(C-3),71.8(C-4),71.8(C-5),62.7(C-6),93.9(C-1’),72.9(C-2’),76.2(C-3’),78.0(C-4’),78.0(C-5’),62.8(C-6’)。1H NMR(500 MHz,CD3OD)谱中给出12个质子信号δ:4.87,4.75,4.57,4.33,3.64,3.56,3.46,3.22,3.12。ESI-MS(m/z)正离子检测:203[Glucose+Na]+,负离子检测:161[Glucose -H3O]-,相对分子质量为342。以上数据与文献[12]报道的麦芽糖谱图数据基本一致(由于溶剂不同化学位移值差异较大),确定化合物L1为麦芽糖(maltose),见图4。
化合物L2为浅黄色油状液体,微具气味,溶于甲醇。13C NMR(150 MHz,CD3OD)谱中给出碳信号δ:163.1(C-1),133.5(C-2),132.4(C-3),132.4(C-4),132.4(C-5),132.4(C-6),133.5(C-7),163.1(C-8),64.3(C-1’),40.1(C-2’),31.6(C-3’),30.1(C-4’),24.9(C-5’),24.0(C-6’),14.4(C-7’),11.4(C-8’),64.3(C-1’’),40.1(C-2’’),31.6(C-3’’),30.1(C-4’’),24.9(C-5’’),24.0(C-6’’),14.4(C-7’’),11.4(C-8’’)。1H NMR(600 MHz,CD3OD)谱中给出质子信号δ:7.70(m,2H),7.52(m,2H),4.26(dd,J1=8.5 Hz,J2=1.6 Hz,2H),4.19(dd,J1=8.5 Hz,J2=1.6 Hz,2H),1.69(m,2H),1.46~1.32(m,16H),0.95~0.90(dd,J=13.8,6.3 Hz,12H)。ESI-MS(m/z)正离子检测:391[M+H]+,413[M+Na]+,166[phthalic acid]+,相对分子质量为390。以上数据与文献[13]报道的数据基本一致,确定化合物L2为1,2-苯二甲酸-双-2’甲基庚酯[Bis(2-methylheptyl)phthalate],见图5。

图4 化合物L1的化学结构式

图5 化合物L2的化学结构式
化合物L3为无色晶体,溶解甲醇,13C NMR(150 MHz,CD3OD)谱中给出碳信号δ:73.8(C-1),64.4(C-2),147.9(C-1’),132.4(C-2’),129.9(C-3’),113.8(C-4’),129.9(C-5’),132.4(C-6’)。1H NMR(600MHz,CD3OD)谱中给出10个质子信号δ:2.02,4.01,4.59,5.01,6.66,7.12。ESI-MS(m/z)负离子检测:150[M-H3]-,相对分子质量为153。以上数据与文献[14]报道的数据基本一致,确定化合物L3为1-(4’-氨苯基)-1,2异二醇[1-(4’-amino-phenyl)-ethane-1,2-diol],见图6。 经以上分析,发现分离鉴定的3个化合物结构都不是一类物质,且均不是新化合物,在其他研究抗氧化活性的植物原料中均有报到,其中一种为最为普通的多羟基化合物——麦芽糖,另一种为塑化剂类结构类似物,第三种为含苯环的多羟基化合物。
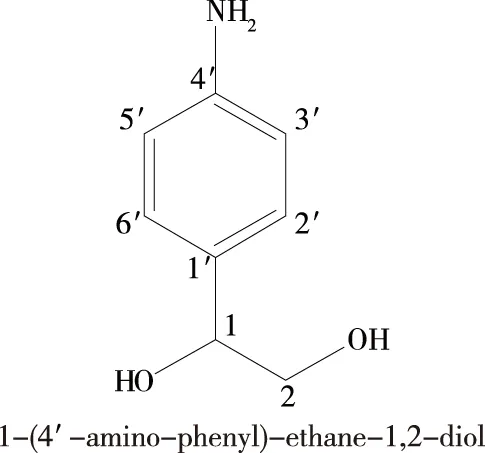
图6 化合物L3的化学结构式
3 结论
以电子鼻口臭检测及评价模型为抑臭活性导向方法,采用有机溶剂分级萃取、硅胶正相柱分离、C18反相柱分离等方法,从余甘子干果95%乙醇提取物分离得到了抑制口臭活性最强的EⅡM20组分,将该组分进行多次正相硅胶柱分离与HPLC制备分离,分离得到了3种化合物,利用1H NMR、13C NMR、HR-ESI-MS等多种波谱结构鉴定了maltose(L1)、1,2-Bis(2-methylheptyl)phthalate (L2)、1-(4’-amino-phenyl)-ethane-1,2-diol(L3)。本研究的抑臭评价手段对清咽类保健食品或口腔清新类产品的研发提供一个评价的方法。由于未能进一步制备纯化的化合物再次进行除臭活性分析,试验结果对寻找有价值的口腔除臭成分还有一定的不足和困难。
[1] 王开良, 姚小华, 熊仪俊, 等. 余甘子培育与利用现状分析及发展前景[J]. 江西农业大学学报, 2003(3): 397-401.
[2] 罗维. 余甘子干果活性成分的分离鉴定与生理活性研究[D]. 广州: 华南理工大学, 2010: 105-106.
[3] 刘伯科, 林仲仪, 姚蕾珺, 等. 余甘子主要营养及功能成分分析[J]. 食品与营养科学, 2015(4): 59-64.
[4] 刘晓丽, 赵谋明. 余甘子的综合利用研究[J]. 食品与机械, 2006, 2(4): 90-93.
[5] KUMAR G S, NAYAKA H, DHARMESH S M, et al. Free and bound phenolic antioxidants in amla (Emblica officinalis) and turmeric (Curcuma longa)[J]. Journal of Food Composition and Analysis, 2006, 19(5): 446-452.
[6] JOSE J K, KUTTAN G, KUTTAN R. Antitumour activity of Emblica officinalis[J]. J. Ethnopharmacol, 2001, 75(3): 65-69.
[7] 崔炳权, 林元藻. 余甘子的抗衰老作用研究[J]. 时珍国医国药, 2007(9): 2 100-2 102.
[8] RAY P, MAJUMDAR S. Antimicrobial activity of some Indian plants[J]. Economic Botany, 1976, 30(4): 317-320.
[9] LEE H, KHO H S, CHUNG J W, et al. Volatile sulfur compounds produced by Helicobacter pylori[J]. J Clin Gastroenterol, 2006, 40(5): 421-426.
[10] MEHROTRA S, JAMWAL R, SHYAM R, et al. Anti-Helicobacter pylori and antioxidant properties of Emblica officinalis pulp extract: A potential source for therapeutic use against gastric ulcer[J]. Journal of Medicinal Plants Research, 2011, 5(12): 2 577-2 583.
[11] BARWAL V S, GARG V, SHARMA R. Development and quality evaluation of aonla mouth freshner[J]. Journal of Food Science and Technology, 2010, 47(6): 697-699.
[12] 李小第, 姜会敏, 霍雅玉, 等. 刺玫果果肉石油醚层化学成分及胰脂酶和α-糖苷酶抑制活性研究[J]. 天然产物研究与开发, 2015(27): 1 011-1 015.
[13] 余辅松, 邓世明, 李慧, 等. 岭南山竹子树皮化学成分研究[J]. 中南药学, 2013, 11(4): 241-244.
[14] TARCILA C, PAULO J, MORAN S, et al. Highly enantioselective deracemization of 1-phenyl-1,2-ethanediol and its derivatives by stereoinversion using Candida albicans in a one-pot process [J]. Journal of Molecular Catalysis B: Enzymatic, 2014, 109: 178-183.
Extraction, separation & identification of bioactive compositions fromPhyllanthusemblicaL. for oral odor inhibity
JIANGYuan-xin1,2LIUBo-ke2LIUXiao-ling2
(1.GuangxiAgriculturalVocationalCollege,Nanning,Guangxi530007,China;2.CollegeofLightIndustryandFoodEngineering,GuangxiUniversity,Nanning,Guangxi530004,China)
Using electronic nose measure and evaluation model as a guidance method for inhibiting halitosis, the strongest bioactive fractions(EⅡM20) were separated from the 95% ethanol emblica extract by organic solvent extraction, repeated normal and reverse phase column chromatography. Consequently, three compounds were isolated from the EⅡM20 by semi-preparative HPLC. Their quantity-quality were 6.8 mg, 4.5 mg, 4.9 mg, repectively. The structures of the three compounds were elucidated by comprehensive spectroscopic methods such as1H NMR,13C NMR, HR-ESI-MS. The spectroscopy analysis indicated that the compounds were maltose, Bis(2-methylheptyl)phthalate and 1-(4’-amino-phenyl)-ethane-1,2-diol.
PhyllanthusemblicaL.; oral odor; purification; structural identification
广西农业职业技术学院基金项目(编号:YKJ 1610)
姜元欣(1980-),男,广西农业职业技术学院讲师,广西大学在读博士研究生。E-mail: 631553385@qq.com
2016-05-24
10.13652/j.issn.1003-5788.2016.10.005
