微生物表面活性剂的生产方法及其在食品添加剂中的应用
2016-12-05孙茂成李怀伟富校轶王舒然
孙茂成 陈 曦 李怀伟 王 丹 富校轶 王舒然
(1.吉林医药学院食品质量与安全教研室,吉林 吉林 132013;2. 贵州省现代农业发展研究所,贵州 贵阳 550006;3. 山东省菏泽市食品药品检验检测中心,山东 菏泽 274000)
微生物表面活性剂的生产方法及其在食品添加剂中的应用
孙茂成1陈 曦2李怀伟3王 丹1富校轶1王舒然1
(1.吉林医药学院食品质量与安全教研室,吉林 吉林 132013;2. 贵州省现代农业发展研究所,贵州 贵阳 550006;3. 山东省菏泽市食品药品检验检测中心,山东 菏泽 274000)
微生物可以合成很多不同种类的表面活性剂,通常将这类表面活性剂称为微生物表面活性剂,其在减少表面和界面张力方面具有很强的能力。本研究对微生物表面活性剂的种类、来源,生产菌株的筛选方法、廉价底物的利用,发酵工艺的优化,产品的分离纯化和微生物表面活性剂在食品添加剂行业中的应用进展进行综述,并提出目前研究过程中存在的问题,为微生物表面活性剂的食品工业化生产与应用提供理论参考。
微生物表面活性剂;生产与工艺优化;乳化剂;防腐剂;抗氧化剂
表面活性剂可以通过改善疏水化合物的溶解性来形成乳液,在工业中具有重要的地位[1]。化学合成的表面活性剂占商品化表面活性剂的70%~75%[2]。在实际应用中,往往需要使用高浓度的化学合成表面活性剂来保证乳化的完全性和稳定性,却容易产生毒性和不可再利用物质的残留。因此,化学合成表面活性剂替代品的开发成了该领域的研究热点。
微生物表面活性剂是微生物代谢合成的具有双亲性(亲水性和亲油性)的一类次级代谢产物[3],因有良好的生物降解性、低毒性、高发泡性和稳定性[4],有望替代化学合成表面活性剂。此外,一些微生物表面活性剂还具有抵抗微生物[5]、调节免疫功能[6]、抗肿瘤[7]等性质,预示着其在食品工业、农业和生物医学等领域大有可为。本研究主要对产微生物表面活性剂菌种的筛选、发酵工艺优化、微生物表面活性剂的分离纯化和在食品添加剂中的应用进行综述。
1 微生物表面活性剂分类和来源
微生物表面活性剂的分类主要是根据其化学结构进行划分的。其中,根据分子量的不同,微生物表面活性剂可以分为低分子量和高分子量两大类。低分子量微生物表面活性剂包括磷脂类、糖脂类和脂肽类;高分子量主要包括蛋白质类、脂蛋白类、脂多糖类和生物大分子的复杂混合物。其中高分子量类可以有效提高水包油型乳液的稳定性,然而低分子量类在降低表面和界面张力方面更为有效。表1[8]列举了生物表面活性剂的主要种类和其微生物来源,其中细菌和酵母是其主要的微生物来源。
2 微生物表面活性剂的生产
2.1 产表面活性剂微生物的筛选方法
对表面活性剂微生物的筛选是微生物表面活性剂工业化的首要任务。筛选方法主要根据表面活性剂的表面和界面特性来选择。表2[9]列举了常见的筛选方法,这些方法可以定性或定量检测微生物表面活性剂,从而指示高产微生物。另外,筛选方法的高通量化是未来发展的主要趋势,这样就可以快速、高效和准确地从大量样本中进行定向筛选。
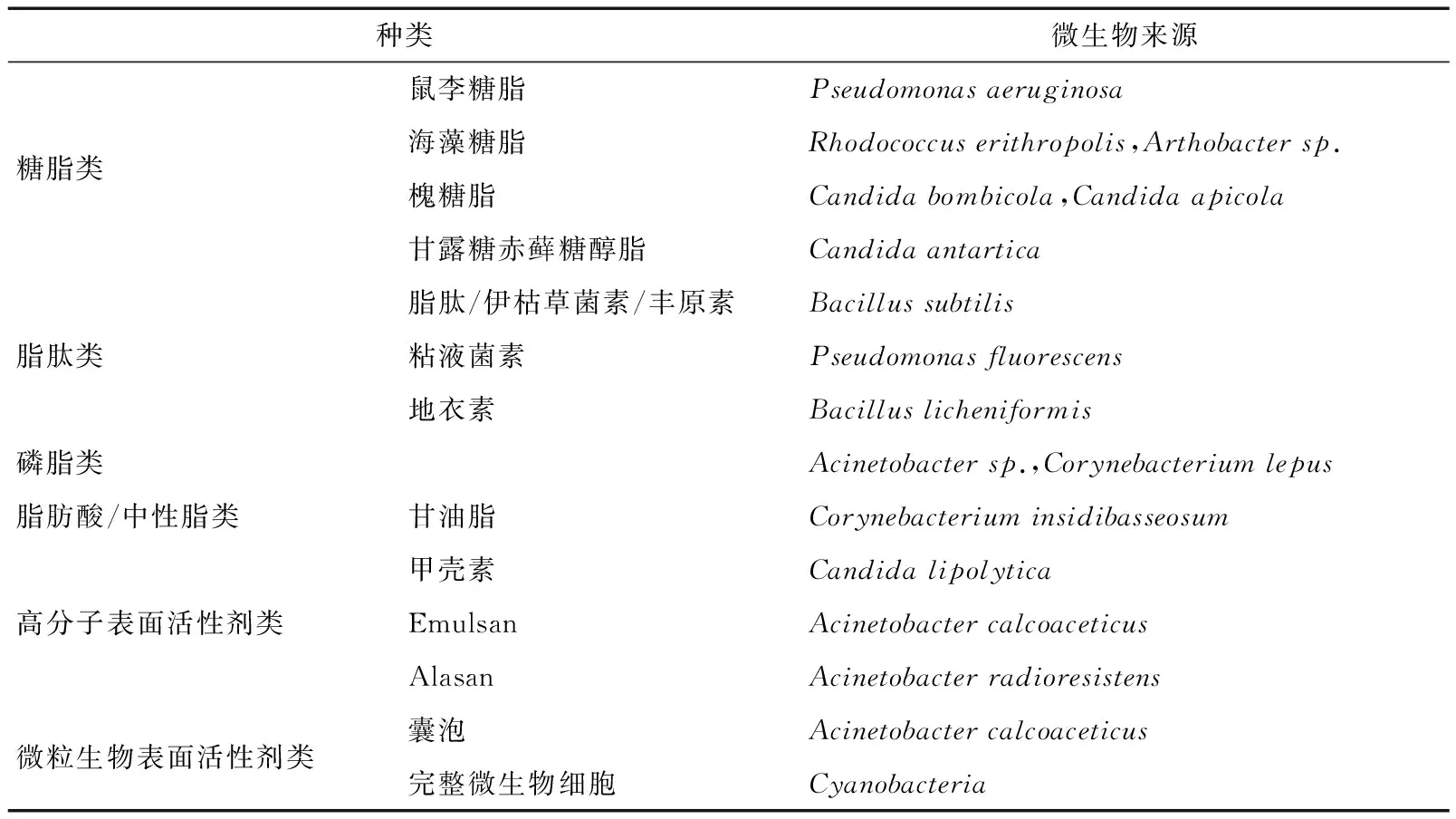
表1 微生物表面活性剂的主要种类和来源
2.2 以工农业副产物为发酵底物
高成本严重制约了微生物表面活性剂的大规模生产,因此降低其生产成本成为了当今的研究热点。以廉价的工农业副产物作为发酵底物有望实现微生物表面活性剂的商品化,如植物油废料、淀粉、乳清和糖蜜等副产物。
2.2.1 植物油废料 葵花籽油和大豆油等植物油可以作为微生物表面活性剂的生产底物,尤其是植物油精炼和油炸食品加工过程中产生的大量废油,这为低成本生产微生物表面活性剂提供了可能。Ruggeri等[10]分离到了能够在菜籽油中生长的Rhodococcussp. BS32,且具有合成胞外表面活性剂的能力。Luna[11]利用Candidasphaerica(UCP 0995)在含有9%花生油精炼残渣的发酵底物中生产出了低成本的糖脂类表面活性剂。Partovi等[12]研究了PseudomonasaeruginosaMR01利用酸化油、脱臭蒸馏物和皂脚3种大豆油的精炼废物进行生产表面活性剂的差别,其中以皂脚作为发酵底物的产品纯度和产量是最高的,分别达到了89.6%和(14.55±1.10) g/L,认为皂脚在降低微生物表面活性剂的生产成本方面具有潜在的应用价值。

表2 筛选微生物表面活性剂的常见方法
2.2.2 淀粉类 淀粉类废料是微生物生产表面活性剂的潜在底物来源。Noah等[13]成功利用马铃薯加工中产生的富含淀粉的废水作为B.subtilis生产表面活性剂的碳源,其产量从48 h 0.9 g/L提高至12~24 h 0.6 g/L。木薯加工产生的废水中含有大量富含糖类的木薯淀粉,Pseudomonasflourescens可以利用木薯废水合成具有优良乳化性能的表面活性剂[14]。PseudomonasaeruginosaL2-1以木薯加工废水为主要发酵底物,生产的鼠李糖脂在生产成本和表面活性上都优于一种鼠李糖表面活性剂产品JBR599[15]。此外,淘米水、玉米浆和谷类食品加工中产生的废水都有望成为微生物产生表面活性剂的发酵底物[16]。
2.2.3 乳清 乳清是乳品工业产生的副产物,尤其是干酪的生产。乳清含有丰富的乳糖和蛋白质等营养成分,直接排放会导致水体污染,因此乳清回收再利用成为当今乳品科学的热点问题。乳清有望成为微生物产表面活性剂的廉价、易得的发酵底物。研究[17]发现,BacilluslicheniformisM104可以在干酪乳清中发酵生成脂肽类表面活性剂。Rodrigues等[18]从乳杆菌中筛选产表面活性剂的乳酸菌,发现Lactobacilluscasei、Lactobacillusrhamnosus、Lactobacilluspentosus和Lactobacilluscoryniformistorquens是最有潜力的菌株,而且它们均能以乳清作为发酵底物。Johny[19]从乳清中筛选出一株具有产生表面活性剂能力的酵母,该表面活性剂(2.77 mg)的排油圈直径是12 mm,其乳化指数为61.42。当以乳清为碳源、硝酸钠为氮源时,Pseudomonassp产表面活性剂的产量高达9.2 g/L[20]。
2.2.4 糖蜜 糖蜜是制糖工业中的副产物,具有价格较低和营养物质丰富的特点,富含碳水化合物、维生素和矿物质,例如甘蔗糖蜜的组成成分为(75%干物质):总糖48%~56%,糖以外的有机物9%~12%,蛋白质2.5%,钾1.5%~5.0%,钙0.4%~0.8%,镁0.06%,磷0.06%~2.0%,生物素1.0~3.0 mg/kg,泛酸15~55 mg/kg,肌醇2 500~6 000 mg/kg和硫胺素1.8 mg/kg[21]。Onbasli等[22]研究了PseudomonasluteolaB17 和PseudomonasputidaB12在不同甜菜糖蜜浓度下产生鼠李糖脂的情况,发现利用5 g/100 mL糖蜜发酵12 h时鼠李糖脂的产量达到最大值。Al-Bahry等[23]以糖蜜作为BacillussubtilisB20的唯一碳源和能量来源生产表面活性剂,产量可达(2.29±0.38) g/L。
大豆糖蜜是生产大豆浓缩蛋白过程中的副产物,含有蔗糖、棉子糖和水苏糖等可溶性糖类,以及微生物生长所需的其它营养因子,可能成为生产微生物表面活性剂的廉价发酵底物。Daniel等[24]基于大豆糖蜜配制的培养基,显著降低了C.bombicola生产槐糖脂的成本。
2.3 微生物表面活性剂的发酵工艺优化
高效、经济的发酵工艺对于微生物表面活性剂的工业化极其重要。其中,发酵条件和培养基成分都可以影响微生物表面活性剂的生产,例如pH、温度、搅拌、通气等发酵条件和碳源、氮源、金属离子等培养基成分。经典的单因素试验优化方法是在一项试验中只有一个因素改变,保持其他的可控因素不变,然而这种优化方法既耗时又不能保证目标代谢物的高产。为了解决上述问题,响应面法已成功的应用于微生物表面活性剂发酵工艺的优化。Mnif等[25]利用响应面法优化BacillussubtilisSPB1生产表面活性剂的发酵条件,结果发现葡萄糖、K2HPO4和尿素的浓度是营养成分中的主要影响因子,当这3个因子浓度分别为15,1,6 g/L时,表面活性剂的最大产量可达(2.93±0.32) g/L,响应面法的结果比单因素试验更为方便和可靠。此外,采用该法还显著提高了PseudomonasaeruginosaMA01[26]、Pseudomonasaeruginosa2297[27]等菌株产表面活性剂的能力。
2.4 微生物表面活性剂的分离纯化
分离纯化占微生物表面活性剂生产成本很大的比重,有些产品的分离纯化甚至可以占总成本的60%。表3列举一些微生物表面活性剂的分离纯化方法。其中,沉淀法和色谱法是微生物表面活性剂最常用的分离纯化技术。此外,泡沫分馏、超滤和吸附-解吸等技术也可用于微生物表面活性剂的分离纯化[33],然而这些技术大多处于实验室阶段。

表3 微生物表面活性剂的常见分离纯化方法
理想的分离纯化步骤,不仅要保证分离效率和产品纯度,还要选用来源广泛、价格低廉、低毒或无毒和环保性溶剂。例如低毒廉价的甲基叔丁醚(MTBE)已被成功应用于Rhodococcus产表面活性剂的分离纯化中[34]。
3 微生物表面活性剂在食品添加剂中的应用
3.1 乳化剂
食品乳状液和胶体是复杂的、多组分的多相体系,很难处于稳定状态。乳化剂对于维持饮料和调味品等乳状液的稳定性至关重要。另外,乳化剂还可以改善食品质地、口感和外观等性质。由于具有低毒性和生物降解性,微生物表面活性剂作为食品乳化剂具有很大的优势。研究发现,由酵母和细菌产生的大多数表面活性剂具有良好的耐热和耐酸碱性,在食品加工过程表现出更好的稳定性,例如Saccharomycescerevisiae,Candidavalida,Candidautilis,Hansenulaanomala,Rrhodotorulagraminis,Rhodospirid-iumdiobovatum,Porphiridiumcruentum,Klebsiellasp和Acinetobactercalcoaceticus产生的表面活性剂不仅具有良好的稳定性,而且乳化性能均优于阿拉伯胶和羧甲基纤维素[35]。鼠李糖脂具有改善食品均匀性、维持脂肪稳定等功能,可以用来提高黄油和冷冻糕点的产品质量[36]。Mnif等[37]发现BacillussubtilisSPB1产生的表面活性剂在提高面包质量的效果上明显优于商品化乳化剂大豆卵磷脂,例如在保持面包外形、体积、质地和货架期等方面。
3.2 防腐剂
许多微生物表面活性剂有望作为食品防腐剂来使用,因为它们具有抗微生物的性质,比如抑制细菌、真菌等。从P.aeruginosaAT10获得的鼠李糖脂在32 μg/mL时,抑制的细菌有Escherichiacoli,Micrococcusluteus,Alcaligenesfaecalis,抑制的真菌有Chaetoniumglobosum,Penicilliumcrysogenum,Aureobasidiumpullulans;在16 μg/mL时,抑制的细菌有Serratiamarcescens,Mycobacteriumphlei,抑制的真菌有AspergillusNiger[38]。Magalhães等[39]研究了微生物表面活性剂鼠李糖脂的抗Listeriamonocytogenes效果,结果表明鼠李糖脂的抑菌浓度范围为78.1~2 500.0 μg/mL,且浓度与抑菌活性呈正相关;此外,鼠李糖脂与Nisin具有强烈的协同抑制L.monocytogenes的作用。从Candidaantartica获得的甘露糖赤藓糖醇酯(MEL),具有良好的抗微生物作用,尤其是对革兰氏阳性菌[40]。
3.3 抗氧化剂
食品在储藏运输过程中除了由微生物作用发生腐败变质外,氧化是导致食品品质下降的重要因素。食品抗氧化剂是防止或延缓食品氧化,提高食品稳定性和延长食品储藏期的食品添加剂。一些微生物表面活性剂具有抗氧化的作用,在食品抗氧化剂的应用方面具有潜力,如Takahashi等[41]发现MEL具有很强的清除超氧化物阴离子自由基的能力;Klebsiella产生的多糖类表面活性剂表现出了抑制大豆油自动氧化的能力,减缓了大豆油变质的进程,其抗氧化机理是包埋作用[42]。
4 问题与展望
尽管微生物表面活性剂在食品添加剂领域表现出了巨大的应用潜力,然而其距离大规模商品化还有一定的距离,这是因为还有许多问题有待解决。第一,很多微生物都可以产生表面活性剂,然而与化学表面活性剂相比,其生产成本仍然较高,开发低成本的微生物表面活性剂势在必行。生产菌种的遗传学特性是影响表面活性剂产能的重要因素,因此利用分子生物学方法创造具有高产和利用工农业副产物能力的突变菌株和重组菌株将是未来的研究热点。第二,缺少大规模工业化生产的下游加工技术。再者,微生物表面活性剂作为食品添加剂的应用研究缺乏毒理学评价资料。相信随着研究的不断深入,微生物表面活性剂一定会成为食品添加剂行业的“宠儿”。
[1] 张世仙, 刘焱, 王正武, 等. 表面活性剂及其在食品工业中的应用[J]. 食品与机械, 2012, 28(6): 268-271.
[2] Marketandmarket.com. Surfactants Market by Product type [Anionic, Non-Ionic, Cationic, Amphoteric] Substrates [Synthetic/ Petrochemical based and Natural/Bio-based/Green] and Applications - Global Trends & Forecast to 2019[R/OL]. (2014-08-01)[2015-05-20]. http://www.marketsandmarkets.com/Market-Reports/biosurfactantsmarket-493.htm.
[3] MUKHERJEE S, DAS P, SEN R. Towards commercial production of microbial surfactants[J]. Trends in Biotechnology, 2006, 24(11): 509-515.
[4] MOLDES A B, TORRADO A M, BARRAL M T, et al. Evaluation of biosurfactant production from various agricultural residues byLactobacilluspentosus[J]. J. Agric. Food Chem., 2007, 55(11): 4 481-4 486.
[6] CHERESHNEV VA, GEIN SV, BAEVA TA, et al. Modulation of cytokine secretion and oxidative metabolism of innate immune effectors byRhodococcusBiosurfactant[J]. Bull Exp Biol Med., 2010, 149(6): 734-738.
[7] KUMAR V, KUMARI A, KUMAR D, et al. Biosurfactant stabilized anticancer biomolecule-loaded poly (D,L-lactide) nanoparticles[J]. Colloids and surfaces B: Biointerfaces, 2014, 117(5): 505-511.
[8] NITSCHKE M, COSTA S. Biosurfactants in food industry[J]. Trends in Food Science & Technology, 2007, 18(5): 252-259.
[9] 程斌斌. 产生生物表面活性剂细菌的筛选以及生物表面活性剂结构的解析[D]. 上海: 华东理工大学, 2013: 1-2.
[10] RUGGERI C, FRANZETTI A, BESTETTI G, et al. Isolation and characterisation of surface active compound-producing bacteria from hydrocarbon-contaminated environments[J]. International Biodeterioration & Biodegradation, 2009, 63(7): 936-942.
[11] LUNA J, RUFINO R, CAMPOS G, et al. Properties of the biosurfactant produced byCandidaSphaericacultivated in low-cost substrates[J]. Chemical Eegineering Transactions, 2012, 27(12): 67-72.
[12] PARTOVI M, LOTFABAD T B, ROOSTAAZAD R, et al. Management of soybean oil refinery wastes through recycling them for producing biosurfactant usingPseudomonasaeruginosaMR01[J]. World Journal of Microbiology and Biotechnology, 2013, 29(6): 1 039-1 047.
[13] NOAH K S, BRUHN D F, BALA G A. Surfactin production from potato process effluent byBacillussubtilisin a chemostat[J]. Applied Biochemistry and Biotechnology: Part A, Enzyme Engineering and Biotechnology, 2005, 121(1): 465-473.
[14] SURYANTI V, MARLIYANA S D, HANDAYANI D S, et al. Production and characterization of biosurfactant byPseudomonasfluorescensusing cassava flour wastewater as media[J]. Indonesian Journal of Chemistry, 2013, 13(3): 229-235.
[15] COSTA S G, NITSCHKE M, LEPINE F, et al. Structure, properties and applications of rhamnolipids produced byPseudomonasaeruginosaL2-1 from cassava wastewater[J]. Process Biochemistry, 2010, 45(9): 1 511-1 516.
[16] MAKKAR R S, CAMEOTRA S S, BANAT I M. Advances in utilization of renewable substrates for biosurfactant production[J]. AMB Express, 2011, 1(1): 1-19.
[17] GOMAA E Z. Antimicrobial activity of a biosurfactant produced byBacilluslicheniformisstrain M104 grown on whey[J]. Braz. Arch. Biol. Technol., 2013, 56(20): 4 396-4 403.
[18] RODRIGUES L, MOLDES A, TEIXEIRA J, et al. Kinetic study of fermentative biosurfactant production byLactobacillusstrains[J]. Biochemical Engineering Journal, 2006, 28(2): 109-116.
[19] JOHNY J M. Screening, gene sequencing and biosurfactant production fromPichiafermentans isolated from dairy effluents[J]. IOSR Journal Of Environmental Science, Toxicology And Food Technology(IOSR-JESTFT), 2013, 6(5): 4-13.
[20] PRAVEESH B, SONIYAMBY A, MARIAPPAN C, et al. Biosurfactant production byPseudomonassp from soil using whey as carbon source[J]. New York Science Journal, 2011, 4(4): 99-103.
[21] SAHARAN B S, SAHU R K, SHARMA D. A review on biosurfactants: fermentation, current developments and perspectives[J]. Genetic Engineering & Biotechnology Journal, 2011, 2 011: 1-14.
[22] ONBASLI D, ASLIM B. Determination of rhamnolipid biosurfactant production in molasses by somePseudomonasspp[J]. New Biotechnology, 2009, 25(6) :S255.
[23] AL-BAHRY S N, AL-WAHAIBI Y M, ELSHAFIE A E, et al. Biosurfactant production byBacillussubtilisB20 using date molasses and its possible application in enhanced oil recovery[J]. International Biodeterioration & Biodegradation, 2013, 81: 141-146.
[24] DANIEL H-J, REUSS M, SYLDATK C. Production of sophorolipids in high concentration from deproteinized whey and rapeseed oil in a two stage fed batch process usingCandidabombicolaATCC 22214 andCryptococcuscurvatusATCC 20509[J]. Biotechnol Lett, 1998, 20(12):1 153-1 156.
[25] MNIF I, CHAABOUNI-ELLOUZE S, GHRIBI D. Optimiz-ation of the nutritional parameters for enhanced production ofB.subtilisSPB1 biosurfactant in submerged culture using response surface methodology[J]. Biotechnol Res Int, 2012, 2 012: 1-8.
[26] ABBASI H, SHARAFI H, ALIDOST L, et al. Respone surface optimization of biosurfactant produced byPseudomonasaeruginosaMA01 isolated from spoiled apples[J]. Prep Biochem Biotechnol, 2013, 43(4): 398-414.
[27] KUMAR A P, JANARDHAN A, RADHA S, et al. Statistical approach to optimize production of biosurfactant byPseudomonasaeruginosa2297[J]. 3 Biotech, 2015, 5(1): 71-79.
[28] OLIVEIRA Acdsmd, BEZERRA Mds, PADILHA Ceda, et al. Recovery of rhamnolipids produced byPseudomonasaeruginosausing acidic precipitation, extraction, and adsorption on activated carbon[J]. Separation Science and Technology, 2013, 48(18): 2 852-2 859.
[29] SIVAPATHASEKARAN C, MUKHERJEE S, SAMANTA R, et al. High-performance liquid chromatography purification of biosurfactant isoforms produced by a marine bacterium[J]. Anal Bioanal Chem., 2009, 395(3): 845-854.
[30] DIMITROV K, GANCEL F, MONTASTRUC L, et al. Liquid membrane extraction of bio-active amphiphilic substances:recovery of surfactin[J]. Biochemical Engineering Journal, 2008, 42(3): 248-253.
[31] PATHAK K V, KEHARIA H. Application of extracellular lipopeptide biosurfactant produced by endophyticBacillussubtilisK1 isolated from aerial roots of banyan (Ficusbenghalensis) in microbially enhanced oil recovery (MEOR)[J]. 3 Biotech, 2014, 4(1): 41-48.
[32] PENFOLD J, THOMAS R K, SHEN H-H. Adsorption and self-assembly of biosurfactants studied by neutron reflectivity and small angle neutron scattering: glycolipids, lipopeptides and proteins[J]. Soft Matter, 2011, 8(3): 578-591.
[33] BAKER S C, CHEN C-Y. Enrichment and purification of lipopeptide biosurfactants[J]. Adv Exp Med Biol., 2010, 672: 281-288.
[34] KUYUKINA M S, IVSHINA I B, PHILP J C, et al. Recovery of rhodococcus biosurfactants using methyl tertiary-butyl ether extraction[J]. J. Microbiol Methods, 2001, 46(2): 149-156.
[35] CAMPOS J M, MONTENEGRO STAMFORD T L, SARUBBO L A, et al. Microbial biosurfactants as additives for food industries[J]. Biotechnol Prog, 2013, 29(5): 1 097-1 108.
[36] MUTHUSAMY K, GOPALAKRISHNAN S, RAVI T K, et al. Biosurfactants: properties, commercial production and application[J]. Current Science, 2008, 94(6): 736-747.
[37] MNIF I, BESBES S, ELLOUZE R, et al. Improvement of bread quality and bread shelf-life byBacillussubtilisbiosurfactant addition[J]. Food Science and Biotechnology, 2012, 21(4): 1 105-1 112.
[38] ABALOS A, PINAZO A, INFANTE M R, et al. Physicochemical and antimicrobial properties of new rhamnolipids produced byPseudomonasaeruginosaAT10 from soybean oil refinery wastes[J]. Langmuir, 2001, 17(5):1 367-1 371.
[40] KITAMOTO D, YANAGISHITA H, SHINBO T, et al. Surface active properties and antimicrobial activities of mannosylerythritol lipids as biosurfactants produced byCandidaantarctica[J]. J. Biotechnol, 1993, 29(93): 91-96.
[41] TAKAHASHI M, MORITA T, FUKUOKA T, et al. Glycolipid biosurfactants, mannosylerythritol lipids, show antioxidant and protective effects against H2O2-induced oxidative stress in cultured human skin fibroblasts[J]. Journal of Oleo Science, 2012, 61(8): 457-464.
[42] KAWAGUCHI K, SATOMI K, YOKOYAMA M, et al. Antioxidative properties of an extracellular polysaccharide produced by a bacteriumKlebsiellasp. isolated from river water[J]. Nippon Suisan Gakkaishi, 1996, 62(1): 123-128.
Production process of microbial surfactants and its application in food additives
SUNMao-cheng1CHENXi2LIHuai-wei3WANGDan1FUXiao-yi1WANGShu-ran1
(1.DepartmentofFoodQualityandSafety,JilinMedicalUniversity,Jilin,Jilin132013,China;2.GuizhouInstituteofIntegratedAgricultureDevelopment,Guiyang,Guizhou550006,China;3.HezeCenterforFoodandDrugControl,Heze,Shandong274000,China)
Microorganisms can synthesize a wide range of surface-active compounds with high ability to reduce surface and interfacial surface tension, generally called microbial surfactants. Major types, sources, screening of producing strain, the use of cheap substrates, optimization of fermentation process, separation and purification on microbial surfactants and its application in food additives were reviewed. Finally, present problems during the research were discussed. This study can provide theoretical basis for the industrial production and application of microbial surfactants in food industry.
microbial surfactants; production and optimisation; food emulsifiers; preservative; antioxidant agents

国家自然科学基金面上项目(编号:81472964);吉林省卫生计生自筹经费项目(编号:2014zc064)
孙茂成,男,吉林医药学院讲师。
王舒然(1968-),男,吉林医药学院教授,博士。
E-mail:shuranwang@163.com
2015-07-10
10.13652/j.issn.1003-5788.2016.10.045
