载血卟啉单甲醚纳米高分子微球的制备及显像实验
2016-11-09飞CHENFei郝兰HAOLan严思静YANSijing邹建中ZOUJianzhong
陈 飞CHEN Fei郝 兰HAO Lan严思静YAN Sijing邹建中ZOU Jianzhong
作者单位1. 重庆医科大学生物医学工程学院 重庆400016 2. 重庆医科大学附属第二医院 重庆400016
载血卟啉单甲醚纳米高分子微球的制备及显像实验
陈 飞1CHEN Fei郝 兰2HAO Lan严思静1YAN Sijing邹建中1ZOU Jianzhong
作者单位1. 重庆医科大学生物医学工程学院 重庆400016 2. 重庆医科大学附属第二医院 重庆400016
Chongqing University of Medical Sciences Institute of Biomedical Engineering, Chongqing 400016, China
Address Correspondence to: ZOU Jianzhong E-mail: zoujz@haifu.com.cn
中国医学影像学杂志2016年 第24卷 第8期:632-636
Chinese Journal of Medical Imaging 2016 Volume 24 (8): 632-636
目的 制备出一种载血卟啉单甲醚(HMME)的聚乳酸-羟基乙酸(PLGA)多功能造影剂(MBPLGA-HMME,MB: Microbubble),检测MBPLGA-HMME的基本性质以及HMME包裹在PLGA微球上后,性质改变情况,探讨其集显像与治疗一体化的可行性。资料与方法 采用双乳化法制备MBPLGA-HMME,对其结构、形态、载药率等性质进行检测,采用体外成像比较HMME药物与MBPLGA-HMME超声/光声成像改变情况以及进行初步体内光声成像。结果 MBPLGA-HMME溶于双蒸水后呈淡红色悬液,显微镜下观察MBPLGA-HMME呈球形,形态规则,大小均匀无聚集、粘连现象,能发出红色荧光,HMME均匀分布在微球上,光学显微镜和透射电镜均可见MBPLGA-HMME为壳核结构,外有一层明显的黑色的壳膜,HMME主要分布于PLGA微球壳上。体外光声成像显示,MBPLGA-HMME溶液浓度为408 µmol/L、816 µmol/L、1632 µmol/L的平均光声信号强度分别为0.2009±0.0636、0.3789±0.0431、0.5380±0.0997;同样浓度梯度下,HMME溶液的平均光声信号值分别为0.0738±0.0133、0.1137±0.0065、0.2170±0.0270,组间和组内两两比较,差异有统计学意义,但药物性质基本未改变。MBPLGA-HMME经静脉注入荷瘤鼠体内后,可进行体内光声显像。结论 本研究成功制备载血卟啉单甲醚药物的MBPLGA-HMME,HMME药物水溶性得到改善,其基本的吸光性质得以保持,可进行体内外超声/光声成像。
造影剂;血卟啉类;聚合物;聚乙醇酸;乳酸;光声成像
血卟啉单甲醚(hematoporphyrin monomethyl ether,HMME)是光动力疗法和声动力疗法最常用的光敏剂和声敏剂[1-4],具有组成单一、性能稳定、肿瘤选择性高、对正常组织光毒性低等优点,是一种具有广阔前景的药物。但也存在副反应,如色素沉着、瘙痒、局部疼痛等,并且难溶于水,在水中易团聚,影响其生物效率和对能量的吸收等性质[5],限制了其临床应用。HMME自带红色荧光,却很少有报道将其用于成像研究,能否利用HMME吸收光这个特性进行成像,实现诊疗一体化呢?如何解决显像的同时不改变其基本性质而实现治疗效果,且在此过程中能实现降低药物的副反应以及增强其水溶性,提高药物在肿瘤部位的积累呢?纳米载体可以将药物和诊断探针整合到一起,实现诊疗一体化[6]。光声成像是近年来发展起来的一种无损医学成像方法,它结合了光学成像的高对比度特性和超声成像的高穿透深度特性,可以提供高分辨率和高对比度的组织成像[7]。本实验利用生物相容性和安全性良好的高分子纳米材料聚乳酸-羟基乙酸共聚物(polylactic acid-glycolic acid,PLGA)[8],尝试将HMME包裹到PLGA上,制备出一种集超声显像和治疗一体的多功能造影剂。
1 材料与方法
1.1材料与仪器 PLGA(50∶50,相对分子质量12 ku,济南岱罡生物工程有限公司)、HMME(上海笛柏化学品技术有限公司)、聚乙烯醇(pol vinyl alcohol,PVA,美国Sigma公司)、SONICS超声声振仪、XHF-D高速分散均质机、琼脂糖凝胶粉(美国Sigma公司)、ZNCLBS智能数显磁力搅拌器、Eppendorf 5804(R)多功能高速离心机、紫外分光光度仪UV-2600(上海元析仪器有限公司),Malvern 3000SSA型激光粒径测量仪(美国Zetasizer)、Vevo®LAZR光声成像系统(加拿大Visual Sonics公司)。
1.2载HMME的PLGA纳米微球(MBPLGA-HMME)的制备 采用双乳化法制备:①称取25 mg PLGA和2 mg HMME粉末溶于2 ml三氯甲烷;②待PLGA和HMME完全溶解后,加入200 μl去离子水采用超声声振仪,连续波振荡45 s,功率80 W,可得淡红色乳化液(W/O微球);③加入2.5 ml 5%PVA,高速分散均质机以13000 r/min,均质2 min(W/O/W微球);④室温下磁力搅拌器搅拌2 h,充分挥发三氯甲烷;双蒸水高速离心洗涤3~5次(5000 r/min,5 min),收集MBPLGA-HMME;⑤在真空冷冻干燥机中将收集的MBPLGA-HMME冷冻干燥48 h后充入C3F8气体,可得MBPLGA-HMME冻干粉,放入4℃冰箱中备用。在上述第①步中不加HMME,其余步骤相同,可获得空白MBPLGA。
1.3琼脂凝胶模型制备 电子天平称取500 mg琼脂凝胶粉,放入500 ml干净烧杯中,加入200 ml双蒸水,加热至沸腾,使其完全溶解于双蒸水中,并搅拌去除溶液中的气体,倒入凝胶模具中并按实验需求插入200 μl枪头,放置于阴凉干燥的坏境中自然冷却,待完全冷却后取出200 μl枪头,即制成实验所需凝胶孔洞模型,放入4℃冰箱备用。
1.4裸鼠人卵巢癌(SKOV3)移植瘤模型的建立 SKOV3细胞由重庆医科大学超声研究所赠与。将铺满培养瓶的SKOV3细胞经0.25%胰蛋白酶消化,离心去上清液,加入少量含10%胎牛血清的RPMI-1640培养液,吹打使细胞混匀,分装至新培养瓶(一传二),再加入适量含血清培养液,置于37℃、5% CO2的孵箱中传代培养。取对数期生长的SKOV3细胞经消化、离心、重悬于无血清的RPMI-1640培养液中,调整细胞浓度为3× 107个/ml;取5只BALB/c裸小鼠(4~5周龄,重庆医科大学动物实验中心提供),右侧臀部皮下接种0.5 ml/只(1.5×107),2周后成瘤,3周左右肿瘤长径为1~2 cm时用于实验。
1.5MBPLGA-HMME一般特性检测 取适量MBPLGA-HMME冻干粉,用双蒸水稀释复溶后,显微镜观察其大小、分布情况以及微球包裹药物情况,Malvern激光粒径测量仪检测微球粒径大小。
1.6紫外分光光度仪测定微球的包封率、载药率 将HMME溶解于二甲基亚砜(DMSO)溶液分别配成0.618 µmol/L、1.632 µmol/L、2.448 µmol/L、3.264 µmol/L、4.080 µmol/L、4.896 µmol/L 的溶液。先取2 ml DMSO溶液置于比色杯中,进行调零;再取2 ml HMME溶液(3.264 µmol/L),用200~800 nm波长的紫外光进行扫描,测得HMME溶液最大吸收波长在401 nm处,此为HMME的特征吸收峰[9],本研究以此来测定包封率及载药率,另外在500~700 nm还出现4个中强吸收峰,其中一个强吸收峰,其波长在622 nm处,此可作为选择光声成像激发波长的依据。然后各取2 ml上述不同浓度的HMME溶液分别置于波长为401 nm处测量OD值,作浓度-吸光度标准曲线。最后取2 ml空白PLGA和MBPLGA-HMME(两者的理论浓度均为3.264 µmol/L)溶液加入比色杯中,置于紫外分光光度仪检测槽中,测OD值,根据标准曲线,计算出实际药物含量,按以下公式算出微球的包封率和载药率。

其中Cm为MBPLGA-HMME内HMME的含量,Ct为HMME总量,Wi为包入纳米微球中的HMME含量,WT为PLGA质量(g)。
1.7体外成像 运用Vevo®LAZR光声成像系统,各取200 μl浓度为1632 µmol/L的HMME和MBPLGA-HMME溶液,加入凝胶模型中,采用探头频率为21 MHz,波长为680~970 nm的脉冲激光进行全波长辐照,选取药物最大激发波长。在选定激发波长下,再分别检测不同浓度(1632 µmol/L、816 µmol/L、408 µmol/L)的MBPLGA、MBPLGA-HMME和HMME超声及光声信号的强度变化。
1.8体内成像 取成瘤3周左右的荷瘤鼠,经腹腔注射10 g/L戊巴比妥钠约0.2 ml麻醉。将MBPLGA-HMME复溶于生理盐水中,稀释成1632 µmol/L,按6 ml/kg经瘤鼠尾静脉注射0.2 ml(实际HMME量约0.15 mg),MBPLGA-HMME逐渐在肿瘤部位积累,30~ 60 min后采用光声成像系统观察成像情况。
1.9统计学方法 采用SPSS 20.0软件。各组间和组内平均光声信号强度比较采用方差分析,P<0.05表示差异有统计学意义。
2 结果
2.1MBPLGA-HMME的一般特性 MBPLGA-HMME外观呈红色粉末状,复溶于双蒸水后呈淡红色悬液,MBPLGA呈乳白色。光学显微镜显示,MBPLGA-HMME呈球形,大小均匀,形态规则,无聚集、粘连现象(图1A)。激光共聚焦显微镜下可见MBPLGA-HMME呈红色荧光,HMME均匀分布在微球上(图1B);光学显微镜和透射电镜均可见MBPLGA-HMME呈球形,为壳核结构,外有一层明显的黑色的壳膜,HHME主要分布于微球壳上(图1A、C)。Malvern激光粒径仪测得MBPLGA、MBPLGA-HMME的平均粒径分别为(483.80±75.42)nm和(497.26±68.25)nm(图1D、E)。
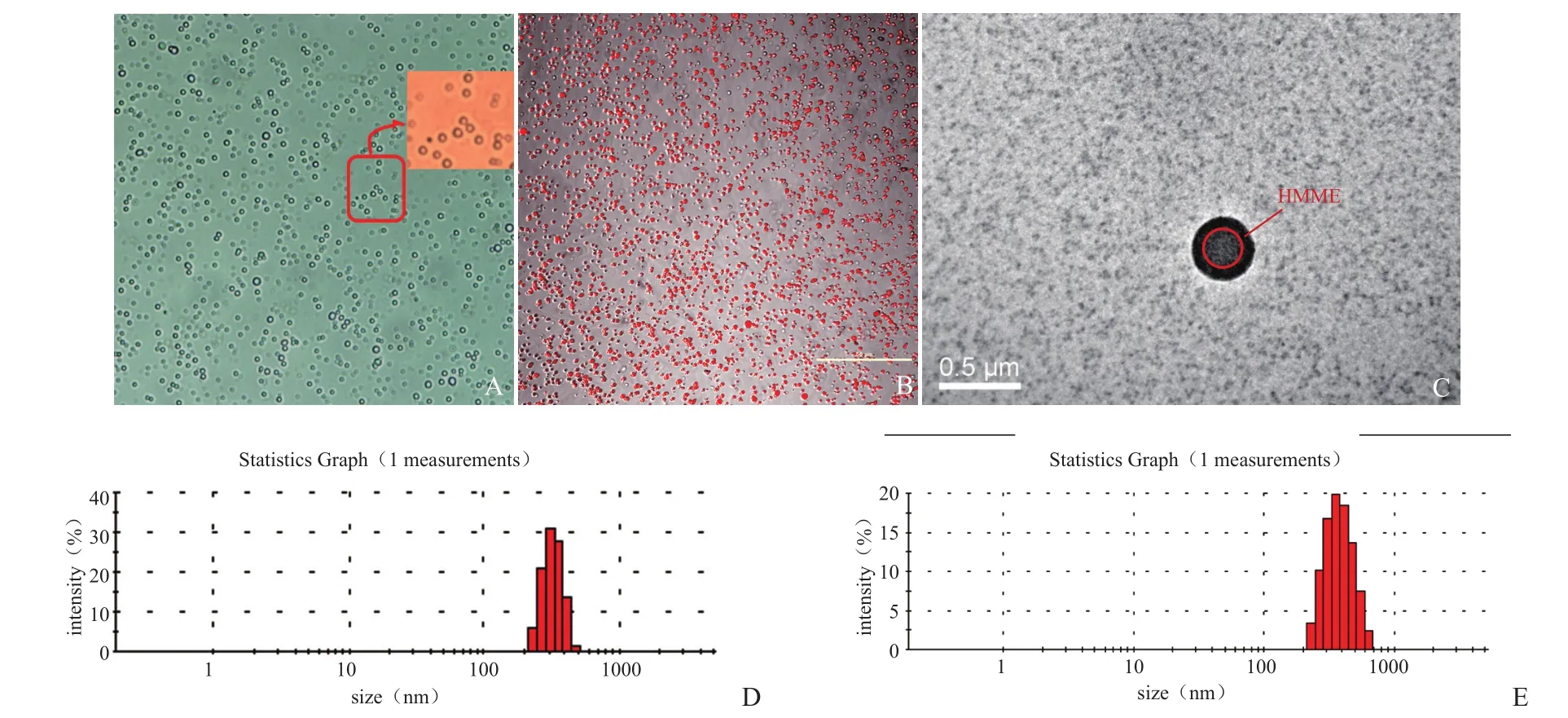
图1 显微镜下观察纳米微球。A. 光镜图(×400);B. 激光共聚焦显微镜图(×400);C.透射电镜图(×70.0K);D. MBPLGA粒径分布;E. MBPLGA-HMME粒径分布
2.2MBPLGA-HMME的包封率和载药率测定 MBPLGA未出现紫外吸收峰,MBPLGA-HMME和HMME溶液的紫外光谱图显示两者的特征性吸收峰均在401 nm,未出现移位现象。另外,在500~700 nm还出现4个中强吸收峰,其中一个强吸收峰,其波长在622 nm处,此峰可作为选择光声成像激发波长的依据(图2A箭头所示)。采用紫外分光光度法所得HMME的标准曲线(图2B),直线回归方程:y=0.1588x-0.0013,R2=0.9998;根据公式计算得到MBPLGA-HMME的包封率为(76.45±0.93)%,载药率为(6.12±0.18)%。
2.3体外成像
2.3.1超声显像 在超声模式下,双蒸水、HMME溶液呈无回声(图3A、B),其回声强度低于周围凝胶模型;MBPLGA、MBPLGA-HMME溶液均可显影(图3A、B),其回声强度高于双蒸水和HMME溶液及周围凝胶模型,并且MBPLGA-HMME溶液在不同浓度下回声强度随浓度降低逐渐减弱(图3C);而不同浓度HMME溶液均未显影,其回声强度始终低于周围凝胶模型(图3D)。
2.3.2光声显像 MBPLGA在不同浓度均未出现光声信号。HMME和MBPLGA-HMME溶液均在激光波长694 nm处出现了最强的光声信号峰(图4A、B箭)。MBPLGA-HMME和HMME溶液不同浓度梯度下均出现了较强的光信号(红色),且随溶液浓度的升高,信号也逐渐变强(图4C、D),两者光声信号值(表1)与浓度成正比,浓度越高其光声信号越强。但在成像过程中,HMME溶液中光信号值达到最大后,随辐照时间延长,其值降低,差异有统计学意义;而MBPLGA-HMME随辐照时间的延长,光声信号一直稳定在较高水平;且两组在相同浓度下,MBPLGA-HMME光声信号强度均大于HMME溶液,差异有统计学意义。

图2 A. HMME和MBPLGA-HMME(理论浓度3.264 µmol/L)的紫外吸收光谱图;B. HMME浓度-吸光度标准曲线

图3 超声B模式下。A. 双蒸水与MBPLGA显像图;B. MBPLGA-HMME与HMME溶液显像图;C. 浓度从左至右分别为1632 μmol/L、816 μmol/L、408 μmol/L 的MBPLGA-HMME溶液超声图;D. 浓度从左至右分别为1632 μmol/L、816 μmol/L、408 μmol/L 的HMME溶液超声图
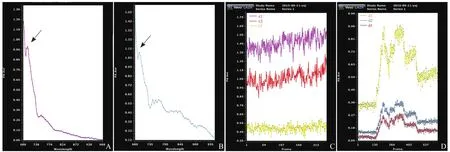
图4 A. MBPLGA-HMME溶液的光声信号图;B. HMME溶液的光声信号图,两者均在694 nm处出现最大光声信号峰;C. 浓度从上至下分别为c1(1632 μmol/L)、c2(816 μmol/L)、c3(408 μmol/L)的MBPLGA-HMME溶液光声信号光谱图;D. 同样浓度梯度(d1、d2、d3)下,HMME溶液光声信号光谱图

表1 不同浓度HMME和MBPLGA-HMME溶液平均光声信号(PA AVR/Area)强度比较
2.4体内成像 超声模式下,肿瘤呈类圆形,边界欠清,低回声,内部回声不均匀(图5A);彩色多普勒血流成像显示肿瘤内部和周边出现现状、分枝状彩色血流(图5B)。光声成像模式下,可见明显光声信号(红色)主要分布在肿瘤周边血供丰富区域,与血流信号走向一致(图5C)。
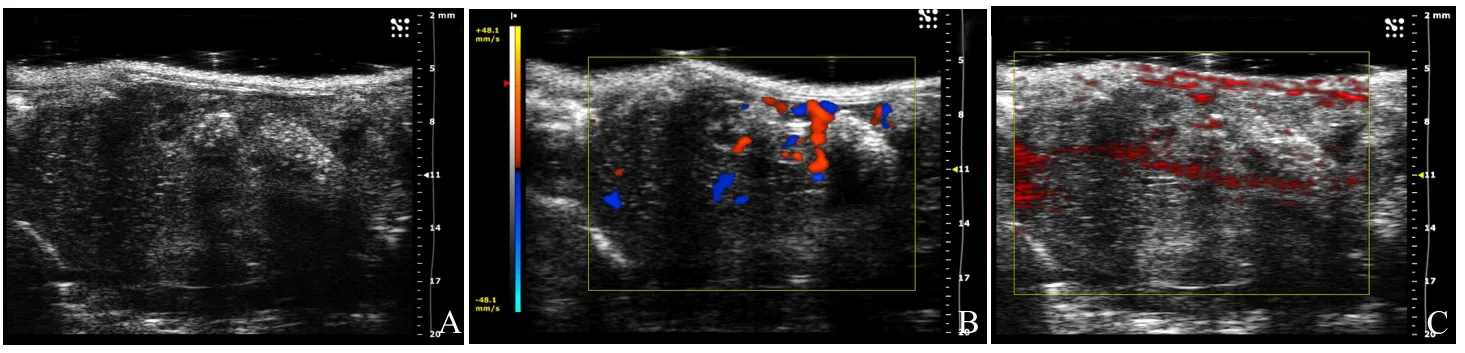
图5 MBPLGA-HMME体内肿瘤成像。A.超声图;B. 彩色多普勒成像;C. 光声成像图
3 讨论
本研究选用包封率高、稳定性和生物相容性好且体内血液循环时间长的高分子材料PLGA作为载体,制备出包裹HMME药物的纳米微球。通过显微镜下观察,可得HMME成功包裹至PLGA高分子微球上,能发出红色荧光,HMME主要位于PLGA微球壁上,包封率和载药量分别为(76.45±0.93)%、(6.12±0.18)%,再次证明PLGA微球可以携载HMME,且主要位于微球壁中[10]。MBPLGA-HMME粒径为(497.26±68.25)nm,远小于红细胞(8 μm),能够通过毛细血管进入肿瘤组织内,在肿瘤组织中累积,提高其药物浓度。
MBPLGA-HMME与HMME药物的紫外光谱吸收图一致,未发生特征性吸收峰的移位,以及光声成像系统检测两者最大光声信号峰均在694 nm处,证实HMME包裹到PLGA微球上后,并未改变其药物结构和基本的吸光性质。另外,在光声成像过程中,HMME在DMSO溶液中光信号值达到最大后,随辐照时间延长,光信号值降低。这是由于HMME的光物理性质具有微环境敏感的特征[11],在复杂的生物体环境内会发生一系列的反应,从而影响其光敏和声敏化活性,其中HMME的存在状态就是一个重要的影响因素。HMME难溶于水且易在水溶液中产生自聚合现象或在有机溶剂中达到其以单体存在形式的最大阈值后,逐渐产生聚合反应,形成分子团样的聚集体,而聚集体会引起其光谱特性的改变,降低其荧光量子产率,还会改变其光/声敏化活性,最终影响治疗效果[5,11],所以出现这种情况可能是HMME在DMSO溶液中达到以单体存在形式的最大阈值,然后分子之间逐渐结合成二聚体,最终形成聚集体,影响其光物理性质,导致上述情况出现。其中浓度为408 μmol/L组与816 μmol/L组光信号值差异无统计学意义,可能浓度为408 μmol/L已达到HMME在溶剂中以单体存在形式的最大值,开始出现少量聚集现象,816 μmol/L时已有部分形成聚合体,导致HMME之间化学键发生了改变,引起光信号值降低较大。而MBPLGA-HMME分散均匀且在一定时间内随辐照时间的延长,光声信号一直稳定在较高水平。另外,MBPLGA-HMME能进行体内光声成像。这可能是MBPLGA-HMME在水溶液中形成稳定的混悬液,减少HMME在血液循环中的聚合反应,保持药物之间不发生团聚,稳定的存在血液循环中,随血流逐渐在肿瘤部位中积累[11]。本实验不足之处:体内成像部分研究不够深入以及还未进行急性细胞毒性实验,后续体内治疗实验还在开展中。
成功制备的MBPLGA-HMME能进行超声和光声成像。其基本性能检测及成像实验显示,MBPLGA-HMME能稳定的存在于水溶液中,增强HMME水溶性且未影响其作为治疗药物的基本吸光性质,为其后续体外体内显像及治疗提供基础。
[1] 王筱冰, 王攀, 刘全宏. 声动力学疗法抗肿瘤的生物学效应研究. 中国医学影像学杂志, 2011, 19(11): 835-838.
[2] 林铌, 包捷, 王爱平. 光动力疗法的抗肿瘤机制研究进展.癌变·畸变·突变, 2014, 26(5): 396-400.
[3] Lei TC, Glazner GF, Duffy M, et al. Optical properties of hematoporphyrin monomethyl ether (HMME), a PDT photosensitizer. Photodiagnosis Photodyn Ther, 2012, 9(3):232-242.
[4] 刘韧耕, 李黎波. 声动力治疗的研究进展. 中国激光医学杂志, 2015, 24(3): 151-157.
[5] Zheng Y, Zhang Y, Ao M, et al. Hematoporphyrin encapsulated PLGA microbubble for contrast enhanced ultrasound imaging and sonodynamic therapy. J Microencapsul, 2012, 29(5): 437-444.
[6] 郑明彬, 赵鹏飞, 罗震宇, 等. 纳米技术在癌症诊疗一体化中的应用. 科学通报, 2014, 59(31): 3009-3024.
[7] 张振奇, 卢漫. 光声成像的研究进展. 实用医院临床杂志,2015, 12(2): 139-141.
[8] Gu B, Sun X, Papadimitrakopoulos F, et al. Seeing is believing,PLGA microsphere degradation revealed in PLGA microsphere/PVA hydrogel composites. J Control Release, 2016,228: 170-178.
[9] 张慧芳, 于长江, 郭颖志, 等. 用于肿瘤光动力治疗的血卟啉单甲醚微纳米载药系统的研制. 中国计划生育学杂志,2007, 15(12): 731-734, 744.
[10] 张勇, 王志刚, 任建丽, 等. 载血卟啉脂质微泡的制备及一般特性的实验研究. 中国超声医学杂志, 2008, 24(7): 577-579.
[11] 王颖, 刘凡光, 顾瑛, 等. 两亲性光敏剂血卟啉单甲醚在不同溶液体系中的存在状态. 中国激光医学杂志, 2005, 14(3):137-145.
(本文编辑 张建军)
Preparation and Imaging Studies of Poly-lactic Acid-glycolic Acid Polymeric Nanoparticles Coated Hematoporphyrin Monomethyl Ether
Purpose To prepare the poly-lactic acid - glycolic acid (PLGA) polymeric nanoparticles coated hematoporphyrin monomethyl ether (HMME) as a multifunction contrast agent (MBPLGA-HMME, micro-bubble), and detectits physical and pharmacological properties, as well as its application and feasibility of imaging. Materials and Methods MBPLGA-HMMEwas prepared by using multi-emulsion method. Its structure, morphology and concentration of HMME loaded on PLGA microcapsules were assessed. In vitro ultrasound/ photoacoustic imaging of HMME and MBPLGA-HMME microspheres were compared and in vivo preliminary photo acoustic imaging of MBPLGA-HMMEmicrospheres was performed. Results MBPLGA-HMMEwas showed as light red suspension after resolving in distilled water;observed as regular and uniformed spherical putamen structure with obvious black shell membrane without aggregation and adhesion, as well as emitting red fluorescence .HMME mainly distributed on the PLGA microspheres. Photoacoustic imaging in vitro showed that the average photoacoustce signal intensity of MBPLGA-HMMEwere 0.2009±0.0636, 0.3789± 0.0431, 0.5380±0.0997 under different concentrations (408 µmol/L, 816 µmol/L, 1632 µmol/L), respectively, while the average photoacoustce signal intensity of HMME were 0.0738±0.0133, 0.1137±0.0065, 0.2170±0.0270 under the same concentration gradient. There was significant difference of signal intensity between two groups in the same concentration and within one group in different concentrations, while the basic pharmacology properties didn't change. Photoacoustic imaging of intravenous injected MBPLGA-HMMEcan be performed in mice with tumor. Conclusion PLGA microspheres coated with HMME was successfully prepared with improved water-soluble and light absorption properties, which can be used in ultrasound/photoacoustic imaging.
Contrast media; Hematoporphyrins; Polymers; Polyglycolic acid; Lactic acid; Photoacoustic imaging
邹建中
国家973计划项目(N2011CB707900);国家自然科学基金(81127901,11274404,81201102)。
R445.1;R445.9
2016-03-08
2016-03-26
10.3969/j.issn.1005-5185.2016.08.020
