鼻咽癌放射性脑损伤的MR动态磁敏感对比灌注成像
2016-11-09洲LIZhou马林MALin陈旺生CHENWangsheng李长清LIChangqing王飞WANGFei李建军LIJianjun
李 洲LI Zhou马 林MA Lin陈旺生CHEN Wangsheng李长清LI Changqing王 飞WANG Fei李建军LI Jianjun
作者单位1.海南省人民医院放射科 海南海口 570311 2.解放军总医院放射科 北京 100853
鼻咽癌放射性脑损伤的MR动态磁敏感对比灌注成像
李 洲1LI Zhou马 林2MA Lin陈旺生1CHEN Wangsheng李长清1LI Changqing王 飞1WANG Fei李建军1LI Jianjun
作者单位1.海南省人民医院放射科 海南海口 570311 2.解放军总医院放射科 北京 100853
Department of Radiology, PLA General Hospital, Beijing 100853, China
Address Correspondence to: MA Lin E-mail: cjr.malin@vip.163.com
中国医学影像学杂志2016年 第24卷 第8期:561-564
Chinese Journal of Medical Imaging 2016 Volume 24 (8): 561-564
目的 鼻咽癌放射性脑损伤的血流动力学变化机制尚不明确,采用MR动态磁敏感对比灌注成像(DSC-PWI)探索鼻咽癌患者接受放疗过程中和放疗结束后的不同阶段双侧颞叶脑组织血流动力学的动态变化特征。资料与方法 回顾性分析80例接受放射治疗的鼻咽癌患者,在放疗前以及放射线剂量达20、40、60 Gy时分别进行DSC-PWI检查,对其中的47例在放疗结束后的第3、6、12个月进行随访。以放疗前自身数据作为协变量进行对照。结果 放疗前脑血容量(CBV)和脑血流量(CBF)值分别为(1146.0±73.5)ml/(min·100 g)和(325.2±29.7)ml/(min·100 g),放疗结束时(60 Gy)分别为(1128.3±71.1)ml/(min·100 g)和(314.9±47.5)ml/(min·100 g),差异无统计学意义(P>0.05);放疗后第3个月,CBV和CBF值分别为(1038.4±75.8)ml/(min·100 g)和(284.3±30.7)ml/(min·100 g),与放疗前比较,差异有统计学意义(P<0.001);放疗后第3个月CBV值及CBF值ROC曲线下面积分别为0.867和0.856。放疗后第3个月后至第12个月,CBV和CBF值不同程度地回升,第12个月时两者分别为(1093.5±63.7)ml/(min·100 g)和(296.5±35.7)ml/(min·100 g),低于放疗前水平,但差异无统计学意义(P>0.05)。结论 DSC-PWI的CBV和CBF等灌注指标能从不同角度反映组织的微循环状态和功能,鼻咽癌放射性脑损伤的靶区血管结构和功能相应发生变化,参与了放射性脑损伤。
鼻咽肿瘤;辐射损伤;脑疾病;磁共振成像;灌注成像;血流动力学
动物实验病理组织学证明,鼻咽癌放射性脑损伤早期即可观察到照射野内微血管的内皮细胞损伤,随着剂量的累积,血管损伤更加严重,激发血管壁玻璃样变性、腔内微血栓形成等进而改变血管的结构,直接导致通透性增加、血管源性水肿及脑组织缺氧缺血等一系列复杂的病理生理反应[1-2]。MR动态磁敏感对比灌注成像(dynamic susceptibility contrast perfusion weighted imaging,DSC-PWI)是一种可反映微血管分布和血流灌注状态的成像技术,本研究采用DSC-PWI探索鼻咽癌患者接受放疗过程中和放疗结束后的不同阶段双侧颞叶脑组织血流动力学的变化特征,探讨血管损伤在鼻咽癌放射性脑损伤中的作用,从血管损伤的角度为放射性脑损伤动态监测评价提供客观理论依据。
1 资料与方法
1.1研究对象 收集2013年7月—2015年12月在海南省人民医院和解放军总医院经影像学检查和鼻咽病灶活检初次确诊为鼻咽癌的患者,体格检查及实验室检查未发现心、肝、肾等重要器官疾病;放疗前常规行颅脑MRI扫描无明显异常征象。排除合并脑白质病变和脑萎缩、脑血管疾病、脑肿瘤和脑外伤史等脑部病变,以及糖尿病、甲状腺功能亢进或(和)减退等内分泌、遗传性和免疫性疾病患者。共80例患者符合标准,男61例,女19例;年龄28~72岁,平均(54±4)岁,其中年龄>45岁55例、平均(60±4)岁,年龄≤45岁25例、平均(37±8)岁。
患者接受放疗和DSC-PWI检查前对本研究知情同意,并签署MR对比剂知情同意书。MRI检查包括放疗开始前、放疗结束和放疗结束后第3个月的颅脑常规扫描,以及放疗总剂量达20 Gy、40 Gy、60 Gy(放疗结束)时以及其中的47例在放疗结束后第3、6、12个月分别进行DSC-PWI检查。
1.2DSC-PWI检查方法 采用Siemens Verio 3.0T MR扫描仪和标准6通道头颅线圈。MRI常规平扫:扫描序列为OSag-T1FLAIR、OAxi-T1FLAIR、OAxi-T2WI和OAxi-T2FLAIR。DSC-PWI采用GRE-EPI序列:TE 40 ms,TR 2000 ms,翻转角为90°,视野24 cm×24 cm,层厚6.0 mm,层间距0.3 mm,激励次数为1。动态灌注扫描平行于前后联合线平面,范围包括双侧颞叶。对比剂钆喷酸葡胺为469.01 mg/15 ml,注射用量0.20 mmol/kg,经肘静脉以5.0 ml/s推注,随后以相同流速用生理盐水20 ml冲洗。MRI增强扫描于DSC-PWI采集完成后进行:扫描序列包括全脑OSag-fsT1WI、OCor-fsT1WI和OAxi-fsT1WI。
1.3图像后处理 将DSC-PWI扫描的数据传输至设备自带的后处理工作站,使用其内置Functool软件进行后处理,调整脑血容量(cerebral blood volume,CBV)值的伪彩图,在定位图的大脑脚层面双侧颞叶前后部的镜像区各绘制2个感兴趣区(ROI),取双侧颞叶共4个ROI的数据平均值用于分析,随访复查时与第一次扫描的图像配准,尽可能保证在同一位置勾画ROI,减少人为因素带来的误差。采用灌注软件自动获得脑血流量(cerebral blood flow,CBF)和CBV的参数图及相应数据。
1.4统计学方法 采用SPSS 18.0软件,灌注数据以±s表示,先行方差齐性检验,DSC-PWI对放射性脑损伤的诊断效能评价采用t检验和受试者工作特征(ROC)曲线下面积(area under curve,AUC),AUC的取值范围为0.5~1.0。P<0.05表示差异有统计学意义。
2 结果
2.1放疗前至放疗结束后第12个月CBV和CBF值的变化 放疗前CBV和CBF值与放疗结束时(60 Gy)差异无统计学意义(P>0.05);放疗结束后第3个月,CBV和CBF值与放疗前比较,差异有统计学意义(t=7.443、7.194,P<0.001);放疗结束后第3个月后至第12个月,CBV和CBF值不同程度地回升,第12个月时低于放疗前水平,但差异无统计学意义(P>0.05)。见表1、图1。
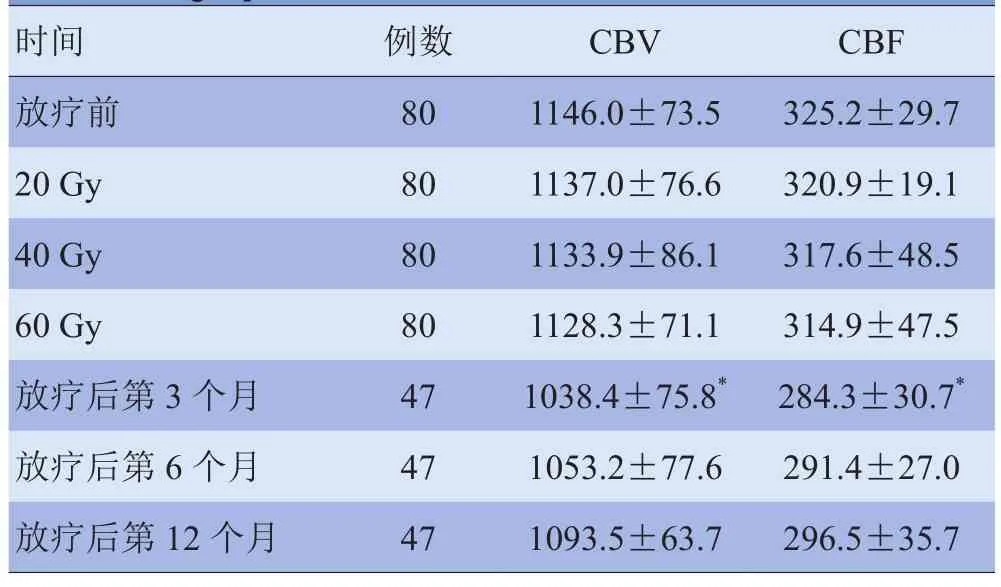
表1 鼻咽癌患者DSC-PWI的CBV和CBF动态变化[ml/(min·100 g)]
2.2DSC-PWI各指标值的ROC分析 ROC曲线分析显示放疗后第3个月CBV值及CBF值AUC别为0.867和0.856(P<0.05),具有较好的诊断效能。见图2。
3 讨论
头颈部肿瘤或某些非肿瘤性病变经放疗后,脑白质会发生不同程度的损伤,颅脑照射后的实验动物病理切片发现,照射野内脑组织首先出现微血管扩张、被覆的内皮细胞缺失及基底膜损伤等改变[1-2],同时,伴有炎症细胞浸润,系统性的炎症反应也是早期放射性脑损伤的重要特征[1,3-5]。这些损伤会导致微血管通透性增加及血-脑屏障破坏,继而影响脑血流动力学[6],由于血管损伤引起脱髓鞘等神经组织的损伤[1]。因此,血管结构受损是放射性脑组织早期损伤的原因和机制。这种微观结构的损伤可以持续较长时间[2],若血管损伤进一步加重,最终会导致脑组织长期缺血而坏死液化[7-8],病理改变也从微观水平发展到宏观状态,脑组织发生不可逆性损伤,引起一系列相应功能区的神经定位体征。因此,有必要对鼻咽癌放疗后双侧颞叶脑组织微结构及循环进行探索。DSC-PWI为研究脑组织微观结构和循环提供了可能。
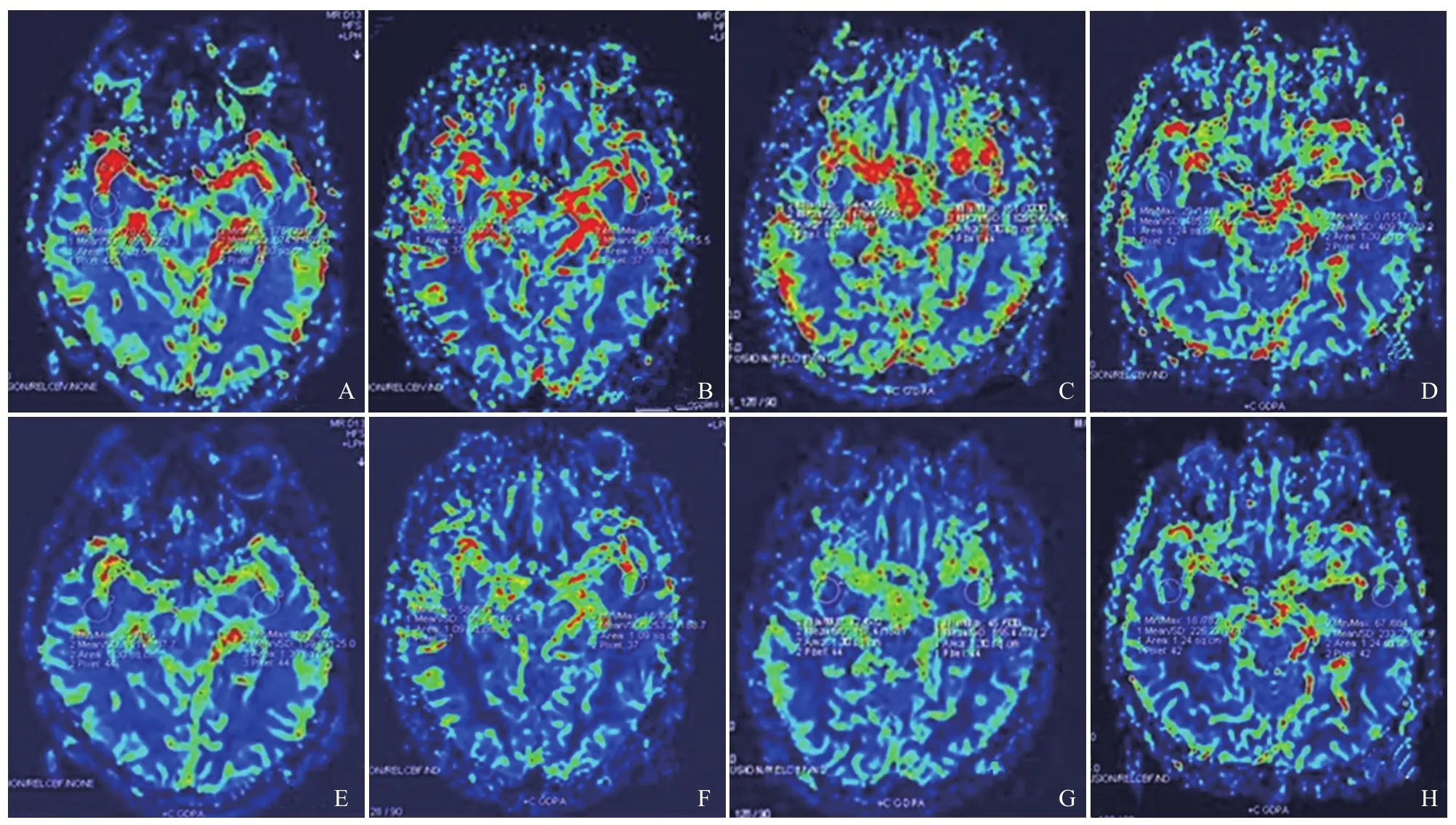
图1 男,52岁,鼻咽癌接受放疗。A~D分别为放疗前、放疗结束、放疗后第3个月和第12个月的CBV图,E~H分别为放疗前、放疗结束、放疗后第3个月和第12个月的CBF图,主要通过数值反映血流量的变化。脑血流图的高信号区提示血流灌注丰富部分,低信号区则血流灌注少,主要通过数值反映血容量的变化
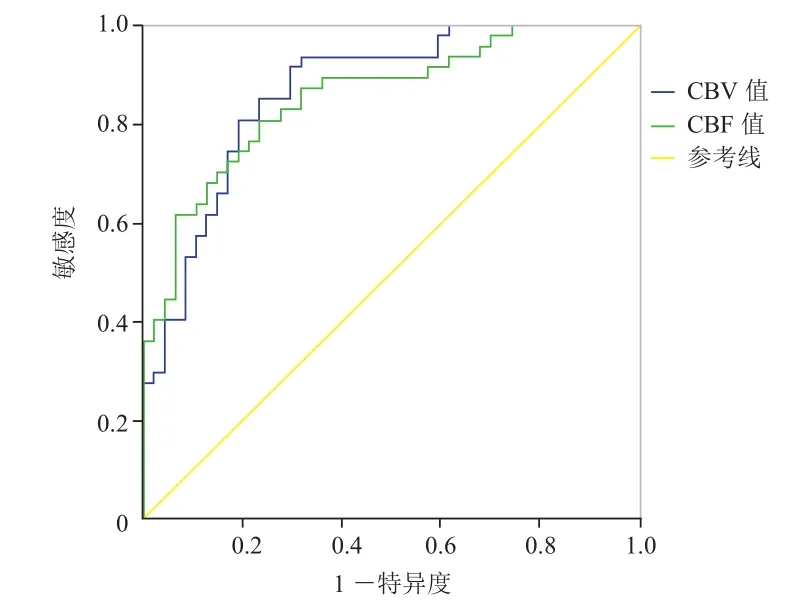
图2 鼻咽癌患者放疗结束后第3个月CBV及CBF值的ROC曲线
本研究主要观察放射性脑损伤的微循环变化,尤其是在损伤的早期阶段微循环的变化很小,需要更敏感的量化指标来监测,所以采用DSC-PWI。结果显示,放疗过程中,CBV和CBF轻微下降,但是与放疗前比较差异无统计学意义(P>0.05)。在放射性脑损伤的急性期,双侧颞叶脑组织在放射线作用下,微观结构发生变化,神经细胞和微血管轻度损伤,动物实验研究也表明,神经元和胶质细胞仅表现为功能轻度受损,微血管内皮细胞连接稀疏。此时,大部分病例DSCPWI的CBV和CBF并无明显变化,少数CBF降低与放疗前比较可见差异性变化。理论上讲,此阶段的微血管内皮细胞分布发生了改变,其功能也会相应地发生变化,尤其是通透性会或多或少变化,这样体现在CBF指标上就会有所反映;而微血管的管壁柔软度和管腔变化并不明显,单位时间内流经血管的血容量指标CBV改变程度不及CBF。CBV和CBF等灌注指标从不同角度反映了组织的微循环状态和功能,但是灌注参数的计算是基于血-脑屏障模型,故这些参数与血-脑屏障的完整性状态有关[9-10]。此外,这些参数还与对比剂的用量和注射速度有关。为突出微血管结构的细微变化带来的CBV和CBF等指标的敏感性,尤其是放射性脑损伤的急性期,DSC-PWI选择GRE-EPI序列,以突出磁敏感的细微差别,从而能够通过相应的参数反映出来。此阶段大部分病例CBV和CBF参数无明显变化,说明微血管的损伤轻微;至于少数病例的CBF改变明显,可能主要与自身因素有关,例如对放射线的反应敏感或者自身免疫状态低下等原因,对微血管的破坏程度相对较重,对比剂轻微外渗,局部磁场不均,GRE-EPI序列可以反映出磁敏感性的细微差别,监测到CBV和CBF降低,特别是后者降低稍明显一些。
放疗结束至放疗后的第3个月,CBV和CBF值均表现为下降趋势,下降幅度较放射治疗过程中稍大。对鼻咽癌放射性脑损伤而言,大血管的损伤并不大,双侧颞叶微观结构和神经组织的代谢和功能改变,主要由毛细血管的损伤导致。可见,CBV和CBF的变化幅度和程度取决于边缘辐射靶区微血管的结构和功能状态。放射治疗结束后的3个月内,虽然没有直接的放射线作用于脑组织,但是电离辐射损伤对人体组织具有时间上的序贯性,脑组织的损伤作用,尤其是微血管的损伤,并不会因为放射线直接停止而即时终止,微血管的损伤进一步加重,由于内皮细胞的连接中断,血管通透性增加,细胞内外水分子分布比例失衡,发生血管源性水肿,细胞外水分子增多,微血管受压,管腔内血液不同程度受阻,流速减慢,单位时间内血容量也就相应减少。此外,微血管的损伤由内向外,损伤深度和程度呈渐进式进展,可能导致微血管肌层纤维化而增厚,血管管壁硬度增加、弹性降低,单位时间流经靶血管的血容量和血流量减少,相应地,DSC-PWI的CBV和CBF减少。更为重要的是,随着脑组织损伤的逐渐加重,可能引起或者启动其他损伤模式,伴随炎性渗出物,甚至引发某些免疫因子的分泌等继发改变,都会不同程度地导致灌注异常。也就是说,此阶段不只是某种单一的损伤模式,而可能存在几种机制的联合作用,或者协同效应加剧脑损伤,在内皮细胞破坏的基础上,内膜继发反应性增生以及管壁透明样变性,这样,放射线对靶区脑组织的微血管损伤突显出来,这些因素叠加的结果,使得CBV和CBF值降至最低水平。当然,磁共振灌注成像的参数模型是建立在血-脑屏障完整的基础上计算得到的,是基于血-脑屏障完整的前提下的数据,对于极少数血-脑屏障局部破坏者,对比剂外渗、局部磁场不均,所测得的CBV和CBF值比实际要偏小一些[11-12]。
在放疗结束后的第4~12个月,CBV和CBF值缓慢上升,但低于放疗前水平,与冯霞等[13]的研究接近。CBV和CBF值增高,表明单位时间内的血容量和血流量增加,提示前期损伤的部分微血管功能和结构有所修复,其原因可能为随着微血管内皮细胞等结构修复,血管内外、神经细胞外间隙水分子分布逐渐恢复平衡,血管源性水肿吸收,微血管的管腔受压缓解;另一方面,放疗过程中少量崩解的髓鞘也被吸收,某些渗出的炎性因子也被吸收,血管内皮细胞的修复加快,血管的通透性慢慢恢复正常。这样,单位时间内流经靶区的血容量和血流量相对急性期有所增加,CBV和CBF值上升。然而,截至放疗结束后的第12个月,CBV和CBF值并不能回升至放疗前水平,可能是因为修复后毛细血管内皮细胞较粗大,细胞之间缺少连接不够紧密,间隙较大,靶区微血管通透性仍然较正常水平要高,即使进行更远期的随访,也未必能恢复到放疗前水平,而且鼻咽癌放疗后的双侧颞叶脑组织的微观损伤可能在较长时间甚至很长时间内存在[13]。
总之,尽管鼻咽癌放疗后MRI常规检查通常表现为阴性,实际上,DSC-PWI监测到微血管损伤导致的血流量和血容量减低,可见,脑组织的微结构和微循环发生了改变,参与了放射性脑损伤。
[1] Wu KL, Tu B, Li YQ, et al. Role of intercellular adhesion molecule-1 in radiation-induced brain injury. Int J Radiat Oncol Biol Phys, 2010, 76(1): 220-228.
[2] Yuan H, Gaber MW, Boyd K, et al. Effects of fractionated radiation on the brain vasculature in a murine model: bloodbrain barrier permeability, astrocyte proliferation, and ultrastructural changes. Int J Radiat Oncol Biol Phys, 2006,66(3): 860-866.
[3] Li H, Wei M, Li S, et al. Increased CD147 and MMP-9 expression in the normal rat brain after gamma irradiation. J Radiat Res, 2013, 54(1): 27-35.
[4] Zawaski JA, Gaber MW, Sabek OM, et al. Effects of irradiation on brain vasculature using an in situ tumor model. Int J Radiat Oncol Biol Phys, 2012, 82(3): 1075-1082.
[5] Nordal RA , Wong CS. Interceullular adhesion mole cule-1and blood-spinal cord barrier disruption in central nervous system radiation injury. J Neuropathol Exp Neurol, 2004 , 63(5): 474-483.
[6] Acker JC, Marks LB, Spencer DP, et al. Serial in vivo observations of cerebral vasculature after treatment with a large single fraction of radiation. Radiat Res, 1998, 149(4): 350-359.
[7] Valk PE, Dillon WP. Radiation injury of the brain. Am J Neuroradiol, 1991, 12(1): 45-62.
[8] Hu LS, Eschbacher JM, Heiserman JE, et al. Reevaluating the imaging definition of tumor progression: perfusion MRI quantifies recurrent glioblastoma tumor fraction, pseudoprogression, and radiation necrosis to predict survival. Neuro Oncol,2012, 14(7): 919-930.
[9] Korkolopoulo P, Patsouris E, Konstantinidou AE, et al. Hypoxia-inducible factor 1alpha/vascular endothalial growth factor axsis in astrocytomas. associations with microvessel morphometry, proliferation and prognosis. Neuropathol Appl Neurobiol, 2004, 30(3): 267-278.
[10] Maia AC Jr, Malheiros SM, da Rocha AJ, et al. MR cerebral blood volume maps correlated with vascular endothelial growth factor expression and tumor grade in nonenhancing gliomas. Am J Neuroradiol, 2005, 26(4): 777-783.
[11] Finch CE , Morgan TE. Systemic inflammation, infection, a poE alleles, and alzheimer disease: a position paper. Curr Alzheimer Res, 2007, 4(2): 185-189.
[12] Ryu JK, Mclarnon JG. A leaky blood-brain barrier, fibrinogen infiltration and microglial reactivity in inflamed Alzheimer's disease brain. J Cell Mol Med, 2009, 13(9A): 2911-2925.
[13] 冯霞, 邱士军. 鼻咽癌患者放射治疗后脑组织微结构及循环改变. 第二军医大学学报, 2013, 34(6): 650-654.
(本文编辑 周立波)
Magnetic Resonance Dynamic Susceptibility Contrast Perfusion Weighted Imaging on Radiation-induced Brain Injury in Nasopharyngeal Carcinoma
Purpose The mechanism of hemodynamic changes in nasopharyngeal carcinoma with radiation-induced brain injury is not clear. The aim of this study is to explore the hemodynamic characteristics of bilateral temporal lobe brain tissue in different radiotherapy stages during and after the treatment using magnetic resonance dynamic susceptibility contrast perfusion weighted imaging (DSC-PWI). Materials and Methods DSC-PWI was applied in all 80 patients before radiotherapy and at the radiation dose of 20 Gy, 40 Gy and 60 Gy, respectively. It was also performed for 47 patients in the 3rd, 6th and 12th month after radiotherapy, and compared with data before radiotherapy. Results Before radiotherapy, cerebral blood volume (CBV) and cerebral blood flow (CBF) values were (1146.0±73.5) ml/(min·100 g) and (325.2±29.7) ml/(min·100 g); at the end of radiotherapy (60 Gy radiation dose) they were (1128.3±71.1) ml/(min·100 g) and(314.9±47.5) ml/(min·100 g), there was no significant difference (P>0.05); three months later after radiotherapy, CBV and CBF were (1038.4±75.8) ml/(min·100 g) and(284.3±30.7) ml/(min·100 g), respectively. There was significant difference compared with the value before radiotherapy (P<0.001). The area under the curve of ROC of CBV and CBF three months later after radiotherapy was 0.867 and 0.856, respectively. Since the 3rd until the 12th month after radiotherapy, CBV and CBF values increased to (1093.5± 63.7) ml/(min·100 g) and (296.5±35.7) ml/(min·100 g), respectively. There was no significant difference compared with the value before radiotherapy (P>0.05). Conclusion The CBV and CBF perfusion index of DSC-PWI can reflect tissue microcirculation and function, suggesting that radiation-induced brain injury in nasopharyngeal carcinoma involved corresponding changes of target vascular structure and function in bilateral temporal lobe.
Nasopharyngeal neoplasms; Radiation injuries; Brain diseases; Magnetic resonance imaging; Perfusion imaging; Hemodynamics
马 林
国家自然科学基金(81360233,81560282);海南省重点科技项目(ZDXM201300269)。
R730.42;R739.6
2016-03-15
2016-04-21
10.3969/j.issn.1005-5185.2016.08.001
