微波辅助肝切除在治疗肝原发恶性肿瘤中的临床应用
2016-10-29徐新保张洪义
陈 智, 徐新保, 赵 刚, 吴 丹, 张洪义
(1安徽医科大学空军临床学院肝胆外科,北京 100142;2中国人民解放军空军总医院肝胆外科; 3中国人民解放军空军总医院麻醉科;*通讯作者,E-mail:zhhyiyi1487@163.com)
微波辅助肝切除在治疗肝原发恶性肿瘤中的临床应用
陈 智, 徐新保, 赵 刚, 吴 丹, 张洪义
(1安徽医科大学空军临床学院肝胆外科,北京 100142;2中国人民解放军空军总医院肝胆外科;3中国人民解放军空军总医院麻醉科;*通讯作者,E-mail:zhhyiyi1487@163.com)
目的 探讨微波消融(MWA)辅助肝切除在治疗肝原发恶性肿瘤中的临床应用。 方法 对2014-01~2016-01来我院行肝部分切除的58例肝原发恶性肿瘤患者进行回顾性分析,微波组是微波辅助肝切除患者37例,对照组是非微波辅助肝切除患者21例。其中微波组腔镜手术7例,开腹手术30例;对照组腔镜手术4例,开腹手术17例。微波组术前在超声引导下或腹腔镜直视下、开腹直视下行微波消融,使肝切缘凝固化,减少肝切除时肝创面出血。记录手术方式、术中出血、术中及术后并发症、手术时间、腹腔引流管拔出时间、术后住院时间、有无阻断肝门情况等。 结果 腹腔镜手术均顺利,无中转开腹,术后无明显胆漏及出血,腹腔镜微波组较腹腔镜对照组出血较少(P=0.004),住院时间短(P=0.000),二者手术时间无差异(P=0.821);开腹手术患者中1例术后因继发胸腹水,肝功能衰竭死亡,开腹微波组较开腹对照组出血较少(P=0.037),手术时间短(P=0.042),二者术后住院时间无差异(P=0.927)。 结论 微波辅助肝切除可有效地减少出血,减少腹腔镜手术中转开腹的可能,增加腹腔镜肝切除的安全性,尤其对合并肝硬化的患者,能有效控制出血,减少手术时间,降低患者围手术期的并发症。
微波消融; 肝切除; 肝原发恶性肿瘤
目前手术切除仍是治疗原发性肝癌最有效的治疗方法,而手术出血是肝切除手术主要的问题,尤其合并肝硬化的病例。近些年来,随着腹腔镜技术的普及,腹腔镜肝切除被越来越多的医院推崇,然而我们要面对的现实是中国原发性肝癌患者往往合并肝硬化,术中出血较多且难以控制,是腔镜手术失败的重要原因,同时对病人生命安全产生巨大危害。如何有效地控制肝断面出血,是腹腔镜肝切除和开腹肝切除的最重要组成部分。研究证明微波消融能使肝断面上肝组织凝固坏死,凝固闭合血管,减少肝创面出血,同时消灭切缘病灶,减少了肿瘤的复发率[1]。大量临床数据也表明微波可以安全、有效的应用[2]。我们对58例肝原发恶性肿瘤患者进行回顾性分析,现将疗效报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2014-01~2016-01在我院行肝切除58例肝原发恶性肿瘤临床病例,入选标准:①CT或MRI高度怀疑肝原发性恶性肿瘤,根据影像学检查结果初步判断可以根治切除或姑息性切除,而无远处转移者;②肝功能Child A级或肝功能B级,经保守治疗后肝功能达A级;③无其他手术禁忌证:包括心、肺功能较差,不耐受手术等;④家庭经济较好,愿意接受手术治疗者。微波组所有患者平均年龄55.5(38-73)岁,男性29例,女性8例。对照组所有患者平均年龄54.8(36-80)岁,男性20例,女性1例 。术前两组患者一般状况比较见表1、2,微波组与对照组在年龄、肝硬化比例、肿瘤直径上无明显差异;以Couinaud 分段,肿瘤具体位置见表3、4。两组患者均签署了知情同意书,并通过了空军总医院伦理委员会的批准。
表1 微波组与对照组腔镜手术术前状况比较
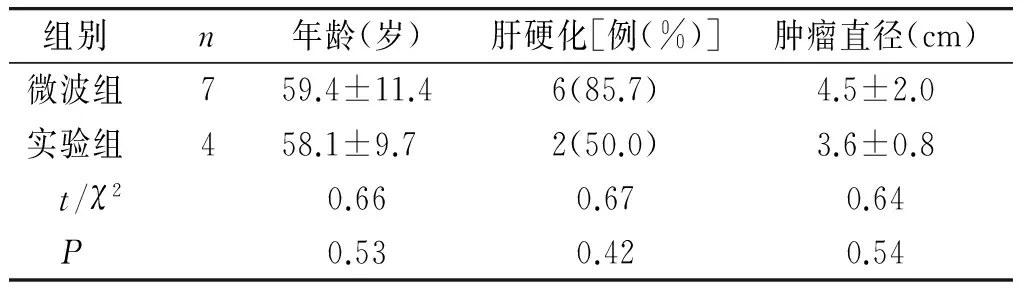
组别 n年龄(岁)肝硬化[例(%)]肿瘤直径(cm)微波组759.4±11.46(85.7)4.5±2.0实验组458.1±9.7 2(50.0)3.6±0.8 t/χ20.660.670.64 P0.530.420.54
表2 微波组与对照组开腹手术术前状况比较
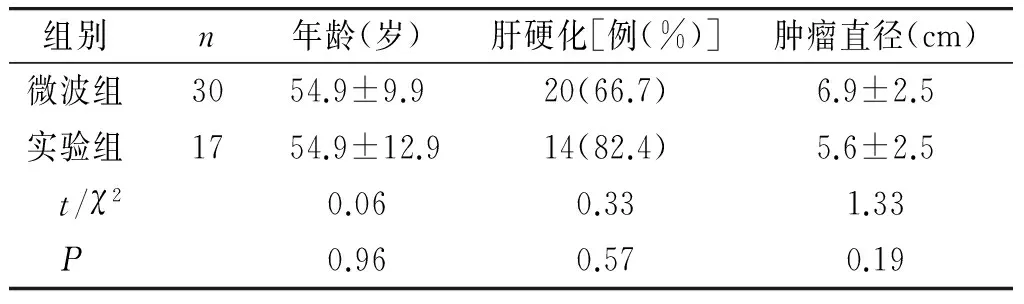
组别 n年龄(岁)肝硬化[例(%)]肿瘤直径(cm)微波组3054.9±9.920(66.7)6.9±2.5实验组1754.9±12.914(82.4)5.6±2.5 t/χ20.060.331.33 P0.960.570.19
表3 微波组与对照组腔镜手术肿瘤位置比较
(例)

组别ⅡⅢⅤⅥⅦⅥ+ⅦⅡ+Ⅲ微波组0111211对照组1210000
表4 微波组与对照组开腹手术肿瘤位置比较
(例)

组别ⅠⅡ+ⅢⅡ+Ⅲ+ⅣⅣⅤⅤ+ⅥⅥⅥ+ⅦⅦⅦ+ⅧⅢ微波组25314245220对照组03132003212
1.2 仪器设备
微波消融针(ECO-100C)产自南京亿高医疗设备有限公司,双片机控制、双数码管显示、双微波源,微波频率(2450±10)MHz,输出功率0-100 W,输出方式分为连续微波与脉冲微波。超声采用国产M7便携式彩色多普勒超声仪。
1.3 手术操作方法
术前均按大手术准备,包括肝功能的调整,胃肠道准备,术前备血,心理准备等。体位应根据具体肿瘤位置调整,肝右叶肿瘤常需右侧垫高,肝左叶肿瘤可取平卧位,以充分暴露手术区域为准则。麻醉采用气管插管全身麻醉。开腹手术切口多采用右肋缘下切口,必要时可向左肋缘下延长切口,呈人字形切口,同样以充分暴露手术区域为准则。
腹腔镜手术取脐下缘切口长约1.0 cm,以气腹针穿刺充CO2气,行人工气腹,腹压压力设置为12 mmHg,流速设置为5.0 L/min,在脐部置入腹腔镜直视下,行剑突下、右腋前线、剑突与脐之间正中线分别置入Trocar,置入电钩、吸引器及抓钳。初步探查腹腔,观察肿瘤的部位及有无肝内、腹腔转移,判断手术切除范围,游离韧带,控制进肝及出肝血流,可通过小网膜孔放置乳胶管以备第一肝门短暂血流阻断,或在肝门处结扎相关血管。术中超声确定手术切除范围后,用电刀电凝出预切线,于预切线处超声引导下插入微波消融针,避开大的血管及胆道,每次插入点间隔3-4 cm,采用输出功率60-80 W、2 450 MHz,微波固化3-5 min,微波针常规扎入4 cm左右,不能扎入太深,逐渐拔出,减少针道出血,拔出微波消融针后,可用电刀电凝穿刺点,止血效果更佳。沿着预切除线形成的微波固化带,用电刀、超声刀或超吸刀沿凝固带切除肝组织,在切除侧用粗线缝扎打结,牵引用。腹腔镜术中遇有直径>0.3 cm的管道结构予以钛夹或不可吸收塑料夹钳闭,开腹手术可用丝线结扎,较大血管可用3-0或4-0血管线缝合。对于肿瘤局部切除者,可在距肝肿瘤边缘1.0-2.0cm周围正常肝组织行微波消融。病灶或肝叶切除后,检查肝断面有无出血或胆汁渗漏,可疑之处给予钛夹夹闭或血管线缝合。然后设计肝断面如何覆盖,如无张力,可行肝断面对合封闭,如无法对合,可用带蒂网膜覆盖或用纤维蛋白胶、止血纱布。对照组手术方法相同。腹腔镜手术常规不放置引流管,开腹手术常规放置1-2个引流管。术后给予抗炎、保肝、止血、营养支持、对症等治疗,注意观察患者生命体征,腹腔引流及尿量情况。
1.4 观察指标
观察记录手术方式、术中出血量,手术时间、术中及术后并发症,有无阻断肝门情况、术后病理结果,术后腹腔引流时间,术后住院时间。
1.5 统计学分析
采用SPSS17.0统计软件进行统计学处理。计量资料采用t检验,计数资料采用卡方检验,P≤0.05为差异有统计学意义。
2 结果
58例手术均顺利切下病灶,腹腔镜手术均未中转开腹,微波开腹组其中1例术中行左半肝切除,术后出现胸腹水,继发感染导致多器官功能衰竭死亡。
腹腔镜手术均为局部肿瘤切除,均未阻断肝门,其中微波组术后病理证实均为肝细胞肝癌,切缘均为阴性,4例无腹腔引流管,其余3-4 d内拔出引流管。7例手术患者肝功能均出现肝转氨酶明显升高,经保肝治疗后,肝功能恢复正常。其中1例合并肝硬化患者术后出现腹水,经保守治疗后恢复;对照组术后病理证实均为肝细胞肝癌,切缘均为阴性,4例患者术后肝转氨酶轻微升高,经治疗后恢复正常。腔镜手术微波组较对照组出血少,差异有统计学意义;两组手术时间无差异;术后住院时间微波组比较短,差异有统计学意义(见表5)。
表5 微波组与对照组腔镜手术效果比较
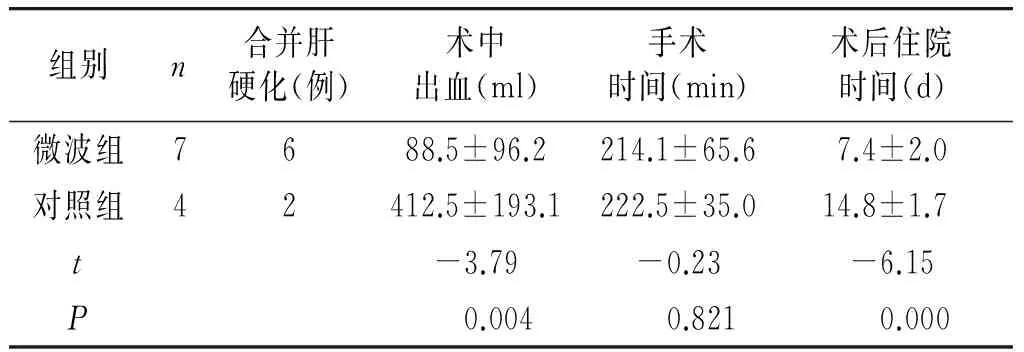
组别n合并肝硬化(例)术中出血(ml)手术时间(min)术后住院时间(d)微波组7688.5±96.2214.1±65.67.4±2.0对照组42412.5±193.1222.5±35.014.8±1.7t-3.79-0.23-6.15P 0.004 0.821 0.000
开腹手术为肿瘤所在的肝叶及肝段规则及部分不规则切除。微波组:7例阻断肝门,术后病理证实22例肝细胞肝癌(合并肝硬化20例),7例肝胆管细胞癌(均不合并肝硬化),1例未分化肉瘤(不合并肝硬化),均以中分化为主,切缘均为阴性。3例无腹腔引流管,其余4-15 d拔出腹腔引流管。所有患者术后均出现肝转氨酶明显升高,6例肝硬化患者术后出现腹水,2例非肝硬化患者术后出现腹水,经对症治疗后肝功能恢复正常,腹水消退;对照组6例阻断肝门,术后病理证实14例肝细胞肝癌(均合并肝硬化),3例肝胆管细胞癌(均不合并肝硬化),以中分化为主,切缘均为阴性。2例无腹腔引流管,其余5-15 d拔出腹腔引流管。所有患者术后均出现肝转氨酶轻微升高,5例患者术后出现腹水,1例患者术后出现肺部感染,经治疗后症状好转。术中出血微波组较少,差异有统计学意义;手术时间微波组较短,差异有统计学意义;两组术后住院时间无差异(见表6)。
表6 微波组与对照组开腹手术效果比较
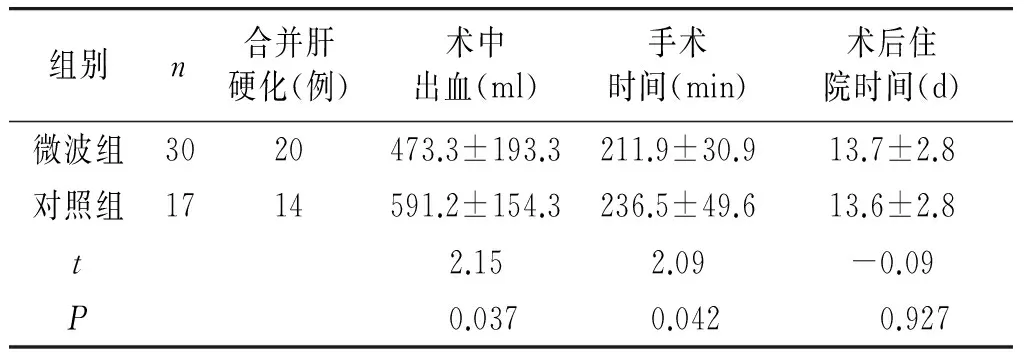
组别n合并肝硬化(例)术中出血(ml)手术时间(min)术后住院时间(d)微波组3020473.3±193.3211.9±30.913.7±2.8对照组1714591.2±154.3236.5±49.613.6±2.8t2.152.09-0.09P0.0370.042 0.927
3 讨论
微波辅助肝切除作为一种新的手术方式,因控制出血效果好,被越来越多的临床医生所认可,同时还可以灵活应用于手术过程中,肝原发恶性肿瘤往往并非一个病灶,当无法同时切除多个病灶时,可切除较大病灶,小病灶可术中超声引导下微波消融,一定程度扩大了手术适应证,如果术前或术中发现肝内可疑病灶或合并血管瘤时,可一并处理,避免不必要手术纠纷。本文重点研究了微波消融在肝切除手术中的作用,按手术方式不同,分成开腹手术与腹腔镜手术,研究微波分别对两种手术方式的影响。腔镜手术因微波消融止血明显,无需放置引流管,术后住院时间也短,但也因腔镜操作下微波较繁琐,并未明显减少手术时间。开腹手术却不太相同,因止血效果好,减少止血时间,加快了手术进程,但未明显降低手术创伤,因此住院时间没显著差异。
射频与微波是最常见的两种热消融方式,但是达到相同的效果,微波所需时间更短[3]。与射频相比,微波理论上具有更多优势,如受干燥及炭化的影响小、持续高温度时间长、不需要电极回路等[4]。目前最常用微波频率是2 450 MHz,理论上915 MHz消融范围更广,但尚未证实[5]。同时应用多根微波消融针消融,其消融的长度、宽度和深度及所能闭合血管直径比单根微波效果强,可减少消融的时间[6],一定程度上增快了手术进程,但是我们还必须考虑患者经济承受能力。微波原先主要用于无法肝切除手术的小肝癌,超声引导下微波消融可使局部肿瘤凝固性坏死,但本质上还属于一种姑息性手术。但是在临床应用过程中,临床医生发现微波消融因使局部组织凝固性坏死,封闭肝组织的小血管从而减少局部肝组织出血,同时热消融还有杀灭肿瘤作用。微波可闭塞直径≤0.3 mm的血管,对胆管只有短暂闭合作用,而无永久凝固闭合作用[7]。有研究显示微波辅助肝切除可以减少术中切肝时间、出血量和术中输血量。另外微波可凝固闭合≤0.5 cm直径的管道,减少缝扎或结扎肝断面的血管及胆管,也增快手术进程[8]。以往单纯腹腔镜肝切除手术切除V、Ⅵ、Ⅶ段时出血难以控制,看作腹腔镜肝切除手术相对禁忌证[9],而微波消融的应用,扩大了腔镜手术的手术适应证,对Ⅴ、Ⅵ段且直径≤5.0 cm浅表肿瘤,及部分位于Ⅶ段且直径<3.0 cm浅表肿瘤也可局部切除[10]。而肿瘤直径>5.0 cm、或肿瘤毗邻第一、二肝门仍是腹腔镜肝切除的禁忌证[11]。
关于如何避免微波针刺破大的血管,笔者认为首先术前根据影像结果,判断肿瘤与周围大的管道毗邻关系,位置特殊者术中依据超声再次确定肿瘤与周围管道毗邻关系,电凝出预切肝线。同时对操作者要求有一定的操作经验,尤其肝规则性切除,一次进针深度不能太深,浅层一般无大的管道,浅层进针一般不超过4 cm,要感受到进针过程中感觉,分层逐步消融,避开大的管道,靠近较大血管时,使用超吸刀,可逐步分离出大的管道,如不慎损伤,必要时使用血管线缝合。行肝深层消融时,需充分暴露消融部位,暴露不明显部位,可用湿纱垫隔开,避免微波针损伤肝外组织。有研究认为增加微波消融的精准性和可靠性,改善引导方法,使显像系统、计算机辅助导航系统及三位多模态系统相结合,用于对肿瘤进行术前及术中精准定位与术后准确评估[12],笔者认为该方法同样可以用于微波辅助肝切除,更加精准避开肝脏内较大管道(动静脉、胆道),实现真正意义上的无血肝切除,提高肝恶性肿瘤阴性切缘率,推动精准医学的进步。
[1] Satoi S,Matsui Y,Kitade H,etal.Long-term outcome of hepatocellular carcinoma patients who underwent liver resection using microwave tissue coagulation[J].HPB,2008,10(4):289-295.
[2] Jones C,Badger SA,Ellis G,etal.The role of microwave ablation in the management of hepatic colorectal metastases[J].Surgeon,2011,9(1):33-37.
[3] 田文硕,匡铭,吕明,等.超声引导经皮射频消融与微波消融治疗肝脏肿瘤的随机对照研究[J].中华肝胆外科杂志,2014,20(2):119-121.
[4] Simon CJ,Dupuy DE,Mayo-Smith WW.Microwave ablation:Principles and applications[J].Radiographics,2005,25(Suppl 1):69-83.
[5] Sun Y,Wang Y,Cheng Z,etal.Comparison of temperature curve and ablation zone between 915-and 2,450-MHz cooled-shaft microwave antenna:results in ex vivo porcine livers[J].Eur J Radiol,2012,81(3):553-7.
[6] Reuter NP, Martin RC 2nd. Microwave energy as a precoagulative device to assist in hepatic resection[J].Ann Surg Oncol,2009,16(11):3057-3063.
[7] Eguchi S,Kanematsu T, Arii S,etal.Comparison of the outcomes between an anatomical subsegmentectomy and a non-anatomical minor hepatectomy for single hepatocellular carcinomas based on a Japanese nationwide survey[J].Surgery,2008,143(4):469-475.
[8] 谭凯,杜锡林,阴继凯,等.微波刀在规则性肝切除术中的应用[J].肝胆胰外科杂志,2013,15(5):367-371.
[9] Dulucq JL,Wintringer P,Stabilini C,etal.Laparoscopic liver resections: a single center experience[J].Surg Endosc,2005,19:886-891.
[10] 何晓军,肖梅,张辉,等.微波消融辅助腹腔镜肝切除29例[J].中华普通外科杂志,2015,30(6):451-453.
[11] 汤晓东,刘双海,赵振国,等.腹腔镜肝脏肿瘤切除术40例[J].中华普通外科杂志,2014,29(10):753-755.
[12] 梁萍,于杰,于晓玲,等.微波消融治疗肝脏恶性肿瘤[J].中华医学杂志,2015,95(27):2143-2145.
首都卫生发展科研专项基金资助项目(2011-2041-02);“十二五”全军后勤科研计划项目(BWS12J029)
陈智,男,1992-04生,硕士,住院医师,E-mail:270959890@qq.com
2016-04-19
R735.7
A
1007-6611(2016)09-0799-04
10.13753/j.issn.1007-6611.2016.09.004
