口腔黏膜多聚甲醛刺激后小鼠三叉神经节AQP1和TRPV4表达变化
2016-09-09谭美芸杨晓欣高俊英周建平肖明
谭美芸 杨晓欣 高俊英 周建平 肖明*
口腔黏膜多聚甲醛刺激后小鼠三叉神经节AQP1和TRPV4表达变化
谭美芸 杨晓欣 高俊英 周建平 肖明*
目的 为验证三叉神经节神经元上表达的水通道蛋白1(AQP1)和瞬时感受器电位离子通道4(TRPV4)可能参与痛觉传导提供形态学依据。方法 应用免疫荧光染色结合FG逆行追踪标记技术比较观察口腔黏膜下注射多聚甲醛(PFA)实验模型组和对照组小鼠三叉神经节内AQP1和TRPV4的表达。结果 与对照组比较,模型组三叉神经节神经元AQP1和TRPV4的表达无明显差异。结论 存在于三叉神经节神经元上的AQP1和TRPV4可能未参与口腔伤害性刺激所引起的三叉神经痛觉的传递。
AQP1 TRPV4 三叉神经节 痛觉 口腔
1 材料与方法
1.1材料与设备 8周龄雄性ICR小鼠,由南京医科大学动物实验中心提供。抗AQP1兔源性多克隆抗体(Millipore,美国);抗TRPV4绵羊源性多克隆抗体(Abcam,美国);荧光追踪剂FG(Fluorochrome Englewood CO,美国);山羊抗兔IgG结合TRITC﹑山羊抗绵羊IgG结合TRITC(Millipore,美国);德国LEICA RM2135 石蜡切片机;德国LEICA CM1900 冰冻切片机;德国LEICA DM4000B 半自动数字式显微镜。
1.2 方法 (1)荧光追踪剂荧光金(FG)和多聚甲醛(PFA)的注射:小鼠常温下经3.5%水合氯醛(350 mg/kg)腹腔注射麻醉后,应用50μl微量注射器,模型组在颊部黏膜下注射1% FG和5% PFA混合液20μl,对照组在颊部黏膜下注射1% FG和生理盐水混合液20μl。动物苏醒后正常饮食,3d后灌注取材。(2)组织制备:小鼠常温下经3.5%水合氯醛(350mg/kg)腹腔注射麻醉,于左心室经升主动脉插管,快速滴注37℃的生理盐水100ml,再灌注4℃含4%PFA磷酸缓冲液(PB,0.1mol/ml,pH7.4)100ml,持续30min,取颊部组织,开颅取三叉神经节后固定2~2.5h。(3)冰冻切片制备:小鼠颊部组织标本,置入含30%蔗糖的PB液中48h。OCT包埋,LEICA冰冻切片机切片,分套收集,片厚35μm,贴于被覆明胶的载玻片上。(4)石蜡切片制备:小鼠三叉神经节标本,经过酒精梯度脱水处理,石蜡包埋。应用LEICA石蜡切片机作连续切片,片厚 7μm,分套收集,再经漂片﹑摊片﹑晾干﹑收集﹑标记后备用。(5)荧光追踪剂FG观察:颊部组织冷冻切片直接在荧光显微镜(UV滤镜)观察荧光染料在注射点黏膜下的扩散范围,以确定FG注射的有效性。(6)免疫荧光标记染色:选用颊黏膜下FG注射有效的小鼠三叉神经节石蜡切片用于免疫荧光染色。石蜡切片经烤片﹑梯度酒精脱蜡至水,抗荧光淬灭剂封片,在LEICA DM4000B 半自动数字式显微镜对FG逆行标记神经元数目相对集中部位进行显微摄片。已摄片切片PBS洗5min×3次,枸橼酸盐缓冲液中92~98℃抗原微波修复20min,自然冷却至室温;10%正常山羊封闭血清封闭1h,加抗AQP1兔源多克隆抗体(1∶800)或抗TRPV4绵羊源多克隆抗体(1∶800),4℃过夜,PBS洗5min×3次;加入山羊抗兔或绵羊IgG结合TRITC(1∶200),37℃湿盒避光孵育1h,PBS洗5min×3次;抗荧光淬灭剂封片,LEICA DM4000B 半自动数字式显微镜下观察﹑摄片。
1.3 图像分析 FG荧光和AQP1(或TRPV4)免疫荧光染色显微图像导入Adobe Photoshop 7.0(Adobe Systems,San Jose,CA,USA),进行位置配准﹑分别进行通道拆分,再将FG荧光图像的红色通道以AQP1(或TRPV4)免疫荧光图像的红色通道替代,融合成FG与AQP1(或TRPV4)的双标记图像。将AQP1(或TRPV4)免疫荧光显微图像,进行去色和色彩方向处理,转化为黑白图像(背景为白色),对照FG与AQP1(或TRPV4)荧光双标记图像,将AQP1(或TRPV4)阳性神经元分成两种类型,即AQP1(或TRPV4)/FG双标记神经元和AQP1(或TRPV4)单标记神经元,应用图像软件ImagePro-Plus分别测定其累计光密度值(IOD)和免疫阳性产物的面积百分比,计算出平均光密度值(MIOD)。每组4~5只动物,每只动物计算3张三叉神经节切片。
1.4统计学方法 采用SPSS11.5统计软件。计量资料以(±s)表示,行单因素方差分析(ANOVA)结合Tukey-Kramer 多重比较检验。P<0.05为差异有统计学意义。
2 结果
观察FG+PFA注射组(模型组)和FG+生理盐水注射组(对照组)三叉神经节上AQP1/FG双标记神经元(投射至注射颊黏膜处的三叉神经节AQP1免疫阳性神经元)和AQP1单标记神经元(非投射至注射处颊黏膜的三叉神经节AQP1免疫阳性神经元)。对AQP1阳性信号进行光密度分析,并进行统计学比较,结果显示(见图1):模型组和对照组AQP1/FG双标记神经元AQP1阳性信号光密度分析比较差异无统计学意义;两组组内AQP1/FG双标记神经元和AQP1单标记神经元的AQP1阳性信号光密度差异无统计学意义。
观察FG+PFA注射组(模型组)和FG+生理盐水注射组(对照组)三叉神经节上TRPV4/FG双标记神经元(投射至注射颊黏膜处的三叉神经节TRPV4免疫阳性神经元)和TRPV4单标记神经元(非投射至注射处颊黏膜的三叉神经节TRPV4免疫阳性神经元)。对TRPV4阳性信进行光密度分析,并进行统计学比较,结果显示(见图2):模型组和对照组TRPV4/FG双标记神经元TRPV4阳性信号光密度分析比较无明显差异;两组组内TRPV4/FG双标记神经元和TRPV4单标记神经元的TRPV4阳性信号光密度无明显差异。
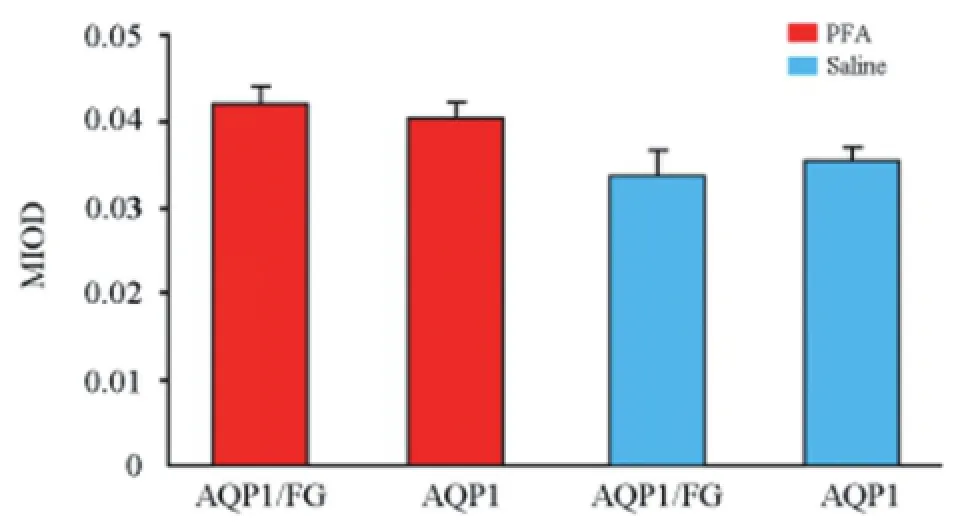
图1 模型组和对照组小鼠三叉神经节神经元AQP1免疫荧光强度光密度分析。AQP1/FG代表AQP1/FG双标记神经元,AQP1代表AQP1单标记神经元
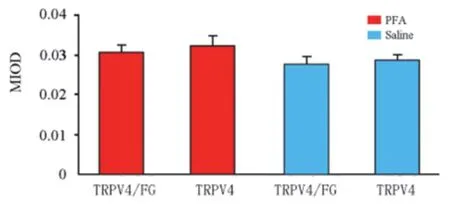
图2 小鼠颊部黏膜下注射FG + PFA或生理盐水后,三叉神经节神经元AQP1免疫荧光强度光密度分析。TRPV4/FG、TRPV4分别代表TRPV4/FG双标记、TRPV4单标记三叉神经节神经元。
3 讨论
三叉神经神经纤维终末广泛分布于头面部的皮肤﹑眼﹑口腔﹑鼻腔﹑鼻旁窦的黏膜﹑牙齿﹑脑膜等,负责传导痛﹑温﹑触等多种感觉。三叉神经传导的初级感觉神经元的胞体位于三叉神经节。
水通道蛋白(AQPs),是对水跨生物膜的进行快速转运的蛋白,近年陆续发现了水通道家族中的13种亚型(AQP0-AQP12)广泛分布于哺乳类动物的各组织细胞[6]。AQP1是神经系统内主要的水通道之一。在人和啮齿类动物的周围神经系统,AQP1主要表达于背根神经节﹑三叉神经节中小型初级神经元上[2,7],AQP1在中﹑小型神经元的特异性表达可能与中﹑小型神经元与浅感觉传导有关。目前有数篇文献报道AQP1在痛觉传递中的作用,但这方面的认识还存在争议。如早期研究发现AQP1基因敲除小鼠对伤害性热刺激(甩尾)或化学刺激(辣椒素)所诱导的疼痛反应存在轻度障碍[8]。与此相反,随后研究发现,AQP1敲除小鼠对伤害性疼痛反应的阈值与野生型并无显著性差异[9]。最近的研究发现AQP1敲除小鼠对舒缓激肽﹑前列腺素E2或辣椒辣素所诱导的热性炎性疼痛反应的敏感性较野生型下降[10]。有关AQP1是否参与三叉神经痛觉传递目前还缺乏直接的功能学研究证据。目前仅有一篇文献观察PFA诱导的急性口周炎模型中,免疫组化和免疫印迹结果均提示在该模型中三叉神经节内AQP2而不是AQP1 有表达变化[11]。本试验应用免疫荧光染色结合FG逆行追踪标记技术发现,注射示踪剂FG后,小鼠三叉神经节AQP1/FG双标记神经元和AQP1单标神经元上的AQP1阳性信号光密度无明显差异,提示FG不影响三叉神经节神经元AQP1表达水平。观察结果FG+PFA注射组和FG+生理盐水注射组三叉神经节AQP1/FG双标记神经元AQP1阳性信号无明显差异,进一步证实口腔黏膜的疼痛刺激不引起三叉神经节神经元AQP1的表达变化。尽管如此,但这些形态学结果还不足以排除AQP1参与痛觉传递功能。更多的功能学,包括AQP1神经元条件性基因敲除鼠的构建,有助于解决这一科学问题。
TRPV是瞬时感受器电位离子通道家族(TRP)成员,可被热﹑细胞外渗透压的改变和细胞内Ca2+的减少等多种理化刺激激活。TRPV4最初是作为渗透压感受器被克隆,因为该通道可被<30 mosM的渗透压激活[12,13]。在周围神经系统,TRPV4高度表达于背根神经节和三叉神经节等初级感觉传入神经元,参与温度﹑渗透压改变﹑化学性和机械性以及炎症性刺激所导致的伤害性感觉的传递作用[14]。有系列研究证据表明TRPV4参与了由机械性刺激或低﹑高渗透性刺激所导致的痛觉传递过程[15~17]。本资料结果显示,FG不影响三叉神经节神经元TRPV4表达水平,同时口腔黏膜下注射PFA并未显著上调三叉神经节神经元TRPV4的表达,这可能与注射的致痛物质及观察时间点不同等有关。有关TRPV4是否有口腔痛觉的传递,还需进行进一步形态学和功能学的实验证明。
本实验观察到TRPV4在三叉神经节有广泛表达。既往的研究发现TRPV4 具有介导低渗透性刺激所诱导的鼠肺上皮细胞下调AQP5的表达过程[18]。结合本实验室前期观察到AQP1广泛在口腔黏膜﹑舌﹑唾液腺等三叉神经纤维终末上广泛表达[19],还观察到给ICR小鼠禁水24h后,三叉神经节AQP1阳性细胞的比例无明显变化,但阳性细胞表达明显上调[20],高度提示可能与口腔渴觉的传导有关。以此推测,TRPV4也可能具有调节三叉神经节神经元在脱水或渗透性变化状态下AQP1的表达,但此推测有待于进一步验证。
1Kai-Kai MA. Cytochemistry of the trigeminal and dorsal root ganglia and spinal cord of the rat. Comp Biochem Physiol A Comp Physiol,1989, 93(1):183~193.
2Ma TH, Gao HW, Fang XD, et al. Expression and function of aquaporins in peripheral nervous system. Acta Pharmacol Sin, 2011, 32(6):711~715.
3Dux M, Sántha P, Jancsó G. The role of chemosensitive afferent nerves and TRP ion channels in the pathomechanism of headaches. Pflugers Arch, 2012, 464(3):239~248.
4Ma T, Gao H, Fang X, et al. Water channel proteins in the peripheral nervous system in health and disease. Mol Aspects Med, 2012,33(5-6):605~611.
5Moftakhar P, Lynch MD, Pomakian JL, et al. Aquaporin expression in the brains of patients with or without cerebral amyloid angiopathy. J Neuropathol Exp Neurol, 2010, 69(12):1201~1209.
6Castle NA. Aquaporins as targets for drug discovery. Drug Discovery Today, 2005, 10(7): 485~493.
7Nandasena BG, Suzuki A, Aita M,et al. Immunolocalization of aquaporin-1 in the mechanoreceptive Ruffini endings in the periodontal ligament. Brain Res, 2007, 1157:32~40.
8Oshio K, Watanabe H, Yan D, et al. Impaired pain sensation in mice lacking aquaporin-1 water channels. Biochem Biophys Res Comm,2006, 341(4):1022~1028.
9Shields SD, Mazario J, Skinner K, et al. Anatomical and functional analysis of aquaporin 1, a water channel in primary afferent neurons. Pain, 2007, 131(1-2):8~20.
10Zhang H, Verkman AS. Aquaporin-1 tunes pain perception by interaction with Na(v)1.8 Na+ channels in dorsal root ganglion neurons. J Biol Chem, 2010, 285(8):5896~5906.
11Borsani E, Bernardi S, Albertini R, et al. Alterations of AQP2 expression in trigeminal ganglia in a murine inflammation model. Neurosci Lett,2009, 449(3):183~188.
12Liedtke W, Choe Y, Martí-Renom MA,et al. Vanilloid receptorrelated osmotically activated channel (VR-OAC), a candidate vertebrate osmoreceptor. Cell, 2000, 103(3):525~535.
13Strotmann R, Harteneck C, Nunnenmacher K, et al. OTRPC4, a nonselective cation channel that confers sensitivity to extracellular osmolarity. Nat Cell Biol, 2000, 2(10):695~702.
14Liedtke W. Molecular mechanisms of TRPV4-mediated neural signaling. Ann N Y Acad Sci, 2008, 1144:42~52.
15Sato M, Sobhan U, Tsumura M, et al. Hypotonic-induced stretching of plasma membrane activates transient receptor potential vanilloid channels and sodium-calcium exchangers in mouse odontoblasts. J Endod, 2013, 39(6):779~787.
16Alessandri-Haber N, Joseph E, Dina OA, et al. TRPV4 mediates painrelated behavior induced by mild hypertonic stimuli in the presence of inflammatory mediator. Pain, 2005, 118(1-2):70~79.
17Alessandri-Haber N, Yeh JJ, Boyd AE, et al. Hypotonicity induces TRPV4-mediated nociception in rat. Neuron, 2003, 39(3):497~511. 18 Sidhaye VK, Güler AD, Schweitzer KS, et al.Transient receptor potential vanilloid 4 regulates aquaporin-5 abundance under hypotonic conditions. Proc Natl Acad Sci U S A, 2006, 103(12):4747~4752.
19谭美芸, 高俊英, 丁炯, 等. 水通道蛋白1在小鼠口腔粘膜的表达与分布. 解剖科学进展. 2011, 17(5):458~460.
20谭美芸, 高俊英, 肖明. 禁水后小鼠三叉神经节AQP1和AQP4表达的改变. 《江苏医药》, 2011, 22:2616~2617.
Objective To provide the morphological evidence for the hypothesis that aquaporin 1(AQP1)and transient receptor potential ion channel 4(TRPV4)in the trigeminal ganglion of mice might take participate in pain transduction. Methods The mice were given oral submucosal injection of paraformaldehyde,then immunofl uorescence staining combined fl uorogold(FG)retrograde tracing technique was performed to observe changes in AQP1 and TRPV4 expression in the trigeminal ganglion neurons that innervate the oral mucosa. Results Expression and distribution of AQP1 and TRPV4 in the trigeminal ganglion neurons that project to the oral mucosa was no signifi cantly different between oral submucosal injection of paraformaldehyde-induced pain group and saline injection control group. Conclusion AOP1 and TRPV4 in the trigeminal ganglion may not take part in pain transduction.caused by the oral harmful stimulating.
AOP1 TRPV4 Trigeminal ganglia Pain sense Oral cavity
江苏省教育厅高校“青蓝工程”资助(苏教师﹝2014﹞23号)
210029 江苏建康职业学院人体结构教研室(谭美芸)210029南京医科大学人体解剖学系(杨晓欣 高俊英周建平 肖明)
头面部的温﹑痛﹑触﹑压觉等多种感觉信息的传导是由三叉神经完成,其初级感觉神经元的胞体位于三叉神经节。三叉神经节神经元由大﹑中﹑小三种类型的假单极神经元组成,这些神经元含有的神经活性物质主要是谷氨酸﹑P物质﹑降钙素基因相关肽和一氧化碳等[1]。除了上述的神经递质外,近年来的研究发现三叉神经节神经元表达多种膜蛋白,例如水通道蛋白(AQPs)和瞬时感受器电位离子通道(TRPV)[2,3]等。其中,AQP1和TRPV4均在三叉神经节表达,周围神经系统的AQP1和TRPV4均可能参与浅感觉的传导[4,5]。2015年2月至7月作者通过实验研究,探讨AQP1和TRPV4在三叉神经口腔痛觉传导中表达的变化。
