MCF-7细胞核的电化学行为研究①
2016-08-03张丽茹王喜洁朱金玲崔继文
王 倩,张 静,张丽茹,王喜洁,朱金玲,崔继文
(1.佳木斯大学药学院,黑龙江 佳木斯 154007; 2.佳木斯大学基础医学院,黑龙江 佳木斯 154007)
MCF-7细胞核的电化学行为研究①
王倩1,张静1,张丽茹1,王喜洁1,朱金玲2,崔继文1
(1.佳木斯大学药学院,黑龙江 佳木斯 154007; 2.佳木斯大学基础医学院,黑龙江 佳木斯 154007)
摘要:目的:研究人乳腺癌细胞(MCF-7)细胞核的电化学行为,为拓展细胞电化学的应用领域提供理论基础。方法:采用单线扫描伏安法研究MCF-7细胞核的电化学行为,使用倒置荧光显微镜观察细胞核提取结果,采用高效液相色谱法分析了细胞核中的嘌呤碱基。结果:MCF-7细胞核在MWCNTs-IL/GCE上出现两个氧化峰,分别归因于黄嘌呤与鸟嘌呤的氧化反应和腺嘌呤与次黄嘌呤的氧化反应。结论:MCF-7细胞核中的嘌呤碱基在MWCNTs-IL/GCE上具有较好的电化学响应,该电化学法有可能用于细胞核内嘌呤的检测。
关键词:MCF-7;细胞核;MWCNTs-IL/GCE;单线扫描伏安法
近年研究表明细胞内具有电化学活性物质,采用循环伏安法测试能够得到较好的电化学信号,在此基础上发展起来的细胞电化学,虽然历史较短,但却因其具有简单、快速、灵敏度高、费用低等优点,从而在生物分析领域受到极大的重视;然而目前对于细胞伏安响应的研究还仅限于对于完整细胞的电化学响应的探讨[1~6],对于细胞内部各种细胞器的电化学响应的研究目前还没有开展,而这方面的研究对于细胞电化学进一步的应用具有极为重要的意义,故本文以人乳腺肿瘤细胞(MCF-7)为模型细胞,研究其细胞核的电化学响应,为拓展细胞电化学的应用领域提供理论基础。
1实验部分
1.1试剂与仪器
电化学工作站,上海辰华仪器有限公司;HH.CP-T型二氧化碳培养箱,上海一恒科学仪器有限公司;Olympus倒置荧光显微镜,日本Olympus公司;安捷伦1100高效液相色谱仪系统,美国安捷伦科技(中国)有限公司;人乳腺肿瘤细胞MCF-7,东北林业大学赠送;普利莱细胞核包浆制备试剂盒(含有核提取试剂与胞浆提取试剂),北京普利莱公司;Janus Green B(吉姆萨染液),次黄嘌呤,黄嘌呤,鸟嘌呤,腺嘌呤,Sigma公司;多壁碳纳米管(MWCNTs),深圳纳米港有限公司;离子液体(IL),J&K Chemical Ltd.;优级胎牛血清、DMEM培养基、双抗(链霉素和青霉素),Gibco公司;其余试剂均为分析纯。
1.2电化学检测
本实验采用三电极体系作为电化学测试系统,其中多壁碳纳米管和离子液体复合修饰玻碳电极(MWCNTs-IL/GCE)为工作电极,Ag/AgCl丝为参比电极,Pt丝为辅助电极,采用单线扫描伏安法进行检测,伏安扫描范围为0.0~+1.1V,扫速为0.05V·s-1,通常扫描两次,一般情况采集第一次的数据。除特殊说明外,测定均在室温条件下进行,测定前需要在电位+0.0V下富集360s。每次电化学测定结束后,MWCNTs-IL/GCE均在pH 7.4 PBS溶液中循环伏安扫描5圈,重新得到稳定性和重复性均良好的更新电极,可用于新的测试;而如果电极跑出的背景无法重合,不断变小,说明电极无法继续使用,需要重新制作新的电极。
1.3MCF-7细胞的培养和收集
MCF-7细胞培养于DMEM培养液中,于37℃恒温、5% CO2、100%饱和湿度培养箱中培养。待细胞长至培养皿面积达80 %的贴壁时,用适量的0.25%胰蛋白酶消化,放入37℃的CO2培养箱中消化至胞质回缩,细胞之间不再连接成片,加适量DMEM培养液,置37℃、5% CO2、100%饱和湿度的培养箱中继续培养。
将生长状态良好且长满培养皿底的细胞依次按0.25%胰蛋白酶消化、吹打悬浮、离心(1000r·min-1,10min)后得细胞沉淀,所得细胞沉淀用pH 7.4 PBS溶液冲洗3次,然后用适量的pH 7.4 PBS溶液配成细胞悬液并计数,取一部分细胞悬液在水浴50℃作用30min后得到MCF-7细胞裂解液进行电化学测定,剩余的细胞悬液留置备用。
1.4细胞核的提取及破碎
将上一步收集备用的细胞悬液,离心洗涤,在普利莱细胞核包浆制备试剂盒中取出2mL胞浆提取试剂加入到细胞悬液中,振荡重悬细胞,冰浴2min,将细胞悬液移至冰预冷的玻璃匀浆器内,上下研磨细胞30次,将混合物移至1.5mL离心管,在800×g,4℃离心分离5min,取管底沉淀加入1mL普利莱细胞核包浆制备试剂盒中的核提取试剂,振荡重悬,在4000×g,4℃再次离心5min,弃上清,得到粗制细胞核;重复离心、洗涤一次得纯净细胞核;将所提取的纯净细胞核加入蛋白酶K 30min后,得细胞核破碎后溶液,用于电化学检测和HPLC检测。
1.5高效液相(HPLC)检测
将细胞核破碎溶液进行HPLC检测,进样量为20μL,并与4种嘌呤标准品混合物的液相图谱作对照。色谱条件:Ascenis RP-Amide柱(250mm×4.0mm ID,5.0μm);DAD检测器;检测波长为254nm;流动相为磷酸二氢钾溶液,pH4.0;流速为1.0 mL·min-1。
2结果
2.1细胞核的提取
采用倒置荧光显微镜观察到的细胞核提取结果如图1所示,放大倍数20倍,象素441×358;图1a显示的是经吉姆萨染液染色后的原位MCF-7细胞,由图中可见细胞核和线粒体被染成蓝色,细胞核和线粒体清晰可辨;图1b则为经吉姆萨染液染色后的纯净细胞核。对比图1a和图1b可知,我们所得到的细胞核已经很纯净,表明提取成功,所得到的样品可以用于下一步的电化学检测和HPLC检测。为保证细胞核的提取效率和测试结果可靠性,须保证测试所用细胞核现用现提,提取过程保持全程0~4℃。另外,研磨过程中细胞的破碎程度,直接影响到细胞核的提取效率,本文经摸索发现匀浆研磨30次最为适宜;少量多次也可以提高提取效率。

图1经吉姆萨染液染色后的MCF-7细胞和细胞核
(a. 原位染色的细胞核;b. 提纯后的细胞核)
2.2MCF-7细胞核在MWCNTs-IL/GCE上的电化学行为
MCF-7细胞裂解液和细胞核在MWCNTs-IL/GCE电极上的电化学行为如图2所示,MCF-7细胞裂解液和细胞核在MWCNTs-IL/GCE上都呈现出良好的峰形,根据以前研究结果可知在+0.623 V处的信号归因于鸟嘌呤与黄嘌呤的氧化,而+0.953 V处的信号归因于腺嘌呤与次黄嘌呤的氧化[7]。加入蛋白酶K后的细胞核破碎溶液所得到的电化学响应最强(图2c),而没有加入蛋白酶K的细胞核的电化学响应非常微弱(图2a),这表明尽管细胞核中含有较多嘌呤,但只有核破碎后才能得以释放;故测试MCF-7细胞裂解液(图2b)所得到的电化学响应主要是细胞质中嘌呤物质的氧化还原反应。
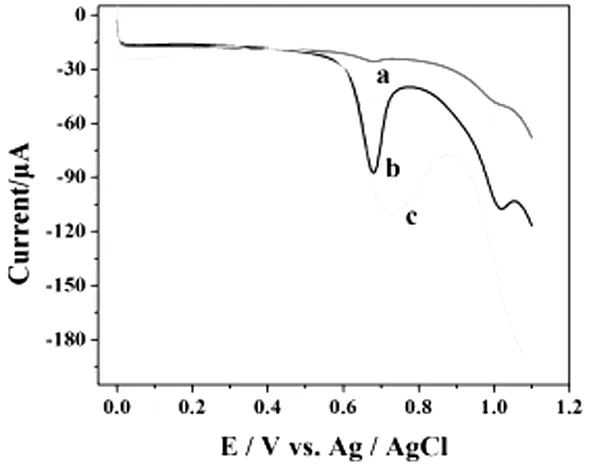
图2 MCF-7细胞和细胞核的单线扫描伏安图
(a. 加入蛋白酶K前的纯净细胞核;b. MCF-7细胞裂解液;c. 加入蛋白酶K后的细胞核破碎溶液)
2.3高效液相检测
MCF-7的细胞核裂解液与四种嘌呤标准品(腺嘌呤,鸟嘌呤,黄嘌呤,次黄嘌呤)的HPLC图谱对照如图3所示,MCF-7的细胞核裂解液的HPLC图谱中得到了6个分离良好的色谱峰(图3b),其中四个色谱峰与标准品图中次黄嘌呤,鸟嘌呤,黄嘌呤和腺嘌呤的峰位一致(图3a),说明MCF-7细胞核中存在次黄嘌呤,鸟嘌呤,黄嘌呤和腺嘌呤,由此可以证明把电化学方法检测的两个信号归因于四种嘌呤的氧化是正确的。
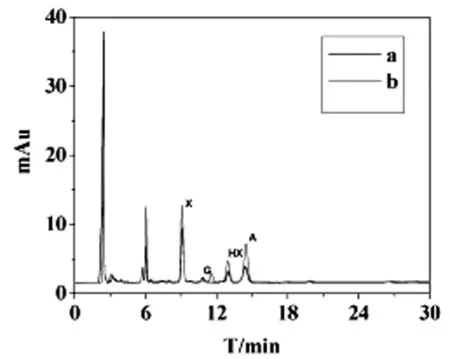
图3 细胞核和四种嘌呤标准品的HPLC图谱
a. 嘌呤标准品混合物;b. 细胞核裂解液A:腺嘌呤 G:鸟嘌呤 X:黄嘌呤 HX:次黄嘌呤
3讨论
我们采用普利莱细胞核包浆制备试剂盒提取的MCF-7细胞核在MWCNTs-IL/GCE上可检测出有两个氧化峰,并且加入蛋白酶K破碎后信号得到明显增强,这表明尽管细胞核中含有较多嘌呤,但只有核破碎后才能得以释放;+0.623V处的信号归因于鸟嘌呤与黄嘌呤的氧化,而+0.953V处的信号归因于腺嘌呤与次黄嘌呤的氧化;HPLC结果证实电化学方法检测的两个信号归因于四种嘌呤的氧化是正确的。此外,HPLC结果表明细胞核中除了四种嘌呤外,还含有其他的物质,但具体是什么物质还有待证实,我们将会在以后的研究中继续探讨。
参考文献:
[1]Byung-Cheon Lee, Jung Sun Yoo. Novel Threadlike structures (Bonghan Ducts) Inside Lymphatic Vessels of Rabbits Visualized With a Janus Green B Staining Method[J]. The Anatomical Record, 2005, 286B:1-7
[2]Yuan Wu,Lingyue Dong,Wei An,et al. Comparison between Different Methods to Extract Mitochondria and Its Effects on Mitochondria Content and Activity[J]. Journal of Capital Medical University, 2010, 4:31-32
[3]Fu Y,Yuan R,Tang D,et al.Study on the immobilization of anti-IgG on Au-colloid modified gold electrode via potentiometric immunosensor, cyclic voltammetry, and electrochemical impedance techniques[J]. Colloids and Surfaces B:Biointerfaces, 2005, 40: 61-66
[4]Yohko Yamada, Koichi Makimura, Hossain Mirhendi,et al. Comparison of Different Methods for Extraction of Mitochondrial DNA form Human Pathogenic Yeasts[J]. Jpn J Infect Dis, 2002, 55: 122-125
[5]Liu Y,Qu X,Guo H,et al. Facile preparation of amperometric laccase biosensor with multifunctionbased on the matrix of carbon nanotubes-chitosan composite[J]. Biosensors and Bioelectronics,2006,21:2195-2201
[6]Volpe E,Cappelli G,Grassi M, et al. Gene expression profiling of human macrophages at late time of infection with Mycobacterium tuberculosis[J]. Immunology, 2006, 118:449-460
[7]Ji-Wen Cui,Tie-Jun Hou,Qian Wang,et al. An Enzyme Assisted Electrochemical Detection System of Purine Intracellular Utilizing MWCNTs-IL Modified Glassy Carbon Electrode[J]. Electrochimica Acta , 2015,180: 360-365
基金项目:①1.佳木斯大学研究生创新课题,编号:LM2014-052;2.黑龙江省自然科学基金项目,编号:H201369。
作者简介:王倩(1989~)女,山东济宁人,在读硕士研究生。 通讯作者:崔继文(1967~)男,黑龙江佳木斯人,博士,教授,硕士研究生导师。E-mail:cjwhljjms@jmsu.edu.cn。
中图分类号:R965.2
文献标识码:A
文章编号:1008-0104(2016)04-0147-02
(收稿日期:2016-01-16)
