紫花苜蓿总黄酮对LPS诱导乳腺上皮细胞炎性因子的抑制作用①
2016-08-03刘立新张羽男郭映雪张云杰
刘立新,张羽男,张 磊,郭映雪,沈 宇,张云杰
(黑龙江省教育厅生物药制剂重点实验室,佳木斯大学药学院, 黑龙江 佳木斯 154007)
紫花苜蓿总黄酮对LPS诱导乳腺上皮细胞炎性因子的抑制作用①
刘立新,张羽男,张磊,郭映雪,沈宇,张云杰
(黑龙江省教育厅生物药制剂重点实验室,佳木斯大学药学院, 黑龙江 佳木斯 154007)
摘要:目的:研究紫花苜蓿总黄酮对LPS诱导小鼠乳腺上皮细胞炎症反应的抑制作用及机理。方法:1 μg/mL LPS刺激细胞之前,分别用50μg/mL、100μg/mL和200μg/mL紫花苜蓿总黄酮预先处理细胞1.5h;采用MTT法测定细胞的活性;分别利用qRT-PCR法和Western boltting法检测炎性因子TNF-α和IL-6 mRNA表达和NF-κBp56蛋白表达。结果:紫花苜蓿总黄酮可以抑制NF-κB核转位,降低TNF-α和IL-6 mRNA的表达量,提高细胞的活力。结论:紫花苜蓿总黄酮可以通过下调NF-κB信号通路抑制炎性因子的产生。
关键词:紫花苜蓿总黄酮;LPS;乳腺上皮细胞;抑制作用
紫花苜蓿素有“牧草之王”的美誉,是广泛应用于奶牛饲料的一种产量高、营养价值高、适口性好的牧草,用紫花苜蓿饲喂奶牛可以提高牛奶的产量和品质[1]。黄酮为紫花苜蓿中主要的生物活性成分之一,其具有增强机体免疫力、抗菌、抗肿瘤、延缓衰老等作用[2]。本实验用LPS诱导小鼠乳腺上皮细胞建立炎症模型,从分子角度研究紫花苜蓿总黄酮的抗炎作用以及炎症反应信号通路调节方面的抗炎机理,为紫花苜蓿总黄酮深入研究和奶牛乳腺炎防治,提供了基础参考依据和数据支持。
1材料、试剂和方法
1.1材料
1.1.1实验动物
清洁级昆明小白鼠,由佳木斯大学实验动物中心提供。
1.1.2药物
LPS(Escherichia coli 0111:B4)(Sigma公司);紫花苜蓿总黄酮由佳木斯大学天然药物化学实验室提供。
1.1.3试剂
优质胎牛血清(FBS)(Sigma公司),DMEM/F12干粉(Sigma公司),Trizol (Invitrogen 公司),MTT(sigma公司),NF-κBp65抗体(Santa Cruz),SYBR®Primx ExTaqTM(TaKaRa),Prime ScriptTMRT reagent Kit(大连宝生物)。
1.1.4仪器
Sunrise-Basic酶标分析仪(瑞士Tecan),CKX41(光学显微镜日本 Olypus),SW-CJ-IFD超净工作台(苏州安泰空气技术有限公司),7300 Real-Time PCR System(美国Applied Biosystems),Forma3111 Series2 CO2恒温培养箱(美国Thermo Electron)。
1.2方法
1.2.1小鼠乳腺上皮细胞的分离和培养
小鼠乳腺上皮细胞的原代培养方法参照王楠楠等的方法[3]稍加改良,以下操作均在超净工作台中进行。具体步骤如下: (1)采集产仔5d后小鼠的乳腺实质部分,用含有双抗的D-Hank’s缓冲液反复清洗;(2)去除淋巴结和结缔组织,在小烧杯中将乳腺组织剪成约1mm3的小块,再用D-Hank's缓冲液反复清洗;(3)加入与组织比例为3:1左右的消化液37℃消化2~3h;(4)用200目铜网过滤,将过滤后的细胞液2000rpm离心15min,收集细胞;(5)加入细胞洗液洗8~10次,每次1000r/min离心1min,去除成纤维细胞;(6)加入含有10% FBS和双抗的细胞培养液转移到新的细胞瓶中于37℃、5% CO2培养箱中培养;(7)培养2~3d后,吸弃上清液,加入新鲜的细胞培养液继续培养。
1.2.2实验分组
将实验分成5组:空白对照组:正常培养的小鼠乳腺上皮细胞;LPS组阳性对照组:正常培养的小鼠乳腺上皮细胞用含1μg/mL LPS的细胞培养液处理;紫花苜蓿总黄酮低剂量组:正常培养小鼠乳腺上皮细胞用含有50μg/mL的紫花苜蓿总黄酮处理1.5h后,用含1μg/mL LPS的细胞培养液处理;紫花苜蓿总黄酮中剂量组:正常培养小鼠乳腺上皮细胞用含有100μg/mL的紫花苜蓿总黄酮处理1.5h后,用含1μg/mL LPS的细胞培养液处理;紫花苜蓿总黄酮高剂量组:正常培养小鼠乳腺上皮细胞用含有200μg/mL的紫花苜蓿总黄酮处理1.5h后,用含1μg/mL LPS的细胞培养液处理。每组设3个重复。
1.2.3细胞活性的检测
将长势良好的小鼠乳腺上皮细胞以适宜的浓度接种于96孔板中,加入含10%胎牛血清的DMEM培养液,置于37℃、5% CO2培养箱培养细胞至生长密度为80%~90%时,弃去培养液,然后加入含紫花苜蓿总黄酮终浓度为50μg/mL、100μg/mL和200μg/mL的细胞培养液,作用1.5h后加入终浓度为1μg/mL的LPS进行刺激,同时设立空白对照组和LPS阳性对照,继续培养24h后,每孔加入终浓度为0.5μg/mL 的MTT溶液,继续培养4~6h后,弃去上清液,每孔加入100μL DMSO,振荡10min ,充分溶解结晶物,用酶标仪于492nm波长下测定吸光值,计算相对细胞存活率。
1.2.4细胞因子mRNA水平检测
将生长良好的小鼠乳腺上皮细胞接种到6孔板中,待细胞密度达90%左右时,按1.2.2方法对实验细胞分组并给药处理,LPS刺激培养12h后收集各组细胞,提取总RNA,具体方法参照:每孔加入1mL Trizol,充分裂解细胞,然后将细胞液转移至离心管中,静置5min后每管分别加入200μL氯仿,振荡后室温静置2~3min;12000r/min、4℃离心10min,吸取上层水相至新离心管中,加入500μL异丙醇,室温静置5min;12000r/min、4℃离心10min,留下沉淀;75%乙醇清洗沉淀;12000r/min、4℃离心5 min,弃上清得总RNA沉淀物,用紫外分光光度计测其纯度。将提取的细胞总RNA反转录成cDNA,以β-Actin为内参基因,采用qRT-PCR法检测TNF-α,IL-6 mRNA的表达情况。TNF-α的引物序列:Sense:5' GGCGGTGCCTATGTCTCA 3',Anti-sense: 5' GGCAGCCTTGTCCCTTGA 3';IL-6的引物序列:Sense 5' TATGGAATAAGGCTGCTATGAA 3',Anti-sense 5' TGGTAAGGATGTGGAGAA 3';β-actin的引物序列:Sense 5' TATGAATAAGGCTGCTATGAA 3',Anti-sense 5' TGGTAAGGATGTGGAGAA 3'。具体反应条件为:95℃,10 s预变性。95℃,5s;60℃,31 s;共计循环40次。qRT-PCR所测得各基因的CT值同内参基因β-actin的CT值相比较,计算该基因的相对表达量,所用计算公式为:相对表达量=2-ΔΔCT 。每个样本至少设立3个平行样。
1.2.5NF-κB p65蛋白水平检测
将生长良好的小鼠乳腺上皮细胞接种到6孔板中,待细胞密度达90%左右时,按1.2.2方法对实验细胞分组并给药处理,LPS刺激培养12h后收集各组细胞,提取核蛋白,具体方法参照[4],采用Western boltting方法检测各组核蛋白的NF-κB p65蛋白表达量的变化。将样品在SDS-PAG中电泳(浓缩胶80V;分离胶120V)1.5h后,利用半干转移电泳仪,将凝胶上的蛋白带电转移到硝酸纤维素膜上(NC),5%脱脂乳封闭1.5h后,TBS洗涤3次,每次10~15min,于一抗工作液(稀释比例1:1000)
中孵育过夜,用辣根过氧化物酶标记的二抗工作液(稀释比例1:2000)孵育1.5h。TBS洗涤3次,超敏发光液显光, Xz一片感光后,显影定影,Tanon 1600R全自动数码凝胶成像分析系统扫描并分析蛋白表达量。β-actin 蛋白作为内参蛋白,蛋白的灰度比值来表示目的蛋白的相对表达量。
2结果
2.1紫花苜蓿总黄酮对小鼠乳腺上皮细胞活性的影响
采用MTT法检测紫花苜蓿总黄酮对小鼠乳腺上皮细胞活性的影响,见图1,与空白对照组相比,单独用LPS处理细胞后,细胞活性显著下降(P<0.01);与LPS对照组相比,用不同浓度紫花苜蓿总黄酮预处理的细胞均能显著或极显著地提高小鼠乳腺上皮细胞的活性(P<0.01,P<0.05),并且剂量越大效果越明显,结果表明,紫花苜蓿总黄酮能增加LPS诱导的小鼠乳腺上皮细胞的活性。
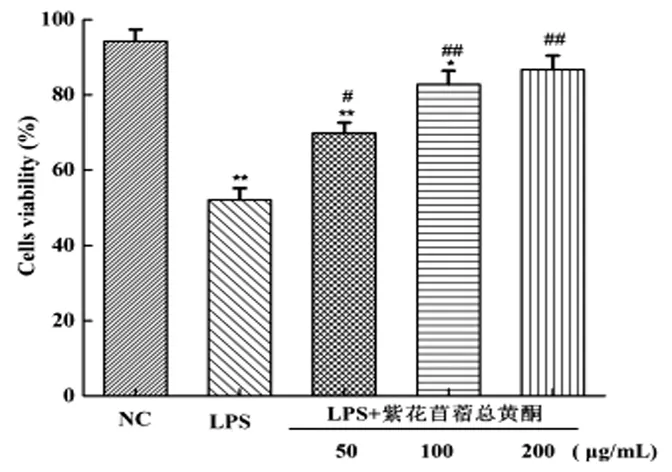
注:与空白对照组相比较,*P<0.05,**P<0.01;与LPS处理组相比较,#P<0.05,##P<0.01。
图1紫花苜蓿总黄酮对小鼠乳腺上皮细胞活性的影响
2.2紫花苜蓿总黄酮对TNF-α和IL-6 mRNA表达的影响
采用qRT-PCR法检测各组细胞因子TNF-α和IL-6的mRNA表达情况,见图2,与空白对照组相比,在LPS作用下细胞TNF-α和IL-6的mRNA表达量极显著升高(P<0.01);加入紫花苜蓿总黄酮干预后再用LPS刺激后,TNF-α和IL-6的mRNA表达被有效地抑制了,并且加入100μg/mL和200μg/mL紫花苜蓿总黄酮组与LPS阳性对照组相比差异极显著(P<0.01)。结果表明,紫花苜蓿总黄酮可以有效地抑制LPS诱导的炎性因子TNF-α和IL-6、的mRNA表达。
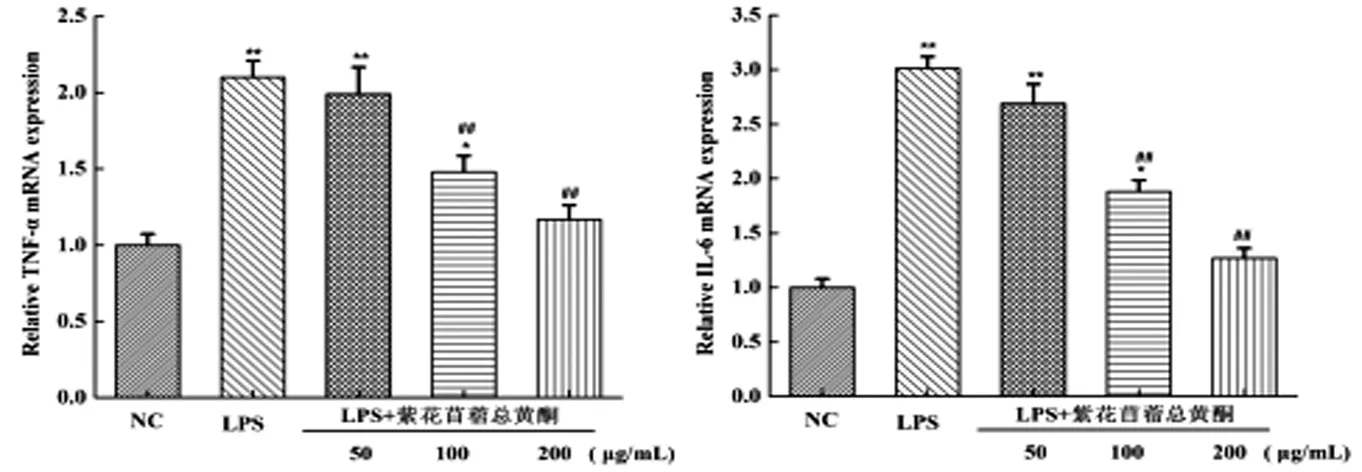
注:与空白对照组相比较,*P<0.05,**P<0.01;与LPS处理组相比较,#P<0.05,##P<0.01。
2.3紫花苜蓿总黄酮对NF-κB p65蛋白表达的影响
采用Western blotting法检测每组细胞中NF-κB p65蛋白的表达情况,见图3,与空白对照组相比,单独用LPS刺激细胞,NF-κB核转位程度增强,即细胞核内NF-κB p65的含量增加;用紫花苜蓿总黄酮预先处理再用LPS刺激后,细胞核內NF-κB p65的含量降低了,与LPS阳性对照组相比,50μg/mL 紫花苜蓿总黄酮组显著抑制NF-κB核转位(P<0.05),100μg/mL和200μg/mL紫花苜蓿总黄酮组极显著抑制NF-κB核转位(P<0.01)。结果表明,紫花苜蓿总黄酮抑制了细胞中NF-κB的核转位。
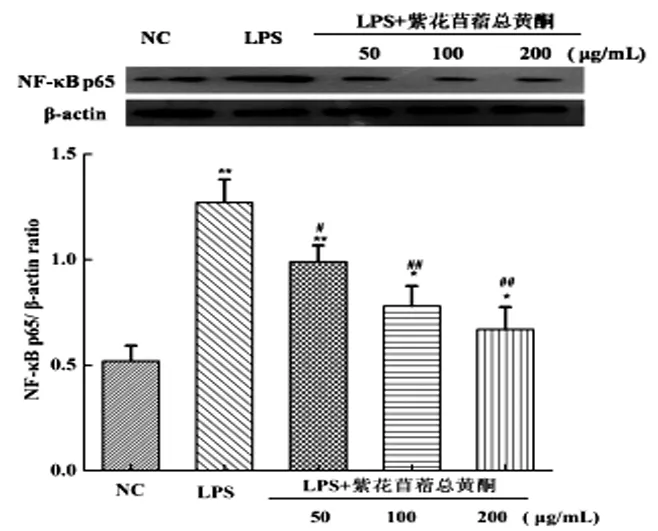
注:与空白对照组相比较,*P<0.05,**P<0.01;与LPS处理组相比较,#P<0.05,##P<0.01。
图3紫花苜蓿总黄酮对NF-κB p65蛋白表达的影响
3讨论
乳腺炎是哺乳动物常见的一种乳腺疾病,严重威胁着母体和后代的健康。其中奶牛乳腺炎的发病率极高,全世约有30%左右的奶牛患有各种类型的乳腺炎[5],从而导致奶产量和品质的下降,给奶牛养殖业带来高额的经济损失[6]。引起乳腺炎发生的原因有多种,其中生物因素占主导地位,包括:球菌、杆菌、真菌、支原体、酵母菌等各种病原微生物。有报道称,在患乳房炎的奶牛乳汁中有TNF-α、IL-1β和IL-6的增加,提示这些细胞因子在乳腺炎症反应过程中的起着重要作用[7]。NF-κB是真核细胞转录因子Rel家族成员之一,是多种信号传导通路的聚集点,在调节炎症和对外来刺激免疫应答方面起着重要作用,NF-κB被激活后进入细胞核内与靶基因上的特定位点结合,发挥转录调控作用从而导致大量具有致热活性炎性因子的合成和释放,主要有TNF-α、IL-1β、IL-6等[8, 9]。
本研究通过检测紫花苜蓿总黄酮对小鼠乳腺上皮细胞NF-κB信号及TNF-α、IL-6的影响,从抗炎角度探讨紫花苜蓿总黄酮的作用机理。实验结果发现,LPS可以激活小鼠乳腺上皮细胞的NF-κB信号通路,导致NF-κB发生核转位,诱导大量TNF-α和IL-6炎症因子产生,导致细胞活性降低。而再LPS刺激前,用紫花苜蓿总黄酮预先处理细胞可以抑制NF-κB进入,抑制炎症因子TNF-α和IL-6的mRNA表达,从而增加细胞的活性。该实验结果表明紫花苜蓿总黄酮能抑制乳腺炎症反应的发生。
参考文献:
[1]苏效双,占今舜,詹康,等. 苜蓿黄酮对体外培养的奶牛乳腺上皮细胞增殖与抗氧化的影响[J].草业学报,2015,24(12):139-145
[2]朱见明,李娜,张亚军,等. 苜蓿黄酮的研究进展[J].草业科学,2009,26(9):156-162
[3]王楠楠,丁云磊,周维,等. CpG-ODN对LPS诱导的大鼠乳腺上皮细胞损伤的保护作用[J].江苏农业科学,2011,39(3):247-249
[4]Li S, Wang W, Fu S, et al. IL-21 Modulates Release of Proinflammatory Cytokines in LPS-Stimulated Macrophages through Distinct Signaling Pathways[J]. Mediators of Inflammation 2013,2013:1-12
[5]Hillerton J E, Berry E A. Treating mastitis in the cows-a tradition or an archaism[J]. J Appl Mierobiol, 2005, 98:1250-1255
[6]Atasever S, Erdern H. Assoeiation between subclinical mastitis markers and body condition score of Holstein cows in the black sea region, Turkey[J]. J Anim Vet Adv, 2009,8(3):476-480
[7]Riollet C, Rainard P, Poutrel B. Cell subpopulations and cytokine expression in cow milk in response to chronic Stap hy lococcus aureus infection[ J]. J Dairy Sci, 2001, 84: 1077-1084
[8]Karin M, Lin A. NF-kappaB at the crossroads of life and death[J]. Nat Immunol, 2002, 3(3): 221-227
[9]Jiang J X, Zhang Y, Ji S H, et al. Kinetics of mitogen-activated protein kinase family in lipopolysaccharide-stimulated mouse Kupffer cells and their role in cytokine production[J]. Shock, 2002, 18(4): 336-341
基金项目:①1.国家自然基金项目,编号:31101250;2.中国博士后科学基金项目,编号:2014M561382。
作者简介:刘立新(1978~)女,黑龙江佳木斯人,在读博士,讲师。
中图分类号:R322.6+6
文献标识码:A
文章编号:1008-0104(2016)04-0001-03
(收稿日期:2016-03-09)
The inhibition effect of total flavonoids of alfalfa on inflammatory cytokines in LPS-induced mammary epithelial cell
LIULi-xin,ZHANGYu-nan,ZHANGLei,GUOYing-xue,SHENYu,ZHANGYun-jie
(The Key Laboratory of Biological Drug Affiliated to Heilongjiang Education Authority, College of Pharmacy in Jiamusi University, Jiamusi 154007, China)
Abstract:Objective: To study the inhibition effects of total flavonoids of alfalfa on inflammatory cytokines and mechanism. Methods: Before the cells were stimulated with 1 μg/mL LPS, the cells were treated with 50μg/mL, 100μg/mL, 200μg/mL total flavonoids of alfalfa for 1.5 hours. The expression levels of TNF-α, IL-6 mRNA and NF-κBp56 protein were determined by qRT-PCR method and Western boltting method respectively. Result: Total flavonoids of alfalfa could inhibit NF-κB nuclear translocation; reduce the expression levels of TNF-a and IL-6 mRNA; and improve cells vitality. Conclusion: Total flavonoids of alfalfa can inhibit the production of inflammatory cytokines by reducing NF-κB signaling pathway.
Key words:total flavonoids of alfalfa; LPS; mammary epithelial cell; inhibition effect
