应用电化学微检测系统检测细胞中嘌呤碱基①
2016-08-03武荣国王书红张思佳崔继文
高 寒,武荣国,王书红,张思佳,年 丽,邬 迪,崔继文
(佳木斯大学药学院,黑龙江 佳木斯154007)
应用电化学微检测系统检测细胞中嘌呤碱基①
高寒,武荣国,王书红,张思佳,年丽,邬迪,崔继文
(佳木斯大学药学院,黑龙江 佳木斯154007)
摘要:目的:构建电化学微检测系统,在电化学检测中节省细胞样品,提高检测效率。方法:以三电极工作系统为基础,在工作电极上套上微管作为微型反应池,倒置后加入微量待测试溶液,将参比电极和对电极放入溶液中,形成稳定的微反应系统,得到更稳定、更强的电化学信号。结果:仅仅30μL MCF-7细胞即在电化学微检测系统中出现两个氧化峰,分别归因于黄嘌呤/鸟嘌呤和腺嘌呤/次黄嘌呤的氧化还原反应。结论:MCF-7细胞中的嘌呤碱基在电化学微检测系统中具有较好的电化学响应,该电化学法有可能用于细胞内嘌呤的检测。
关键词:MCF-7;微检测系统;MWCNTs-IL/GCE;单线扫描伏安法
近年研究表明细胞内嘌呤碱基具有电化学活性,采用循环伏安法测试能够得到较好的电化学信号,但基于传统三电极工作系统的电化学检测中细胞样本消耗较大,导致检测成本升高,从而限制了其进一步应用[1~9];如果能够改进检测体系,降低细胞样本消耗量,又能得到足够的电化学响应,可以有效评价细胞活性,将对细胞电化学进一步的应用具有极为重要的意义,故本文以人乳腺肿瘤细胞(MCF-7)为模型细胞,在原三电极体系的基础上进行了一下巧妙的改装,设计了一种相对比较简便、快捷并且十分廉价的微检测体系,来研究细胞内嘌呤碱基的电化学行为,为拓展细胞电化学的应用领域提供实践基础。
1实验部分
1.1试剂与仪器
电化学工作站,上海辰华仪器有限公司;HH.CP-T型二氧化碳培养箱,上海一恒科学仪器有限公司;人乳腺肿瘤细胞MCF-7,东北林业大学赠送;次黄嘌呤,黄嘌呤,鸟嘌呤,腺嘌呤,Sigma公司;多壁碳纳米管(MWCNTs),深圳纳米港有限公司;离子液体(IL),J&K Chemical Ltd.;优级胎牛血清、DMEM培养基、双抗(链霉素和青霉素),Gibco公司;其余试剂均为分析纯。
1.2电化学微检测系统的建立
本实验通过大胆的构想,设计一种相对比较简便、快捷并且十分廉价的微电极体系:在原三电极体系的基础上进行了一下巧妙的改装,把一个与工作电极粗细相当的塑料管套在工作电极上,然后将工作电极倒立,以玻碳电极的镜面作为反应池的底,塑料管作为反应池的侧壁,用移液枪往反应池中打入待测液,再把参比电极和对电极插入到液面下,即得电化学微检测系统,该体系仅需30μL待测液即可完成一次电化学检测。
1.3电化学检测
本实验分别采用电化学微检测系统和常规三电极体系完成电化学测试,其中多壁碳纳米管和离子液体复合修饰玻碳电极(MWCNTs-IL/GCE)为工作电极,Ag/AgCl丝为参比电极,Pt丝为辅助电极,采用单线扫描伏安法进行检测,伏安扫描范围为0.0~+1.0V,扫速为0.05 V·s-1,通常扫描两次,一般情况采集第一次的数据。除特殊说明外,测定均在室温条件下进行,测定前需要在电位+0.0V下富集360 s。每次电化学测定结束后,MWCNTs-IL/GCE均在pH 7.4 PBS溶液中循环伏安扫描5圈,重新得到稳定性和重复性均良好的更新电极。
1.4MCF-7细胞的培养和收集
MCF-7细胞放在DMEM培养液中,于37℃恒温、5% CO2、100% 饱和湿度培养箱中培养。待细胞长至在培养皿中80%贴壁时,用适量的0.25%胰蛋白酶消化,放入37℃的CO2培养箱中消化至胞质回缩,细胞之间不再连接成片,加适量DMEM培养液,置37℃、5% CO2、100%饱和湿度的培养箱中继续培养。
将生长状态良好且长满培养皿底的细胞依次按0.25% 胰蛋白酶消化、吹打悬浮、离心(1000 r·min-1,10min)后得细胞沉淀,所得细胞沉淀用pH 7.4 PBS溶液冲洗3次,然后用适量的pH 7.4 PBS溶液配成细胞悬液并计数,取一部分细胞悬液在50℃水浴锅中加热30min后得到MCF-7细胞裂解液用于电化学测定。
1.5高效液相(HPLC)检测
将不同浓度细胞裂解液和4种嘌呤标准品混合物进行HPLC检测,进样量均为为20μL,色谱条件:Ascenis RP-Amide柱(250mm×4.0mm ID,5.0μm),DAD检测器,检测波长为254nm,流动相为磷酸二氢钾溶液,pH 4.0,流速为1.0mL·min-1。
2结果与讨论
2.1电化学微检测系统和常规三电极体系对比
图1是浓度均为5×10-6mol·L-1的次黄嘌呤,鸟嘌呤,黄嘌呤和腺嘌呤的混合溶液的单线扫描伏安图,在电化学微检测系统和常规三电极体系中检测均得到两个电化学信号,分别在0.5936V和0.9216V左右出现两个信号,前一个信号为鸟嘌呤和黄嘌呤的氧化还原峰,后一个信号为腺嘌呤和次黄嘌呤的氧化还原峰,对比图1a和1b可知,电化学微检测系统检测得到的峰电流变得更强,以上检测结果表明电化学微检测系统在消耗较少待测液的情况下,还可以得到较强的电化学响应信号,如果应用于细胞电化学检测则可以有效节省细胞样品,提高检测效率,因此本实验所建立的电化学微检测系统具有很高的应用价值。
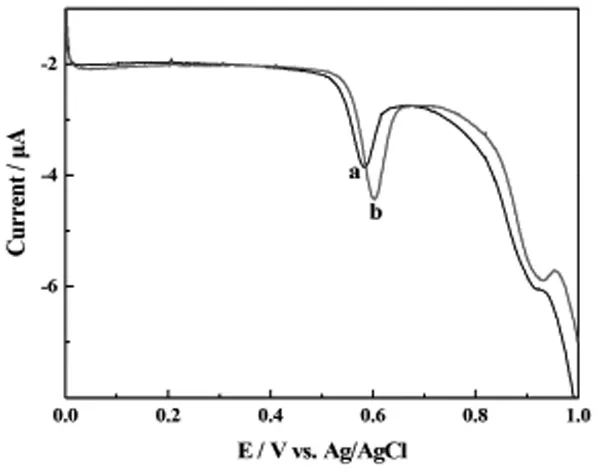
图1 电化学微检测系统和常规三电极体系对比
2.2MCF-7细胞在微反应电极系统上的电化学行为
MCF-7细胞裂解液在电化学微检测系统和常规三电极体系中的电化学行为如图2所示,MCF-7细胞裂解液在常规三电极体系中仅在0.5941V处出现一个信号,归属于鸟嘌呤和黄嘌呤的氧化还原峰,而在电化学微检测系统中则分别在0.6230V和0.9587V处出现两个明显的电化学信号,分别归属于鸟嘌呤/黄嘌呤和 腺嘌呤/次黄嘌呤的氧化还原峰[9],这个结果表明电化学微检测系统的电化学检测敏感性要远高于常规三电极体系,把它应用到细胞活性与抗癌药物敏感性,将可以节省大量细胞样品,从而降低检测费用,为细胞电化学用于临床检测奠定一定的基础。
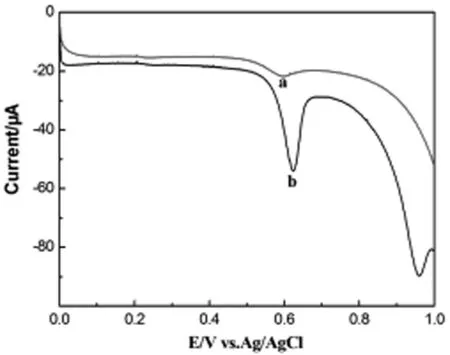
图2 MCF-7细胞裂解液的单线扫描伏安图
2.3高效液相检测
本实验采用高效液相色谱法对细胞中嘌呤类物质进行分析,结果如图3所示,通过四种混合标准品得到了四个分离良好的液相峰(图3A),保留时间分别为:12.53,13.63,15.65,21.41min,依次为次黄嘌呤,鸟嘌呤,黄嘌呤和腺嘌呤,说明四种嘌呤类物质能够很好的分离。图3B为MCF-7细胞的不同浓度的色谱图,得到了7个分离良好的色谱峰,其中能确定的四个色谱峰:12.68,13.78,15.88,21.53min与标准品图中次黄嘌呤,鸟嘌呤,黄嘌呤和腺嘌呤的峰位一致,说明MCF-7细胞也存在次黄嘌呤,鸟嘌呤,黄嘌呤和腺嘌呤,由此可以证明把电化学方法检测的两个信号归因于四种嘌呤的氧化还原是正确的。
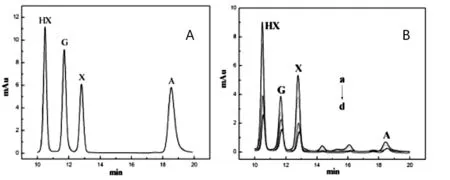
图3 不同浓度细胞和四种嘌呤标准品的HPLC图谱
(A)嘌呤标准品混合物;(B)细胞裂解液(HX:次黄嘌呤,G:鸟嘌呤,X:黄嘌呤,A:腺嘌呤;a:1×106cells mL-1b:7×105cells mL-1c:3×105cells mL-1d:8×104cells mL-1)
3讨论
我们采用工作电极上套上微管作为微型反应池,并把参比电极和对电极集成在一起构建了电化学微检测系统,仅仅消耗30μL MCF-7细胞样本即在电化学微检测系统中得到分别归属于黄嘌呤/鸟嘌呤和腺嘌呤/次黄嘌呤的氧化还原峰,结果表明MCF-7细胞中的嘌呤碱基在电化学微检测系统中具有较好的电化学响应,该电化学法有可能用于细胞内嘌呤的检测。
参考文献:
[1]J T Wang, X E Li, J G Liu, et al. Voltammetric behavior of the MCF-7 cell cytoplasm and the effect of taxol on voltammetric response[J]. Anal Biochem, 2009, 394: 229-236
[2]J T Wang, L Y Ge, X Yuan, et al. Detection of the cell viability and proliferation using two-signal electrochemical method[J]. Analyst, 2012, 137:3230-3233
[3]G G Gao, G B Xu, J L Li, et al. Low-level expression of purine bases in BALB/3T3 cells monitored by ultrasensitive graphene-based glass carbon electrode[J].Anal Biochem, 2014, 467:40-46
[4]程冠华,张树萌,陈年丰,等. MCF-7细胞原位电化学检测方法研究[J]. 黑龙江医药科学,2014,37(1):91-92
[5]刘慧东,李锦莲,武冬梅. 裂解温度对培养板中MCF-7细胞质电化学信号的影响 [J]. 黑龙江医药科学,2015,38(2):10-11
[6]G B Xu, J M Cui, H Liu, et al. Highly selective detection of cellular guanine and xanthine by polyoxometalate modified 3D graphene foam[J]. Electrochim Acta, 2015, 168: 32-40
[7]H W Qin, Q D Gao, H M Niu, et al. An in situ electrochemical detection method of cell viability[J]. Analyst, 2013, 138: 3372-3375
[8]J L Li, R X Lin, Q Wang, et al. Two-signal electrochemical method for evaluation suppression and proliferation of MCF-7 cells based on intracellular purine[J]. Anal Biochem, 2014, 456:1-5
[9]J W Cui, T J Hou, Q Wang, et al. An Enzyme Assisted Electrochemical Detection System of Purine Intracellular Utilizing MWCNTs-IL Modified Glassy Carbon Electrode[J]. Electrochimica Acta, 2015, 180: 360-365
基金项目:①1.国家级大学生创新训练计划项目,编号:201310222002;2.佳木斯大学科学技术面上项目,编号:L2014-004;3.佳木斯大学科学技术面上项目,编号:L2012-054。
作者简介:高寒(1992~)女,山东济宁人,在校本科学生。 通讯作者:崔继文(1967~)男,黑龙江佳木斯人,博士,教授,硕士研究生导师。E-mail:cjwhljjms@163.com。
中图分类号:R965.2
文献标识码:A
文章编号:1008-0104(2016)04-0099-02
(收稿日期:2016-04-04)
