人类精子VDAC2 基因启动子在小鼠GC-2spd细胞的克隆和报告基因载体构建*
2016-06-17徐爱明张建中柳长坤凯华艺博王海南刘边疆王增军南京医科大学第一附属医院泌尿外科实验室南京210029
徐爱明 张建中 柳长坤 陈 伟 赵 凯华艺博 王海南 奚 伟 刘边疆王增军南京医科大学第一附属医院泌尿外科实验室(南京 210029)
人类精子VDAC2 基因启动子在小鼠GC-2spd细胞的克隆和报告基因载体构建*
徐爱明 张建中 柳长坤 陈 伟赵 凯华艺博 王海南 奚 伟 刘边疆**王增军**
南京医科大学第一附属医院泌尿外科实验室(南京210029)
摘要目的线粒体电压依赖性阴离子通道蛋白2(Voltage-dependent anion channel 2,VDAC2)是VDAC重要的家族成员,参与机体众多的生理活动和病理疾病的发生发展。本次研究目的主要是确定和验证人VDAC2基因启动子的活性,为进一步探究它的调控机制奠定基础。方法通过从正常人射出的精子中提取基因组DNA。利用软件预测启动子区,我们针对性设计三对引物并正确的扩增出来。将验证正确的启动子序列结合到质粒PDS_ psiCHECK-2中,转染到小鼠GC-2细胞中去。转染48h后,通过双荧光素酶报告基因系统检测预测片段的启动子活性。结果VADC2基因上游-2000~+1000bp具有相对较高的活性。结论这是首次对人类精子中VDAC2基因启动子的确定和活性验证,为后续研究VDAC2基因在精子的发生发展以及弱精子症方面提供新的研究思路。
关键词VDAC2基因;双荧光素酶报告系统;启动区(遗传学);精子
线粒体电压依赖性阴离子通道蛋白(Voltagedependent anion channel,VDAC),首次在草履虫线粒体外膜中以有活性的孔道蛋白发现[1,2]。自发现以来, VDAC 蛋白结构研究一直处于瓶颈期,直到2008年三个来自不同国家的研究小组同时发现VDAC蛋白结构信息打破了这一瓶颈[2-5]。2010年,De Pinto等运用实时定量PCR(qPCR)定量赫拉细胞中VDAC基因表达,称表达量比VDAC1高10倍的为VDAC2,表达量比VDAC2高100倍的为VDAC3来区别VDAC的同源体[6]。如今在高等真核生物中,三种同源体分辨编码三种不同的蛋白,每种蛋白与其他亚型有70%的相似度[7, 8]。VDAC通道有明显的电压依赖性和离子选择性[9]。在膜两侧电压比较低的时候,VDAC通道一直处于有活性的状态,允许大分子物质如ATP,穿过脂质双分子层;在电压比较高的时候,VDAC保持多种活性状态从而保证多种离子或蛋白通过[10-12]。
VDAC2是VDAC家族中重要的一员,参与精子发生能量代谢的调控。类似于VDAC3,VDAC2存在于睾丸组织和精子中[13, 14]。在2009年,Menzel首次报道了从牛的精子中分离纯化出VDAC2蛋白,并发现位于膜外侧的VDAC2、VDAC3主要分布于精子鞭毛的外周致密纤维层(ODF, outer dense fibers)。这说明VDAC2蛋白具有能够维持弹性结构和精子鞭毛的弹性回缩功能,保护精子不被从附睾中射出来时产生的剪切力的损伤[14, 15]。
VDAC在男性不育中有重要的作用[16]。在我们前期研究中,我们收集了正常成年男性的精子样本,首次检测到VDAC蛋白在人类精子中的表达,尤其是在精子鞭毛区[17]。我们进一步比较了VDAC各亚型蛋白在正常成年男性和特发性弱精子症患者中精子样本表达差异,发现精子活力与VDAC2蛋白有相关性[16, 18]。然而,正如VDAC3缺乏小鼠患有特发性弱精子症一样,具体机制仍然不是十分清楚[19]。
众所周知,单核苷酸多态性和组蛋白修饰,后者往往是甲基化修饰,调控基因的表达。在我们前期的工作中,我们通过对中国汉族人群分析,已经发现VDAC2基因的多态性与特发性弱精子症无相关性。由此,我们进一步探讨异常的基因甲基化调节VDAC2蛋白的表达从而导致男性特发性弱精子症的发生。
材料和方法
一、材料和试剂
(一)细胞、菌株、质粒
小鼠精原细胞株GC-2spd由南京医科大学国家重点生殖实验室赠送。报告基因载体psi_CHECK-2(内接萤光虫荧光素酶报告基因firefly luciferase和接海肾荧光素酶报告基因)购自上海诺百生物化学有限公司。大肠杆菌DH5α由泌尿外科实验室保存。
(二)试剂
全基因组提取试剂盒购自日本TaKaRa公司,引物主要由上海英俊公司(Invitrogen合成)合成,Taq DNA聚合酶、dNTP、T4连接酶、DNA Marker购自美国Fermentas公司。转染试剂盒Lipofectamine2000TM购自上海英俊公司。双荧光素酶报告基因检测试剂盒购自Promega公司。DMEM培养基、胎牛血清购自美国Gibco公司。
二、方法
(一)基因组DNA提取和基因组克隆
我们利用全基因组提取试剂盒,按照操作说明书,从人类正常人精子标本中提取全基因组DNA。
(二)引物设计及和PCR反应产物的回收
根据引物设计原则,采用Omiga 2.0软件对Promoter Scan预测的-2000 ~ +1000bp的序列进行引物设计(表1)。分别引入KpnI/ NheI酶切位点及保护碱基,引物由invitrogen公司合成。以人类精子全基因组DNA为模板,分三段扩增长度为3000bp的人VDAC2基因启动子片段(40个循环,95℃ 15s,60℃ 1min,退火温度70℃,1min)。用1.5%的琼脂糖凝胶电泳鉴定扩增片段,并用胶回收试剂盒纯化扩增产物。

表11 内参及VVDDAACC22启动子各段扩增引物
(三)人VDAC2基因启动子报告基因载体构建利用获得的人VDAC2基因启动子片段构建了VDAC2启动子报告基因。为此限制性内切酶KpnI/ NheI分别酶切扩增产物和psi_CHECK-2载体质粒。挑菌培养,酶切电泳并送测序鉴定。T4连接酶将酶切产物于16℃过夜反应连接,转入感受态细胞DH5α中并扩增。得到的产物命名为psi_CHECK-2-VDAC2。设立阴性对照质粒psi_CHECK-2-NC。
(四)细胞培养及转染
GC-2spd细胞用10%胎牛血清的DMEM完全培养基,于37.5℃,5% CO2细胞孵箱内培养。当细胞扩增至80%~90%融合时用0.25%胰酶消化,以5×105细胞/mL密度接种于6孔板中。待细胞长至60%~70%融合时,提前1h换无双抗培养基。对每种细胞用lipofectamine2000分别转染miRNA和质粒组合,另设1组为转染对照。各组均设3个重复。转染过夜后换液,并继续培养至48h。
(五)双荧光素酶报告基因检测
按照双荧光素酶检测试剂盒(Dual Lueiferase Assay System)的操作说明书,吸除转染48h后的6孔板上清液,PBS洗两遍,加细胞裂解液300μL,置冰上裂解10min,收集裂解液,12 092×g,离心5min。每个样品取100μL裂解液,加100μL firefly检测试剂,记录RLU(relative light unit)值;再加100μL检测工作液,记录第二个RLU值分别读出载体荧光素酶活性剂内参质粒荧光素酶活性数值,两者之比为荧光素酶相对活性值。
三、统计学处理
所有统计在SPSS20.0软件内完成。数据资料采用Student's-t检验。P<0.05有统计学意义。
结 果
一、人精子VVDDAACC22基因启动子片段扩增结果
以正常成年男性精子基因组D N A为模板扩增VDAC2基因启动子目的片段3 0 0 0 b p(-2000~+1000),电泳结果(见图1)显示于3000bp处见明亮清晰条带影,与预期位置相符。
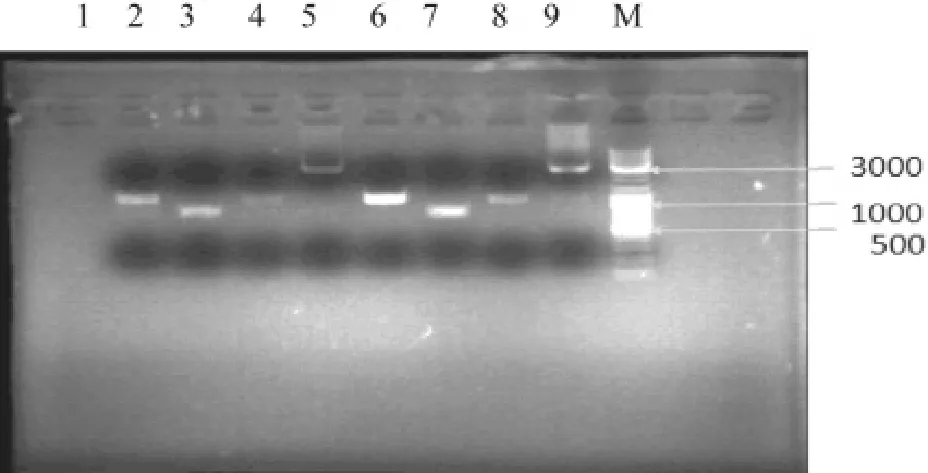
图11 人VVDDAACC22启动子片段KpnI/ NNhheeII双酶切结果鉴定
M:3000 bp DNA Marker,2-5为psi_CHECK-2-VDAC2,6-9为重复。其中,2-4、6-8为启动子分三段的产物,5、9为拼接后的产物。由图可知,我们成功的扩增出预期长短的人VDAC2基因的启动子片段
二、荧光素酶报告质粒psi_CHECK-2-VVDDAACC22的构建及鉴定
我们运用限制性内切酶KpnⅠ和NHEiⅠ双酶切扩增产物以及psi_CHECK-2-VDAC2载体质粒。切下大小约为3000bp,将重组质粒送上海英俊生物公司测序鉴定(见图2),结果表明重组质粒中插入序列为3000bp,并准确插入质粒psi_CHECK-2载体质粒多克隆位点KpnI/ NheI之间,证实成功构建了启动子报告基因载体。
三、小鼠GC--22ssppdd细胞中人VVDDAACC22基因启动子活性测定结果
将构建好的重组荧光素酶报告质粒psi_CHECK-2-VDAC2和阴性对照转染进小鼠GC-2spd精原细胞中,24h后检测荧光比值活性。小鼠GC-2spd细胞中长度为3000bp启动子活性检测结果表明,报告质粒的活性高于阴性质粒psi_CHECK-2-NC,P<0.05,差异有统计学意义(见图3)。
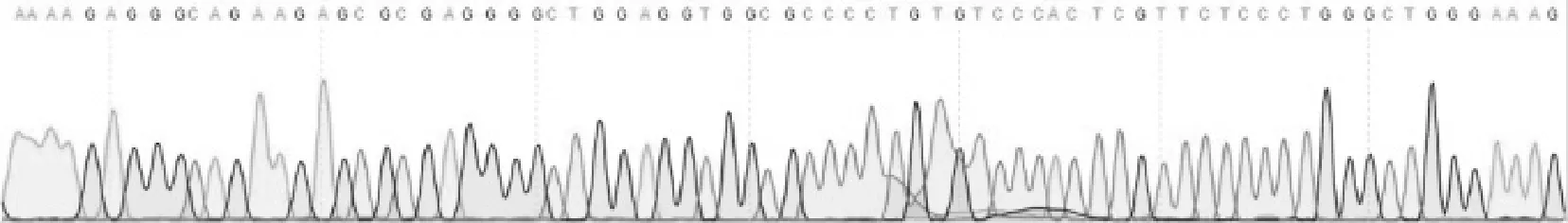
图22 人VVDDAACC22重组质粒的部分测序图测序结果证实我们成功构建了启动子报告基因载体
讨 论
VDAC基因家族的发现和其在生殖系统中发挥的作用已经不是什么新鲜事了[15, 19, 20]。最近,VDAC2蛋白作为哺乳动物精子发生过程中不可或缺的调控因素,已经受到越来越多的重视。精子活力和存活率可能会直接受到VDAC蛋白的调控[15, 16, 21]。不考虑对Ca2+影响,利用DIDS阻断VDAC蛋白能够显著的减少精子的运动能力;而对照组中精子的活力不受影响[16]。因此,VDAC家族蛋白,尤其VDAC2,可能对精子来说是一种很重要的结构功能复合体蛋白。在我们前期研究工作中,我们发现VDAC2基因mRNA在特发性弱精子症患者中表达明显高于正常男性精子中的表达量,但是VDAC2影响人类精子活力的具体机制仍然不十分清楚[16-18, 21]。
为了进一步了解VDAC2基因和精子活力之间的关系,我们利用双荧光素酶报告基因,首次成功地构建并在小鼠精原细胞GC-2spd中验证人VDAC2基因启动子活性。我们调取NCBI基因文库,设计启动区引物,并提取人类精子基因组DNA,通过PCR技术扩增出人类VDAC2启动子区。将含有VDAC2基因启动子的重组质粒转染到小鼠GC-2细胞中24h后,利用双荧光素酶检测试剂盒检测荧光强度,通过荧光强度来反映启动子是否有活性。我们的结果表明,VDAC2基因-2000~+500具有启动子活性,而核心启动子区域有待我们进一步实验筛查讨论。
最近Hakan等在一次实验中意外发现有活性的芳烃受体(AhR, aryl hydrocarbon receptor)能够上调VDAC2的表达,这是首次发现外界环境影响因子调控VDAC2蛋白表达。除此而外,后续的实验进一步证实了活化的AhR受体引起VDAC2蛋白表达上调的必要性,并且说明了VDAC2基因的上调是在转录水平而非翻译水平[22, 23]。我们进一步猜想所有与VDAC2基因表达上调的疾病是否都含有活化的或者说有功能的AhR?这将是研究环境病理因素与VDAC2蛋白表达增高相关疾病新的研究方向。
我们的实验结果表明,在-2000~+1000启动子区存在着调控VDAC2基因表达的重要元件,这将是我们进行后续表观研究的关键点[24]。基于我们2010年的研究基础,我们将继续讨论异常的DNA甲基化是否会引起VDAC2蛋白表达异常引起特发性弱精子症。此外,随着环境污染不断严重,尤其是各类化学污染物,例如戴奥辛(2,3,7,8-Tetrachlorodibenzo-p-dioxin),通过调控VDAC2蛋白的表达来影响正常生理功能,并且这些是否是针对VDAC2基因启动子的改变?因此,我们仍然有许多工作要做来解答上述问题。
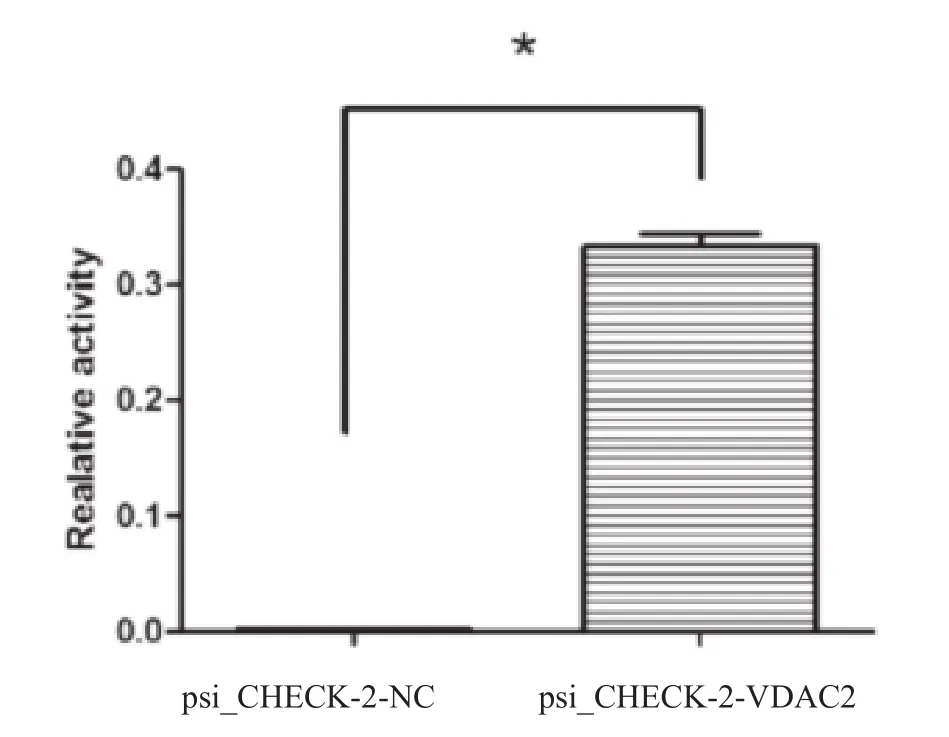
图33 荧光素酶报告基因实验
用不同比例的报告基因载体psi_CHECK-2-VDAC2和psi_ CHECK-2-NC共转染进小鼠GC-2spd细胞中,24h后收获细胞裂解后检测上清中荧光素酶活性。与psi_CHECK-2-NC比较,*为P <0.05,表明长度为3000bp的启动子片段具有启动子活性
参 考 文 献
1 Benz R. Porin from bacterial and mitochondrial outer membranes. CRC Crit Rev Biochem 1985; 19(2): 145-190
2 Schein SJ, Colombini M, Finkelstein A Reconstitution in planar lipid bilayers of a voltage-dependent anion-selective channel obtained from paramecium mitochondria. J Membr Biol 1976; 30(2): 99-120
3 Bayrhuber M, Meins T, Habeck M, et al. Structure of the human voltage-dependent anion channel. Proc Natl Acad Sci U S A 2008; 105(40): 15370-15375
4 Hiller S, Garces RG, Malia TJ, et al. Solution structure of the integral human membrane protein VDAC-1 in detergent micelles. Science 2008; 321(5893): 1206-1210
5 Ujwal R, Cascio D, Colletier JP, et al. The crystal structure of mouse VDAC1 at 2.3 A resolution reveals mechanistic insights into metabolite gating. Proc Natl Acad Sci U S A 2008; 105(46): 17742-17747
6 De Pinto V, Guarino F, Guarnera A, et al. Characterization of human VDAC isoforms: a peculiar function for VDAC3? Biochim Biophys Acta 2010; 1797(6-7): 1268-1275
7 Decker WK, Bowles KR, Schatte EC, et al. Revised fi ne mapping of the human voltage-dependent anion channel loci by radiation hybrid analysis. Mamm Genome 1999;10(10): 1041-1042
8 Decker WK, Craigen WJ. The tissue-specifi c, alternatively spliced single ATG exon of the type 3 voltage-dependent anion channel gene does not create a truncated proteinisoform in vivo. Mol Genet Metab 2000; 70(1): 69-74
9 Shoshan-Barmatz V, De Pinto V, Zweckstetter M, et al. VDAC, a multi-functional mitochondrial protein regulating cell life and death. Mol Aspects Med 2010;31(3): 227-285
10 Rostovtseva T, Colombini M. ATP flux is controlled by a voltage-gated channel from the mitochondrial outer membrane. J Biol Chem 1996; 271(45): 28006-28008
11 Benz R. Permeation of hydrophilic solutes through mitochondrial outer membranes: review on mitochondrial porins. Biochim Biophys Acta 1994; 1197(2): 167-196
12 Gincel D, Silberberg SD, Shoshan-Barmatz V. Modulation of the voltage-dependent anion channel (VDAC) by glutamate. J Bioenerg Biomembr 2000; 32(6): 571-583
13 Ficarro S, Chertihin O, Westbrook VA, et al. Phosphoproteome analysis of capacitated human sperm. Evidence of tyrosine phosphorylation of a kinaseanchoring protein 3 and valosin-containing protein/p97 during capacitation. J Biol Chem 2003; 278(13): 11579-11589
14 Menzel VA, Cassara MC, Benz R, et al. Molecular and functional characterization of VDAC2 purified from mammal spermatozoa. Biosci Rep 2009; 29(6): 351-362
15 Hinsch KD, De Pinto V, Aires VA, et al. Voltagedependent anion-selective channels VDAC2 and VDAC3 are abundant proteins in bovine outer dense fibers, a cytoskeletal component of the sperm flagellum. J Biol Chem 2004; 279(15): 15281-15288
16 Kwon WS, Park YJ, Mohamed el SA, et al. Voltagedependent anion channels are a key factor of male fertility. Fertil Steril 2013; 99(2): 354-361
17 Liu B, Wang Z, Zhang W, et al. Expression and localization of voltage-dependent anion channels (VDAC)in human spermatozoa. Biochem Biophys Res Commun 2009; 378(3): 366-370
18 Liu B, Wang P, Wang Z, et al. Analysis and difference of voltage-dependent anion channel mRNA in ejaculated spermatozoa from normozoospermic fertile donors and infertile patients with idiopathic asthenozoospermia. J Assist Reprod Genet 2010; 27(12): 719-724
19 Sampson MJ, Decker WK, Beaudet AL, et al. Immotile sperm and infertility in mice lacking mitochondrial voltage-dependent anion channel type 3. J Biol Chem 2001; 276(42): 39206-39212
20 Hinsch KD, Asmarinah, Hinsch E, et al. VDAC2 (porin-2)expression pattern and localization in the bovine testis. Biochim Biophys Acta 2001; 1518(3): 329-333
21 Liu B, Wang P, Wang Z, et al. The use of anti-VDAC2 antibody for the combined assessment of human sperm acrosome integrity and ionophore A23187-induced acrosome reaction. PLoS One 2011; 6(2): e16985
22 Sarioglu H, Brandner S, Haberger M, et al. Analysis of 2,3,7,8-tetrachlorodibenzo-p-dioxin-induced proteome changes in 5L rat hepatoma cells reveals novel targets of dioxin action including the mitochondrial apoptosis regulator VDAC2. Mol Cell Proteomics 2008; 7(2): 394-410
23 Weiss C, Kolluri SK, Kiefer F, et al. Complementation of Ah receptor deficiency in hepatoma cells: negative feedback regulation and cell cycle control by the Ah receptor. Exp Cell Res 1996; 226(1): 154-163
24 Turecki G, Meaney MJ. Effects of the social environment and stress on glucocorticoid receptor gene methylation: a systematic review. Biol Psychiatry 2016 ;79(2):87-96
(2015-09-17收稿)
doi:10.3969/j.issn.1008-0848.2016.03.002
中图分类号R 321.1
*基金项目资助:国家自然科学基金(30872575,81200467)
Clones and the construction of luciferase report vector of human sperm VDAC2 promoter in GC-2spd cell lines
Xu Aiming, Zhang Jianzhong, Liu Changkun, Chen Wei, Zhao Kai,Hua Yibo, Wang Hainan, Xi Wei, Liu Bianjiang**, Wang Zengjun**
Department of Urology, the First Affi liated Hospital of Nanjing Medical University, Nanjing 210029, China Corresponding author: Liu Bianjiang, E-mail: bjliu@njmu.edu.cn; Wang Zengjun, E-mail: zengjunwang@njmu.edu.cn
AbstractObjectiveVoltage-dependent anion channel 2 (VDAC2) is an important member of VDAC family, and involves in many physiological activities and pathological changes in diseases. This study is mainly to identify and analyze the active of promoter of human VDAC2 gene for further investigation on its regulatory mechanism. MetthhooddssGenomic DNA from normal human ejaculated sperm was extracted. The promoter region was correctly amplifi ed using three pairs of primer. PDS_pisCHECK-2 carried the correct promoter sequence was transfected into GC-2spd cell line. 48h after cell transfection, a Dual-Luciferase® Reporter Assay Kit was used to detect the activity of VDAC2 gene promoter constructs. RessuullttssIt showed that the -2000~+1000bp located at upstream of VDAC2 had the highest activity. ConcluussiioonnThis study fi rst identify and analyze the activity of promoter region of VDAC2 in human sperm.
Key wordsVDAC2 gene;dual-luciferase reporter system;promoter regions (genetics);spermatozoa
**共同通讯作者:刘边疆,E-mail: bjliu@njmu.edu.cn; 王增军,E-mail: zengjunwang@njmu.edu.cn
