t(8;21)急性髓系白血病的临床特征及预后分析
2016-06-17史娜娜吴博文刘延方谢新生刘林湘姜中兴
史娜娜,吴博文,孙 慧,刘延方,马 杰,谢新生,刘林湘,姜中兴,孙 玲
郑州大学第一附属医院血液内科 郑州 450052
t(8;21)急性髓系白血病的临床特征及预后分析
史娜娜,吴博文,孙慧,刘延方,马杰,谢新生,刘林湘,姜中兴,孙玲#
郑州大学第一附属医院血液内科 郑州 450052
关键词白血病,非淋巴细胞,急性;白细胞指数;染色体;治疗;预后
摘要目的:观察 t(8;21)急性髓系白血病(AML)的临床特征并分析影响预后的因素。方法:回顾性分析郑州大学第一附属医院68例初治成人t(8;21)AML患者的血常规、骨髓细胞形态学、免疫表型、细胞遗传学、疗效及生存状况,分析影响总体生存(OS)、无复发生存(RFS)的因素。结果:68例 t(8;21)AML按FAB分型1例为M1型,1例为M4型,66例为M2型。单纯t(8;21)AML 病例占38.2%(26/68),伴附加染色体异常病例占61.8%(42/68),主要为伴性染色体(-Y或-X)缺失。59例行流式细胞术检测,CD34 阳性率93.2%, CD19 阳性率54.2%,CD56阳性率79.7%,CD34CD19共表达者占54.2%。总体完全缓解(CR)率为94.1%(64/68),1个疗程CR率为73.5%(50/68)。64例可统计生存的患者3 a OS率为44.8%,3 a RFS率为47.9%。白细胞指数、染色体核型、中大剂量Ara-C疗程数对OS有影响(P<0.05)。结论:白细胞指数、染色体核型、中大剂量Ara-C疗程数是影响t(8;21)AML预后的主要因素。
t(8;21)(q22;q22)是急性髓系白血病(acute myeloid leukemia,AML)最常见的染色体异常之一,主要见于FAB分型中的M2型。文献[1]报道其在AML的发生率约为9.8%。该染色体的异位使位于21号染色体上的AML1基因、位于8号染色体上的ETO基因形成AML1/ETO融合基因,正常的AML1-CBF是影响造血干细胞分化的转录复合物,AML1/ETO融合可通过抑制核心结合因子影响造血干细胞分化,加上其他基因异常改变共同导致白血病的发生。t(8;21)AML在危险分层上属于预后较好的类型,治疗上完全缓解(CR)率高、长期预后好,尤其是大剂量阿糖胞苷(Ara-C)在巩固治疗上的应用能改善预后已成共识,但仍有部分患者长期预后差。该文回顾性分析了68例t(8;21)(q22;q22)AML的临床资料,以进一步了解其临床特征及影响预后的因素。
1对象与方法
1.1研究对象所有病例均为2011年1月至2014年8月郑州大学第一附属医院收治的初治AML患者,根据患者细胞形态学、细胞化学、免疫表型、染色体和(或)AML1/ETO融合基因检查结果诊断为AML伴t(8;21),骨髓涂片染色后进行FAB分型,免疫表型采用流式细胞术进行分析,阳性标准为≥20%,染色体采用G显带分析,至少分析20个分裂相,应用FISH法检测AML1/ETO融合基因[2]。选取完成诱导治疗并评价疗效的非移植患者共68例,随访截至2015年8月30日,中位随访时间28(12~54)个月。
1.2临床治疗诱导缓解采用含标准剂量Ara-C的化疗方案,如DA、MA、HA等(DNR:25~45 mg·m-2·d-1×3 d;MIT:8~10 mg·m-2·d-1×3 d;HHT:2.5 mg·m-2·d-1×7 d;Ara-C:100 mg·m-2·d-1×7 d)。缓解后治疗包括常规剂量的DA、AA、MEA等化疗方案和含中大剂量Ara-C(1~3 g·m-2·12 h-1×3 d)的化疗方案。
1.3疗效判定参考文献[3]标准判定。自确诊日期起至死亡日期或随访结束日期的时间为总体生存(OS)时间,无复发生存(RFS)时间自CR日计算。白细胞指数为外周血白细胞计数(×109L-1)与骨髓幼稚细胞百分比的乘积。
1.4统计学处理应用SPSS 21.0进行统计学处理。CR率的比较采用Fisher确切概率法,OS、RFS的比较采用Kaplan-Meier法并用Log-rank方法进行检验,将单因素分析中P<0.1的因素进行多因素COX回归分析。检验水准α=0.05。
2结果
2.1一般特征68例患者中男34例,女34例;中位年龄35(14~59)岁;FAB分型M1型1例,M4型1例,M2型66例;发病时中位白细胞数9.99(1.60~73.20)×109L-1,8.8%(6/68)的患者白细胞数高于40.00×109L-1。中位白细胞指数5.81(0.46~62.97)。骨髓幼稚细胞百分比中位数为58.6%(15.2%~91.0%)。
2.2细胞遗传学特征和免疫表型特征68例患者染色体核型分析均检出t(8;21)(q22;q22),单纯t(8;21)(q22;q22)患者26例(38.2%),伴有附加染色体异常42例(61.8%)。最常见的附加异常为伴性染色体(-Y或-X)缺失,共34例(50.0%),-Y 21例(占男性病例的61.8%),-X 13例(占女性病例的38.2%);伴9q- 7例(10.3%),复杂核型5例(7.4%,2例伴-X、9q-,1例伴-Y、9q-,伴-7、伴+4各1例)。59例患者免疫表型分析结果见表1。
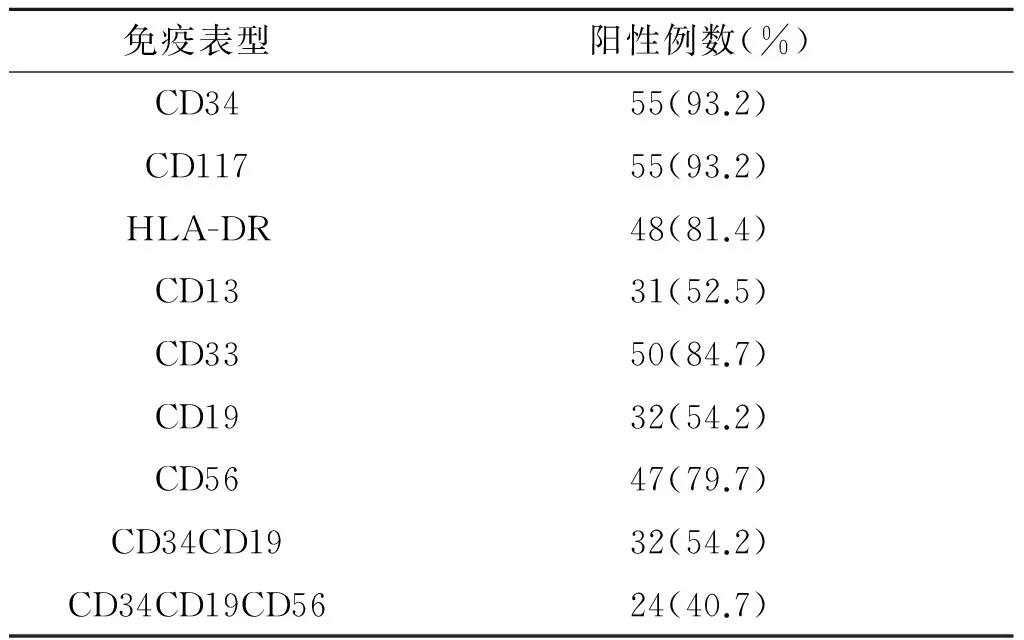
表1 免疫表型分析结果(n=59)
2.3治疗与预后68例患者诱导治疗后64例(94.1%)获得CR,1个疗程CR率73.5%(50/68),2个疗程CR率17.6%(12/68),剩余2例3个疗程获得CR。单纯t(8;21)和伴附加染色体异常的患者CR率分别为96.2%(25/26)、92.9%(39/42)(P>0.999),CD19+和CD19-患者的CR率分别为 96.9%(31/32)、88.9%(24/27)(P=0.323)。
64例CR患者中除4例巩固治疗不足3个疗程自行停止化疗外,余60例CR患者均进行巩固治疗3个疗程以上,4例自行停止化疗的患者均于0.5 a内复发。60例中57例(95.0%)采用了含中大剂量Ara-C的方案巩固治疗(1个疗程15例,2个疗程17例,3个疗程以上25例)。60例中复发21例(35.0%),采用含中大剂量Ara-C方案巩固治疗3个疗程以上者复发6例(24.0%)。除4例自行停止化疗者,余64例患者中位OS和RFS时间分别为26个月和 31个月,3 a OS 率44.8%,3 a RFS率47.9%。
2.4预后分析
2.4.1单因素分析结果见表2。
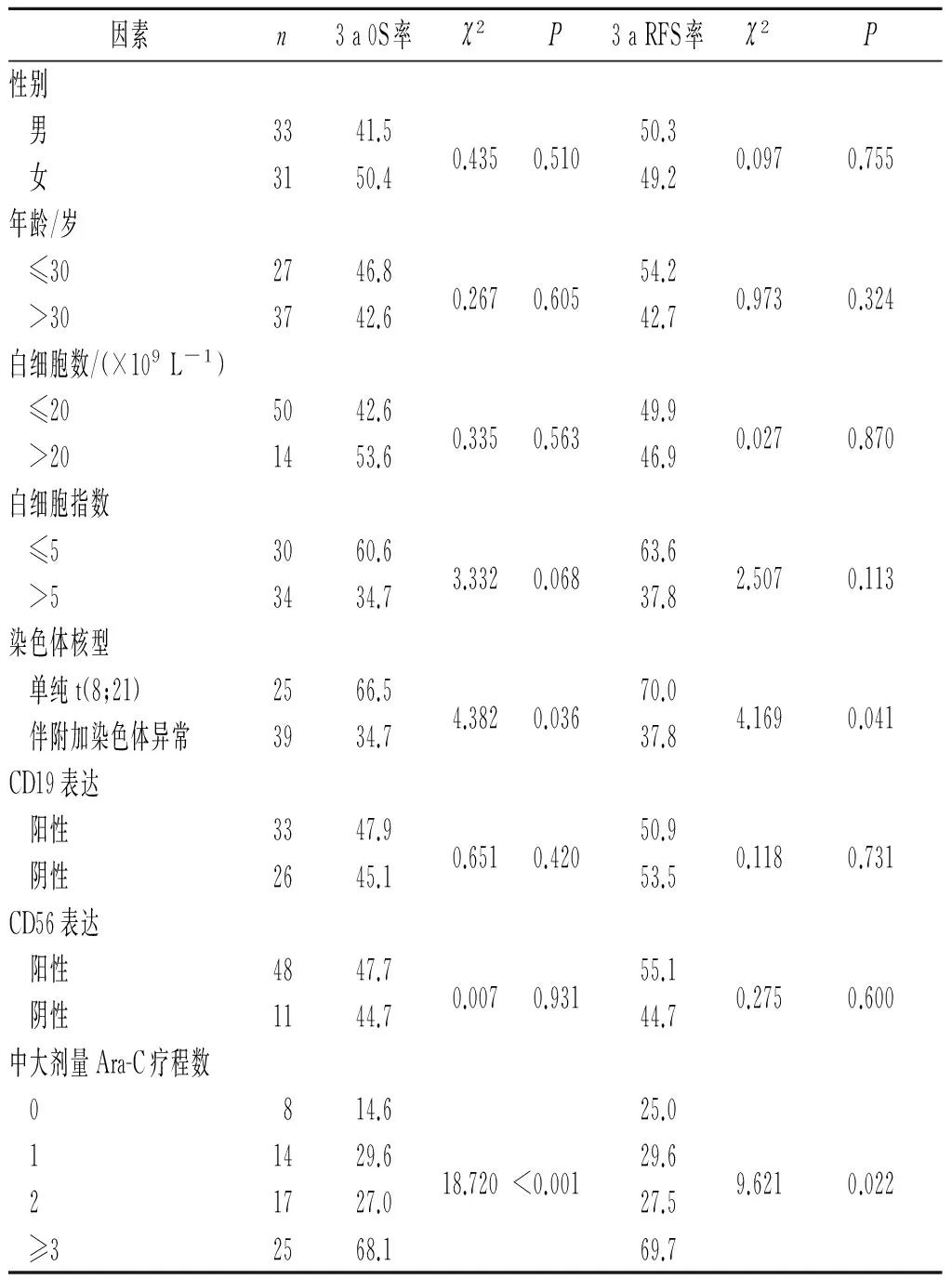
表2 影响t(8;21)AML预后的单因素分析结果 %
2.4.2多因素分析变量赋值见表3。结果表明,白细胞指数、染色体核型、中大剂量Ara-C疗程数对OS均有影响(表4)。

表3 变量赋值表
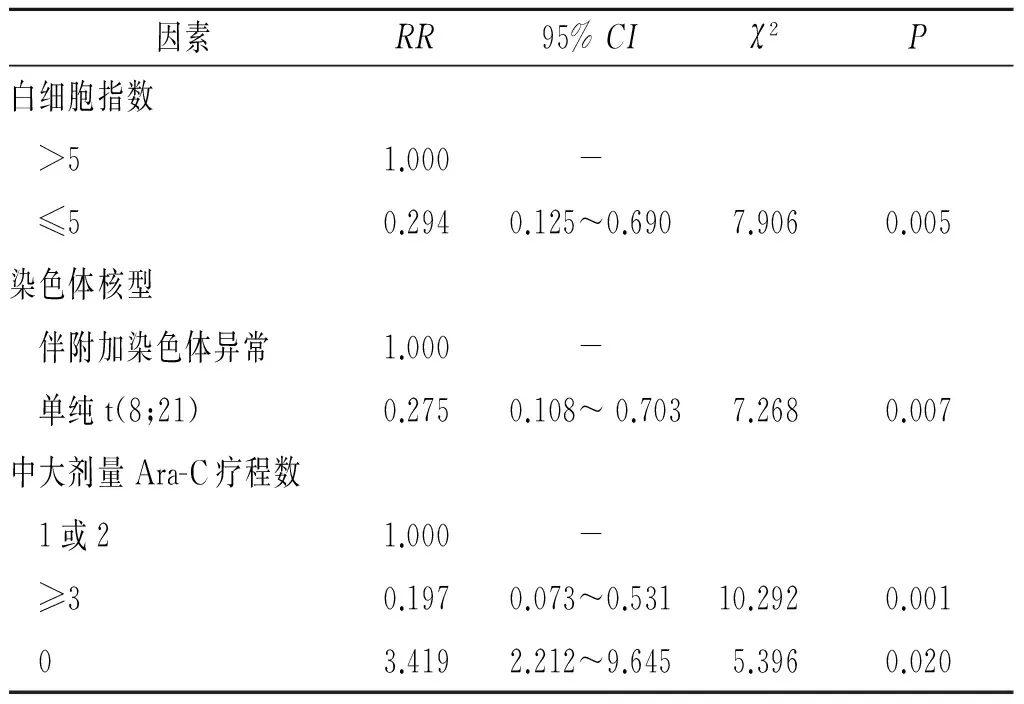
表4 影响t(8;21)AML预后的相关因素
3讨论
t(8;21)(q22;q22)AML有其独特的生物学特征,发病时白细胞数偏低,骨髓白血病细胞具有分化潜能,伴异常中幼粒细胞增多及嗜酸性粒细胞增多,含有Auer小体,细胞遗传学上常伴性染色体缺失、9q-等附加染色体异常,免疫表型上特征性的表现为CD34和CD19双表达。
该组病例发病年龄小,中位年龄35岁,白细胞数低,仅有8.8%的病例白细胞数高于40.00×109L-1,评价骨髓细胞发育成熟程度的白细胞指数中位数为5.81。Nguyen等[4]的前瞻性大样本研究中,白细胞指数是影响预后的惟一指标。作者以白细胞指数5为分界进行分析,3 a OS率及RFS率比较差异无统计学意义,但低白细胞指数患者具有明显的生存优势,多因素分析结果显示白细胞指数可影响预后。
t(8;21)AML免疫表型特异性的表现为交叉系列抗原CD34+CD19+共表达。刘艳荣等[5]对610例AML患者进行免疫表型分析,发现CD34+CD19+共表达的比例低于10%。而在t(8;21)AML中,有学者[6]报道共表达的比例为75%。该组病例中为 54.2%,提示t(8;21)AML中CD34+CD19+共表达比例较高,并提示免疫表型结果可预测AML是否伴t(8;21)。CD19阳性与预后的关系尚存在争议,该研究结果显示CD19阳性的CR率及3 a OS率、FRS率与CD19阴性患者比较,差异无统计学意义。另外,该组病例造血祖细胞抗原CD34、HLA-DR 及NK细胞抗原CD56 阳性率亦较高。
细胞遗传学对AML的预后具有重要影响。t(8;21)AML常伴有其他染色体异常,如-Y、-X、9q-、+8、+7、复杂核型,最常见的为性染色体缺失,占60%~80%[7]。该组病例61.8%伴有附加染色体异常,50.0%伴性染色体缺失。大多数研究未能证实伴附加染色体异常与预后不良有关,有报道[8]认为9q-及性染色体缺失对生存不利,也有报道[9]指出性染色体缺失与预后无关。该研究结果显示,伴附加染色体异常是预后不良的影响因素之一。关于附加异常,该研究中性染色体缺失所占比例最高,其他异常所占比例均较低,未能做进一步分析,具体哪类异常对预后影响最大有待进一步研究。
治疗方案是影响AML预后的重要因素。与传统标准剂量相比,诱导治疗中加大蒽环类药物、Ara-C剂量或者联合第3种药物,结果并无明显改善。缓解后中大剂量Ara-C的应用可改善t(8;21)AML患者的预后[10-14]。国外2个研究中心分别对包括200例以上的inv(16)和t(8;21)移植患者进行观察分析,发现在CR1期,自体移植和异基因移植的预后无明显差异[15];Gorin等[16]发现自体移植和异基因移植的长期生存率近似,高白细胞数对预后不利;Schlenk等[7]发现,异基因移植组与化疗组相比,并无明显优势,这进一步提示大剂量Ara-C对缓解后治疗的重要性。该研究结果显示,缓解后治疗方案对预后有影响,≥3个疗程中大剂量Ara-C组的3 a RFS率和OS率明显提高,说明充分的缓解后治疗十分必要。
总之, t(8;21)AML是一类具有异质性的白血病亚型,特征性的表现为伴B细胞系抗原表达及常伴附加染色体异常,缓解后大剂量Ara-C治疗后复发率低、预后好,但仍需更多的研究以明确预后的影响因素。
参考文献
[1]中美联合上海市白血病协作组.上海市623例成人急性髓系白血病非选择病例的WHO亚型分布、初始疗效及预后[J].中华血液学杂志,2010,31(2):102
[2]SCHLENK RF,BENNER A,KRAUTER J,et al.Individual patient data-based meta-analysis of patients aged 16 to 60 years with core binding factor acute myeloid leukemia: a survey of the German Acute Myeloid Leukemia Intergroup[J].J Clin Oncol,2004,22(18):3741
[3]张之南,沈悌.血液病诊断及疗效标准[M].3版.北京:科学出版社,2007:106
[4]NGUYEN S,LEBLANC T,FENAUX P,et al.A white blood cell index as the main prognostic factor in t(8;21) acute myeloid leukemia(AML): a survey of 161 cases from the French AML Intergroup[J].Blood,2002,99(10):3517
[5]刘艳荣,王亚哲,陈珊珊,等.610例急性髓系白血病免疫表型和白血病相关免疫表型分析[J].中华血液学杂志,2007,28(11):731
[6]REIKVAM H,HATFIELD KJ,KITTANG AO,et al.Acute myeloid leukemia with the t(8;21) translocation: clinical consequences and biological implications[J].J Biomed Biotechnol,2011,2011:104631
[7]SCHLENK RF,PASQUINI MC,PÉREZ WS,et al.HLA-identical sibling allogeneic transplants versus chemotherapy in acute myelogenous leukemia with t(8;21) in first complete remission: collaborative study between the German AML Intergroup and CIBMTR[J].Biol Blood Marrow Transplant,2008,14(2):187
[8]MARCUCCI G,MROZEK K,RUPPERT AS,et al.Prognostic factors and outcome of core binding factor acute myeloid leukemia patients with t(8;21) differ from those of patients with inv(16):a Cancer and Leukemia Group B study[J].J Clin Oncol,2005,23(24):5705
[9]GRIMWADE D,HILLS RK,MOORMAN AV,et al.Refinement of cytogenetic classification in acute myeloid leukemia: determination of prognostic significance of rare recurring chromosomal abnormalities among 5876 younger adult patients treated in the United Kingdom Medical Research Council trials[J].Blood,2010,116(3):354
[10]邹萍.急性髓性白血病的规范化诊治[J].中国实用内科杂志,2007,27(14):1110
[11]SINHA C,CUNNINGHAM LC,LIU PP.Core binding factor acute myeloid leukemia:new prognostic categories and therapeutic opportunities[J].Semin Hematol,2015,52(3):215
[12]KADIA TM,RAVANDI F.Progress in acute myeloid leukemia[J].Clin Lymphoma Myeloma Leuk,2015,15(3):139
[13]BYRD JC,DODGE RK,CARROLL A,et al.Patients with t(8;21)(q22;q22)and acute myeloid leukemia have superior failure-free and overall survival when repetitive cycles of high-dose cytarabine are administered[J].J Clin Oncol,1999,17(12):3767
[14]CASSILETH PA,LEE SJ,LITZOW MR,et al.Intensified induction chemotherapy in adult acute myeloid leukemia followed by high-dose chemotherapy and autologous peripheral blood stem cell transplantion:an Eastern Cooperative Oncology Group trial(E4995)[J].Leuk Lymphoma,2005,46(1):55
[15]KUWATSUKA Y,MIYAMURA K,SUZUKI R,et al.Hematopoietic stem cell transplantation for core binding factor acute myeloid leukemia: t(8;21) and inv(16) represent different clinical outcomes[J].Blood,2009,113(9):2096
[16]GORIN NC,LABOPIN M,FRASSONI F,et al.Identical outcome after autologous or allogeneic genoidentical hematopoietic stem-cell transplantation in first remission of acute myelocytic leukemia carrying inversion 16 or t(8;21): a retrospective study from the European Cooperative Group for Blood and Marrow Transplantation[J].J Clin Oncol,2008,26(19):3183
Clinical features and prognostic factors of acute myeloid leukemia with t(8;21)
SHINana,WUBowen,SUNHui,LIUYanfang,MAJie,XIEXinsheng,LIULinxiang,JIANGZhongxing,SUNLing
DepartmentofHematology,theFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052
Key wordsleukemia,nonlymphocytic,acute;white blood cell index;chromosome;therapy;prognosis
AbstractAim: To investigate the clinical features and the prognostic factors of acute myeloid leukemia(AML) with t(8;21).Methods: A total of 68 AML patients with t(8;21)in the First Affiliated Hospital of Zhengzhou University were retrospectively analyzed,including white blood cell index,marrow morphology,immunophenotype,chromosome karyotype,therapeutic effects,as well as the overall survival(OS)and relapse free survival(RFS).The prognostic factors were analyzed.Results: According to FAB classification,there were 66 cases of M2,1 case of M1, and 1 case of M4. Cytogenetically,38.2%(26/68) were simply t(8;21), while 61.8%(42/68) were accompanied with additional chromosomal abnormalities,mainly loss of sex chromosome(-Y or -X).Out of all the 59 cases with flow cytometry results,the positive rate of CD34 according to immunophenotype analysis was 93.2%,that of CD19 was 54.2%,that of CD56 was 79.7%, and that of CD34CD19 was 54.2%. The overall complete remission(CR) rate was 94.1%(64/68),CR rate after the first course was 73.5%(50/68). The 3 year OS rate was 44.8% and 3 year FRS rate was 47.9%. White blood cell index,chromosome karyotype,intermediate/high dose cytarabine(IDAC) courses were influencing factors for OS(P<0.05).Conclusion: White blood cell index,chromosome karyotype, IDAC courses are important prognostic influencing factors for AML with t(8;21).
doi:10.13705/j.issn.1671-6825.2016.03.032
#通信作者,女,1957年12月生,博士,主任医师,研究方向:造血系统恶性疾病的基础及临床,E-mail:sunling6686@126.com
中图分类号R551.3
