Survivin在胃癌组织中的表达及其与幽门螺杆菌感染的关系
2016-03-02焦建新温风霞张玲
焦建新++++++温风霞++++++张玲玲++++++焦东晟++++++李蕾++++++季万胜++++++冯玉光++++++张小茜
[摘要] 目的 探讨胃癌组织中Survivin的表达与临床病理因素及其与幽门螺杆菌(H.pylori)感染之间的关系。 方法 采用免疫组织化学方法检测60例胃癌组织中Survivin的表达情况;采用快速尿素酶法及Warthin-Starry银染色法检测60例胃癌组织中的H.pylori感染情况。分析Survivin表达与各临床病理因素及H.pylori感染的关系。所有患者随访至少5年或直到死亡。 结果 60例胃癌组织中Survivin表达阳性率为68.3%,肿瘤侵及固有肌层组(77.8%)和浆膜层组(60.0%)Survivin的表达高于肿瘤局限于黏膜及黏膜下层组(44.4%),差异有统计学意义(P<0.05);低分化组Survivin的表达高于中高分化组(81.8%比55.6%,P<0.05);Survivin阳性表达率在有淋巴结转移的胃癌组织中明显高于无淋巴结转移的胃癌组织(80.4%比44.4%,P<0.05);TNM分期Ⅲ/Ⅳ期胃癌组织Survivin表达的阳性率明显高于Ⅰ/Ⅱ期(86.5%比56.5%,P<0.01);Survivin表达阳性患者5年生存率明显低于表达阴性患者(39.0%比63.2%,P<0.05);Survivin阳性表达率在H.pylori阳性胃癌组织中明显高于H.pylori阴性胃癌组织(75.6%比46.7%,P<0.05)。 结论 Survivin的表达与胃癌的发生、发展有关,可作为判断胃癌预后的一个客观指标;H.pylori感染能够促进Survivin的表达。
[关键词] 胃肿瘤;Survivin;幽门螺杆菌;免疫组织化学
[中图分类号] R735.2 [文献标识码] A [文章编号] 1674-4721(2016)02(a)-0004-05
Relationship between Survivin expression and Helicobacter pylori infection in gastric cancer
JIAO Jian-xin1 WEN Feng-xia1 ZHANG Ling-ling2▲ JIAO Dong-sheng1 LI Lei1 JI Wan-sheng1 FENG Yu-guang1 ZHANG Xiao-qian1
1.Department of Gastroenterology,the Affiliated Hospital of Weifang Medical University,Shandong Province,Weifang 261031,China;2.Department of Oncology,Binzhou People′s Hospital,Shandong Province,Binzhou 256610,China
[Abstract] Objective To explore the relationship between Survivin expression and the clinicopathologic parameters of Helicobacter pylori (H.pylori) infection in gastric cancer. Methods In 60 patients with gastric cancer,expression of Survivin was detected by immunohistochemistry,H.pylori infection was determined by Warthin-Starry staining and rapid urease test.All the cases were followed up at least 5 years or until death.The relationship between Survivin expression and the clinicopathologic parameters,H.pylori infection was respectively analyzed. Results The positive rate of Survivin was 68.3% (41/60) in 60 patients with gastric cancer.The positive rate of Survivin in cases limited to muscularis and serosa was higher than that of Survivin in cases limited to mucosa and submucosa (77.8%,60.0%,44.4%,P<0.05).Survivin expression rate was higher in poorly differentiated group than that in well differentiated one (81.8% vs 55.6%,P<0.05).The positive rate of gastric cancer with lymph node metastasis was higher than that of gastric cancer without lymph node metastasis (80.4% vs 44.4%,P<0.05).The positive rate of Ⅲ/Ⅳ stage gastric cancer was higher than that of Ⅰ/Ⅱ stage (86.5% vs 56.5%,P<0.01).Five-year survival rate in Survivin positive cases was lower than that in Survivin negative cases (39.0% vs 63.2%,P<0.05).The positive rate of positive H.pylori infection gastric cancer was higher than that of negative H.pylori infection gastric cancer (75.6% vs 46.7%,P<0.05). Conclusion Suvivin expression is related with the occurrence and development of gastric cancer,a detection of the expression may be used as an objective index for predicting the prognosis of this disease.H.pylori infection can promote Suvivin expression.
[Key words] Stomach Neoplasms;Survivin;Helicobacter pylori;Immunohistochemistry
胃癌是我国常见的恶性肿瘤之一,胃癌的发生发展与细胞的增殖凋亡密切相关。Survivin是凋亡抑制蛋白(inhibitor of apoptosis proteins,IAPs)成员之一,是迄今为止最强的凋亡抑制因子,Survivin不但能抑制肿瘤细胞的凋亡,而且还参与肿瘤新生血管的形成。幽门螺杆菌(Helicobacter pylori,H.pylori)感染是慢性胃炎、消化性溃疡的主要病因,亦与胃癌的发生有关。本研究采用免疫组化法检测Survivin在胃癌组织中的表达,探讨其表达与胃癌临床病理特征之间的关系及患者术后5年生存率之间的关系,并分析其与H.pylori感染的关系,阐明Survivin在胃癌发生发展中的作用及机制,为从分子水平进一步研究胃癌的发生发展、预后和治疗寻求新的思路。
1 资料与方法
1.1 一般资料
60例胃癌组织标本取自我院2008年1~12月收治的胃癌患者,患者均采取胃癌根治术治疗,患者术前均未接受放疗、化疗或其他针对胃癌的特殊治疗。其中男39例,女21例;年龄43~80岁,平均58.7岁;胃癌位于胃底10例,胃体16例,胃窦34例;胃癌局限于黏膜及黏膜下层9例,侵及肌层15例,浆膜层36例;乳头状腺癌15例,管状腺癌34例,黏液癌6例,印戒细胞癌3例,未分化癌2例;高分化4例,中分化23例,低分化27例,未分化6例;有淋巴结转移51例,无淋巴结转移9例;7例有肝转移,53例无肝转移。依据1997年IUCC分期标准进行TNM分期:Ⅰ期9例,Ⅱ期14例,Ⅲ期23例,Ⅳ期14例。
1.2 方法
采用免疫组织化学S-P法,操作步骤参照试剂盒说明书,每次实验用PBS代替一抗作为阴性对照,已知胃癌切片作为阳性对照。H.pylori采用快速尿素酶法及Warthin-Starry染色法检测,两者均阳性则判定为H.pylori感染阳性。其中实验用兔抗人Survivin多克隆抗体购自福州迈新生物技术开发公司。
1.3 免疫组织化学染色结果判定标准
由两位不了解患者病情的病理医师独立进行判定评分。
1.3.1 依据切片中细胞的染色程度进行评分 无着色:0分;呈浅黄色:1分;呈棕黄色:2分;呈棕褐色:3分。
1.3.2 依据阳性细胞比例进行评分 每例随机观察5个视野,每个视野100个细胞,计数500个细胞中染色阳性的细胞数。染色细胞数占<5%:0分;染色细胞数占5%~25%:1分;染色细胞数占26%~50%:2分;染色细胞数占51%~75%:3分;染色细胞数占>75%:4分。
1.3.3 最终评分 以上述两种评分的乘积作为最终评分,≥2分为阳性。
1.4 统计学分析
采用SPSS 17.0统计软件进行统计学分析,计数资料的比较采用χ2检验或Fisher确切概率法,用Log-rank法比较两组之间生存曲线的差异,以P<0.05为差异有统计学意义。
2 结果
2.1 胃癌和癌旁正常胃黏膜组织中Survivin的表达
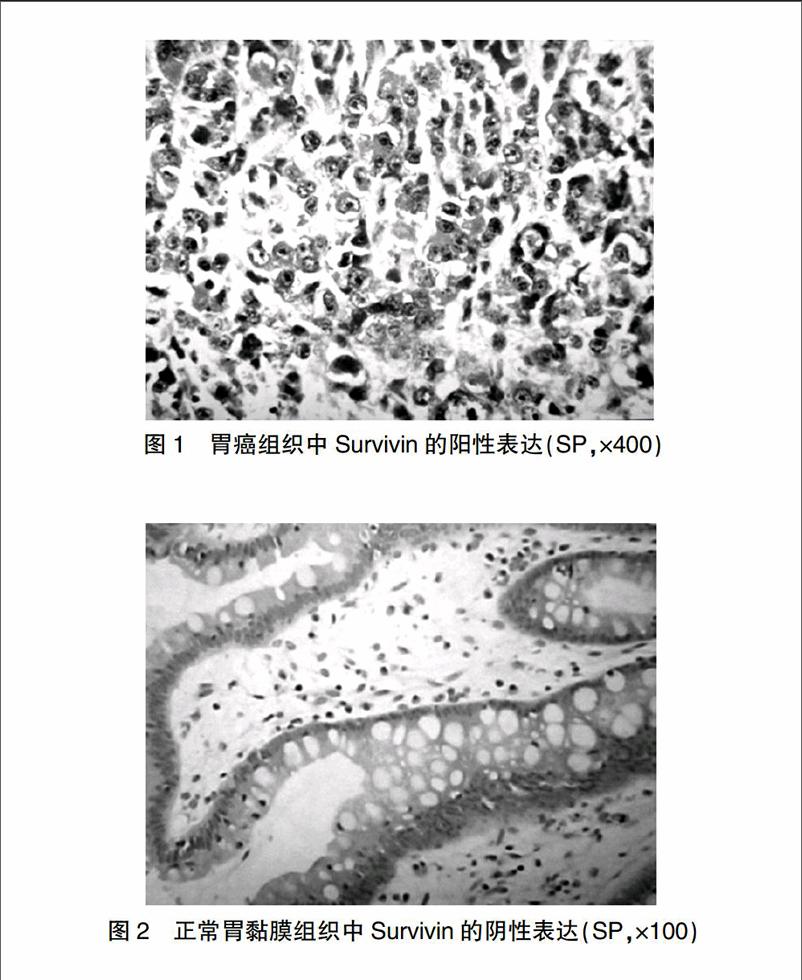
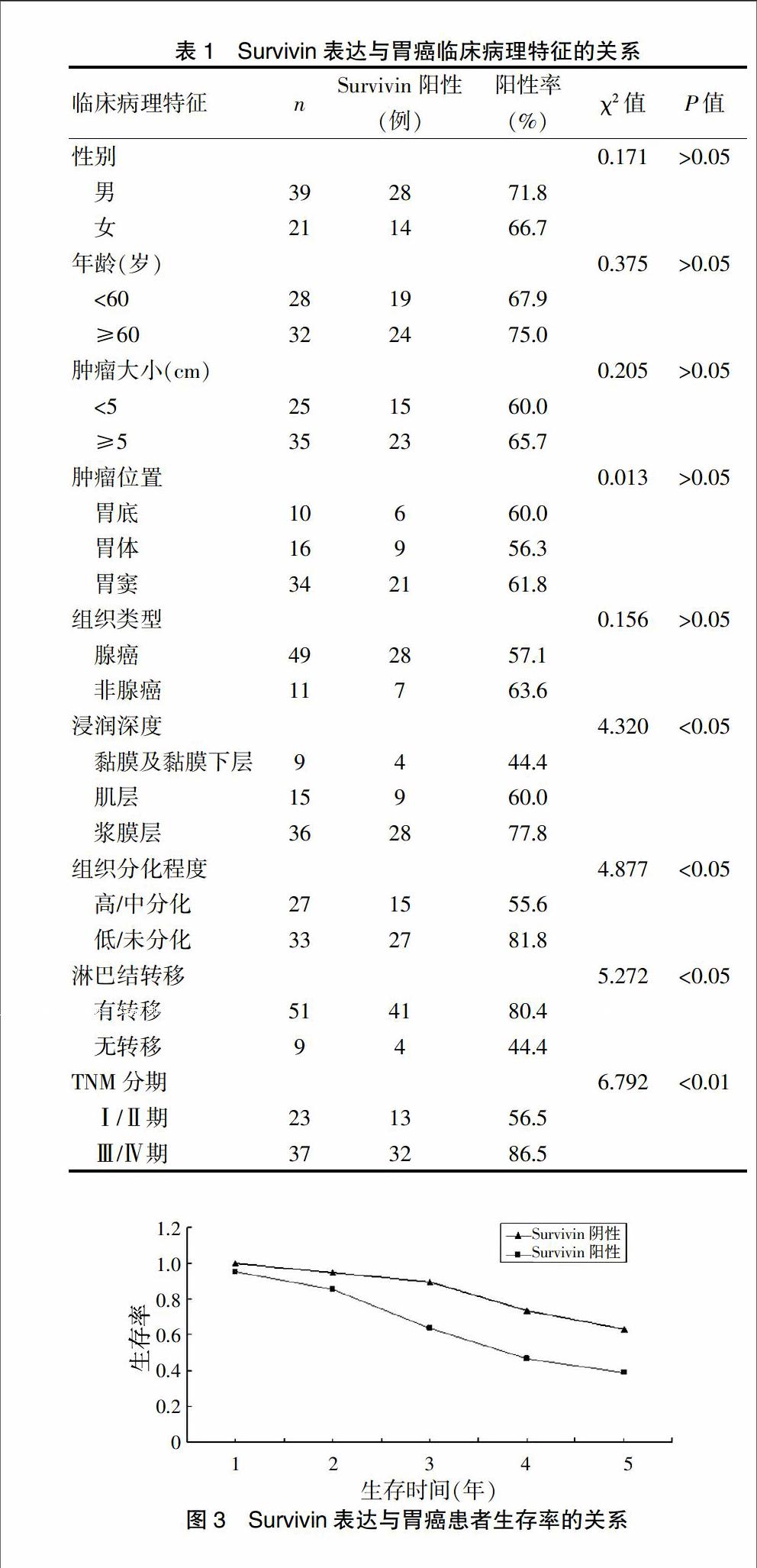
胃癌组织中Survivin主要定位于癌细胞胞质内,表现为粗细不均的棕黄色颗粒,其阳性率为68.3%(41/60)(图1),在癌旁正常胃黏膜组织中Survivin几乎不表达(图2),两者差异有统计学意义(P<0.01)。
图1 胃癌组织中Survivin的阳性表达(SP,×400)
图2 正常胃黏膜组织中Survivin的阴性表达(SP,×100)
2.2 Survivin表达与胃癌临床病理特征之间的关系
Survivin表达与胃癌患者的年龄,性别,肿瘤大小、位置,组织类型无关,而与肿瘤浸润深度、组织分化程度、有无淋巴结转移及TNM分期相关(表1)。
2.3 Survivin表达与胃癌预后的分析
60例胃癌患者随访至少5年或到其死亡,共28例存活,5年总体生存率为46.7%;Survivin阳性患者存活16例,生存率为39.0%(16/41);Survivin阴性患者存活12例,生存率为63.2%(12/19)。采用Kaplan-Meier法绘制生存曲线(图3),Log-rank检验两者差异有统计学意义(P<0.05)。
2.4 Survivin表达与H.Pylori感染的关系
60例胃癌患者中H.Pylori阳性45例,H.Pylori阳性患者中Survivin阳性率为75.6%(34/45),H.Pylori阴性患者中Survivin阳性率为46.7%(7/15),两者差异有统计学意义(χ2=4.225,P<0.05)。
3 讨论
Survivin是由Ambrosini等[1]于1997年发现的一种新的IAPs,是迄今为止克隆出的最小的IAPs成员,全长14 700 bp,该基因定位于17q25,可编码生成分子质量为16.2 kD、由142个氨基酸构成的蛋白。Survivin是已知的最强的凋亡抑制因子[2],能抑制由Bax、Fas等介导的下游反应,可阻止caspase活化,抑制caspase-3、caspase-7等高表达所诱导的细胞凋亡[3-4]。Survivin能与细胞周期调控因子CDK4形成复合体,使p21从中释放出来,p21再与caspase-3结合,抑制其活性,阻止凋亡[5]。Survivin能参与调节细胞的有丝分裂,Survivin仅在G2/M期表达,是细胞周期中G2/M期的调节基因。Survivin具有同源二聚体的独特分子结构,其氨基端有一个交织螺旋结构,该结构是与纺锤体微管蛋白相结合的位点,若干扰Survivin与之结合,则其抗凋亡功效下降,使细胞逃避G2/M期的监控,导致细胞异常分裂增殖,进而产生肿瘤。因此,Survivin具有抑制凋亡和调控细胞分裂的多重功效,与肿瘤的发生、发展密切相关[6-7]。
Survivin表达与细胞增殖有关,有细胞增殖的组织均有Survivin的表达。Survivin在正常成人已分化的组织中不表达,而在肿瘤组织中均有不同程度的表达,诸如食管癌、胃癌、肝癌、结肠癌、胰腺癌、乳腺癌、鼻咽癌、膀胱癌等,表达率为30%~100%,而且Survivin的表达与肿瘤患者的临床病理特点有关[8]。不同的肿瘤组织Survivin的表达不尽相同,可能与Survivin的不同结构形式和作用机制有关。有关Survivin在大肠癌中的表达与肿瘤临床病理特征的关系的报道不尽一致。Hernandez等[9]报道Survivin在结肠癌中高表达,而在正常组织中无表达。Dukes C期、Dukes D期阳性率高于Dukes A期、Dukes B期。Survivin阳性大肠癌患者5年生存率明显低于Survivin阴性患者。Survivin表达与肿瘤大小、侵袭深度、淋巴结转移及分化程度无明显关系。同样,Survivin在胃癌中的表达与临床病理特征的关系亦不尽一致,Stauber等[10]研究显示,Survivin基因表达强度与胃癌患者临床分期、组织分化程度及淋巴结转移有关,胃癌患者的临床分期越晚、组织分化恶性程度越高,其Survivin表达的阳性率就越高。Lu等[11]报道Survivin在胃癌中的表达率为34%,且其表达与胃癌患者的病灶大小、侵袭深度、组织学类型以及淋巴管浸润有关。然而,Miyachi等[12]报道Survivin mRNA表达与胃癌组织学类型及侵袭深度无明显关系,但与是否存在淋巴结转移有关,发生淋巴结转移者Survivin mRNA阳性率高,提示Survivin mRNA表达可出现在胃癌早期阶段,其可作为判断胃癌发生淋巴结转移可能性大小的依据。
为进一步明确Survivin与胃癌患者临床病理特征之间的关系,本研究采用免疫组织化学法检测Survivin在胃癌组织中的表达,并探讨其表达与临床病理特征之间的关系。研究表明,Survivin在正常胃组织中的表达呈阴性,而在胃癌组织中呈现高表达,其阳性率为68.3%。Survivin表达主要位于胃癌细胞质内,细胞核中未见阳性表达,癌旁组织也未见阳性表达,这与相关文献的报道大致相同[13]。Survivin在胃癌组织中的表达与性别、年龄、肿瘤大小、位置及组织类型无明显相关性(P>0.05);与肿瘤侵袭深度、组织分化程度、淋巴结转移及TNM分期相关(P<0.05)。肿瘤侵袭越深,Survivin阳性率越高;有淋巴结转移者阳性率高于无淋巴结转移者;低/未分化组阳性率高于高/中分化组;TNM Ⅲ/Ⅳ期患者阳性率高于TNM Ⅰ/Ⅱ期。由此可见Survivin不仅在胃癌的发生、发展中起重要作用,而且可能参与了癌细胞的转移过程,以上临床病理特点使Survivin可成为辅助肿瘤诊断、判断患者预后的一项重要指标,亦为肿瘤的诊断和治疗提供了新的靶点[14]。其作用机制可能在于Survivin对肿瘤新生血管形成具有重要作用。肿瘤生长、转移离不开丰富的血液供应,即需要有不断的新生血管形成。新生血管形成是内皮细胞增殖与凋亡相平衡的结果。应用血管内皮细胞生长因子、碱性成纤维细胞生长因子及血管形成素-1等刺激内皮细胞,可诱导内皮细胞Survivin表达,而炎症因子、TNF-α、IL-1等未能诱导其表达,提示Survivin能维持内皮细胞增殖,其凋亡明显受到抑制,从而导致新生毛细血管网的形成[15]。血管形成素-1是内皮细胞的特异性配体,是维持血管稳定和管腔形成的关键因子,但其作用需依赖Survivin表达上调,故Survivin在血管形成中具有重要意义,对肿瘤的浸润、转移可能发挥关键性作用[16]。
Survivin表达与肿瘤预后可能存在相关性,Sarela等[17]报道Survivin阳性结肠癌根治性切除术术后5年生存率为53.0%,Survivin阴性患者则达77.7%,Survivin阳性结肠癌术后复发率及复发后病死率均显著高于Survivin阴性患者,故认为Survivin为肿瘤预后不良的独立危险因素。Hoffmann等[18]亦报道,通过检测外周血中Survivin mRNA的表达可判定手术切除胃肠道肿瘤的疗效,术前Survivin mRNA的阳性率为88%,术后降为59%,认为Survivin mRNA可成为手术切除是否完整及预后的一个分子标志物。Okada等[19]研究显示Survivin在胃癌细胞中的阳性率为82%,Survivin阳性患者的5年生存率为30.56%,Survivin阴性患者达58.49%,可见Survivin表达与胃癌患者生存率相关。本研究结果也显示,Survivin阳性患者5年生存率为39.0%,Survivin阴性患者则为63.2%,Log-rank检验两者差异有统计学意义(P<0.05),提示Survivin阳性患者预后不良,故Survivin可成为一个判断胃癌患者预后的重要的新的客观指标[20-21]。
现已确认H.pylori感染是慢性胃炎、消化性溃疡的主要病因,与胃癌的发生也有密切关系,被认为是胃癌的重要致病因素之一,1994年WHO宣布H.pylori是胃癌的Ⅰ类致癌原。H.pylori是一种革兰氏阴性微需氧菌,机体感染后难以自行将其杀灭清除,能长期定植于胃黏膜上皮细胞层。一方面,H.pylori凭借其产生的多种毒素和酶,损害黏膜的防御/修复机制;另一方面,H.pylori感染可导致高胃泌素血症,使胃泌素和胃酸分泌增加。这两方面共同作用造成了胃黏膜的慢性炎症,若炎症持续进展则导致黏膜腺体破坏、数量减少而发生慢性萎缩性胃炎,此时胃黏膜细胞内已发生了某些基因的异常表达,但尚处于量变阶段,属于癌前病变。病变若继续发展可引起肠化生和不典型增生,最终可演变成胃癌,故H.pylori感染在慢性萎缩性胃炎和胃癌的病因学上起重要作用。胃黏膜慢性炎症,历经萎缩、肠化生、不典型增生,最终演变成胃癌,这是由慢性炎症导致肿瘤的代表性模型之一。本实验显示Survivin 阳性率在H.pylori阳性胃癌组织中高于H.pylori阴性胃癌组织(P<0.05),说明Survivin在胃癌组织中的表达与H.pylori感染有关,两者在胃癌的发生中可能起协同作用,其作用机制可能为H.pylori可产生尿素酶、黏液酶、脂酶、磷脂酶A、脂多糖、细胞毒素CagA等有害因子,能引起胃黏膜上皮细胞的损伤,上皮细胞可产生IL6、IL-8、TNF-α等,它们不仅具有免疫抑制作用,尚可促进肿瘤的形成、生长和转移;H.pylori能破坏细胞的周期调节,诱导细胞凋亡及导致细胞周期阻滞。H.pylori能通过丝裂原活化蛋白激酶途径使周期素D1激活,使其高表达,引起细胞周期改变而致增殖加速,从而导致肿瘤的发生;H.pylori还可引起细胞DNA的损伤及基因突变,包括原癌基因的激活和抑癌基因的失活等,如H.pylori可使原癌基因c-met高表达,也可使抑癌基因p53突变、失活,而c-met高表达与胃黏膜增殖和恶化有关,p53等在胃癌的发生和发展中亦起重要作用。H.pylori可能通过上调胃癌组织中Survivin的表达,抑制癌细胞凋亡,促进癌细胞生长。另外,根除H.pylori感染可减轻胃黏膜活动性炎症,阻止或延缓萎缩和肠化生,进而有利于减少胃癌的发生。由于肿瘤的发生是一个多基因、多步骤、多因素参与的漫长演变过程,各种因素的相互作用共同决定了肿瘤的发生、发展和预后。所以,Survivin和H.pylori感染在胃癌的发生、发展中可能起协同作用,但其具体的作用机制尚待进一步研究[22]。
由于在日常临床工作中,所诊治的患者大多已属于中晚期胃癌,而中晚期胃癌手术、化疗、放疗等疗效均不甚理想,因此采用基因疗法治疗胃癌就被提上日程。鉴于胃癌组织中Survivin表达具有较高的特异性,使得Survivin可以成为肿瘤靶向治疗的新靶点[23],在临床工作中采用靶向方式治疗胃癌也就成为了可能。借助检测胃癌组织中Survivin的表达,即可为胃癌的临床靶向治疗提供依据。
综上所述,Survivin在胃癌组织中呈高表达,其表达与胃癌的临床病理因素有关,对胃癌的发生发展和预后判断是一种颇有价值的客观的参考指标,亦可成为一种新的肿瘤基因诊断的标志物和肿瘤靶向治疗的靶点。H.pylori感染能够促进Survivin的表达,两者在胃癌的发生、发展中可能起协同作用,共同导致了胃癌的发生、发展。
[参考文献]
[1] Ambrosini G,Adida C,Altieri DC.A novel anti-apoptosis gene,survivin,expressed in cancer and lymphoma[J].Nat Med,1997,3(8):917-921.
[2] Liu Z,Zhang X,Xu X,et al.RUNX3 inhibits survivin expression and induces cell apoptosis in gastric cancer[J].Eur J Cell Biol,2014,93(3):118-126.
[3] Niu Y,Li JS,Luo XR.Enhancement of expression of survivin promoter-driven CD/TK double suicide genes by the nuclear matrix attachment region in transgenic gastric cancer cells[J].Gene,2014,534(2):177-182.
[4] Sun XP,Dong X,Lin L,et al.Up-regulation of survivin by AKT and hypoxia-inducible factor 1α contributes to cisplatin resistance in gastric cancer[J].FEBS J,2014,281(1):115-128.
[5] Liu ML,Zhang SJ.Effects of resveratrol on the protein expression of survivin and cell apoptosis in human gastric cancer cells[J].J BUON,2014,19(3):713-717.
[6] Habib R,Akhtar J,Taqi M,et al.Lentiviral vector-mediated survivin shRNA delivery in gastric cancer cell lines significantly inhibits cell proliferation and tumor growth[J].Oncol Rep,2015,34(2):859-867.
[7] Dang SC,Feng S,Wang PJ,et al.Overexpression of Survivin mutant Thr34Ala induces apoptosis and inhibits gastric cancer growth[J].Neoplasma,2015,62(1):81-87.
[8] Shintani M,Sangawa A,Yamao N,et al.Smac/DIABLO expression in human gastrointestinal carcinoma:association with clinicopathological parameters and survivin expression[J].Oncol Lett,2014,8(6):2581-2586.
[9] Hernandez JM,Farma JM,Coppola D,et al.Expression of the antiapoptotic protein survivin in colon cancer[J].Clin Colorectal Cancer,2011,10(3):188-193.
[10] Stauber RH,Mann W,Knauer SK.Nuclear and cytoplasmic survivin:molecular mechanism,prognostic,and therapeutic potential[J].Cancer Res,2007,67(13):5999-6002.
[11] Lu B,Mu Y,Cao C,et al.Survivin as a therapeutic target for radiation sensitization in lung cancer[J].Cancer Res,2004,64(8):2840-2845.
[12] Miyachi K,Sasaki K,Onodera S,et al.Correlation between survivin mRNA expression and lymph node metastasis in gastric cancer[J].Gastric Cancer,2003,6(4):217-224.
[13] Shintani M,Sangawa A,Yamao N,et al.Immunohistochemical expression of nuclear and cytoplasmic survivin in gastrointestinal carcinoma[J].Int J Clin Exp Pathol,2013, 6(12):2919-2927.
[14] Waligórska-Stachura J,Jankowska A,Wasko R,et al.Survivin——prognostic tumor biomarker in human neoplasms[J].Ginekol Pol,2012,83(7):537-540.
[15] Zhang J,Zhu Z,Sun Z,et al.Survivin gene expression increases gastric cancer cell lymphatic metastasis by upregulating vascular endothelial growth factor-C expression levels[J].Mol Med Rep,2014,9(2):600-606.
[16] Li Y,Zhou Y,Zheng J,et al.Downregulation of survivin inhibits proliferation and migration of human gastric carcinoma cells[J].Int J Clin Exp Pathol,2015,8(2):1731-1736.
[17] Sarela AI,Macadam RC,Farmery SM,et al.Expression of the antiapoptosis gene,survivin,predicts death from recurrent colorectal carcinoma[J].Gut,2000,46(5):645-650.
[18] Hoffmann AC,Warnecke-Eberz U,Luebke T,et al.Survivin mRNA in peripheral blood is frequently detected and significantly decreased following resection of gastrointestinal cancers[J].J Surg Oncol,2007,95(1):51-54.
[19] Okada E,Murai Y,Matsui K,et al.Survivin expression in tumor cell nuclei is predictive of a favorable prognosis in gastric cancer patients[J].Cancer Lett,2001,163(1):109-116.
[20] Krieg A,Baseras B,Tomczak M,et al.Role of survivin as prognostic and clinicopathological marker in gastric cancer:a meta-analysis[J].Mol Biol Rep,2013,40(9):5501-5511.
[21] Tong WW,Tong GH,Chen XX,et al.HIF 2α is associated with poor prognosis and affects the expression levels of survivin and cyclin D1 in gastric carcinoma[J].Int J Oncol,2015,46(1):233-242.
[22] 张金花,冯玉光,高桂鹏,等.常氧与低氧下CagA+幽门螺杆菌对人胃癌SGC7901细胞系HIF-2α、ABCG2表达的影响[J].世界华人消化杂志,2013,21(4):293-299.
[23] Lu WD,Qin Y,Yang C,et al.Effect of curcumin on human colon cancer multidrug resistance in vitro and in vivo[J].Clinics (Sao Paulo),2013,68(5):694-701.
(收稿日期:2015-10-30 本文编辑:卫 轲)
