Bcl-2家族蛋白在莱菔硫烷诱导人涎腺腺样囊性癌细胞系ACC-M凋亡中的作用
2016-02-27贾志宇庄志征张英怀河北医科大学第二医院口腔颌面外科河北石家庄050000河北省胸科医院口腔科河北石家庄05004河北大学附属医院口腔科河北保定07000
贾志宇,郭 涛,庄志征,岳 磊,杨 威,张英怀*(.河北医科大学第二医院口腔颌面外科,河北 石家庄 050000;.河北省胸科医院口腔科,河北 石家庄 05004; .河北大学附属医院口腔科,河北 保定 07000)
·论著·
院副主任医师,医学博士,从事头颈肿瘤疾病诊治研究。
Bcl-2家族蛋白在莱菔硫烷诱导人涎腺腺样囊性癌细胞系ACC-M凋亡中的作用
贾志宇1,郭涛2,庄志征3,岳磊1,杨威1,张英怀1*(1.河北医科大学第二医院口腔颌面外科,河北 石家庄 050000;2.河北省胸科医院口腔科,河北 石家庄 050041; 3.河北大学附属医院口腔科,河北 保定 071000)
[摘要]目的观察莱菔硫烷(sulforaphane,SFN)对腺样囊性癌细胞ACC-M中Bcl-2家族成员表达的影响,探讨Bcl-2家族蛋白在SFN诱导ACC-M细胞凋亡中的作用。方法20或40 μmol/L SFN处理ACC-M细胞特定时间后,采用倒置显微镜,Wright-Giemsa染色和透射电镜观察细胞形态学变化,流式细胞术检测细胞凋亡率。40 μmol/L SFN处理细胞4、8、16、24 h,采用Western blot方法检测Bax、Bak、Bcl-2和Bcl-xL的表达。结果倒置显微镜,Wright-Giemsa染色和透射电镜显示SFN可诱导ACC-M细胞凋亡,流式细胞术检测可见凋亡率随处理时间延长和药物浓度增加而上升,各组间差异有统计学意义(P<0.05)。经40 μmol/L SFN处理后,促凋亡蛋白Bax、Bak的表达以及Bax/Bcl-2比值随着时间的延长而增加,抗凋亡蛋白Bcl-2和Bcl-xL的表达随时间延长逐渐降低,差异均有统计学意义(P<0.05)。结论SFN以浓度-时间依赖方式诱导ACC-M细胞凋亡,并上调Bax和Bak的表达,下调Bcl-2和Bcl-xL的表达。SFN对Bcl-2家族蛋白的调节可能是其诱导凋亡的机制。
[关键词]口腔肿瘤;莱菔硫烷;细胞凋亡
doi:10.3969/j.issn.1007-3205.2016.02.010
莱菔硫烷(sulforaphane,SFN)是异硫氰酸盐的衍生物,天然存在于十字花科蔬菜中,在某些花椰菜品种中含量非常高,因其出色的抗肿瘤效果受到了极大关注[1]。SFN对前列腺癌[1]、乳腺癌[2]、白血病[3]、结肠癌[4]、口腔癌[5]等多种人类肿瘤都有化学预防和治疗作用。但是,少有SFN对人涎腺腺样囊性癌细胞系作用的研究报道。Bcl-2家族成员在细胞凋亡的基因调控过程中起着重要的作用。目前已知的Bcl-2家族包括抗凋亡蛋白(如Bcl-2、Bcl-xL、Bcl-w、Mcl-1、Bfel、Al、Ced-9等)和促凋亡蛋白(如Bcl-rambo、Bid、Bax、Bak、Bcl-xS、Bad、Bik、PUMA等)[6],它们之间通过组成同源二聚体、异源二聚体来促进或抑制细胞凋亡。本研究采用SFN处理体外培养的人腺样囊性癌细胞系ACC-M,用蛋白质印迹法检测SFN处理不同时间后抗凋亡蛋白Bcl-2、Bcl-xL以及促凋亡蛋白Bax、Bak的表达,验证Bcl-2家族成员在SFN诱导ACC-M凋亡过程中作用,报告如下。
1材料与方法
1.1材料人腺样囊性癌细胞系ACC-M由上海交通大学口腔颌面外科实验室提供。D′ L-SFN(纯度≥99%)购自美国LKT实验室。Annexin-V-FITC/PI试剂盒购自北京联科生物技术有限公司。Pvdf膜购自美国Millipore公司。兔抗人Bax、Bak、Bcl-2和Bcl-xL多克隆抗体购自美国Santa Cruz公司,鼠抗人β-actin单克隆抗体及二抗购自美国KPL公司。
1.2细胞培养和药液配制ACC-M细胞采用RPMI1640培养液加入10%胎牛血清和抗生素,于37 ℃、5% CO2恒温箱内饱和湿度培养,以0.04%二乙胺四乙酸(ethylene diamine tetraacetic acid,EDTA)和0.25%胰蛋白酶混合液消化传代。SFN用二甲基亚砜配置成100 mmol/L的储存液,储存于-20 ℃冰箱中,使用前用培养液稀释。实验组SFN终浓度为20 μmol/L或40 μmol/L,培养液中加入等量二甲基亚砜作为对照组(终浓度0.04%)。
1.3方法
1.3.1细胞形态学观察3×105个细胞接种于60 mm培养皿中,倒置显微镜观察细胞在对照组和实验组中不同培养时间的生长状况。2×105个细胞接种于6孔板中,孔中放置盖玻片,爬片成功后加入20、40 μmol/L SFN或0.04%二甲基亚砜液,培养0、24、48和72 h后,Wright-Giemsa染色,光镜观察。细胞接种于50 mL培养瓶中,贴壁成功后加入40 μmol/L SFN或0.04%二甲基亚砜,处理48 h后,制备电镜标本,透射电镜下观察2组细胞的超微结构差异。
1.3.2细胞凋亡率检测 3×105个细胞接种于60 mm培养皿中。分为24、48、72 h组,处理浓度为40 μmol/L,观察固定浓度SFN处理不同时间的细胞凋亡率;分别用0.04%二甲基亚砜,20、40 μmol/L的SFN处理细胞48 h,观察固定时间不同浓度SFN处理细胞的凋亡变化。处理完毕并获取细胞后,用Annexin-V-FITC和PI双标记活细胞,流式细胞仪检测细胞凋亡情况。实验重复3次。
1.3.3蛋白质印迹法8×105个细胞接种于25 mL培养瓶中,实验组和对照组各4瓶。贴壁后,实验组加入40 μmol/L SFN,对照组加入0.04%二甲亚砜 。分别培养4、8、16和24 h后,获取细胞。裂解细胞,提取蛋白质并测定浓度。经过上胶、电泳、转膜、加一抗、二抗、免疫显色,产生条带。实验重复3次。采用电泳凝胶成像分析软件ImageJ2x测量条带的灰度值,每个指标由同一人测量灰度值2次,得到6组数值,对结果进行量化分析。
1.4统计学方法应用SPSS 13.0软件进行统计学处理,计量资料比较分别采用F检验、SNK-q检验。P<0.05为差异有统计学意义。
2结果
2.1倒置显微镜观察对照组细胞贴壁生长,细胞生长迅速,多呈扁平多角形,呈“铺路石”状生长,胞质饱满,细胞中央处可见圆形细胞核(图1A);实验组细胞生长受到明显抑制,并可见有脱壁细胞、部分贴壁细胞变圆、皱缩变小、核颜色加深、细胞间连接松解、细胞折光性增强等凋亡表现(图1B)。
2.2Wright-Giemsa染色对照组细胞核浆比例大,并且可见多个核仁(图1C);而实验组核浆比例降低,胞质浓缩,核仁显著减少甚至消失,并可见部分细胞染色质沿核膜内侧排列,发现细胞核碎裂等凋亡现象(图1D)。
2.3透射电镜观察对照组细胞核浆比例大,核仁明显,细胞内各细胞器清晰可见,功能亢进,可见明显分裂象(图1E);实验组胞质浓缩,核浆比例小,核仁减少甚至消失,出现明显的染色体边集现象,并可见凋亡小体(图1F)。
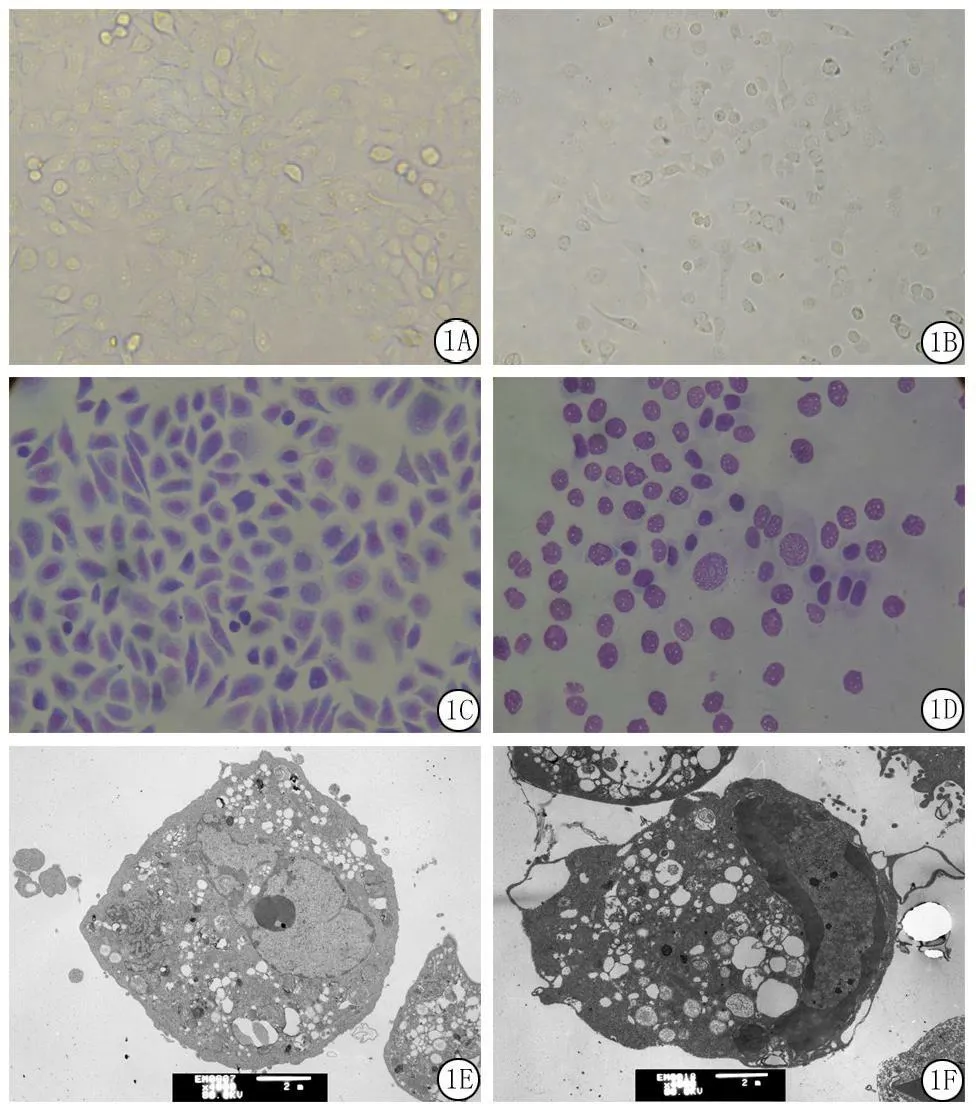
图1ACC-M细胞形态学改变
A.对照组(倒置显微镜 ×200);B.SFN 20 μmol/L处理24 h(倒置显微镜 ×200);C.对照组 (Wright-Giemsa ×200);D.SFN 40 μmol/L处理24 h(Wright-Giemsa ×200);E.对照组 (透射电镜 ×4 000);F.SFN 40 μmol/L处理48 h(透射电镜 ×4 000)
Figuer 1Morphology changes of ACC-M cells
2.4不同培养时间和不同SFN浓度处理后凋亡率比较随着培养时间延长,凋亡率逐渐升高,48 h和72h与对照组差异有统计学意义(P<0.05),
72 h与48 h差异有统计学意义(P<0.05);随着SFN浓度增加,凋亡率逐渐升高,40 μmol/L组与20 μmol/L组和对照组差异有统计学意义(P<0.05)。见表1。
2.5SFN处理不同时间ACC-M细胞Bcl-2家族蛋白表达SFN处理后不同时间的ACC-M细胞Bak、Bax蛋白表达和Bax/Bcl-2比值呈逐渐升高的趋势,而Bcl-2和Bcl-xL呈逐渐降低趋势,见图2,表2。
表1SFN处理ACC-M细胞不同时间和不同浓度凋亡率比较
Figure 1Apoptosis rate of ACC-M cells after treatment with different concentration of SFN for different time
(n=3,±s,%)

(n=3,±s,%)
组别凋亡组别 凋亡对照组 7.86±1.20对照组 6.10±0.9524h组12.31±2.1520μmol/L组13.10±5.0148h组26.43±3.68*#40μmol/L组26.43±3.68*#72h组55.33±8.95*#△F 55.195F 24.276P 0.000P 0.001
*P<0.01与对照组比较#P<0.01与24 h或20 μmol/L组比较△P<0.01与48 h组比较(q检验)
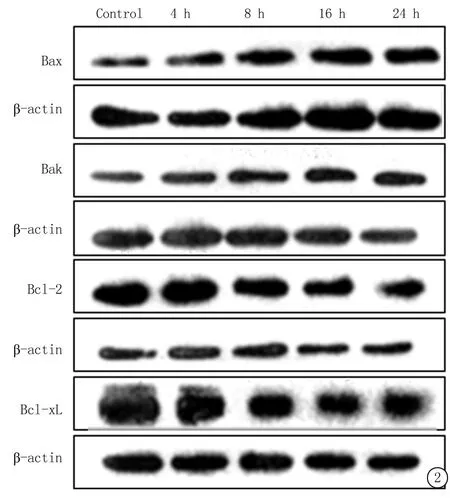
图2SFN 40 μmol/L处理4、8、16、24 h后ACC-M细胞中Bcl-2家族蛋白表达(Western blot)
Figure 2Western blot analysis for protein expresson of Bcl-2 family in ACC-M treated with 40 μmol/L SFN for 4,8,16 and 24 h
表2SFN处理后ACC-M细胞中Bcl-2家族蛋白表达及Bax/Bcl-2比值变化
Table 2 Fold changes and ratio of Bax/Bcl-2 for Bcl-2 family in ACC-M treated with SFN(n=6,±s)
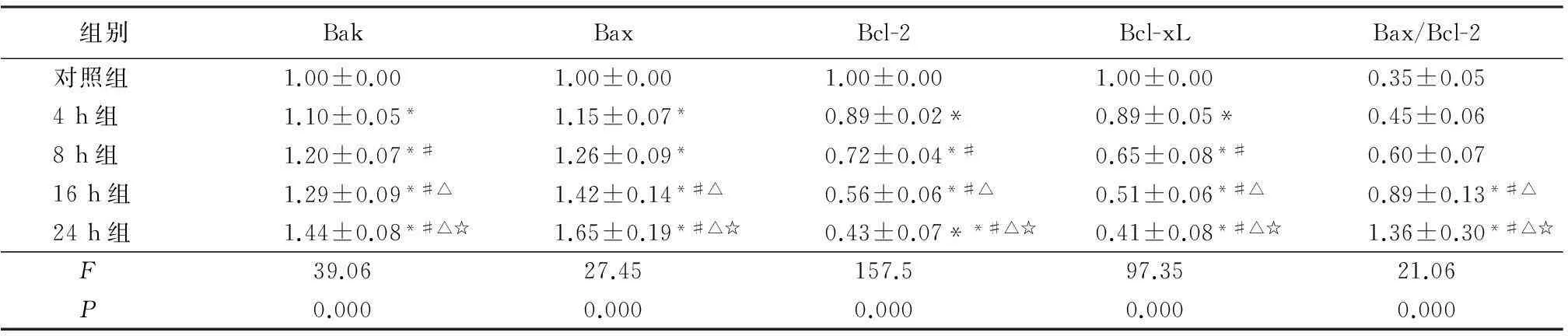
Table 2 Fold changes and ratio of Bax/Bcl-2 for Bcl-2 family in ACC-M treated with SFN(n=6,±s)
组别BakBaxBcl-2Bcl-xLBax/Bcl-2对照组1.00±0.001.00±0.001.00±0.001.00±0.000.35±0.054h组1.10±0.05*1.15±0.07*0.89±0.02*0.89±0.05*0.45±0.068h组1.20±0.07*#1.26±0.09*0.72±0.04*#0.65±0.08*#0.60±0.0716h组1.29±0.09*#△1.42±0.14*#△0.56±0.06*#△0.51±0.06*#△0.89±0.13*#△24h组1.44±0.08*#△☆1.65±0.19*#△☆0.43±0.07**#△☆0.41±0.08*#△☆1.36±0.30*#△☆ F39.0627.45157.597.3521.06 P0.0000.0000.0000.0000.000
*P<0.05与对照组比较#P<0.05与4 h组比较△P<0.05与8 h组比较☆P<0.05与16 h组比较(SNK-q检验)
3讨论
腺样囊性癌是涎腺最常见的恶性肿瘤之一,该肿瘤浸润性极强,沿面神经生长并且易发生远处转移,其远处转移率在口腔颌面部居首位。该病的治疗手段主要是手术切除,但是术后10年的的神经侵袭率和远处转移率仍高达50%和39%[7]。因此,有必要探索新的治疗方法,以提高治疗腺样囊性癌的效果,减少局部复发和远处转移的发生,改善患者的生存质量。目前,具有抗肿瘤活性的植物有效成分的研究受到重视,其中包括SFN。本研究采用倒置显微镜,Wright-Giemsa染色和透射电镜观察到,经SFN处理的ACC-M细胞出现典型凋亡的形态学表现,证明SFN能够诱导ACC-M细胞凋亡。流式细胞术也显示,ACC-M细胞凋亡率与SFN处理时间和浓度有一定相关性。但是SFN诱导ACC-M细胞凋亡的机制尚不清楚。
本研究前期实验表明,在SFN诱导ACC-M细胞凋亡的过程中,Caspase-3和9的活性显著增高,说明内源性凋亡途径,即线粒体途径参与了SFN诱导的凋亡[8]。Bcl-2家族蛋白是公认的调节线粒体凋亡途径的重要凋亡因子。其中Bax在药物诱导刺激后,基因活化,导致其蛋白含量增加,并形成Bax同源二聚体或异源二聚体,引起细胞色素C的释放,继而激活Caspase级联反应,最终导致细胞凋亡[9]。而Bcl-2可以对抗引起线粒体破裂的离子失衡,阻断线粒体凋亡诱导因子如细胞色素C向细胞质内释放,从而抑制细胞凋亡[10]。Bcl-xL蛋白与Bcl-2蛋白有74%的同源性。Bcl-xL蛋白与Bcl-2蛋白协同可使细胞的生存期延长,也可通过激活可溶性单体Bax,抑制Bax蛋白结合到线粒体外膜,阻止其与膜上的其他蛋白发生齐聚反应,从而对细胞凋亡起到相应的抑制作用[10]。Bak蛋白的促凋亡作用可能是通过诱导线粒体外膜穿孔导致线粒体破裂来实现的。Bak蛋白可以与Bcl-2和Bcl-xL蛋白结合,形成异源二聚体,抑制Bcl-2和Bcl-xL的抑凋亡活性,从而诱导细胞凋亡的发生,其诱导凋亡的效果大于Bax[11]。本研究结果显示,SFN处理可上调ACC-M中促凋亡蛋白Bax和Bak的表达,下调抗凋亡蛋白Bcl-2和Bcl-xL的表达。证明Bcl-2家族蛋白在SFN诱导ACC-M凋亡过程中起重要作用。Bax/Bcl-2在同一组织细胞中的表达比值可以决定细胞的存亡,即Bax/Bcl-2比值高的细胞促凋亡,细胞趋向死亡,而Bax/Bcl-2比值低的细胞抑凋亡,细胞趋向生存[10]。本研究结果显示,用药后Bax/Bcl-2比值与对照组相比明显增大。这可使肿瘤细胞对凋亡更敏感,更易发生凋亡,可能是SFN诱导细胞凋亡、发挥抗肿瘤作用的重要机制之一。
Bcl-2家族的转录受到其上游的STAT蛋白的调控,研究显示SFN可以下调头颈癌细胞PCI-13中STAT3的磷酸化水平,减少STAT3的构成性激活和IL-6诱导的激活[12]。在ACC-M细胞中Bcl-2家族的变化是否受STAT3调控,值得进一步研究。另外,本研究的前期实验也显示SFN可提高Caspase-8的活性[8],说明死亡受体途径也参与SFN诱导的凋亡,SFN能否影响Fas、肿瘤坏死因子α等凋亡蛋白的表达,也是我们下一步的工作。
[参考文献]
[1]Labsch S,Liu L,Bauer N,et al.Sulforaphane and TRAIL induce a synergistic elimination of advanced prostate cancer stem-like cells[J].Int J Oncol,2014,44(5):1470-1480.
[2]Hussain A,Mohsin J,Prabhu SA,et al.Sulforaphane inhibits growth of human breast cancer cells and augments the therapeutic index of the chemotherapeutic drug,gemcitabine[J].Asian Pac J Cancer Prev,2013,14(10):5855-5860.
[3]Suppipat K,Park CS,Shen Y,et al.Sulforaphane induces cell cycle arrest and apoptosis in acute lymphoblastic leukemia cells[J].PLoS One,2012,7(12):e51251.
[4]Constantinescu S,Hecht K,Sobotzki N,et al.Transcriptomic responses of cancerous and noncancerous human colon cells to sulforaphane and selenium[J].Chem Res Toxicol,2014,27(3):377-386.
[5]Jee HG,Lee KE,Kim JB,et al.Sulforaphane inhibits oral carcinoma cell migration and invasion in vitro[J].Phytother Res,2011,25(11):1623-1628.
[6]Bai L,Chen J,McEachern D,et al.BM-1197:a novel and specific Bcl-2/bcl-xl inhibitor inducing complete and long-lasting tumor regression in vivo[J].PLoS One,2014,9(6):e99404.
[7]van Weert S,Bloemena E,van der Waal I,et al.Adenoid cystic carcinoma of the head and neck:a single-center analysis of 105 consecutive cases over a 30-year period[J].Oral Oncol,2013,49(8):824-829.
[8]李晓玲,岳磊,贾志宇,等.Caspase在莱菔硫烷诱导人腺样囊性癌细胞系ACC-M凋亡中的作用[J].现代口腔医学杂志,2015,29(1):20-22,45.
[9]Mignard V,Lalier L,Paris F,et al.Bioactive lipids and the control of Bax pro-apoptotic activity[J].Cell Death Dis,2014,29(5):e1266.
[10]Alibek K,Irving S,Sautbayeva Z,et al.Disruption of Bcl-2 and Bcl-xL by viral proteins as a possible cause of cancer[J].Infect Agent Cancer,2014,23(9):44.
[11]满莹,唐国瑶,王万春,等.口腔扁平苔藓、白斑及鳞癌组织Bak蛋白表达特点及其与细胞凋亡相关性研究[J].现代口腔医学杂志,2014,28(3):136-142.
[12]贾志宇,赵云转,王维丽,等.莱菔硫烷对头颈癌细胞系PCI-13中信号转导和转录激活因子1和3的影响[J].实用口腔医学杂志,2013,29(6):811-815.
(本文编辑:许卓文)
Effect of Bcl-2 family on apoptosis of salivary adenoid cystic carcinoma cell line ACC-M induced by sulforaphane
JIA Zhi-yu1, GUO Tao2, ZHUANG Zhi-zheng3,
YUE Lei1, YANG Wei1, ZHANG Ying-huai1*
(1. Department of Oral and Maxillofacial Surgery, the Second Hospital of Hebei Medical University,
Shijiazhuang 050000, China;2. Department of Stomatology, Hebei Chest Hospital,
Shijiazhuang 050041, China;3. Department of Stomatology, Affiliated Hospital
of Hebei University, Baoding 071000, China)
[Abstract]ObjectiveTo study the effect of sulforaphane(SFN) on expression of Bcl-2 family in salivary adenoid cystic carcinoma cell line ACC-M, and to evaluate the effect of Bcl-2 family on apoptosis of ACC-M cells induced by SFN. MethodsAfter ACC-M cells were treated with 20 or 40 μmol/L SFN for desired time, morphology changes of ACC-M cells were observed with inversion phase contrast microscope, Giemsa staining and transmission electron microscope(TEM). Flow cytometry with Annexin-V-FITC/propidium iodide double staining were used to detect the apoptosis rate of ACC-M. After ACC-M cells were treated with 40 μmol/L SFN for 4, 8, 16 and 24 hours, the expression of Bax, Bak, Bcl-2 and Bcl-xL were detected by Western blot. ResultsImage data showed that SFN could induce apoptosis of ACC-M cells. Flow cytometry data showed that apoptosis rate was increased with time and concentration of SFN. There were significantly different among each groups(P<0.05). Expression of proapoptosis protein Bax and Bak as well as ratio of Bax/Bcl-2 were increased with treating time, whereas that of anti-apoptosis protein Bcl-2 and Bcl-xL were decreased by treatment with 40 μmol/L SFN for 4, 8, 16 and 24 h. There were significantly different among each groups(P<0.05). ConclusionSFN could induce apoptosis of ACC-M cells with time- and concentration-dependent manners, and up-regulate expressions of Bax and Bak, and down-regulate expressions of Bcl-2 and Bcl-xL, which might be the mechanisms for the apoptosis of ACC-M induced by SFN.
[Key words]mouth neoplasms; sulforaphane; apoptosis
[中图分类号]R39.8
[文献标志码]A
[文章编号]1007-3205(2016)02-0161-05
通讯作者*。E-mail:zhyh787@163.com
[作者简介]贾志宇(1973-),男,河北武邑人,河北医科大学第二医
[基金项目]河北省医学科学研究重点课题(20110340;20130150)
[收稿日期]2015-02-02;[修回日期]2015-03-04
