小鼠生精细胞的体外双室无血清培养
2016-02-27郭浅妤任广伟河北医科大学基础医学院组织胚胎学教研室河北石家庄05007河北医科大学第一医院肾内科河北石家庄05003
龚 淼,张 雷,赵 昱,尹 青,郭浅妤,任广伟(.河北医科大学基础医学院组织胚胎学教研室,河北 石家庄 05007;2.河北医科大学第一医院肾内科,河北 石家庄 05003)
·论著·
小鼠生精细胞的体外双室无血清培养
龚淼1,张雷1,赵昱1,尹青1,郭浅妤1,任广伟2*(1.河北医科大学基础医学院组织胚胎学教研室,河北 石家庄 050017;2.河北医科大学第一医院肾内科,河北 石家庄 050031)
[摘要]目的探讨无血清条件下应用插入式细胞培养皿(Transwell小室)对小鼠睾丸间质细胞-支持细胞-生精细胞的双室培养技术。方法取60日龄C57BL/6雄性小鼠睾丸间质细胞和15日龄雄性小鼠睾丸支持细胞与生精细胞混合细胞团双室共培养,不添加血清。每日在倒置显微镜下观察生精细胞的形态和生长情况,苏木精染色观察生精细胞形态,染色体倍性分析检测细胞分化情况。结果在培养1周后,可见圆形精子细胞出现,2周后可见长形精子细胞,3周后可见较短鞭毛,生精细胞可存活8周;培养1周时,流式细胞术可检测出单倍体细胞,单倍体细胞百分比随培养时间延长而增加。结论应用双室无血清培养体系体外培养小鼠生精细胞可获得精子且生精细胞存活时间较长。
[关键词]精细胞;细胞培养技术;小鼠
doi:10.3969/j.issn.1007-3205.2016.01.001
由于精子发生与睾丸结构的复杂性,很难针对整个有机体精子发生及相关基因的作用机制进行深入研究。同时,外源化学物质对精子发生的影响逐渐引起更多学者的关注,主要以动物实验和体外研究为主[1-2]。因此,生精细胞的体外培养成为深入研究精子发生过程,阐明精子发生相关基因功能与作用机制的手段[3-4]。长期且稳定的体外培养生精细胞成为基因功能研究、靶向基因治疗和药物研发新模型的基础条件[5]。目前,生精细胞的培养方法主要有单细胞培养、支持细胞-生精细胞共培养和睾丸组织块培养三类,培养时间较短,细胞存活率低,不能获得令人满意的单倍体精子细胞转化率[6]。本研究在不添加外源血清的条件下应用Transwell小室对小鼠睾丸间质细胞-支持细胞-生精细胞进行双室培养,模拟生精细胞体内生长微环境,以期建立一个长期稳定的小鼠生精细胞体外培养体系,旨在为小鼠生精细胞的体外分化研究提供细胞模型。
1材料与方法
1.1动物与主要试剂15日龄和60日龄清洁级C57BL/6雄性小鼠(合格证号:SCXK京2009-0004),购买于北京华阜康生物科技股份有限公司。DMEM-F12培养液购自Hyelone公司,胰岛素-转铁蛋白-硒酸钠(insulin-transferrin-selenium,ITS)、脱氧核糖核酸酶Ⅰ(deoxyribonuclease Ⅰ,DNaseⅠ)、胶原酶Ⅰ、表皮生长因子(epidermal growth factor,EGF)、睾酮、视黄酸、重组人促卵泡激素(recombination-follicle stimulating hormone,rFSH)购自Sigma公司。
1.2睾丸间质细胞的分离、纯化与培养无菌取出60日龄小鼠双侧睾丸,眼科剪剪碎后用0.03%胶原酶37 ℃水浴振荡消化15 min(150 r/min),取上清液离心后再次加入0.03%胶原酶,匀速振荡15 min(130 r/min),取上清液离心重悬后第3次加入0.03%胶原酶,慢速消化15 min(100 r/min),吸取上清液离心,重悬后应用配制好的55%Percoll 连续密度梯度离心液,室温离心 15 min(3 000 r/min),收集37%~60%的细胞用间质细胞培养液(100 mL DMEM/F-12培养液中,含有10 000 U青霉素、100 mg链霉素、100 μL ITS)制成细胞悬液,经3β-羟基类固醇脱氢酶(3β-hydroxysteroid dehydrogenase,3β-HSD)染色鉴定后接种于6孔板的各孔内。
1.3睾丸支持细胞-生精细胞的分离与培养 无菌取出15~18日龄小鼠睾丸,轻柔快速去除睾丸周围脂肪组织与附睾,用含青霉素、链霉素和两性霉素的D-Hank's缓冲液冲洗。冰上去除睾丸被膜,用眼科剪剪碎游离的生精小管,于上述缓冲液中孵育 2 min,加入0.1%胶原酶Ⅳ,37 ℃水浴振荡30 min(80 r/min),离心弃上清,重复使用用0.1%胶原酶Ⅳ消化5 min(80 r/min),取沉淀物加入0.25%胰蛋白酶和0.1%透明质酸酶,混匀后37 ℃、5%CO2培养箱静置5 min,200目筛网过滤,弃去上清液,加入含0.1% 胶原酶Ⅳ、0.1%透明质酸酶和1.0 μg/mL DNaseⅠ的 DMEM-F12培养液,37 ℃水浴振荡 5 min(80 r/min),室温静置5 min,应用共培养体系培养液(100 mL DMEM-F12培养液中,含有10 000 U青霉素、100 mg链霉素、100 μg EGF、100 μL ITS、0.5 μmol/L视黄酸、0.1 μmol/L睾酮、2.5 U rFSH重悬细胞)。
1.4睾丸间质细胞-支持细胞-生精细胞双室培养体系的建立将6孔培养板的6个孔内接种间质细胞,支持细胞-生精细胞团接种到Transwell小室内,小室内加入上述共培养体系培养液,6孔板孔内加入间质细胞培养液,使小室外液面略高于小室底部。隔日进行不完全换液,每次换掉2/3旧液。
1.5苏木精染色 取Transwell小室内悬浮的生精细胞团,用4%多聚甲醛固定 12 h后离心,常规石蜡包埋细胞团块,切片机连续切4 μm厚蜡带制成石蜡切片,常规HE与苏木精染色,中性树胶封片,光学显微镜下观察并摄片。
1.6流式细胞术检测生精细胞中单倍体细胞比例分别于培养第1、7、14、21、28和42天取生精细胞加入70%乙醇,-20 ℃固定12 h,洗涤后加入碘化丙碇(propidium iodide,PI)染液,室温静置15 min后上机检测PI荧光强度,四倍体(4N)细胞表示初级精母细胞,二倍体(2N)细胞表示精原细胞、次级精母细胞,单倍体(1N)细胞表示精子细胞。每次计数104个细胞,计算单倍体细胞百分比。
2结果
2.1倒置相差显微镜观察培养第2天,Transwell小室底部薄膜上的支持细胞开始贴壁生长;以精原细胞和精母细胞为主的生精细胞团悬浮生长于支持细胞上。培养第1周,生精细胞团内可见体积较大的细胞为精母细胞和体积较小的圆形精子细胞(图1A)。培养第2周,生精细胞成团附着于支持细胞表层,但未见贴壁;生精细胞团中出现处于形态改变过程中的长形精子细胞(图1B)。培养第3周,游离于培养液中的圆形细胞数量增多;可见正在分裂的细胞,细胞饱满,折光性较强;偶见胞体呈椭圆形改变的精子细胞一端出现鞭毛(图1C)。
2.2苏木精染色观察培养第1周,生精细胞团中初级精母细胞数量增多,精原细胞体较小,呈圆形或椭圆形,胞核呈卵圆形,染色质粗细不一,胞质染色浅;初级精母细胞体积较大,呈圆形,细胞核大而圆,呈绒球状;可见少量圆形精子细胞,体积小,核呈圆形,染色质细密,核质比大(图2A)。培养第2周,可见处于形态改变过程中的精子细胞,由圆形变为长形,细胞核偏向一侧,染色加深(图2B)。培养第3周,可见一端长出鞭毛的精子细胞,细胞核深染,呈锥体形,胞质未完全脱落(图2C)。
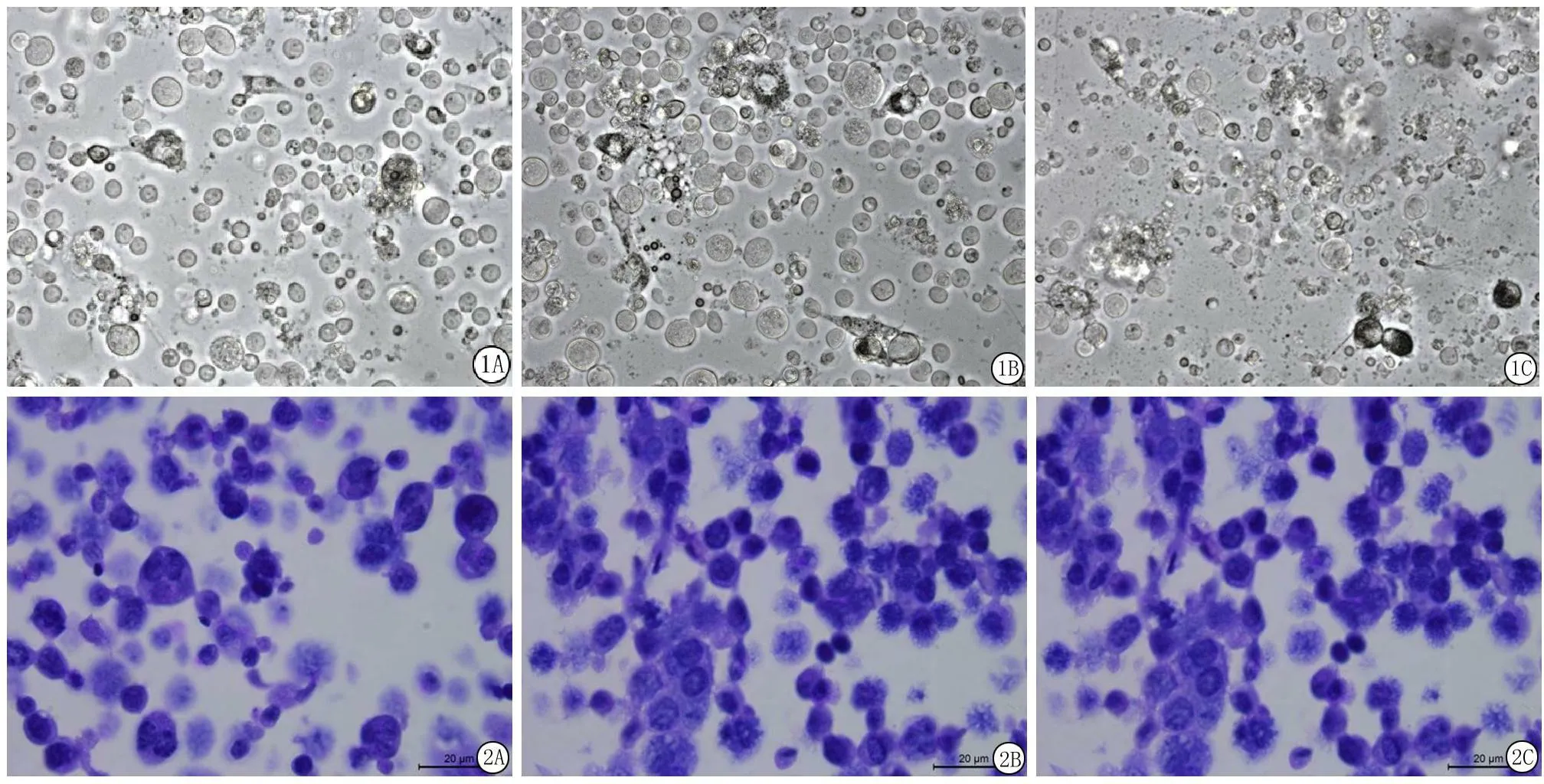
图1倒置相差显微镜下双室培养生精细胞的形态(×400)
A.第7天;B.第15天;C.第21天
Figure 1Changes in the microscopic aspect of cocultured Leydig cell-sertoli cell-spermatogenic cells in bicameral chambers(×400)
图2双室培养生精细胞的形态(苏木精染色 ×1 000)
A.第7天; B.第15天; C.第21天
Figure 2Morphological structure of spermatogenic cells (Hematoxylin staining×1 000)
2.3流式细胞术检测单倍体细胞百分比培养第7天开始出现少量单倍体细胞,占细胞总数的(15.32±1.02)%,随着培养时间的增加,单倍体细胞的百分比逐渐增高至(24.93±1.65)%。
3讨论
精子正常发生的微环境主要取决于2个因素:一是睾丸支持细胞,参与精子发生的启动与维持,分泌多种蛋白类物质维持生精上皮微环境的稳态,对生精细胞起支持、营养与保护作用[7];二是睾丸间质细胞,是体内睾酮的主要分泌细胞,雄激素在精子发生过程中不可或缺[8]。同时,间质细胞与支持细胞之间存在相互影响、相互作用的关系。支持细胞通过分泌细胞因子,直接或间接地作用于间质细胞,在二者之间形成短环式结构,促进间质细胞更好地发挥作用[9]。间质细胞通过分泌雄激素等相关物质促进支持细胞的功能发挥。本研究采用间质细胞-支持细胞-生精细胞共培养的方法,借鉴国内外关于间质细胞原代分离的方法[10-12]。首先,采用低浓度胶原酶差速消化与Percoll密度梯度离心法相结合,有效去除睾丸结缔组织和其他细胞,差速消化用时短,减轻了消化酶对间质细胞的损伤,提高了间质细胞的获得率和纯度;3β-HSD只存在于睾丸间质细胞的滑面内质网内,应用此酶鉴定间质细胞纯度,使结果准确可靠[13]。其次,采用改良方法分离纯化支持细胞与生精细胞,胶原酶去除生精小管周围的结缔组织,能较好地分离生精小管,胰蛋白酶与透明质酸酶可有效去除生精小管周围的肌样上皮细胞和基膜等;为避免酶类对细胞的损伤,本研究应用多种酶联合短时消化,保证了细胞的纯度和完整性。同时,本研究首次采用间质细胞-支持细胞-生精细胞双室共培养,在培养皿内放置一个底部由透明的渗透性薄膜构成的套皿,使培养皿分隔为上下两室,间质细胞在下室的间质培养液中培养,支持细胞与生精细胞置于上室,间质细胞分泌的雄激素和细胞因子通过渗透膜进入上室的共培养体系培养液中,使共培养体系的生理环境接近生精细胞在睾丸中发育的微环境,促进生精细胞培养的稳定性,使生精细胞存活时间超过30 d,初级精母细胞完成精子发生的过程,产生了形态学上的精子,但由于数量很少,没有进行活力检测,后续研究将分离精子进行体外受精实验,检测精子是否具有功能。
本研究选取15日龄小鼠睾丸组织,使分离的生精细胞团内只有支持细胞、精原细胞和少量初级精母细胞,与非阻塞性无精子症患者睾丸组织内细胞成分相似。有研究显示,生精细胞发育障碍与睾丸内支持细胞和间质细胞的功能异常及局部微环境失衡有关[14-15]。本研究在模拟睾丸组织内微环境的条件下,体外培养生精细胞,脱离了患者睾丸组织内不良环境,在体外将初级精母细胞诱导分化为单倍体精子细胞甚至形成长尾的精子。同时,本研究不在培养体系中加入动物源性的血清,为以后人的精子细胞培养与移植的研究提供了无外源动物因子干扰的实验基础。
由于Transwell小室空间有限,支持细胞在铺满小室底部后发生接触抑制,存活时间大约可维持1个半月左右,同时,睾丸支持细胞分泌雄激素的功能也在3周后逐渐降低。本研究结果显示,培养4周后生精细胞存活率明显降低,8周后存活细胞已很少。提示生精细胞存活率降低有可能与支持细胞和间质细胞的功能降低有关。本研究重新分离纯化睾丸支持细胞接种于Transwell小室底部薄膜上,将培养8周后存活的生精细胞移至支持细胞表面,培养2周后生精细胞仍有少量存活,但未见精子细胞出现鞭毛,这可能与生精细胞生存环境的改变有直接关系。
本研究流式细胞术检测结果显示,培养第7天开始出现少量单倍体细胞,提示圆形精子细胞出现于培养第7天左右,与形态学研究结果一致。随着培养时间的延长,精子细胞的数量逐渐增加,提示生精细胞发生了分化,形成了精子细胞。
综上所述,在生精细胞-支持细胞-间质细胞双室共培养体系中,不外源添加动物血清,也能获得长形精子细胞甚至精子,并能延长生精细胞的培养时间,为生精细胞的培养与分化提供新的技术方法。此外,生精细胞体外与间质细胞和支持细胞双室共培养,不仅模拟了睾丸组织内各种细胞的正常功能,还避免了体内不良内分泌环境的干扰,在维持睾丸内各细胞间联系的基础上,真实地反映精子发生过程中各类生精细胞的发育情况,不仅可用于研究外源化学物质对精子发生的影响,也有利于阐明精子发生的调控机制。本研究计划后续实验尝试使用该培养体系获得的单倍体精子进行卵胞浆内单精子注射,深入检测培养体系能否培养具有受精能力的正常精子,进一步完善培养体系。
[参考文献]
[1]Zhou L,Wu CQ,Luo YW,et al. Studies on the characteristics and mechanisms of testicular toxicity induced by Hydroxyurea[J]. Toxicol Mech Methods,2015,25(5):396-401.
[2]Kolasa-Wolosiuk A,Misiakiewicz-Has K,Baranowska-Bosiacka I,et al.Androgen levels and apoptosis in the testis during postnatal development of finasteride-treated male rat offspring[J]. Folia Histochem Cytobiol,2015,53(3):236-248.
[3]Rodriguez-Sosa JR,Bondareva A,Tang L,et al. Phthalate esters affect maturation and function of primate testis tissue ectopically grafted in mice[J]. Mol Cell Endocrinol,2014,398(1/2):89-100.
[4]Saito S,Lin YC,Murayama Y,et al. In vitro derivation of mammalian germ cells from stem cells and their potential therapeutic application[J]. Cell Mol Life Sci,2015,72(23):4545-4560.
[5]Zhu M,Sun WJ,Wang YL,et al. P38 participates in spermatogenesis and acrosome reaction prior to fertilization in Chinese mitten crab Eriocheir sinensis[J]. Gene,2015,559(2):103-111.
[6]Amory JK,Hong S,Yu X,et al.Melphalan,alone or conjugated to an FSH-beta peptide,kills murine testicular cells in vitro and transiently suppresses murine spermatogenesis in vivo[J]. Theriogenology,2014,82(1):152-159.
[7]Karagiannis T,Boura P,Tsapas A.Safety of dipeptidyl peptidase 4 inhibitors:a perspective review[J]. Ther Adv Drug Saf,2014,5(3):138-146.
[8]张芬熙,洪艳,梁文妹.小鼠睾丸支持细胞对人脐带间充质干细胞增殖能力的影响[J].解剖学报,2013,44(3):334-338.
[9]Zhang L,Chen M,Wen Q,et al. Reprogramming of Sertoli cells to fetal-like Leydig cells by Wt1 ablation[J]. Proc Natl Acad Sci U S A,2015,112(13):4003-4008.
[10]Makala H,Pothana L,Sonam S,et al. Regeneration of Leydig cells in ectopically autografted adult mouse testes[J]. Reproduction,2015,149(3):259-268.
[11]Yang Y,Su Z,Xu W,et al. Directed mouse embryonic stem cells into leydig-like cells rescue testosterone-deficient male rats in vivo[J]. Stem Cells Dev,2015,24(4):459-470.
[12]Jung H,Roser JF,Yoon M. UTF1,a putative marker for spermatogonial stem cells in stallions[J]. PLoS One,2014,9(10):e108825.
[13]Teerds KJ,Huhtaniemi IT.Morphological and functional maturation of Leydig cells:from rodent models to primates[J]. Hum Reprod Update,2015,21(3):310-328.
[14]Benavides-Garcia R,Joachim R,Pina NA,et al. Granulocyte colony-stimulating factor prevents loss of spermatogenesis after sterilizing busulfan chemotherapy[J]. Fertil Steril,2015,103(1):270-280.
[15]Chinta G,Ramya Chandar Charles M,Klopĉiĉ I,et al. In silico and in vitro investigation of the piperine's male contraceptive effect:docking and molecular dynamics simulation studies in androgen-binding protein and androgen receptor[J]. Planta Med,2015,81(10):804-812.
(本文编辑:赵丽洁)
Establishment of culture system of mouse spermatogenic cells in vitro without serum
GONG Miao1,ZHANG Lei1,ZHAO Yu1,YIN Qing1,GUO Qian-yu1,REN Guang-wei2*
(1.Department of Histology and Embryology,the School of Basic Medical Science,Hebei Medical
University,Shijiazhuang 050017,China;2.Department of Nephrology,the First Hospital of
Hebei Medical University,Shijiazhuang 050017,China)
[Abstract]ObjectiveTo establish a mouse Leydig cell-Sertoli cell-germ cell double-chamber coculture system in vitro without serum.MethodsThe Leydig cells were isolated from the testes of postnatal day 60 male C57BL/6 mice.Total germ cells and Sertoli cells were isolated from the testes of postnatal day 15 male C57BL/6 mice.The cells in bicameral chambers culture system were grown in media without serum.The morphology and growth of culture cells were monitored daily under contrast phase microscope,and were identified by Hematoxylin staining.Ploidy analysis of cells was observed by flow cytometry.ResultsIn bicameral culture system,sporadic round spermatids were detected after one week,and elongating spermatids or spermatids with flagella were observed after three weeks.The spermatogenic cells survived as long as eight weeks.The haploid peak was detected after one week; the percentage of monoploid increased with culture time.ConclusionThe spermatogenic cells in bicameral culture system matured into morphologically normal spermatozoa and survived longer.
[Key words]spermatids;cell culture techniques;mice
[中图分类号]R321.1
[文献标志码]A
[文章编号]1007-3205(2016)01-0001-04
*通讯作者
[作者简介]龚淼(1983-),女,河北石家庄人,河北医科大学基础医学院实验师,医学硕士,从事组织胚胎学研究。
[基金项目]河北省自然科学基金项目(H2013201139)
[收稿日期]2015-09-14;[修回日期]2015-10-26
